Эффективность мультимодальной пререабилитации у пациентов высокого риска кардиологических осложнений
Автор: Тонеев Е.А., Комаров А.С., Мидленко О.В., Маракаев Д.Х., Мухутдинова А.Н., Шагдалеев Р.Ф.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 3 (89), 2024 года.
Бесплатный доступ
Введение. В настоящее время хирургический метод применяется для лечения злокачественных новообразований легкого. Наиболее часто данная патология встречается у пациентов пожилого возраста, имеющих выраженный коморбидный фон. Эти условия создают риск возникновения кардиологических осложнений после перенесенной операции, что ухудшает течение послеоперационного периода.Материалы и методы. В статье представлен анализ послеоперационных показателей у пациентов из группы риска кардиологических осложнений после перенесенной лобэктомии по поводу злокачественных новообразований легких. Исследуемые разделены на 2 группы: пациенты, которым проводилась мультимодальная пререабилитация (n=39) и группа контроля (n=36). Перед рандомизацией проведена оценка показателей функции внешнего дыхания, фракции выброса левого желудочка, среднего давления в легочной артерии, а также результатов функциональных тестов. Оценка риска развития кардиологических осложнений проводилась согласно предложенной модели риска.Результаты. При анализе послеоперационных осложнений (Grade II-Grade V) было отмечено меньшее их количество в группе пациентов, прошедших пререабилитацию (р=0,020). Частота кардиологических осложнения в группе пререабилитации была существенно ниже, чем в группе контроля (p=0,040). Срок госпитализации пациентов значительно различался в зависимости от наличия пререабилитации: в контрольной группе он составил 12,08±2,26 дней, а в группе пререабилитации - 11,05±1,81 дней (p=0,031).Выводы. Использование программы пререабилитации у пациентов высокого риска может позволить снизить риск развития кардиологических осложнений после хирургического лечения рака легкого.
Рак легкого, пререабилитация, лобэктомия, кардиологические осложнения
Короткий адрес: https://sciup.org/142242553
IDR: 142242553 | УДК: 616.831-089.87 | DOI: 10.17238/2072-3180-2024-3-119-128
Текст научной статьи Эффективность мультимодальной пререабилитации у пациентов высокого риска кардиологических осложнений
В настоящее время одним из методов лечения злокачественных новообразований легких является хирургический. Несмотря на оптимизацию способов хирургического лечения, периоперационного ухода за пациентами и расширения методов реабилитации после перенесенных вмешательств, не исключается развитие послеоперационных осложнений [1].
Основной задачей современной хирургии является ускоренное восстановление пациентов после оперативного вмешательства. Согласно данным Всемирной Организации Здравоохранения, средний возраст для постановки диагноза злокачественного новообразования составляет 65 лет [2]. Данная возрастная категория пациентов зачастую имеет выраженный коморбидный фон, чаще всего проявляющийся в виде сердечно-легочной патологии. В связи с этим крайне важной задачей является выявление рисков развития кардиологических осложнений и разработка методов их минимизации [3].
Несмотря на стремительное развитие и усовершенствование методов реабилитации пациентов после хирургического лечения при онкологических заболеваниях, в настоящее время
не существует стандартизированной программы пререабилитации пациентов, которая позволила бы подготовить их к радикальному лечению.
В условиях ГУЗ ОКОД используется собственный стандартизированный мультидисциплинарный протокол пререабилитации, который функционирует с 01.01.2020 года для всех пациентов, которым планируется радикальное хирургическое вмешательство по поводу злокачественного новообразования. Данное исследование направлено на оценку эффективности и безопасности программы пререабилитации у лиц с высоким риском развития кардиологических осложнений, которым планируется лобэктомия по поводу рака легкого.
Материалы и методы
В исследовании был выполнен сравнительный анализ 75 пациентов с злокачественными новообразованиями в легком, которым выполнялась лобэктомия торакотомным доступом, в период с 01.01.2020 по 31.12.2023 в хирургическом отделении торакальной онкологии ГУЗ «Областной клинический онкологический диспансер» г. Ульяновск (рис. 1).
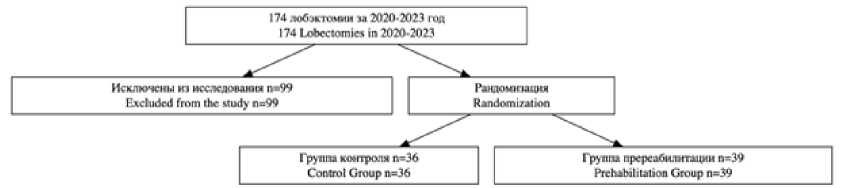
Рис. 1. Дизайн исследования
Fig. 1. Study Design
Пациенты, включенные в исследование, соответствовали следующим критериям:
-
• Оперативный доступ: торакотомия.
-
• Объем оперативного вмешательства – лобэктомия.
-
• Наличие высокого риска кардиологических осложнений.
-
• Отсутствие ранее проводимых операций в грудной полости.
Анализ исследуемых групп пациентов выполнен по единому разработанному протоколу. У пациентов были исследованы значения показателей функции внешнего дыхания по данным спирографии, путем эхокардиографии оценивалась величина фракции выброса левого желудочка и среднее давление в легочной артерии. На догоспитальном этапе всем исследуемым пациентам были выполнены функциональные тесты: лестничная проба и челночный ход. Для выявления недостаточности питания у исследуемых пациентов применялась схема скрининга недостаточности питания (MUST-Malnutrition Universal Screening Tool) [4]. При выявлении белковой недостаточности проводилась полноценная коррекция, с помощью приема 1,5 мг/кг белковых добавок, а также полноценного питания, включающего весь спектр витаминов, и обеспечение достаточ-
ной калорийности. В результате все пациенты, поступающие на хирургическое лечение, имели низкий риск недостаточности питания по MUST. С целью оценки психоэмоционального состояния пациентов использовалась «Госпитальная Шкала Тревоги и Депрессии» (HADS), пациенты, набравшие более 7 баллов, получали консультацию психотерапевта, назначалось соответствующее лечение [5]. Из 75 пациентов, включенных в исследование, потребность в коррекции была у 9 (12 %). Послеоперационные осложнения были стратифицированы согласно предложенной классификации The Thoracic Morbidity and Mortality (TMM) [6]. Объем выполнимой пререабилитации – высокоинтенсивная интервальная тренировка (ВИИТ) по следующей схеме. Занятия проводились по 45 минут на велотренажере, состояли из 10 минутной разминки, при пиковой ЧСС 60–70 %, далее 4 интервала работы и 3 интервала отдыха, при пиковой ЧСС 85–95 % и 10 минутная заминка при пиковой ЧСС 60–70 % с упражнениями на отягощение и растяжку (рис. 2).
Оценка риска развития кардиологических осложнений проводилась по разработанной ранее прогностической модели (заявка на патент № 2023128138 от 01.11.2023).
оі234ввтвоіо Баллы
V9 Вв 80 Тв ТО в* во вв во 4540
ВО 75 70 вв ВО 55 5045
V16 -------zz—z:-----=—=--:---:------=•
16 18 20 22 24 26 2в 30 32 34 36 ЗВ
V17 о от ов ов 1
Сумма баллов -------------------------------------------------------------------------------
О 2 4 в в >0 12 14 15 18 го а 24 И
Линейный предиктор
РИСК
0 1 02 030405080 7 08 09
Рис. 2. Прогностическая шкала оценки риска развития кардиологических осложнений (заявка на патент № 2023128138)
Прим.: V9 – уровень общего белка крови, V15 – фракция выброса левого желудочка, V16 –индекс массы тела, V17 – гипертоническая болезнь Fig. 2. Prognostic Scale for Assessing the Risk of Developing Cardiac Complications (Patent Application № 2023128138)
Note: Баллы – Points, V9 – total blood protein level, V15 – left ventricular ejection fraction, V16 – body mass index, V17
– hypertension, Сумма баллов – sum of points, Линейный предиктор – linear predictor, РИСК – risk
В исследовании были включены пациенты с высоким риском развития кардиологических осложнений. Пороговым значением для включения в группу был уровень риска больше значения 0,5.
Исследование являлось открытым параллельным контролируемым рандомизированным с двумя группами – группой контроля (ГК) (пациенты со стандартной подготовкой) и груп-
пой пререабилитации (ГП) (пациенты с пререабилитацией). Рандомизация проводилась по блочному типу с использованием таблицы случайных чисел. У всех пациентов получали информированное согласие на участие в исследовании.
Настоящее исследование одобрено этическим комитетом ГУЗ ОКОД и от всех пациентов получено добровольное информированное согласие.
Анализ статистических данных
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10). Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка. Для оценки диагностиче-
ской значимости количественных признаков при прогнозировании определенного исхода, применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Все проведенные анализы были выполнены с помощью программы StatTech v. 4.1.2 (разработчик – ООО «Статтех», Россия).
Результаты
Клинико-функциональные параметры исследуемых пациентов представлены в таблице 1.
Таблица 1
Клинические параметры исследуемых пациентов
Table 1
При анализе исследуемых групп до начала программы пререабилитации было определено, что по основным параметрам (пол, возраст, ИМТ, ИПЛ) статистическая разница в исследуемых группах пациентов отсутствует. Частота ХОБЛ среди оперированных пациентов составила 33,3 % (12 человек) в контрольной группе и 35,9 % (14 человек) в группе пререабилитации. Показатели функции внешнего дыхания представлены в таблице 2.
Частота встречаемости ХОБЛ 3 стадии составила 5,6 % в контрольной группе и 2,6 % в группе пререабилитации. Пациентов с ХОБЛ 4 стадии не было. У всех оперированных пациентов имелась сопутствующая патология. Структура сопутствующей патологии представлена в таблице 3.
Все пациенты, участвующие в исследовании, были скомпенсированы перед операцией, а пациенты с ХСН 3 стадии были исключены в пользу других методов лечения. Функциональные показатели оценивались у всех пациентов до рандомизации, а в группе пререабилитации проводилась повторная оценка функциональных параметров перед операцией. Показатели фракции выброса левого желудочка и показатели среднего давления в легочной артерии по данным эхокардиографии у исследуемых групп пациентов представлены в таблице 4.
Несмотря на проводимую программу пререабилитации, изменений показателей среднего давления в легочной артерии не отмечено, что свидетельствует о необходимости поиска
Clinical Parameters of the Studied Patients
|
Критерий Criterion |
Группа контроля n=36 Control Group n=36 |
Группа пререабилитации n=39 Prehabilitation Group n=39 |
p |
|
|
Возраст лет, Me [IQR] Age, years, Me [IQR] |
63,50 [60,00; 68,25] |
64,00 [58,50; 69,50] |
0,865 |
|
|
Жен. абс. (%) Women, abs. (%) |
11 (30,6 %) |
14 (35,9 %) |
0,748 |
|
|
Муж. абс. (%) Men, abs. (%) |
25 (69,4 %) |
25 (64,1 %) |
||
|
ИПЛ, Me [IQR] Pack-years index, Me [IQR] |
24 [11; 33] |
26 [12; 35] |
0,475 |
|
|
ИМТ, Me [IQR] BMI, Me [IQR] |
26,00 [23,09; 28,83] |
25,24 [22,71; 27,92] |
0,429 |
|
|
Ожирение Obesity |
Отсутствие Absence |
30 (83,3 %) |
34 (87,2 %) |
0,749 |
|
Наличие Presence |
6 (16,7 %) |
5 (12,8 %) |
||
Прим.: ИМТ – индекс массы тела; ИПЛ – индекс пачка/лет. Note: BMI – Body Mass Index
методов для его коррекции, и до конца не решенной проблемы выполнены функциональные пробы на догоспитальном этапе. компенсации данного показателя. Всем исследуемым пациентам Результаты функциональных тестов представлены в таблице 5.
Таблица 2
Показатели функции внешнего дыхания исследуемых пациентов
Table 2
Indicators of External Respiratory Function of the Studied Patients
|
Критерий Criterion |
Группа контроля n=36 Control Group n=36 |
Группа пререабилитации n=39 Prehabilitation Group n=39 |
p |
|
|
ФЖЕЛ, Me [IQR] FVC, Me [IQR] |
87,50 [83,00;94,25] |
87,00 [78,50; 93,00] |
0,599 |
|
|
Индекс Тииффно, Me [IQR] Tiffeneau Index, Me [IQR] |
0,96 [0,88; 1,08] |
0,96 [0,80; 0,99] |
0,417 |
|
|
ОФВ1, Mе (SD) FEV1, Mе (SD) |
82,97 (19,98) |
77,82 (15,63) |
0,216 |
|
|
ЖЕЛ, Me [IQR] VC, Me [IQR] |
84,00 [79,50; 91,75] |
84,00 [76,00; 90,50] |
0,563 |
|
|
Стадия ХОБЛ, абс. (%) COPD Stage, abs. (%) |
Нет ХОБЛ No COPD |
24 (66,7 %) |
25 (64,1 %) |
0,841 |
|
1 стадия Stage 1 |
4 (11,1 %) |
4 (10,3 %) |
||
|
2 стадия Stage 2 |
6 (16,7 %) |
9 (23,1 %) |
||
|
3 стадия Stage 3 |
2 (5,6 %) |
1 (2,6 %) |
||
Прим.: ФЖЕЛ – форсированная жизненная ёмкость лёгких; ОФВ1– объем форсированного выхода за 1 секунду; ЖЕЛ – жизненная емкость легких; ХОБЛ – хроническая обструктивная болезнь легких.
Note: FVC – Forced Vital Capacity of the lungs; FEV1 – Forced Expiratory Volume in 1 second; VC – Vital Capacity of the lungs; COPD – Chronic Obstructive Pulmonary Disease.
Таблица 3
Сопутствующая патология исследуемых пациентов
Table 3
Comorbidities of the Studied Patients
|
Критерий Criterion |
Группа контроля n=36 Control Group n=36 |
Группа пререабилитации n=39 Prehabilitation Group n=39 |
p |
|
|
Charlson, Me [IQR] Charlson, Me [IQR] |
5,00 [4,00; 5,25] |
4,00 [3,50; 5,00] |
0,223 |
|
|
ИБС абс. (%) CAD, abs. (%) |
Отсутствие Absence |
25 (69,4 %) |
23 (59,0 %) |
0,345 |
|
Наличие Presence |
11 (30,6 %) |
16 (41,0 %) |
||
|
ГБ, абс. (%) Hypertension, abs. (%) |
Отсутствие Absence |
14 (38,9 %) |
23 (59,0 %) |
0,269 |
|
1 стадии Stage 1 |
1 (2,8 %) |
0 (0,0 %) |
||
|
2 стадии Stage 2 |
13 (36,1 %) |
11 (28,2 %) |
||
|
3 стадии Stage 3 |
8 (22,2 %) |
5 (12,8 %) |
||
Продолжение Таблицы 3
|
ХСН, абс. (%) CHF, abs. (%) |
Отсутствие Absence |
23 (63,9 %) |
31 (79,5 %) |
0,301 |
|
ХСН 1 CHF 1 |
7 (19,4 %) |
5 (12,8 %) |
||
|
ХСН 2 CHF 2 |
6 (16,7 %) |
3 (7,7 %) |
||
|
СД, абс. (%) Diabetes Mellitus, abs. (%) |
Отсутствие Absence |
35 (97,2 %) |
33 (84,6 %) |
0,109 |
|
Наличие Presence |
1 (2,8 %) |
6 (15,4 %) |
Прим.: ИБС – ишемическая болезнь сердца; ГБ – гипертоническая болезнь; ХСН – хроническая сердечная недостаточность; СД – сахарный диабет.
Note: CAD – Coronary Artery Disease; Hypertension – Hypertension; CHF – Chronic Heart Failure; DM – Diabetes Mellitus.
Таблица 4
Показатели фракции выброса левого желудочка и среднего давления в легочной артерии
Table 4
Indicators of Left Ventricular Ejection Fraction and Mean Pulmonary Artery Pressure
|
Показатель Indicator |
Контрольная группа (n=36) Control Group (n=36) |
Пререабилитация (n=39) Prehabilitation Group (n=39) |
р |
|
ФВ1, % Me [IQR] EF1, % Me [IQR] |
63,50 [60,00; 67,00] |
64,00 [60,00; 65,00] |
0,377 |
|
ФВ2, % Me [IQR] EF2, % Me [IQR] |
63,50 [60,00; 67,00] |
65,00 [62,00; 70,00] |
0,011* |
|
СДЛА1, Me [IQR] MPAP1, Me [IQR] |
15,00 [13,28; 20,00] |
14,70 [12,60; 17,60] |
0,228 |
|
СДЛА2, Me [IQR] MPAP2, Me [IQR] |
15,00 [13,28; 20,00] |
15,40 [12,60; 18,50] |
0,316 |
Прим.: ФВ1 – фракция выброса до проведения рандомизации; ФВ2 – фракция выброса, проведенная пациентам перед оперативным вмешательством после пререабилитации; СДЛА1 – среднее давление в легочной артерии до проведения рандомизации; СДЛА2 – среднее давление в легочной артерии после проведенной пререабилитации
Note: EF1 – Ejection Fraction before randomization; EF2 – Ejection Fraction conducted on patients before surgery after prehabilitation; MPAP1 – Mean Pulmonary Artery Pressure before randomization; MPAP2 – Mean Pulmonary Artery Pressure after prehabilitation.
Таблица 5
Показатели лестничной пробы исследуемых пациентов
Table 5
Indicators of the Stair Climb Test of the Studied Patients
|
Показатель Indicator |
Контрольная группа (n=36) Control Group (n=36) |
Пререабилитация (n=39) Prehabilitation Group (n=39) |
р |
|
Лестничная проба1, M (SD) Stair Climb Test 1, M (SD) |
14,33 (2,10) |
14,72 (2,18) |
0,439 |
|
Лестничная проба2, Me [IQR] Stair Climb Test 2, Me [IQR] |
14,00 [13,00; 16,00] |
16,00 [14,00; 17,00] |
0,003* |
|
Челночный ход1, Me [IQR] Shuttle Walk 1, Me [IQR] |
310,00 [287,50; 340,00] |
310,00 [300,00; 330,00] |
0,737 |
|
Челночный ход2, M (SD) Shuttle Walk 2, M (SD) |
310,28 (40,53) |
326,92 (26,67) |
0,042* |
Прим.: Лестничная проба1 – показатели функциональной пробы до рандомизации; Лестничная проба2 – показатели функциональной пробы после пререабилитации.
Note: Stair Climb Test 1–- indicators of the functional test before randomization; Stair Climb Test 2 – indicators of the functional test after prehabilitation.
Анализ показателей лестничной пробы продемонстрировал, что пациенты после проведенной пререабилитации статистически значимо увеличили свои результаты в данной нагрузочной пробе (p=0,003). В результате выполнения программы комплексной пререабилитации пациенты значительно увеличили дистанцию прохождения челночного хода (р=0,042). Были проанализированы послеоперационные результаты у пациентов, а осложнения классифицированы согласно предложенной системе The Thoracic Morbidity and Mortality (TMM) [6] (табл. 6).
Таблица 6.
Осложнения исследуемых пациентов по классификации The Thoracic Morbidity and Mortality (TMM)
Table 6
Complications of the Studied Patients according to The Thoracic Morbidity and Mortality (TMM) Classification
|
Осложнение Complication |
Контрольная группа (n=36) Control Group n=36 |
Пререабилитация (n=39) Prehabilitation Group n=39 |
p |
|
Нет осложнений No complications |
8 (22,2 %) |
17 (43,6 %) |
0,103 |
|
Grade I |
7 (19,4 %) |
12 (30,8 %) |
|
|
Grade II |
13 (36,1 %) |
6 (15,4 %) |
|
|
Grade IIIA |
2 (5,6 %) |
2 (5,1 %) |
|
|
Grade IIIB |
0 (0 %) |
0 (0 %) |
|
|
Grade IVA |
4 (11,1 %) |
1 (2,6 %) |
|
|
Grade IVB |
0 (0 %) |
0 (0 %) |
|
|
Grade V |
2 (5,6 %) |
1 (2,6 %) |
|
|
Grade II–Grade V |
21 (58,3 %) |
10 (25,6 %) |
0,020 |
При анализе всех типов осложнений не была обнаружена статистически значимая разница между исследуемыми группами. Однако, при рассмотрении только тяжелых осложнений (Grade II–Grade V) было отмечено меньшее их количество в группе пациентов, прошедших пререабилитацию (р=0,020). Отдельно проанализированы кардиологические осложнения исследуемых группы, результаты представлены в таблице 7.
При изолированной оценке кардиологических осложнений было выявлено, что их частота составляет 16 из 26 (61,5 %) в контрольной группе и 7 из 22 (31,8 %) в группе пререабилитации. Статистический анализ показал, что значимые различия наблюдаются только по показателям Grade II–Grade V (p=0,040). Срок госпитализации пациентов значительно различался в зависимости от наличия пререабилитации: в контрольной группе он составил 12,08±2,26 дней, а в группе пререабилитации – 11,05±1,81 дней (p=0,031).
Таблица 7
Структура кардиологических осложнений
Table 7
Structure of Cardiac Complications
|
Осложнение Complication |
ГК CG |
ГП PG |
p |
|
Grade I |
|||
|
• Аритмия (ФП), эпизоды, не требующие фармакологической коррекции Arrhythmia (AF), episodes not requiring pharmacological correction |
4 |
3 |
0,610 |
|
Grade II • Аритмия (ФП), требующая фармаколо- |
2 |
0 |
0,140 |
|
гической коррекции Arrhythmia (AF), requiring pharmacological correction • Приступ стенокардии, требующий фармакологической коррекции Angina attack requiring pharmacological correction |
4 |
2 |
0,340 |
|
Grade III • Нарушение ритма сердца, требующее кардиоверсии электростимуляцией |
1 |
0 |
0,290 |
|
Cardiac rhythm disturbance requiring cardioversion |
1 |
1 |
0,950 |
|
• ОКС без гемодинамических нарушений, требующий инвазивного лечения ACS without hemodynamic disturbances, requiring invasive treatment |
|||
|
Grade IV • ОКС с развитием гемодинамических |
1 |
0 |
0,290 |
|
нарушений ACS with development of hemodynamic disturbances |
1 |
0 |
0,290 |
|
• Отек легких Pulmonary edema |
|||
|
Grade V |
|||
|
• Смерть Death |
2 |
1 |
0,510 |
|
Grade II–Grade V |
12 |
4 |
0,040 |
Прим.: ГК – контрольная группа (n=36); ГП – группа пререабилитации (n=39); ФП –фибрилляция предсердий; ОКС – острый коронарный синдром.
Note: CG – Control Group (n=36); PG – Prehabilitation Group (n=39); AF – Atrial Fibrillation; ACS – Acute Coronary Syndrome.
Обсуждение
Анатомическая резекция легкого является оптимальным методом лечения злокачественных новообразований легких, однако данный метод несет в себе риски возникновения по- слеоперационных осложнений, которые обусловлены тем, что пациенты имеют как правило выраженный коморбидный фон. По данным Европейского общества торакальных хирургов, частота послеоперационных сердечно-легочных осложнений варьируется от 7 до 43 %, а летальность составляет до 1,9 %.
Выявление пациентов с высоким риском послеоперационных сердечно-легочных осложнений и их профилактика посредством комплексной мультимодальной пререабилитации являются ключевыми факторами в повышении безопасности проводимой резекции легкого при злокачественных новообразованиях. С целью минимизации послеоперационных осложнений была разработана программа пререабилитации, которая направлена на улучшение физического состояния пациентов. Впервые данная стратегия была применена в колоректальной хирургии, при этом была продемонстрирована ее эффективность по сравнению с послеоперационной реабилитацией [7].
Улучшение физического и психологического состояния пациентов перед хирургическим лечением повышает шансы на более легкое течение послеоперационного периода, особенно среди пациентов с высоким риском сердечно-легочных осложнений. ИБС является частой встречаемой сопутствующей патологией у пациентов, которым необходимо проведение хирургического лечения рака легких. Частота встречаемости ИБС у пациентов, которым планируется хирургическое лечение, остается на высоком уровне по данным отечественной и зарубежной литературы. Данное исследование не является исключением – частота встречаемости ИБС у пациентов обеих групп составила 30,6 % и 41 % соответственно, что связано с тем, что большинство пациентов относится к старшей возрастной группе.
Согласно данным исследований зарубежных и отечественных авторов, частота развития ОКС в периоперационном периоде варьирует в пределах от 0,9 до 7 % [8–10], однако эти данные охватывают все виды оперативных вмешательств, а также не учитывают пациентов из группы высокого риска сердечно-легочных осложнений. По данным Smilowitz R. et.al., периоперационный ОКС чаще всего возникал у пациентов, перенесших сосудистые (2,0 %), трансплантационные (1,6 %) и торакальные (1,5 %) операции [11]. В нашем исследовании ОКС развился у 3 (4 %) пациентов, что обусловлено тем, что все пациенты были из группы высокого риска сердечно-легочных осложнений.
Послеоперационная аритмия у пациентов после резекции легкого чаще всего возникает на 2–3 сутки после оперативного вмешательства, частота встречаемости указанного осложнения варьируется от 6 до 46 %. [12, 13]. В проведенном исследовании у пациентов высокого риска развития кардиологических осложнений аритмия встречалась у 10 (13,3 %) исследуемых, причем в 1 случае пациенту потребовалась кардиоверсия электростимуляцией для восстановления ритма ввиду начавшихся гемодинамических нарушений и отсутствия эффективности лекарственной терапии.
Среднее давление в легочной артерии является важным предиктором сердечно-легочных осложнений в торакальной хирургии, однако на сегодняшний день существует ограниченное число исследований, посвященных данному вопросу [14]. Данный показатель оценивался на всех этапах обследования пациентов. Несмотря на проводимое комплексное предоперационное лечение, добиться изменения его показателей в лучшую сторону не удалось, поэтому необходим поиск дальнейших путей его коррекции.
Было продемонстрировано, что проведение высокоинтенсивной интервальной тренировки у пациентов в группе пререабилитации значительно улучшило показатели функциональных проб и показатели фракции выброса левого желудочка. Также несмотря на то, что кардиологические послеоперационные осложнения возникали в обеих группах пациентов, частота возникновения тяжелых осложнений Grade II – Grade V в группе пререабилитации была существенно ниже (p=0,040).
Недостатком настоящего исследования является малая выборка исследуемых групп пациентов. В дальнейшем необходимо увеличить количество исследуемых пациентов, а также оценить и другие возможные осложнения, в первую очередь церебро-васкулярные.
Вывод
Использование программы пререабилитации у пациентов высокого риска может позволить снизить риск развития кардиологических осложнений после хирургического лечения рака легкого.
Список литературы Эффективность мультимодальной пререабилитации у пациентов высокого риска кардиологических осложнений
- Nepogodiev D., Martin J., Biccard B., Makupe A., Bhangu A., Nepogodiev D. et al. Global burden of postoperative death. Lancet, 2019, рр. 393-401. https://doi.org/10.1016/S0140-6736(18)33139-8
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J. Clin., 2021.
- Ferguson M.K., Celauro A.D., Vigneswaran W.T. Validation of a modified scoring system for cardiovascular risk associated with major lung resection. Eur J. Cardiothorac Surg., 2012, Vol. 41(3), рр. 598-602. https://doi.org/10.1093/ejcts/ezr081
- Elia M. The MUST report. Nutritional screening of adults: a multidisciplinary responsibility. Red-ditch: BAPEN, 2003
- Zigmond A.S., Snaith R.P. The Hospital Anxiety and Depression Scale. Acta psychiatrica Scandinavica, 1983, № 67(6), рр. 361-370
- Seely, A. J., Ivanovic, J., Threader, J., Al-Hussaini, A., Al-Shehab, D., Ramsay, T., Gilbert, S., Maziak, D. E., Shamji, F. M., & Sundaresan, R. S. Systematic classification of morbidity and mortality after thoracic surgery. The Annals of thoracic surgery, 2010, № 90(3), рр. 936-942.
- Berkel A.E.M., Bongers B.C., Kotte H., Weltevreden P., de Jongh F.H.C., Eijsvogel M.M.M., Wymenga M., Bigirwamungu-Bargeman M., van der Palen J., van Det M.J., van Meeteren N.L.U., Klaase J.M. Effects of Community-based Exercise Prehabilitation for Patients Scheduled for Colorectal Surgery with High Risk for Postoperative Complications: Results of a Randomized Clinical Trial. Ann Surg., 2022, Feb,1, № 275(2), рр. e299-e306. https://doi.org/10.1097/SLA.0000000000004702
- Smilowitz N.R., Gupta N., Guo Y., Berger J.S., Bangalore S. Perioperative acute myocardial infarction associated with non-cardiac surgery. European Heart Journal, 2017, Volume 38, Issue 31, № 14, рр. 2409-2417.
- Ollila A., Vikatmaa L., Virolainen J., Vikatmaa P., Leppäniemi A., Albäck A., Salmenperä M., Pettilä V. Perioperative Myocardial Infarction in Non-Cardiac Surgery Patients: A Prospective Observational Study. Scand J Surg., 2017, Jun; № 106(2), рр. 180-186. https://doi.org/10.1177/1457496916673585
- Большедворская О.А., Протасов К.В., Улыбин П.С., Дворниченко В.В. Послеоперационный инфаркт миокарда у больных раком легкого: частота выявления, клинические особенности, прогностические факторы. Российский кардиологический журнал, 2020, № 25(11), рр. 3946. https://doi.org/10.15829/1560-4071-2020-3946
- Smilowitz N.R., Gupta N., Guo Y., Berger J.S., Bangalore S. Perioperative acute myocardial infarction associated with non-cardiac surgery. European Heart Journal, 2017, Volume 38, Issue 31, рр. 2409-2417
- Жихарев В.А., Порханов В.А., Бушуев А.С., Шолин И.Ю., Корячкин В.А. Предрасполагающие факторы развития фибрилляции предсердий у пациентов после анатомической резекции легких. Вестник анестезиологии и реаниматологии, 2019. Т. 16. № 1. С. 49-55. https://doi.org/10.21292/2078-5658-2019-16-1-49-55
- Джиоева О.Н., Драпкина О.М. Послеоперационная фибрилляция предсердий как фактор риска сердечно-сосудистых осложнений при внесердечных хирургических вмешательствах. Кардиоваскулярная терапия и профилактика, 2020. № 19(4). С. 2540. https://doi.org/10.15829/1728-8800-2020-2540
- Asakura K., Mitsuboshi S., Tsuji M., Sakamaki H., Otake S., Matsuda S. Pulmonary arterial enlargement predicts cardiopulmonary complications after pulmonary resection for lung cancer: a retrospective cohort study. J.Cardiothorac Surg., 2015, Vol. 10, рр. 113. https://doi.org/10.1186/s13019-015-0315-9


