Эффективность нейрофидбэк-терапии острой неспецифической вертеброгенной боли у лиц с повышенным уровнем тревожности
Автор: Быковский П.В., Шерман М.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нервные болезни
Статья в выпуске: 1 т.16, 2020 года.
Бесплатный доступ
Цель: оценить эффективность терапии острой неспецифической вертеброгенной боли и тревоги, как связанных состояний, с использованием неинвазивного метода биологической обратной связи (БОС), в частности методики нейрофидбэк. Материал и методы. В исследование включено 60 пациентов с неспецифическим рефлекторным вертеброгенным болевым синдромом в фазе обострения и легко повышенной тревожностью. Пациенты разделены на две равные группы (по 30 человек в каждой) методом случайной выборки в зависимости от проводимой терапии. В основной группе применяли стандартную базисную терапию и нейрофидбэк, пациентам группы сравнения проводилась только терапия по общепринятой методике. Эффективность лечения оценивали по снижению оценки болевого синдрома (по ВАШ), снижению тревожности (по SCL-90-R) и по увеличению индекса альфа-ритма. Результаты. В основной группе отмечены больший регресс болевого синдрома и значимое увеличение мощности альфа-колебаний, регистрируемое в биоэлектрической активности головного мозга. Все исследуемые факторы (уровень тревожности, степень выраженности острой неспецифической боли и индекс альфа-ритма) умеренно связаны между собой (р
Боль в нижней части спины, боль в шее, нейрофидбэк, острая неспецифическая боль, тревожность
Короткий адрес: https://sciup.org/149135529
IDR: 149135529 | УДК: 616-009.7
Текст научной статьи Эффективность нейрофидбэк-терапии острой неспецифической вертеброгенной боли у лиц с повышенным уровнем тревожности
значимой проблемой, приводящей к существенной нагрузке на систему здравоохранения и значительным экономическим потерям [1, 2]. Пациенты с вер-теброгенной болью могут иметь ассоциированные психологические факторы в виде тревоги, депрессии, страха перед движением, негативно влияющие на течение заболевания и отрицательно сказывающиеся на результатах лечения [3]. Присутствующая тревога часто реализуется в виде таких соматических симптомов, как усталость и мышечное напряжение [4]. Даже в случае, когда повышение тревожности служит защитной и пассивно ориентированной реакцией на болевой фактор [5], негативные эмоции, становясь непропорциональными ситуации (патологическими), в состоянии усилить боль [6]. Помимо этого, повышенная тревожность может способствовать учащению обострений, формированию стационарного течения болевого синдрома, переходу острой неспецифической вертеброгенной боли в хроническую [7]. Существующие доказательства того, что преодолением тревоги можно уменьшить алгический синдром, немногочисленны и преимущественно касаются коррекции хронической боли [8].
Одним из перспективных направлений немедикаментозной коррекции боли признана методика нейрофидбэк (neurofeedback — NFB), вариант биологической обратной связи (БОС), неинвазивная психофизиологическая техника лечения с системой биомониторинга, позволяющая сознательно изменять биоэлектрическую активность (БЭА) головного мозга с целью улучшения нейрорегуляции [9]. Для коррекции боли, уменьшения стресса и тревоги используется разновидность нейрофидбэк — альфа-тренинг, протокол, позволяющий синхронизировать альфа-активность головного мозга [9].
Цель: оценить эффективность терапии острой неспецифической вертеброгенной боли и тревоги, как связанных состояний, с использованием неинвазивного метода БОС, в частности методики нейрофидбэк.
Материал и методы. В исследование включены 60 пациентов с неспецифическим рефлекторным вертеброгенным болевым синдромом в фазе обострения, преимущественно умеренно и сильно выраженным. Проведение исследования одобрено локальным этическим комитетом. Больные рандомизированы в две терапевтические группы. Пациенты основной группы (30 человек: 7 мужчин и 23 женщины) получали стандартную базисную терапию (нестероидные противовоспалительные и миорелаксирующие средства, физиолечение, лечебная физкультура) и альфа-тренинг; средний возраст составил 50,7±2,5 года (M±m). У больных группы сравнения (30 человек: 8 мужчин и 22 женщины) применялась только базисная терапия; средний возраст 50,7±2,2 года (M±m). Согласно принятой клинической систематике (МКБ-10) диагноз соответствовал разделам: M50.3 (другая дегенерация межпозвоночного диска шейного отдела), M51.3 (другая уточненная дегенерация межпозвоночного диска), M53.8 (другие уточненные дорсопатии).
Клиническое исследование больных включало использование нескольких формализованных шкал в начале и в конце лечения. С целью определения степени выраженности и динамики боли применялись Визуальная аналоговая шкала (ВАШ). Для оценки выраженности тревожных и депрессивных нарушений использовался «Опросник выраженности психопатологической симптоматики» (SCL-90-R), инструмент регистрации актуального, присутствующего на данный момент, психологического симптоматического статуса [10, 11]. Шкала тревожности опросника рассматривает такие аспекты, как нервозность, напряжение, чувство страха и некоторые соматические компоненты тревожности. Каждый вопрос оце- нивался по пятибалльной системе (от 0 до 4), где 0 соответствует позиция «совсем нет», а 4 — «очень сильно». Пациенты с депрессией в исследование не включались.
Проводившийся в основной группе больных аль-фа-стимулирующий тренинг представлял собой релаксационную электроэнцефалографическую (ЭЭГ) БОС-терапию. ЭЭГ регистрировалась по биполярным затылочным отведениям (О1 и О2). Для обеспечения сеансов БОС использовался реабилитационный психофизиологический комплекс «Реакор» (НПКФ «Медиком ЛТД», Таганрог). Испытуемые располагались в затемненной комнате, в кресле, в удобной позе. На этапах тренинга обратная связь предоставлялась в виде музыкального сопровождения. Задачей обследуемого было усилить громкость и четкость звука, что увеличивало значение контролируемого параметра. Контролируемым параметром выступал суммарный показатель индекса альфа-ритма в процентах. Курс терапии методом БОС включал 10 сеансов альфа-тренинга, по 25 минут каждый.
Контроль эффективности NFB проводился посредством оценки индекса альфа-ритма во время первого и последнего сеансов. Эффективность биоуправления оценивалась по снижению оценки болевого синдрома (по ВАШ) и по приращению альфа-ритма.
Статистическая обработка результатов произведена с помощью пакета прикладных статистических программ Statistica v. 10.0 (StatSoft-Russia, 2011). Для оценки нормальности распределения количественных данных применялся критерий Шапиро–Уилка. В качестве показателей для величин, имеющих нормальное или близкое к нормальному распределение, использовались среднее арифметическое (M) и стандартная ошибка среднего (±m). Величины с отличным от нормального распределением описывали с помощью медианы (Ме) и межквартильного размаха (Q1-Q3). Качественные признаки были представлены в виде относительных величин (%). В зависимости от характера распределения для проверки гипотез о неравенстве величин применялись параметрические и непараметрические методы. В качестве критерия оценки статистической значимости различий выборочных средних использовался критерий Стьюдента для независимых и зависимых выборок. Для определения гомогенности дисперсий проводился тест Левена. В случае отличного от нормального распределения количественных данных для их оценки по группирующему качественному признаку применяли непараметрический критерий Манна–Уитни. Для сравнения двух связанных выборок по количественным признакам при распределении, отличном от нормального, использовали критерий Вилкоксона. Критическим уровнем статистической значимости различий (p) считался р<0,05. Для выявления связи между исследуемыми показателями применялся корреляционный критерий Спирмена.
Результаты. Среднее значение ВАШ в основной группе при поступлении составляло 5,0 (4,0–7,0) см, в группе сравнения 5,5 (5,0–7,0) см, что свидетельствует об умеренной интенсивности боли. По шкале «тревожность» опросника SCL-90-R исходно средний балл в основной группе и группе сравнения составлял 0,75 (0,50–1,30) и 0,75 (0,50–1,30) соответственно, подтверждая присутствие клинически значимого низкого уровня тревожности у обследуемых лиц.
В результате проведенной методом БОС терапии уровень тревожности по SCL-90-R в основной группе снизился значимо (p<0,001) (в среднем на 0,50±0,08 балла) и сопоставимо (на 0,52±0,10 балла, p<0,001) в группе сравнения. В основной группе наблюдалось менее рассеянное распределение величин за счет уменьшения их квартильного размаха, прежде всего в результате снижения числа случаев с наибольшим повышением уровня тревоги (рис. 1).
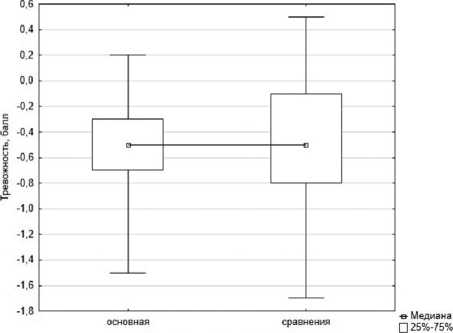
Группа наблюдения I Мин.-Макс.
Рис. 1. Изменение выраженности тревожности в группах к концу лечения (шкала «тревожность» опросника SCL-90-R), баллов
Отмечалось также уменьшение болевого синдрома до легкого как в основной группе (3,0 (2,0–4,0) см; p=0,0001), так и в группе сравнения (3,0 (3,0–4,0) см; p=0,0001). Полученные результаты подтвердили эффективность базисной терапии вертеброгенной мышечно-скелетной боли не только с использованием нейробиоуправления, но и без него. Однако t-тест показал (p=0,035), что у пациентов, получавших альфа-тренинг, выраженность боли по ВАШ к выписке составляла на 0,9 см меньше (регресс боли на 3,1±0,33 см), чем у пациентов группы сравнения (регресс боли на 2,2±0,28 см). Таким образом, включение методики нейрофидбэк в схему терапии острого болевого синдрома позволило добиться большего регресса боли (рис. 2).
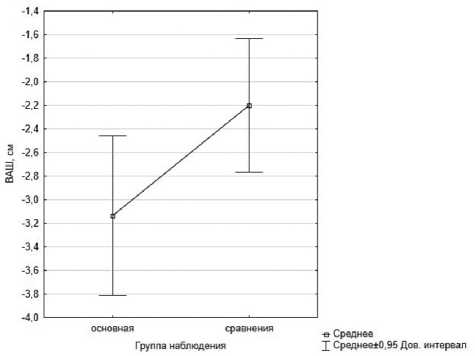
Рис. 2. Средние значения изменений интенсивности боли в группах (ВАШ), см
Помимо этого, у пациентов основной группы наблюдалось статистически значимое (p=0,004) увеличение мощности альфа-ритма от 39,77±2,65 до 45,94±2,81 % к заключительному сеансу альфа-тренинга (рис. 3).
В основной группе в начале лечения выявлялась значимая (p<0,05) умеренная отрицательная корреляционная связь между индексом альфа-ритма и тревожностью (r=–0,53), однако к концу лечения между данными показателями связь значительно ослабевала (r=–0,26). Вероятно, это произошло вследствие снижения уровня тревожности и уменьшения размаха показателя до 0,3 (0,50–1,30) балла.
Анализ коэффициента корреляции Спирмена также продемонстрировал умеренную отрицательную связь между динамикой боли и изменением мощности альфа-ритма (r=–0,39, p<0,05), а также близкую по силе, но уже положительную корреляцию между регрессом боли и снижением тревожности (r=0,41, p<0,05). Следовательно, к моменту завершения лечения прослеживалась взаимосвязь уменьшения выраженности боли и усиления синхронизации альфа-активности головного мозга, а также, по мере снижения тревожности, наблюдалось уменьшение боли.
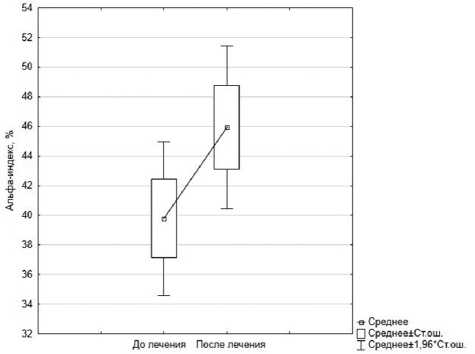
Рис. 3. Изменение величин альфа-индекса после альфа-тренинга, %
Обсуждение. Проведенное исследование обнаружило умеренную связь между всеми тремя изучаемыми факторами: тревожностью, острой скелетномышечной болью и альфа-активностью головного мозга. Показано, что у пациентов увеличение альфа-индекса связано с уменьшением боли и тревоги даже в случае легко выраженной тревожности.
В настоящее время достаточно мало известно о механизмах, связывающих симптомы тревоги у пациентов с неспецифической болью, и проблема оценки влияния БОС-обучения на произвольную регуляцию мозговой активности, тревожность и боль далека от полного ее разрешения. Тем не менее сведения, полученные в ходе данного исследования, во многом согласуются и могут быть частично объяснены с помощью результатов, опубликованных ранее [12, 13].
Вероятно, нейрофизиологический механизм реализации терапевтического воздействия альфа-тренинга (снижение модуляции восприятия острой боли) заключается в способности метода эффективно изменять ассоциированную с болью биоэлектрическую волновую активность головного мозга: повышать мощность альфа-ритма путем ингибирования тала- муса и нивелирования персистирующей таламокорковой дисритмии [14–16].
Кроме того, контролируемым параметром в протоколе альфа-лечения была наиболее распространенная полоса частот (диапазон частот 7–10 Гц), синхронизация с которыми вызывает глубокое мы-
шечное расслабление и психологическую релаксацию, уменьшающие ощущение боли [17].
Заключение. Результаты исследования подчеркивают необходимость внимания к тревожности как одному из психологических факторов, связанных с острой неспецифической болью в шее и нижней части спины. Представляется целесообразным использование неинвазивного нейромодулирующего метода БОС, в частности методики нейрофидбэк, с целью снижения уровня тревоги и коррекции острой умеренно выраженной вертеброгенной боли.
Список литературы Эффективность нейрофидбэк-терапии острой неспецифической вертеброгенной боли у лиц с повышенным уровнем тревожности
- Murray CJ, Vos T, Lozano R, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380: 2197-223. https:// doi.org/10.1016/S0140-6736 (12) 61689-4.
- Kurenkov E L, Makarova VV. Some aspects of pathogenesis of human intervertebral disc degenerative changes (review of literature). Vyatskiy meditsinskiy vestnik 2018; 58 (2): 52-7. Russian (Куренков Е. Л., Макарова В. В. Некоторые аспекты патогенеза дегенеративных изменений межпозвонкового диска у человека (обзор литературы). Вятский медицинский вестник 2018; 58 (2): 52-7).
- Ramond A, Bouton C, Richard I, et al. Psychosocial risk factors for chronic low back pain in primary care: a systematic review. Fam Pract 2011; 28 (1): 12-21. http://doi.org/10.1093/f ampra/cmq072.
- Hallegraeff JM, Kan R, van Trijffel E, Reneman MF. State anxiety improves prediction of pain and pain-related disability after 12 weeks in patients with acute low back pain: a cohort study. J Physiother 2020; 66 (1): 39-44. http://doi.org/10.1016/j. jphys. 2019.11.011.
- Esteve R, Ramírez-Maestre C, López-Martínez AE. Experiential avoidance and anxiety sensitivity as dispositional variables and their relationship to the adjustment to chronic pain. Eur J Pain 2011; 16 (5): 718-26. http://doi.org/10.1002/j. 15322149.2011.00035. x.
- Polo-Kantola P, Aukia L, Karlsson H, et al. Sleep quality during pregnancy: associations with depressive and anxiety symptoms. Acta Obstet Gynecol Scand 2017; 96 (2): 198-206. http://doi.org/10.1111/aogs. 13056.
- Kessler RC. The epidemiology of pure and comorbid generalized anxiety disorder: a review and evaluation of recent research. Acta Psychiatr Scand Suppl 2000; 102: 7-13. http://doi.org/10.1111 /j. 0065-1591.2000. acp29-02. x.
- Bean DJ, Johnson MH, Kydd RR. Relationships between Psychological Factors, Pain, and Disability in Complex Regional Pain Syndrome and Low Back Pain. Clin J Pain 2014; 30 (8): 647-53. http://doi.org/10.1097/ajp. 0000000000000007.
- Marzbani H, Marateb HR, Mansourian M. Neurofeedback: a comprehensive review on system design, methodology and clinical applications. Basic Clin Neurosci 2016; 7 (2): 143-58. http://doi.org/10.15412/J. BCN. 03070208.
- Derogatis LR, Lipman RS, Covi L. SCL-90: An outpatient psychiatric rating scale: Preliminary report. Psychopharmacol Bull 1973; 9: 13-28.
- Sereda Y, Dembitskyi S. Validity assessment of the symptom checklist SCL-90-R and shortened versions for the general population in Ukraine. BMC Psychiatry 2016; 16 (1): 300. https://doi.org/10.1186/s12888-016-1014-3.
- Jensen MP, Hakimian S, Sherlin LH, Fregni F. New insights into neuromodulatory approaches for the treatment of pain. J Pain 2008; 9: 193-9. https://doi.org/10.1016/j. jpain. 2007.11.003.
- Ecsy K, Jones AK, Brown CA. Alpha-range visual and auditory stimulation reduces the perception of pain. Eur J Pain 2017; 21 (3): 562-72. https://doi.org/10.1002/ejp. 960.
- Nickel MM, May ES, Tiemann L, et al. Brain oscillations differentially encode noxious stimulus intensity and pain intensity. Neuroimage 2017; 148: 141-7. https://doi.org/10.1016/j. neuroimage. 2017.01.011.
- Schulman JJ, Ramirez RR, Zonenshayn M, et al. Thalamocortical dysrhythmia syndrome: MEG imaging of neuropathic pain. Thal Rel Syst 2005; 3 (01): 33-9. https://doi.or g/10.1017/s1472928805000063.
- Camfferman D, Moseley GL, Gertz K, et al. Waking EEG cortical markers of chronic pain and sleepiness. Pain Med 2017; 18 (10): 1921-31. https://doi.org/doi:10.1093/pm/pnw294.
- Vernon DJ. Can Neurofeedback Training Enhance Performance? An Evaluation of the Evidence with Implications for Future Research. Applied Psychophysiol Biofeedback 2005; 30 (4): 347-64. http://dx.doi.org/10.1007/s10484-005-8421-4.


