Эффективность перорального иксазомиба в комбинации с леналидомидом и дексаметазоном при рецидивах/рефрактерных формах множественной миеломы в реальной клинической практике
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Иксазомиб - первый пероральный ингибитор протеасомы, одобренный в комбинации с леналидомидом-дексаметазоном (Ixa-Rd) для лечения пациентов с ММ, которые ранее получили ≥ 1 линии терапии. Одобрение было основано на результатах международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования III фазы TOURMALINE-MM1. Исследование TOURMALINE-MM1 продемонстрировало статистически значимое улучшение выживаемости без прогрессирования (PFS) при применении иксазомиба-Rd по сравнению с плацебо-Rd у пациентов с рецидивирующей/рефрактерной множественной миеломой (РРММ). Однако результаты клинических испытаний не всегда воплощаются в реальные результаты. Кроме того, зачастую они носят ретроспективный характер. Исследование REMIX является одним из крупнейших проспективных реальных анализов эффективности Ixa-Rd при РРММ. Среди пациентов, получающих Ixa-Rd в 2-й и 3-й линиях терапии, медиана беспрогрессивной выживаемости (mPFS) была аналогична для пациентов, ранее получавших леналидомид (19,5 мес.), и не получавших его (22,6 мес., p=0,29). mPFS составила 19,1 мес. у пациентов моложе 80 лет и 17,4 мес. у пациентов в возрасте 80 лет и старше (p=0,06). Результаты исследования REMIX согласуются с результатами TOURMALINE-MM1и подтверждают пользу комбинации Ixa-Rd в реальной клинической практике. Схема Ixa-Rd зарекомендовала себя как безопасный и эффективный вариант лечения для реальных пациентов с рецидивами/рефрактерными формами множественной миеломы.
Рецидив и рефрактерная множественная миелома, реальные доказательства, иксазомиб, эффективность, безопасность, пожилые люди
Короткий адрес: https://sciup.org/170207414
IDR: 170207414
Текст научной статьи Эффективность перорального иксазомиба в комбинации с леналидомидом и дексаметазоном при рецидивах/рефрактерных формах множественной миеломы в реальной клинической практике
Принятие решения о лечении таких пациентов становится все более сложным. Устойчивость к одному или нескольким препаратам имеет особенно плохие результаты выживаемости, что является одним из наиболее важным факторов, влияющих на выбор терапии у пациента с прогрессированием заболевания. Кроме того, у части пациентов наблюдается развитие нежелательных явлений (НЯ), требующих снижения доз препаратов или даже отмены терапии, поэтому остается потребность в разработке не только эффективной, но и переносимой терапии [1,5]
Оптимальная стратегия при РРММ нередко представляет собой проблему для практикующих врачей. При выборе лечебного подхода чрезвычайно важным является анализ 3 групп факторов, определяющих успех лечения [1, 6, 7]:
-
1. Связанные со специфическим лечением:
-
• Тип предшествующей терапии, включая аутологичную трансплантацию гемопоэтических стволовых клеток (АутоТГСК)
-
• Глубина и продолжительность предшествующего ответа
-
• Чувствительность/рефрактерность к предшествующей терапии
-
• Безопасность/переносимость предшествующей терапии
-
2. Связанные с заболеванием:
-
• Клинический vs биохимический рецидив
-
• Агрессивность рецидива и темпы развития болезни
-
• Оценка факторов риска (цитогенетические аномалии высокого риска, экстрамедуллярное заболевание, быстрое увеличение опухолевой нагрузки)
-
• Время до развития рецидива
-
3. Связанные с пациентом:
-
• Возраст/ослабленность
-
• Почечная недостаточность
-
• Нарушение функции печени
-
• Коморбидность
-
• Соматический статус
-
• Социальные факторы
-
• Предпочтение пациента
Иксазомиб – первый пероральный ингибитор протеасомы, который был одобрен в Европе и США в комбинации с леналидомидом и дексаметазоном для лечения пациентов с РРММ, получивших, по крайней мере, одну линию предшествующей терапии, и зарегистрирован в Российской Федерации в 2017 г.
Клиническое исследование TOURMALINE-MM1 является базовым по оценке эффективности и безопасности триплета иксазомиб+леналидомид+дексамета зон (Ixa-Rd) у пациентов с РРММ [8, 9]. Исследование было проведено в популяции пациентов, получивших 1 линию (медиана) предшествующей терапии (диапазон 1–3). Убедительно продемонстрирована значительно более длительная выживаемость без прогрессирования (PFS) в группе пациентов, получавших иксазомиб в комбинации с дуплетом Rd, чем в группе с плацебо-Rd (20,6 мес. по сравнению с 14,7 мес.) и значительное увеличение общей частоты ответа. Преимущество по PFS получено во всех выделенных подгруппах пациентов, включая низкий клиренс креатинина, стадию III по ISS и возраст >75 лет. Неожиданным оказался факт отсутствия различий медианы PFS в группах высокого и стандартного риска (21,4 мес. и 20,6 мес. соответственно). Причем преимущество в отношении PFS в группе Ixa-Rd по сравнению с плацебо-Rd было устойчивым при анализе различных пороговых значений для положительных результатов del(17p) и t(4;14).
Результаты этого двойного слепого плацебо-кон-тролируемого исследования фазы III показали, что добавление иксазомиба к Rd значительно улучшило не только эффективность лечения, но и качество жизни, поддерживая ее в течение всего цикла лечения, что отражает ограниченную дополнительную токсичность, наблюдаемую при терапии IxaRd по сравнению с плацебо-Rd. Эти результаты подтверждают целесообразность долгосрочного использования схемы IxaRd без какого-либо пагубного воздействия на качество жизни пациентов [10].
Важен и тот факт, что ингибиторы протеасомы и даратумумаб назначались чаще в группе плацебо-Rd из-за более раннего прогрессирования заболевания по сравнению с группой иксазомиб-Rd. Кроме того, у пациентов, которые не получали последующую терапию, наблюдалась бо́льшая польза от применения иксазомиба-Rd, чем плацебо-Rd, по сравнению с теми, которые получали терапию.
Эффективность Ixa-Rd нашла подтверждение в исследовании, проведенном в Китае, в котором также отмечено существенное (на 67%) улучшение PFS при применении иксазомиба в сравнении с плацебо (HR= 0,598, 95%CI: 0,367–0,972; p = 0,035; медиана составила 6,7 мес. (95%CI: 4,63–9,53) против 4,0 мес. (95%CI: 2,79–5,52) [11]. В этом исследовании отмечено улучшение общей выживаемости (OS) на
139% при применении иксазомиба-Rd по сравнению с плацебо-Rd (р=0,001), причем с 10-месячной разницей между группами. Преимущество OS при применении иксазомиба-Rd наблюдалось во всех анализируемых подгруппах, и не зависело от возраста, статуса заболевания, предшествующей терапии и функции почек.
В недавно увидевшем свет 2 томе федерального руководства по гематологии, представлены сведения, охватывающие результаты данных клинических исследований, которые демонстрируют роль иксазомиба в лечении рецидивирующей/рефрактер-ной ММ [1].
Цель настоящего обзора . Обновление и систематизация данных об эффективности и безопасности иксазомиба в комбинации с леналидомидом и дексаметазоном при рецидивах/рефрактерных формах множественной миеломы, с акцентом на реальную клиническую практику и с учетом факторов, определяющих успех лечения.
Почему это важно? Подсчитано, что значительная доля типичных пациентов с РРММ (примерно 40%) исключена из клинических исследований, что делает адаптацию результатов клинических разработок в реальной клинической практике достаточно сложной и неопределенной.
Материалы и методы . Для достижения поставленной цели нами проанализированы основные научные публикации, посвященные применению триплета иксазомиб+леналидомид+дексаметазон (IxaRd) в реальной клинической практике. Для изучения отобраны 39 работ, опубликованных в преобладающем большинстве в течение последних 10 лет. Включение источников более ранних периодов публикации допускалось в связи с высокоинформативным материалом либо если это были первоисточники.
Результаты. Иксазомиб (Ixa) – это селективный обратимый ингибитор 20S протеасомы, который был отобран из библиотеки ингибиторов протеа-сомы структурных производных борной кислоты на основании ряда существенных отличий физикохимических свойств препарата от бортезомиба. Подобно бортезомибу и карфилзомибу, иксазомиб связывается преимущественно с его β5-субъединицей, обладающей химотрипсиноподобной активностью. В миеломных клетках иксазомиб ингибирует про-теасомную активность с концентрацией полумакси-мального ингибирования (IC50), равной 3,4 нмоль. Связь с β1- и β2-субъединицами происходит при концентрациях, многократно превышающих терапевтическую, и поэтому не имеет практического значения. Иксазомиб быстро абсорбируется после приема через рот с достижением максимальной концентрации в плазме через 1 час. Абсолютная биодоступность одной принятой капсулы составляет 58%. Короткий период диссоциации иксазомиба от протеасомы (18 мин против 110 мин для бортезомиба) обеспечивает лучшее распределение в тканях [12, 13].
В доклинических исследованиях иксазомиб продемонстрировал, во-первых, активное воздействие на жизнеспособность и апоптоз опухолевых клеток, а во-вторых – синергизм с леналидомидом. Иксазомиб запускает апоптоз миеломных клеток как по внутреннему (каспаза-9), так и внешнему (каспаза-8) сигнальным путям через активацию проапоптотических белковых систем p53-p21, p53–NOXA–PUMA и Rb–E2F; индуцирует стресс эндоплазматического ретикулума в ответ на нарушение холдинга белков, а также ингибирует ядерный фактор каппа В (NF-kB) [1, 13].
Для большинства больных ММ пероральный препарат всегда в приоритете. Как при назначении любого нового терапевтического препарата, выбор Ixa основан на поиске баланса между эффективностью, токсичностью и характеристиками пациента, включая возраст, слабость/хрупкость или цитогенетические аномалии. При раннем рецидиве выбор лечения в основном ориентирован на рефрактерность к леналидомиду и/или бортезомибу. У пожилых пациентов оценка хрупкости и сопутствующих заболеваний имеет большое значение для выбора лечения [1, 1417]. Пожилой возраст часто связан с недостаточностью функции органов, что может снизить переносимость и повлиять на результаты терапии. Однако строгие критерии приемлемости в рандомизированных клинических испытаниях (РКИ) исключали пациентов с сопутствующими заболеваниями, такими как нарушение функции почек и сердечно-сосудистые заболевания, ограничивая обобщаемость РКИ.
Именно у такой категории пациентов наличие полностью пероральной комбинации может представлять большой интерес. Недопредставленность пожилых пациентов и пациентов с распространенными сопутствующими заболеваниями и пониженным соматическим статусом в РКИ может привести к заметным пробелам в реальной клинической практике [18, 19].
Определение наиболее подходящих последовательностей лечения для каждого пациента, с учетом их характеристик и использованием каждой линии терапии, требует большего понимания в реальной практике [15, 20-22]. Реальные исследования необходимы для обобщения результатов на реальных популяциях пациентов.
В этой связи мы хотим обратить внимание именно на реальную клиническую практику. Во-первых, рассмотрим результаты исследования Sokol J. et al., целью которого была оценка эффективности и безопасности триплета Iха-Rd в реальной клинической практике [22]. Исследование привлекает внимание уже тем, что были проанализировали результаты лечения пациентов с РРММ, получавших Iха-Rd в сопоставлении с результатами исследования TOURMALINE-MM1. Проанализированы результаты 106 пациентов с ММ, получавших лечение IxaRd в 2 академических центрах Словакии до прогрессии, непереносимой токсичности или смерти. Медиана возраста больных на момент постановки диагноза составила 63 года. Медиана числа линий предшествующей терапии составляла 2 (диапазон 1-7) по сравнению с 1 линией в исследовании TOURMALINE-MM1. Большинство пациентов в обеих исследуемых популяциях имели рецидив заболевания: 79,2% в настоящем исследовании и 77% в исследовании TOURMALINE-MM1. Основная часть пациентов имела высокий риск по шкале ISS (56%), в то время как в исследовании TOURMALINE-MM1 доля больных с ISS III равнялась 12%. Медиана времени от момента постановки диагноза ММ была короче (28,5 против 44,2 месяца), т.е. пациенты в данном когортном исследовании находились на лечении иксазомибом более короткий промежуток времени.
После 29 месяцев наблюдения, 41,5% пациентов все еще продолжали лечение, медиана беспрогрес-сивной выживаемости (mPFS) составила 43 мес. (95%CI: 35,6-50,4), то есть почти вдвое больше, чем в исследовании TOURMALINE-MM1. Был проведен подгрупповой анализ PFS с учетом возраста, стадий по ISS, числа линий предшествующей терапии, цитогенетического риска и ответа на лечение. Выявлена тенденция к более длительной выживаемости без прогрессии у молодых пациентов в сравнении с пожилыми пациентами (≤ 65 лет: 43 мес. [95%CI: 25,7-52,3] против > 75 лет: 13 мес. [95%CI: 0,0–28,0]); у пациентов с ISS I по сравнению с продвинутым стадиями ММ; у пациентов, которые получили меньшее количество предшествующих линий терапии (1 линия: 45 мес. [95%CI: 43,4–46,6] против 2-х линий: 33 месяца [95%CI: 24,3–41,7]); у пациентов с лучшим ответом на терапию (полный ответ: не достигнут против стабилизации: 7 мес. [95%CI: 25,0–41,3]).
Обращала на себя внимание совершенно иная ситуация среди пациентов стандартного и высокого цитогенетического риска. Медиана PFS у пациентов со стандартным риском составила 39 месяцев (95% CI: 25,8–52,2), а при высоком риске 31 мес. (95%CI: 29,0– 33,0), то есть существенных различий не обнаружено, как и в клиническом исследовании TOURMALINE-MM1. Медиана общей выживаемости не достигнута. Общий уровень ответа составил 74,5%. Пациенты, которые получили ранее только одну линию терапии, достигли полного ответа (13,1%), очень хорошего (охЧО) или частичного ответа (80,4%). У пациентов, получивших более двух линий предшествующей терапии, частота охЧО или частичного ответа (ЧО) составила 27,3%, стабилизация – 50% и прогрессия ММ наблюдалась у 22,7% больных. Ни один из этих пациентов не достиг полного ответа.
В представленном исследовании больные РРММ получили Ixa-Rd в реальной клинической практике. Длительность наблюдения в этом исследовании была на 6 месяцев дольше, чем в TOURMALINE-MM1, изученная популяция моложе, но с более продвинутыми стадиями ММ по ISS, с большим числом линий предшествующей терапии, и почти все пациенты ранее получали бортезомиб в отличие от исследования TOURMALINE-MM1. Тем не менее, mPFS в два раза превысила таковую в исследовании TOURMALINE-MM1 (43,0 против 20,3 месяца). Это преимущество скорее всего было связано с тем, что пациенты, вошедшие в исследование, имели менее длительный анамнез заболевания, чем пациенты в TOURMALINE-MM1 [23]. Такое предположение подтверждается тем, что пациенты, получившие меньше линий предшествующей терапии, достигали более глубоких ответов и более длительной беспрогрессивной выживаемости. Исследование Sokol J. et al. [22] не выявило преимущества PFS у пациентов с цитогенетическими аномалиями высокого риска над стандартным риском, что наблюдалось и в исследовании TOURMALINE-MM1. Лечение по схеме Ixa-Rd переносилось вполне удовлетворительно. Чаще всего все НЯ можно было отнести к 1-2 ст. тяжести
В целом сходные результаты показало еще одно исследование, целью которого была также оценка результатов лечения пациентов с РРММ в реальных условиях комбинацией на основе иксазомиба [24]. Исследование, как и предыдущее, носило ретроспективный характер. В общей сложности в анализ вошло 78 больных ММ разного пола с рецидивом/реф-рактерностью. Медиана возраста составила 68 лет (диапазон 38-90), медиана наблюдения – 22 мес. (диапазон 1-39), а длительности заболевания с момента постановки диагноза – 55 мес. Болезнь была оценена как "клинически агрессивная" у 37% пациентов. 64% больных получили иксазомиб во 2-й линии терапии, 19% – в 3-й линии. Большинство больных (87%) ранее получали бортезомиб-содержащие режимы терапии, 41% – иммуномодуляторы (леналидомид, талидомид). 35% больных рецидивировали после выполненной ранее АутоТГСК. У двадцати девяти (48% из 60 доступных) больных выявлены хромосомные аберрации высокого риска t(4:14), t(14:16), del17p) или (+1q21). Большинство пациентов (82%) получали иксазомиб в сочетании с леналидомидом и дексаметазоном (IxaRd).
Частота общего ответа (ЧОО) на комбинацию IxaRd составила 88%. 45% пациентов достигли охЧО или выше. В исследовании не выявлено существенной разницы в зависимости от числа линий предшествующей терапии. Так, ЧОО при назначении иксазо-миба во 2-й, 3-й и > 3-х линий терапии достигла 85%, 100% и 82% соответственно. Медиана PFS составила 77% и 47% на 12 и 24 мес. соответственно. Медиана OS не была достигнута, а 12-месячная и 24-месячная составила 91% и 80% соответственно. Высокая активность ЛДГ, пожилой возраст (> 65 лет) и клиническая агрессивность болезни были связаны с худшим значением PFS. Не было обнаружено никакого влияния на PFS цитогенетического риска, признаков CRAB синдрома, предшествующей противоопухолевой терапии и АутоТГСК.
По мнению авторов, схема IxaRd является эффективным и безопасным режимом терапии при РРMM в реальных условиях и вполне сопоставима с данными РКИ. Терапия IxaRd имела наиболее благоприятные результаты среди пациентов, которые оставались без прогрессирования ≥ 24 месяца после индукции бортезомиб-содержащими режимами.
Такие оптимистичные результаты подтверждаются сообщениями нескольких других исследовательских групп. Так, были представлены данные реальной клинической практики из чешского регистра моноклональной гаммапатии и INSIGHT [25]. Опубликованы также позитивные результаты венгерской когорты больных с РРММ, получавших Ixa-Rd [26].
В таблице 1 представлено несколько основных исследований по оценке эффективности и безопасности Ixa-Rd, в том числе в реальной клинической практике [24, 26, 29, 30, 31].
Более подробно мы хотим остановиться на результатах исследования REMIX, которое является одним из крупнейших проспективных исследований, предоставивших убедительные доказательства эффективности комбинации Ixa-Rd в реальных условиях [27]. REMIX — это неинтервенционное многоцентровое исследование, проведенное во Франции у пациентов с РРММ, которым был назначен пероральный иксазомиб в сочетании с леналидомидом и дексаметазоном (Ixa-Rd). В исследование были включены взрослые пациенты, получившие не менее 1 линии предшествующей терапии, а Ixa должен был быть инициирован одновременно с Rd. Первичной конечной точкой были mPFS и показатели PFS, оцениваемые в сроки наблюдения 12, 18, 24 и 36 месяцев. Вторичные конечные точки включали общую выживаемость (ОS), определяемую как временной интервал с даты первой дозы Ixa до даты смерти, через 12, 18, 24, 36, 42 и 48 месяцев и продолжительность ответа (DoR) – интервал между лучшим ответом на лечение до прогрессирования или смерти, который когда-либо происходил первым среди пациентов с по крайней мере частичным ответом (ЧО). Данные собирались каждые 3 месяца в течение первых двух лет, а затем каждые 6 месяцев до окончания исследования. Сведения о безопасности отслеживали в течение 30 дней после последнего введения лечебной дозы препаратов. Коморбидность оценивали с помощью индекса ко-морбидности Чарльсона, а слабость/хрупкость с помощью упрощенной шкалы слабости, включающей возраст, индекс коморбидности Чарльсона и ECOGPS (шкалы оценки тяжести пациента) [27]. PFS, OS и ЧОО определяли в целом и в рамках подгрупп: в соответствии с линиями лечения (вторая – L2, третья – L3 и ≥ четырех – L4 +), возрастными группами больных (< 80 лет по сравнению с ≥ 80-летними), слабостью/хрупкостью (хрупкие vs не хрупкие), предыдущим лечением леналидомидом, времен- ным интервалом между последним использованием леналидомида и Ixa-Rd (≤ 12 месяцев по сравнению с > 12 месяцев), почечной недостаточностью (клиренс креатинина > 50 мл/мин, 30–50 мл/мин, ≤ 30 мл/мин), АутоТГСК, сопутствующими заболеваниями (индекс Чарльсона) и цитогенетическими аномалиями на исходном уровне (стандартный риск по сравнению с высоким, определяемым как del(17p) и/или t(4;14) и/или t(14;16).
В исследование REMIX были включены 376 пациентов, которым инициировали Ixa одновременно с Rd в период с августа 2017 года по октябрь 2019 года. 32 пациента в ходе обследования и уточнения анамнеза были исключены из анализа. Перед включением в исследование медиана возраста большинства больных составила 71 год, но 69 (18,4%) пациентов были старше 80 лет. 48,8% пациентов были отнесены к слабым, а 62,8% имели по крайней мере одну сопутствующую болезнь. 18,2% пациентов имели ECOG-PS ≥ 2, включая 4 пациентов (1,9%) с ECOG-PS=3. Большинство пациентов, 227 (60,4%), получили только 1 предшествующую линию терапии, но были и такие, которые получили до 4 и более линий терапии. Так, схема Ixa-Rd была назначена в качестве 2-й линии 60,0% пациентам, 3-ей – 18% и ≥ 4-й – 22%. Преобладающая часть пациентов (91,7%) ранее лечились бортезомибом, 65,1% – иммуномодуляторами (39,2% – леналидомид и 42,4% – талидомид) и у 14% пациентов предшествующее лечение включало даратумумаб. В качестве 2-й, 3-й и ≥ 4-й линии терапии леналидомид получали 10,6%, 73,5% и 91,3% больных соответственно. Медиана продолжительности предшествующего приема леналидомида была одинаковой независимо от линии терапии (16,0–18,0 месяцев), а медиана времени от последней дозы леналидомида до начала Ixa-Rd составила 16 месяцев. Около половины пациентов (44,5%) в анамнезе имели АутоТГСК; 53,3% пациентов в третьей или ≥ 4-й линии терапии по сравнению с 38,8% во второй линии.
В основном Ixa был назначен в полной дозе 4 мг/ день (90,4% пациентов), в то время как остальным пациентам доза была снижена до 3 мг/день или меньше. Начальная суточная доза леналидомида варьировала от 25 мг (61,3% больных) до 20 мг (4,0% пациентов), причем 16,9% больных получали15 мг/ день, 17,7% – 10 мг/день или менее. Дексаметазон назначался в суточной дозе 40 мг или 20 мг у 52,7% и 43,0% пациентов соответственно.
После медианы наблюдения равной 28,7 (диапазон 0,4 – 49,5) месяцев, у 226 из 358 (63,1%) пациентов наблюдалось прогрессирование заболевания или наступил летальный исход. Кривые PFS по Каплан-Мейеру в общей популяции больных показаны на рисунке 1, из которого следует, что mPFS в целом составила 19,1 мес. (95% CI [15,9–21,5]) (рисунок 1a), но у пациентов, получавших Ixa-Rd в качестве второй линии терапии (L2) – 21,5 мес. (95% CI
[19,2–24,8]), а в качестве третьей линии (L3) – 21,9 них линий терапии (L4+) – 5,8 мес. (95% CI [4,8–9.4]) мес. (95% CI [16,2–28,7]), четвертой или более позд- (рисунок 1b).
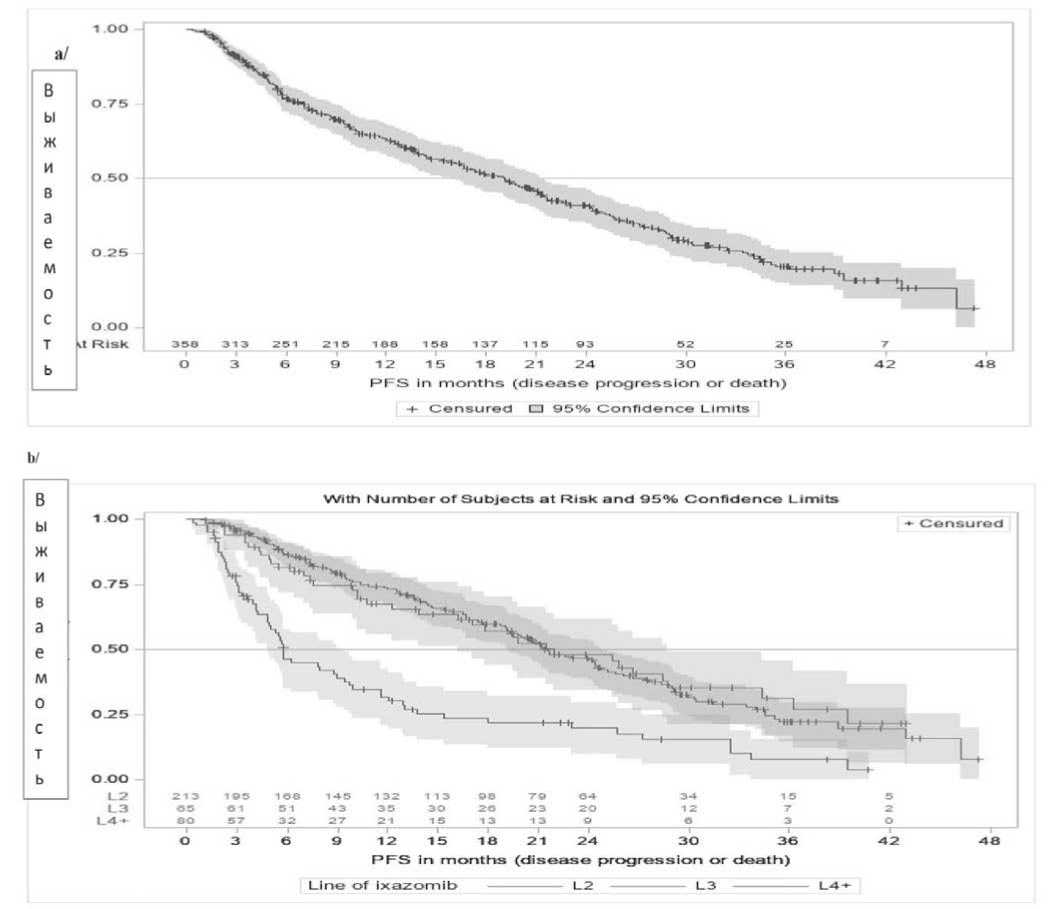
Рисунок 1. Распределения PFS с 95% доверительными интервалами в a/ общей популяции; b/ пациенты, получающие Ixa-Rd в качестве терапии второй линии или в качестве терапии третьей линии и за ее пределами
Примечание. PFS in months (disease progression or death) – беспрогрессивная выживаемость в месяцах (прогрессия или смерть); Line of ixazomib – линия терапии иксазомибом
Весьма показательны оказались результаты лечения в выделенных подгруппах больных. Так, у пациентов моложе 80 лет mPFS составила 19,1 месяца (95% CI [15,9–21,9]), а у больных в возрасте 80 лет или старше – 17,4 месяца (95% CI [10,8–23,0]) (p=0,06), то есть без существенных отличий (рисунок 2c). В то же время mPFS была значительно ниже у ослабленных пациентов по сравнению с сохранным соматическим статусом (14,6 мес. (95% CI [10,8–21,3] по сравнению с 21,5 мес. (95% CI [17.0–29.1]), p <0,01, рисунок 2d). Однако примечательно, что mPFS была сходной у пациентов с и без предшествующей АутоТГСК (19,8
месяца (95% CI [14,3, 24,8]) и 17,8 месяцев (95% CI [14,4–21,5]) p=0,30), а также в подгруппах коморбид-ных больных (с сопутствующими заболеваниями: 19,5 мес. (95% CI [12,8–24,0]) и без сопутствующих заболеваний: 18,8 мес. (95% CI [15,3–21,9]; p=0,67). Что касается цитогенетического профиля, то, как и в выше приведенных исследованиях, не обнаружено существенных различий – mPFS составила 21,2 мес. (95% CI [14,7–25,6]) в группе стандартного риска, 19,8 мес. (95% CI [16,4–29,0]) в группе высокого риска и 15,4 месяца (95% CI [11,6–21,0]) в группе без оценки степени риска (p=0,07).
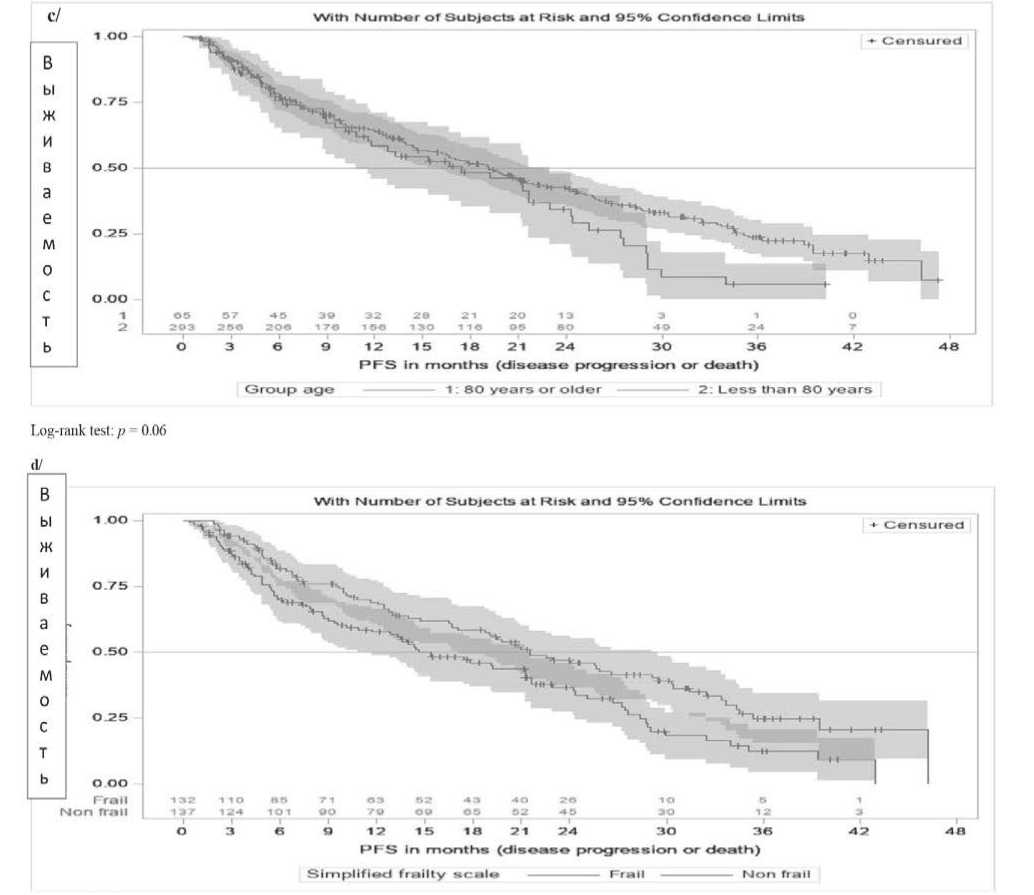
Рисунок 2. Распределения PFS с 95% доверительными интервалами в c/ пациенты в возрасте до 80 лет и старше; d/ ослабленные больные (Fral) и пациенты с сохранным соматическим статусом (Non frail). Примечание. Simplified frailty scale – упрощенная шкала слабости/хрупкости
ЧОО составила 73,1% в группе больных с Ixa-Rd, причем ответ был сопоставимым в возрастных группах: 72,4% у людей в возрасте <80 лет и 76,8% у людей в возрасте ≥ 80 лет. Ответ был выше в тех случаях, когда Ixa-Rd применялся в качестве 2 и 3 линии терапии (80,3% и 70% соответственно) и меньше, когда в четвертой или более линий терапии (54,4%). Медиана DoR в целом составила 10,9 мес. (95% CI [8,7–14,8]).
На момент настоящего анализа медиана OS в целом еще не была достигнута. Оценочный показатель OS на 12 мес., 24 мес., 36 мес., 42 мес. и 48 мес. составил 82,2%, 71,6%, 58,3%, 55,4% и 52,4% соответственно. Только в подгруппе пациентов, получавших лечение IxaRd в L4+, медиана OS достигнута и составила 18,5 мес. (95% CI [11,0, 33,7]). У пациентов старше 80 лет медиана OS составила 31,6 месяца (95% CI [23,0, не достигнуто]).
При фокусе на вторую и третью линию терапии, обращало на себя внимание, что mPFS была аналогична в подгруппах пациентов, ранее получавших леналидомид (mPFS – 19,5 мес. (95% CI [14,3–28,4]) и у пациентов, не получавших леналидомид (mPFS – 22,6 мес., 95% CI [20,0–26,7]), p=0,29 (рисунок 3) независимо от каких-либо различий в характеристиках пациентов в обеих подгруппах. Эти результаты были похожи лишь в том случае, когда анализ был сосредоточен на пациентах второй линии. У предварительно подвергшихся воздействию леналидомидом пациентов, когда время между последней дозой леналидомида и началом Ixa-Rd ≤ 12 мес., mPFS составила 7,4 мес. (95% CI [4,9–17,8]), в то же время, когда этот период превысил 12 мес. – 25,8 мес. (95% CI [15,9-не достигнуто]), (p=0,0043).
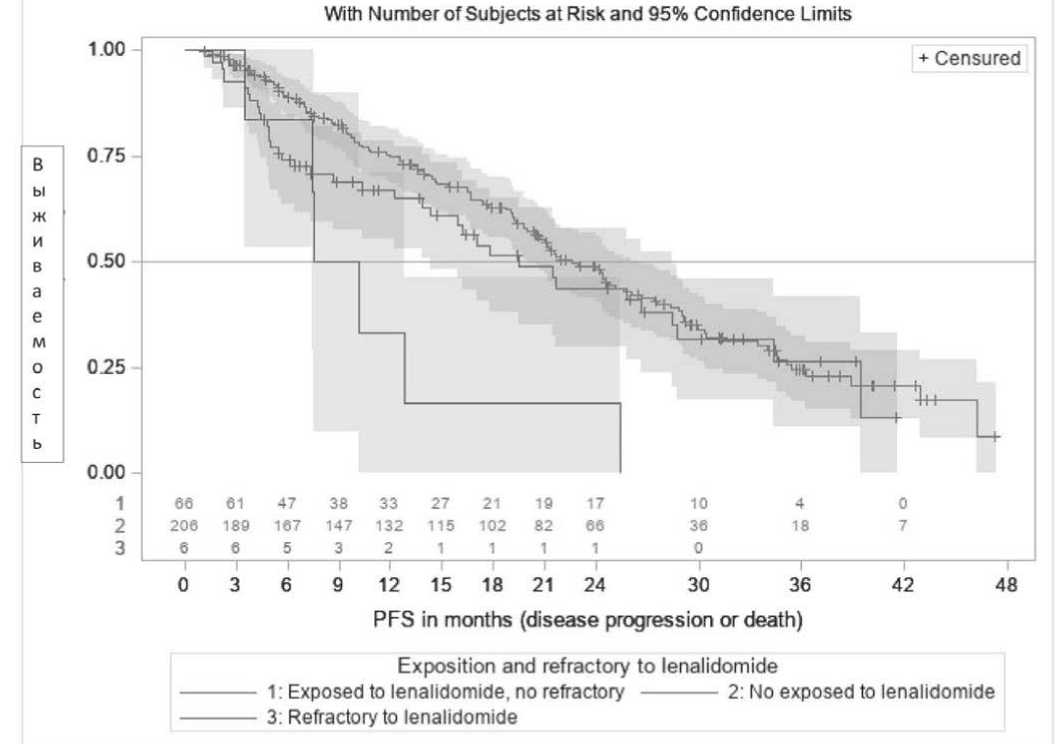
Рисунок 3. Распределения PFS с 95% доверительными интервалами у пациентов, получающих Ixa-Rd в L2 и L3 в соответствии с предшествующей терапией леналидомидом.
Примечание. Exposed to lenalidomide, no refractory – получавшие леналидомид, не рефрактерные;
No exposed to lenalidomide - не получавшие леналидомид; Refractory to lenalidomide – рефрактерные к леналидомиду;L2 – вторая линия; L3 – третья линия.
Снижение дозы Ixa в ходе лечения было выполнено у 99 пациентов (26,4%), а леналидомида – у 129 пациентов (34,4%). Временные приостановки лечения зарегистрированы у 83 пациентов (22,1%) с Ixa и у 80 пациентов (21,3%) с леналидомидом. В итоге 278 (74,1%) прекратили использование Ixa и 215 (57,3%) леналидомида. Прекращение Ixa было вызвано токсичностью у 21% (79/376) пациентов и прогрессированием у 34,6% (130/376) пациентов. Медиана продолжительности лечения Ixa составила 12,4 мес.
Неблагоприятные события/нежелательные явления (НЯ) были зарегистрированы у 294 пациентов (78,2%), получавших Ixa-Rd, включая тяжелые НЯ (54,3%), но только 40,7% нежелательных явлений были связанны с лечением. Наиболее частыми НЯ, связанными с лечением (> 10 пациентов), были диарея (13,9%), тромбоцитопения (12,6%), тошнота (8,5%), астения (7,1%), анемия (4,4%), нейтропения (4,4%), рвота (4,1%), периферическая нейропатия (4,1%) и цитопения (3,4%). Частота неблагоприятных событий, НЯ, связанных с лечением, тяжелых
НЯ в целом и тяжелых НЯ, связанных с лечением, у пациентов < 80 составила 77,2%, 41,7%, 54,1% и 16,0%, а у пациентов ≥ 80 лет – 82,6%, 36,2%, 55,1% и 11,6% соответственно. Наиболее частые тяжелые НЯ включали тромбоцитопению (12,2%), смерть (7,8%), нейтропению (5,8%), общее ухудшение физического здоровья (5,4%), диарею (4,4%) и анемию (4,4%).
После прекращения лечения Ixa-Rd у 177 пациентов, в связи с прогрессированием, последующие методы лечения включали помалидомид (n=99, 55,9%), даратумумаб (n=91, 51,4%), карфилзомиб (n=63, 35,6%), бортезомиб (n=60, 33,9%) и циклофосфамид (n=53, 29,9%).
Таким образом, REMIX является крупнейшим перспективным реальным исследованием по оценке тройного перорального режима Ixa-Rd у пациентов с РРММ и подтверждает его эффективность и вполне приемлемую безопасность. Исследование включало большую долю пациентов старше 75 и 80 лет (35% и 18% соответственно), а средний возраст (71 год) был выше, чем в любом другом реальном исследовании [23, 25, 28, 29, 30], как показано в таблице 1.
Эффективность с точки зрения mPFS и ЧОО остается значимой у пожилых пациентов, особенно у людей в 80 лет и старше (mPFS 17,4 месяца, ЧОО 76,8%), причем mPFS была аналогична таковой молодых пациентов (p=0,06). Медиана OS достигнута в подгруппе пожилых больных, однако, как и ожидалось, молодые пациенты еще не достигли медианы общей выживаемости. Хорошо переносимый режим пероральных триплетов особенно выгоден для пожилых пациентов по сравнению с другими доступными вариантами лечения, которые являются более интенсивными и требуют госпитализации. Пациенты старше 80 лет, как правило, исключены из клинических испытаний, и в литературе мало данных об их исходах. Тем не менее, эти пациенты имеют решающее значение, поскольку они представляют собой наибольшую когорту пациентов с ММ, наблюдаемых в обычной клинической практике.
Насколько нам известно, это первое исследование, в котором опубликовано такое понимание пожилых пациентов с РРММ и продемонстрированы преимущества триплета Ixa-Rd, что позволяет рекомендовать его в качестве альтернативного варианта пациентам, с которыми клиницисты имеют дело ежедневно. Хрупкие пациенты, включенные в исследование REMIX, также получали лечение Ixa-Rd. Хотя mPFS была короче в этой подгруппе, чем у сохранных пациентов (14,6 мес. против 21,5 мес.), этот результат, тем не менее, является положительным, учитывая приемлемый профиль толерантности, который трудно сравнить, поскольку слабые пациенты часто исключаются из клинических исследований. Это означает, что Ixa-Rd также может быть интересным альтернативным подходом для пациентов с пониженным соматическим статусом.
Таблица 1Исследование REMIX и другие исследования по оценке эффективности Ixa-Rd
|
Источник |
Название исследования |
Дизайн |
Страны |
Число пациентов |
Характеристики пациентов |
Эффективность |
Безопасность |
Подгрупповой анализ |
|
Moreau P. et al. [8] / Richardson P. et al. [9] |
TOURMALINE-MM1 |
Клиническое исследование |
26 стран |
722 пациента (360 в группе Ixa-Rd) |
Медиана возраста: 66 лет, % > 65 лет: 53%, L2 (62%), L3 (27%), L4 (11%), предшествующая терапия леналидомидом: 12% |
ЧОО: 78% ≥ охЧО: 48%, mPFS: 20,6 мес., mPFS > 75 лет: 18,5, mPFS ISS III: 18,4 мес., mPFS при высоком цитогенетическом риске: 21,4 мес., mOS: 53,6 мес. |
Прекратили лечение из-за токсичности: 17% |
Возраст, стадия ISS, цитогенетический риск, количество предшествующих линий терапии, предшествующая терапия IP и IMID, рефрактерность к последней линии терапии, рецидив или рефрактерность |
|
Macro M. et al. 2023 [27] |
REMIX |
Проспективное исследование в реальной клинической практике |
Франция |
376 пациентов |
Медиана возраста: 71 год, %80+: 18% L2 (60%), L3 (18%), L4 + (22%), предшествующая терапия леналидомидом: 39.2% |
ЧОО: 73%, ≥ охЧО: 45%, mPFS: 19,1 мес., L2 и L3: 22 мес. против L4 +: 6 мес. ≥ 80 лет: 17 мес. vs 19 мес. <80 лет слабые: 15 мес. vs 22 мес. при сохранном статусе, mOS не достигнута |
Прекратили лечение из-за токсичности: 21% |
Возраст, хрупкость, линия терапии, почечная недостаточность, коморбидность, предшествующая АутоТГСК, предшествующая терапия леналидомидом |
|
Varga G. et al. [26] |
- |
Ретроспективное исследование в реальной клинической практике |
Венгрия |
77 пациентов |
Медиана возраста: 66 лет L2 (27%), L3 (35%), L4 (39%) |
ЧОО: 67%, ≥ охЧО: 23%, mPFS: 11,4 мес., mPFS не достигнута в L2, L3: 10 мес., L4: 8.8 мес., нет различий по стадиям ISS и цитогенетическим профилям |
Отсутствие постоянных перерывов в приеме препаратов из-за НЯ |
ISS классификация, цитогенетический профиль |
|
Cohen Y.C. et al. [24] |
- |
Ретроспективное исследование в реальной клинической практике |
Израиль |
78 пациентов |
Медиана возраста: 68 лет L2 (64%), L3 (19%), L4+ (17%) Предшествующее лечение леналидомидом: 26% |
ЧОО: 88%, ≥ охЧО: 45%, mPFS: 24 мес., mPFS не достигнута vs 20,2 мес. ≤ 65 vs > 65 соответственно, mOS не достигнута |
Прекратили лечение из-за токсичности: 14% |
Возраст (≤ 65), влияние пола на PFS, число линий иксазо-миба, уровень парапротеина и вовлеченность легких цепей, цитогенетический риск, ISS, присутствие CRAB, предшествующая терапия (IMiDs, PIs) и АутоТГСК |
|
Terpos E. et al. [29] |
- |
Ретроспективное исследование в реальной клинической практике |
Греция, Великобритания и Чехия |
155 пациентов |
Медиана возраста: 68 лет, L2 (51%), L3 (28%), L4+ (21%), предшествующее лечение леналидомидом: 17% |
ЧОО: 74%, (76,5% в L2, 71,2% в L3+), ≥ охЧО: 35%, mPFS: 27,6 мес. L2: 27,6 мес., L3+: 19,9 мес., предшествующий леналидомид: mPFS 4.8 мес. (n=26), нет леналидомида: 27,6 (n = 129) |
Прекратили лечение из-за токсичности: 9% |
Пол, предшествующая АутоТГСК, продолжительность применения иксазоми-ба, Предшествующая терапия IMID |
|
Minarik J. et al. [30] |
- |
Проспективное исследование в реальной клинической практике |
Греция |
127 пациентов |
Медиана возраста: 66 лет, L2 (58%), L3 (24%), L4+ (19%), предшествующее лечение леналидомидом: 17% (6% рефрактерны) |
ЧОО: 73%, ≥ охЧО: 33,3%, mPFS: 17,5 мес., L2: 32,8 мес., L3+: 23,1 мес., L4: 9,7 мес. L5+: 5 мес. >75 лет: 11,1 мес. mOS: 36,6 |
Прекратили лечение из-за токсичности: 3,1% |
Возраст, ISS, АутоТГСК, цитогенетика, максимальный ответ на лечение и предшествующее лечение |
|
Hajek R. et al. [31] |
- |
Исследование в реальной клинической практике |
13 стран (INSIGHT MM и Греция RMG) |
263 пациента |
Медиана возраста: 68 лет, 15% > 75 лет L2 (44%), L3 (35%), L4 + (21%), предшествующее лечение леналидомидом: 27% (7% рефрактерны) |
ЧОО: 73%, ≥ охЧО: 37%, mPFS: 21 мес., L2: 26 мес., L3: 24 мес., L4: 14 мес. |
Прекратили лечение из-за токсичности: 32% |
Линии терапии |
Примечание . АутоТГСК – аутологичная трансплантация гемопоэтических стволовых клеток, ЧОО – частота общего ответа, охЧО – очень хороший частичный ответ, IP – ингибиторы протеасомы, IMID – иммуномодуляторы, mPFS – медиана беспрогрессивной выживаемости, mOS – медиана общей выживаемости, L2 – вторая линия терапии, L3 – третья линия терапии, L4 – четвертая линия терапии, L5 – пятая линия терапии.
В целом эффективность Ixa-Rd в реальной ситуации (mPFS 19,1 мес., ЧОО 73%) была аналогична контролируемому регистрационному исследованию TOURMALINE-MM1 (mPFS 20,6 месяца, ЧОО 78%). В то же время, популяция REMIX была старше (средний возраст 71 год) по сравнению с TOURMALINE-MM1 (средний возраст 66 лет) и включала больше пациентов с прогрессирующим заболеванием (L4 +) 21,5% по сравнению с 11% в TOURMALINE-MM1 и ECOG > 1 (18,2%) по сравнению с TOURMALINE-MM1 (5%). Важно отметить, что в исследовании REMIX больше пациентов ранее получали леналидомид (39,2%), чем в TOURMALINE-MM1 (12%) или борте- зомиб (REMIX 91,7%; TOURMALINE MM1 69%). Кроме того, некоторые пациенты в исследовании REMIX ранее получали карфилзомиб (7,5%), помалидо-мид (11,7%) или даратумумаб (13,9%) в отличие от TOURMALINE MM1.
Таким образом, пациенты подвергались более интенсивному лечению до включения в исследование REMIX, чем в TOURMALINE-MM1, что, как считается, оказывает негативное влияние на эффективность последующей терапии. Более того, 49,8% пациентов в REMIX были слабыми/хрупкими, и две трети имели сопутствующие заболевания, в отличие от исследования TOURMALINE-MM1, из которого такие пациенты были исключены. И, что не менее важно, большинство проведенных реальных исследований являются ретроспективными с небольшой выборкой, mPFS в них варьировала от 11,4 до 27,6 месяцев. Пациенты моложе, чем в исследовании REMIX, и предварительно менее подвержены воздействию леналидомида (максимум: 27%).
Медиана беспрогрессивной выживаемости пациентов в исследовании REMIX, получавших Ixa-Rd в L2 (21,5 месяца) и в L3 (21,9 месяца), была больше, чем у пациентов в L4 и выше (5,8 месяца), p <0,01. Это соответствует результатам клинического исследования TOURMALINE-MM1 и большинству реальных исследований (таблица 1). Аналогичным образом, лучший ответ на лечение (ПО и охЧО) наблюдался чаще в L2 и L3, чем в последующих линиях терапии. Как и в исследовании TOURMALINE-MM1, эффективность Ixa-Rd остается высокой при втором рецидиве (L3) и эквивалентна первому рецидиву (L2). На практике так оно и есть, теперь признается, что преимущества лечения снижаются на поздних стадиях заболевания [26, 31, 32].
В исследовании REMIX большая часть пациентов получала леналидомид перед началом Ixa-Rd, в первую очередь это относится к пациентам с L3 (73,5%) и L4 + (91,3%) и реже к пациентам с L2 (10,6%). Пациенты, которые были рефрактерны к предшествующей терапии леналидомидом или ингибиторам протеасомы, были исключены из исследования TOURMALINE-MM1. Примечательно, что в исследовании REMIX предварительное применение леналидомида у не рефрактерных пациентов и пациентов третьей линии не связано со снижением эффективности Ixa-Rd. Медиана беспрогрессивной выживаемости остается эквивалентной в обоих группах (19,5 мес. против 22,6 мес., p=0,29). Для чувствительных к леналидомиду пациентов с РРММ повторное его использование может принести пользу.
Результаты других реальных исследований показывают, что польза IxaRd может быть ограничена у пациентов, предварительно получавших леналидомид [28]. Однако, поскольку на фоне длительного применения леналидомида нередко наблюдается прогрессирование ММ, трудно определить его реальную эффективность при раннем и позднем рецидиве заболевания. Анализ данных исследования REMIX показывает, что период после последней дозы леналидомида, равный примерно 12 мес., может повысить эффективность Ixa-Rd.
Кроме предварительного применения леналидомида, пациенты с L4 также получали другие иммуномодулирующие препараты, ингибиторы протеасомы и анти-CD38 моноклональные антитела. Половина этих пациентов получали помалидомид или дарату-мумаб, а почти четверть – карфилзомиб. И наоборот, очень немногие пациенты получили эти препараты с L2 или L3. Множественное предварительное воздействие указанных препаратов на пациентов с L4 + может отражать резистентность больных ММ к лечению и будет связано с более низкой эффективностью Ixa-Rd в этой подгруппе.
Прекращение лечения, связанное с НЯ, было отмечено у 24,5% пациентов, в основном среди ослабленных и пожилых пациентов, что немного выше, чем в исследовании TOURMALINE-MM1 (17%). Как и в других исследованиях, наиболее часто сообщаемыми НЯ были желудочно-кишечные или гематологические, без выявленных новых сигналов [29–31, 33]. Однако, гематологическая токсичность предсказуема и известна нам из предыдущего опыта применения бортезомиба, при этом транзитор-ная циклическая тромбоцитопения, по сути, является классическим явлением при применении ингибиторов протеасомы [34,35]. Повышенная токсичность для желудочно-кишечного тракта также отражает опыт применения бортезомиба [35, 36], в то время как частота периферической нейтропении была ниже, чем при применении бортезомиба [37]. Учитывая эметогенный потенциал иксазоми-ба, следует рассмотреть возможность назначения адекватной противорвотной терапии, основанной на потребностях пациентов, и, при необходимости, профилактических противорвотных средств. Применение антагонистов серотониновых рецепторов перед приемом иксазомиба эффективно уменьшает тошноту и должно быть рассмотрено у пациентов, у которых развивается тошнота.
Увеличение частоты тромбоцитопении 3/4 степени тяжести не имело каких-либо клинических последствий в виде значительных кровотечений или отмены препарата. Кумулятивного эффекта на количество тромбоцитов не наблюдается, и тромбоцитопения обычно управляема. В таких ситуациях изменение дозы считается оправданным, рекомендуется поочередное снижение дозы леналидомида и иксазомиба, учитывая, что при применении обоих препаратов отмечается тромбоцитопения. Во время лечения иксазомибом необходимо контролировать количество тромбоцитов, по крайней мере, ежемесячно, а в течение первых трех циклов следует рассмотреть возможность более частого контроля (еженедельно), пока не будет достигнута стабильная доза [33, 35].
В отличие от большинства других реальных исследований, REMIX является проспективным и, следовательно, дает более точное представление об эффективности и НЯ, чем ретроспективные исследования. Ограничениями исследования REMIX являются те, которые относятся к реальным наблюдательным исследованиям, в частности, связанным с ответом на лечение или прогрессированием, которые оцениваются исследователем. Расчет оценки хрупкости был основан на ECOG-PS, если пациенты были ≤ 80 лет, что реже используется в обычной клинической практике, чем в клинических испытаниях. Из-за отсутствия данных по ECOG-PS, упрощенная оценка хрупкости была доступна только для 283 пациентов (75,0%).
Заключение . Проведённый анализ литературы, посвящённой применению триплета иксазомиб+ле налидомид+дексаметазон в реальной клинической практике, позволяет утверждать, что полная пероральная комбинированная терапия по протоколу IxaRd у пациентов с рецидивами/рефрактерными формами ММ открыла новую эру в лечении этого заболевания. Результаты исследований, в которых проводилась оценка эффективности и безопасности полностью перорального триплета Ixa-Rd в реальной практике (в частности исследование REMIX), согласуются с результатами TOURMALINE-MM1 и подтверждают его пользу в реальной клинической практике, особенно при раннем рецидиве ММ. Исследование REMIX четко продемонстрировало, что предшествующий леналидомид у пациентов второй и третьей линии терапии не влияет на эффективность и предполагает полезное повторное использование его при ранних рецидивах.
Профиль безопасности IxaRd в целом контролируем. Наблюдаемые токсические эффекты характерны также для леналидомида и описаны в литературе. Исследование REMIX демонстрирует ценность перорального Ixa-Rd у пожилых людей (> 80 лет), сохраняется эффективность и приемлемая толерантность (нет более высоких показателей НЯ или прекращения лечения). С токсичностью можно справиться при регулярном поддерживающем лечении и переносе или снижении дозы препаратов.
Одним из ключевых вопросов является продолжительность терапии. На фоне терапии IxaRd не наблюдается признаков кумулятивной гематологической токсичности или периферической нейропатии, что указывает на потенциальную целесообразность длительного лечения. Важность непрерывного ле- чения ММ, независимо от возраста больных, была обоснована большими анализами из реальной клинической практики [38, 39]. Во-первых, установлено, что прекращение приема терапии из-за НЯ коррелирует с повышенным риском смерти в течение первых 6 месяцев жизни; во-вторых, продолжительность терапии второй линии напрямую связана с улучшением 1-летней общей выживаемости пациентов с РРММ. Причем, больше пользы от долгосрочной терапии второй линии получают как молодые, так и пожилые пациенты. Врач при встрече с больным ММ должен поставить перед собой цель – устранить любые барьеры, которые препятствуют удержанию пациента на терапии до прогрессирования заболевания. Режим на основе иксазомиба может быть особенно привлекательным для пациентов, которые остаются без прогрессирования в течение 24 мес. и более после индукционной/ре-индукционной терапии. Следует обратить внимание на постоянное информирование пациентов и лиц, осуществляющих уход за ними, о возможных симптомах НЯ, чтобы максимально повысить информированность пациентов о себе, и надлежащим образом контролировать токсичность с помощью своевременных стандартных медицинских вмешательств.
Протокол Ixa-Rd может рассматриваться как предпочтительный вариант по сравнению со схемами, включающими парентерально вводимые агенты для пациентов, которым необходимо преодолевать большие расстояния, чтобы посетить клинику, для которых бремя повторных посещений для внутри-венных/подкожных инъекций может ограничить целесообразность длительной терапии. В этих условиях удобство полностью перорального тройного режима Ixa-Rd при рецидивах ММ не вызывает сомнений.
Список литературы Эффективность перорального иксазомиба в комбинации с леналидомидом и дексаметазоном при рецидивах/рефрактерных формах множественной миеломы в реальной клинической практике
- Федеральное руководство по гематологии. Т. 2 / [Бессмельцев С.С. и др.]; под ред. С.С. Бессмельцева и С.В. Сидоркевича. – М.: СИМК, 2024. – 572 с.
- Anderson K.C. Progress and paradigms in multiple myeloma. // Clin Cancer Res Off J Am Assoc Cancer Res. – 2016. – Vol. 22. – P. 5419–5427.
- Boudreault J-S., Touzeau C., Moreau P. Triplet combinations in relapsed/refractory myeloma: update on recent phase 3 trials. // Expert Rev Hematol. – 2017. – V0l. 10. – P. 207–215.
- Dimopoulos M.A., Moreau P., Terpos E. et al Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. // Ann Oncol Off J Eur Soc Med Oncol. – 2021. – Vol. 32. – P. 309–322.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия. (Часть 2)// Вестник гематологии. – 2022. - №3. – С. 4-31.
- Moreau P. How I treat myeloma with new agents. – Blood. – 2017. – Vol. 130. – P. 1507–1513.
- Richardson P.G., San Miguel J.F., Moreau P. et al. Interpreting clinical trial data in multiple myeloma: translating findings to the realworld setting. //Blood Cancer J. – Vol. 2018. – Vol. 8. – P. 109.
- Moreau P., Masszi T., Grzasko N. et al Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. // N Engl J Med. – 2016. – Vol. 374. – P. 1621–1634.
- Richardson P.G., Kumar Sh.K., Masszi Tama ́s et al. Final Overall Survival Analysis of the TOURMALINE-MM1 Phase III Trial of Ixazomib, Lenalidomide, and Dexamethasone in Patients with Relapsed or Refractory Multiple Myeloma // J Clin Oncol. – 2021. – Vol. 39, N 22. – P. 2430-2442.
- Leleu X., Masszi T., Bahlis N.J. et al Patient-reported health- related quality of life from the phase III TOURMALINE-MM1 study of ixazomib-lenalidomide-dexamethasone versus placebo- lenalidomide-dexamethasone in relapsed/refractory multiple myeloma. // Am J Hematol. – 2018. https://doi.org/10.1002/ajh.25134.
- Hou J., Jin J., Xu Y. et al. Randomized, double-blind, placebo-controlled phase III study of ixazomib plus lenalidomide-dexamethasone in patients with relapsed/refractory multiple myeloma: China Continuation study. // J Hematol Oncol. – 2017. – Vol. 10, N 1. – P. 137.
- Бессмельцев С.С. Иксазомиб в лечении больных множественной миеломой//Вестник гематологии. - 2023. - Т. XIX, № 3. - С. 28-51.
- Семочкин С.В. Иксазомиб в лечении рецидивирующей множественной миеломы// Медицинский совет. – 2018. - № 10. – 84-91.
- Willan J., Eyre T.A., Sharpley F., Watson C., King A.J., Ramasamy K. Multiple myeloma in the very elderly patient: challenges and solutions. // Clin Interv Aging. – 2016. – Vol. 11. – P. 423–435.
- Zweegman S., Engelhardt M., Larocca A. Elderly patients with multiple myeloma: towards a frailty approach? // Curr Opin Oncol. – 2017. – Vol. – 29. – P. 315–321.
- Fraz M.A., Warraich F.H., Warraich S.U. et al. Special con- siderations for the treatment of multiple myeloma according to advanced age, comorbidities, frailty and organ dysfunction. // Crit Rev Oncol Hematol. – 2019. – Vol. 137. – P. 18–26.
- Shah J.J., Abonour R., Gasparetto C. et al. Analysis of common eligibility criteria of randomized controlled trials in newly diagnosed multiple myeloma patients and extrapolating outcomes. // Clin Lymphoma Myeloma Leuk. – 2017. – Vol. 17. P. 575-583.e2.
- Hungria V.T.M., Lee H.C., Abonour R. et al. Real-world (RW) multiple myeloma (MM) patients (Pts) remain under represented in clinical trials based on standard laboratory parameters and baseline characteristics: analysis of over 3,000 Pts from the Insight MM Global, Prospective, Observational Study. // Blood. – 2019. – Vol. 134. – P. 1887.
- Chari A., Romanus D., Palumbo A., Blazer M., Farrelly E., Raju A., Huang H., Richardson P. Randomized clinical trial representativeness and outcomes in real-world patients: comparison of 6 hallmark RCTs in relapsed/refractory multiple myeloma. // Clin Lymphoma Myeloma Leuk. – 2019. https://doi.org/10.1016/j.clml.2019.09. 625 9-11.
- Palumbo A., Bringhen S., Mateos M-V. et al. Geriatric assessment predicts survival and toxicities in elderly myeloma patients: an International Myeloma Working Group report. // Blood. – 2015. – Vol. 125. – P. 2068–2074.
- Hari P., Romanus D., Luptakova K., Blazer M., Yong C., Raju A., Farrelly E., Labotka R., Morrison V.A. The impact of age and comorbidities on practice patterns and outcomes in patients with relapsed/refractory multiple myeloma in the era of novel therapies. // J Geriatr Oncol. – 2018. – Vol. 9. – P. 138–144.
- Sokol J., Guman T., Chudej J. et al. Ixazomib, lenalidomide, and dexamethasone combination in “real-world” clinical practice in patients with relapsed/refractory multiple myeloma// Annals of Hematology. – 2022. – Vol. 101, N 1. – P. 81-89.
- Moreau P., Masszi T., Grzasko N. et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. // N Engl J Med. – 2016. – Vol. 374. – P. 1621-1634.
- Cohen Y.C., Magen H., Lavi N. Ixazomib-based regimens for relapsed/refractory multiple myeloma: are real-world data compatible with clinical trial outcomes? A multi-site Israeli registry study// Annals of Hematology. – 2020. – Vol. 99, N 6. – P. 1273-1281.
- Costello C., Davies F.E., Cook G. et al. INSIGHT MM: a large, global, prospective, non-interventional, real-world study of patients with multiple myeloma. // Future Oncol. – 2019. - Vol. 15, N 13. – P. 1411–1428.
- Varga G., Nagy Z., Demeter J. et al. Real-world efficacy and safety results of ixazomib lenalidomide and dexamethasone combination in relapsed/ refractory multiple myeloma: data collected from the Hungarian ixazomib named patient program. // Pathol Oncol. – 2019. – Vol. 25, N 4. - P. 1615-1620.
- Macro M., Hulin C., Vincent L. et al. Real-world effectiveness of ixazomib combined with lenalidomide and dexamethasone in relapsed/ refractory multiple myeloma: the REMIX study// Annals of Hematology. – 2023. – Vol. 102. – P. 2137–2151.
- Facon T., Dimopoulos M.A., Meuleman N. et al A simplified frailty scale predicts outcomes in transplant-ineligible patients with newly diagnosed multiple myeloma treated in the FIRST (MM-020) trial. // Leukemia. – 2020. – Vol. 34. – P. 224–233.
- Terpos E., Ramasamy K., Maouche N. et al Real-world effectiveness and safety of ixazomib-lenalidomide-dexamethasone in relapsed/refractory multiple myeloma. // Ann Hematol. – 2020. – Vol. 99. – P. 1049–1061.
- Minarik J., Pika T., Radocha J. et al Survival benefit of ixazomib, lenalidomide and dexamethasone (IRD) over lenalidomide and dexamethasone (Rd) in relapsed and refractory multiple myeloma patients in routine clinical practice. // BMC Cancer. – 2021. – Vol. 21, N 1. – P. 73.
- Há jek R., Minař í k J., Straub J. et al. Ixazomib-lenalidomide- dexamethasone in routine clinical practice: effectiveness in relapsed/refractory multiple myeloma. // Future Oncol Lond Engl. – 2021. – Vol. 17. – P. 2499–2512.
- Gandhi U.H., Cornell R.F., Lakshman A. et al. Outcomes of patients with multiple myeloma refractory to CD38-targeted monoclonal antibody therapy. // Leukemia. – 2019. – Vol. 33. – P. 2266–2275.
- Kumar S., Moreau P., Hari P. et al Management of adverse events associated with ixazomib plus lenalidomide/dexamethasone in relapsed/refractory multiple myeloma. // Br J Haematol. – 2017. – Vol. 178. – P. 571–582.
- Lonial S., Waller E.K., Richardson P.G. et al. Risk factors and kinetics of thrombocytopenia associated with bortezomib for relapsed, refractory multiple myeloma. // Blood. – 2005. – Vol. 106. – P. 3777–3784.
- Бессмельцев С.С., Абдулкадыров К.М. Множественная миелома: рук. для врачей. – М.: МК. 2016. – 504.
- San Miguel J.F. Schlag R., Khuageva N.K. et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. // New England Journal of Medicine. – 2008. – Vol. 359. – P. 906–917.
- Moreau P., Pylypenko H., Grosicki S. et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: a randomised, phase 3, non-inferiority study. //Lancet Oncology. – 2011. – Vol. 12. – P. 431–440.
- Бессмельцев С.С., Стельмашенко Л.В., Карягина Е.В. и др. Лечение пожилых пациентов с множественной миеломой на современном этапе// Онкогематология. – 2010. - № 4. – С. 6-13.
- Hari P., Romanus D., Palumbo A. et al. Prolonged duration of therapy is associated with im- proved survival in patients treated for relapsed/refractory multiple myeloma in routine clinical care in the United States. // Clin Lymphoma, Myeloma Leuk. – 2018. – Vol. 18, N 2. – P. 152–160.


