Эффективность получения андрогенных гаплоидов ячменя в зависимости от способа регенерации растений, состава питательной среды и плотности инокуляции пыльников
Автор: Белинская Елена Владимировна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Изучали возможность одноэтапного получения растений-регенерантов в культуре пыльников in vitro ячменя ярового при замене агар-агара в индукционной среде кукурузным крахмалом, выделенным из зерна линии- носителя мутантного гена структуры эндосперма su 2, и химически модифицированным крахмалом Д-5а, а также влияние на эффективность гаплопродукционного процесса плотности инокуляции пыльников. Установлено, что на питательных средах, содержавших крахмал, снижение частоты регенерации происходило либо вследствие высокой интенсивности роста неэмбриогенного каллуса ( su 2 -крахмал), либо из-за ингибирования роста и развития эмбриоидов (химически модифициролованный крахмал). Уменьшение плотности инокуляции пыльников способствовало повышению частоты регенерации растений на агаровой среде.
Ячмень hordeum vulgare l), культура пыльников in vitro, питательная среда, агар-агар, крахмал, эмбриоидогенез, регенерация растений
Короткий адрес: https://sciup.org/148202046
IDR: 148202046 | УДК: 633.854.78:631
Текст научной статьи Эффективность получения андрогенных гаплоидов ячменя в зависимости от способа регенерации растений, состава питательной среды и плотности инокуляции пыльников
Как известно, общая схема получения андрогенных гаплоидов предусматривает культивирование пыльников на питательной среде с целью индукции аномального многократного деления гаплоидных микроспор с образованием морфогенных структур, из которых формируются растения-регенеранты [1, 2].
Обычно процесс проходит в два этапа при использовании двух типов сред. Первая среда - индукционная - содержит комплекс физиологически активных веществ, стимулирующих отклонение микроспор от гаметофитного пути развития, их многократное деление и дальнейший каллусогенез или эмбриоидогенез. Состав второй среды – регенерационной – способствует регенерации растений из перенесенных на нее морфогенных структур микроспориального происхождения. При этом наиболее быстрым и экономически выгодным путем получения гаплоидов является эм-бриоидогенез – образование биполярных структур с синхронным развитием апексов корня и стебля непосредственно из многоклеточных микроспор (прямой эмбриоидогенез) или из эмбриогенного каллуса (непрямой эмбриоидогенез) [3].
Следует отметить, что высокая регенерационной способность эмбриоидов, которые могут прорастать на индукционной среде, позволяет получать гаплоиды без использования регенерационной среды, что существенно уменьшает трудоёмкость и способствует экономии материалов.
Нами впервые установлено, что замена агар-агара химически модифицированными [4, 5] и естественными крахмалами [6, 7] в индукционной среде способствовала повышению частоты прямого эмбриои-догенеза и регенерации растений в культуре in vitro пыльников ячменя ярового. В связи с этим целью исследований было изучение возможности одноэтапного получения гаплоидов этого вида растений на крахмалсодержащих средах и определение влияния плотности инокуляции пыльников на эффективность гап-лопродукционного процесса.
МАТЕРИАЛ И МЕТОДЫ
В качестве модельного генотипа была использована линия ячменя ярового ( Hordeum vulgare L.) ДГ00-126, полученная методом культуры пыльников in vitro на основе F 1 гибрида Харьковский 74×Экзотик и характеризующаяся высокой частотой образования эмбриоидов, эмбриогенного каллуса и нормально пигментированных растений-регенерантов [8].
Растения, служившие донорами пыльников, выращивали в полевых условиях. Отбор, предобработка колосьев и получение асептической культуры пыльников были проведены по методикам, опубликованным ранее [9, 10].
Пыльники культивировали на индукционных питательных средах [10], различающихся гелеобразующими компонентами. В частности, NMSмод.2 содержала 0,8% агар-агара («Difco», США); NMSsu 2 - 6,5% кукурузного крахмала, полученного из зерна линии АС-11, которая является носителем естественной мутации гена структуры эндосперма su 2 [7]; NMS 5a -12,0% химически модифицированного крахмала Д-5а [5]. Препараты крахмалов были любезно предоставлены С.М. Тымчуком и П.Г. Дульневым.
Пыльники помещали в стеклянные пробирки (10×150 мм) или стерильные пластиковые чашки Петри (d=35 мм). В каждую пробирку на «косячок» среды и в чашку Петри высаживали по 30-45 шт пыльников, вычлененных из одного колоса. В эксперименте по изучению влияния на показатели гаплопродукции плотности инокуляции пыльников в одну пробирку высаживали пыльники, изолированные из половины колоса.
Наблюдения за индукцией и развитием морфогенных структур проводили через каждые 5-7 сут, начиная с 20-х сут с момента инокуляции пыльников. Последний подсчет количества морфогенных пыльников в обоих вариантах опыта был проведен на 35 сут от начала культивирования пыльников, после чего в контроле была проведена пересадка каллуса и эмбриоидов на среду для регенерации. Подсчет растений-регенерантов был проведен через две недели после пересадки в контроле и одновременно в варианте «без пересадки».
Регенерационная среда содержала соли макро– и микроэлементов по Мурасиге и Скугу [11], а также (в мг/л): мио-инозитол – 100; витамины В1, В6 и РР – по 0,5; ИУК и БАП – по 0,2, (витамины и фитогормоны – «Serva», Германия); глутамин – 100 («PRS-CODEX», Испания); сахарозу – 30 г/л («Merck», Германия), агар-агар – 0,8% («Difco», США); pH 5,7-5,8.
Показателями эффективности экспериментального андрогенеза in vitro служили количество морфогенных пыльников, зеленых и хлорофиллдефектных растений в процентах от общего количества пыльников, высаженных на среду. В варианте «без пересадки» также было определено количество дифференцированных эмбриоидов, которые не проросли.
Экспериментальные данные обработаны при помощи методов дисперсионного анализа и вариационной статистики [12] с использованием пакета программ «ОСГЭ».
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наблюдения показали, что через 20 сут после инокуляции пыльников на питательную среду имело место интенсивное образования морфогенных макроструктур – каллуса и эмбриоидов на всех средах. Затем в пробирках с агаровой NMSмод.2 и крахмалсодержащей средой NMSsu 2 , которые были оставлены для обноэтапного получения гаплоидов, происходило разрастание каллуса с формированием сплошной массы, среди которой были видны эмбриоды, и пророс-тание последних з образованием растений-регенерантов (рис. 1)

а)
б)
Рис. 1. Регенерация растений в культуре пыльников in vitro линии ячменя ярового ДГ00-126 на индукционной среде: а - с химически модифицированным крахмалом Д-5а; б - с агар-агаром через 40 сут после инокуляции пыльников
Результаты эксперимента (табл. 1) свидетельствуют о том, что в целом не удалось решить поставленную задачу по получению растений без пересадки морфогенных структур на регенерационную среду. Отсутствие достоверных различий по количеству эмбриогенных пыльников на средах с однотипным гелеобразователем можно считать подтверждением одинаковых стартовых условий про- цесса регенерации растений. Однако высокая частота индукции андрогенных структур и интенсивный рост каллуса, которые свойственны линии ДГ00-126, при ограниченной площади питания в вариантах «без пересадки» привели, очевидно, к конкуренции между ними и потере способности к регенерации, в том числе и эмбриоидами. Так, на обеих средах не проросло более 22% эмбриоидов.
Таблица 1 . Индукция морфогенных структур и регенерация растений в культуре пыльников in vitro линии ячменя ярового ДГ00-126 в зависимости от способа регенерации растений и гелеобразующего компонента питательной среды (2009 г.)
|
Среда |
Высажено пыльников, шт . |
Получено |
||||||
|
морфогенных пыльников |
зеленых растений-регенерантов |
растений-альбиносов |
количество эмбриоидов3 |
|||||
|
шт. |
% |
шт. |
% |
шт. |
% |
% |
||
|
NMSмод.2(п)1 |
248 |
102 |
41,13 |
66 |
26,61 |
37 |
14,92 |
– |
|
NMSмод.2 (бп)2 |
152 |
56 |
36,84 |
23 |
15,13 |
44 |
28,97 |
23,11 |
|
NMSsu 2 (п)1 |
225 |
74 |
32,89 |
88 |
39,11 |
24 |
10,67 |
– |
|
NMSsu 2 (бп)2 |
167 |
52 |
31,13 |
15 |
8,98 |
16 |
9,58 |
22,15 |
|
НСР 05 |
9,45 |
8,17 |
6,98 |
– |
||||
Прим. NMSмод.2 - 0,8 % агар-агара; NMSsu 2 – 6,5 % кукурузного крахмала типа su 2 . 1 - морфогенные структуры пересаживали на среду для регенерации; 2 - регенерация происходила на индукционной среде без пересадки; 3 - эмбриоиды, которые не проросли на индукционной среде
Следует отметить, что более интенсивный рост каллуса наблюдался на среде, содержавшей su 2 -крахмал, и следствием «перерастания» культуры было многократное уменьшение частоты регенерации растений. Поскольку в ходе эксперимента выяснилось, что проблемой одноэтапного получения гаплоидов ячменя является высокая интенсивность роста каллуса с низкой регенерационной способностью, который заполняет весь объем пробирки, препятствуя реализации морфогенетического потенциала культуры, логичными шагами в направлении повышения выхода растений-регенерантов представлялось использование компонентов питательной среды, которые снижают скорость нарастания каллусной массы, а также увеличение площади питания за счет уменьшения плотности инокуляции пыльников.
Принимая во внимание то, что на питательных средах, которые содержали вместо агар-агара химически модифицированные крахмалы, наряду со стимуляцией прямого эмбриоидогенеза снижался рост каллуса [7, 8], один из этих препаратов – Д-5а - был использован для разработки методики одноэтапного получения гаплоидов ячменя. В качестве культуральных сосудов были использованы чашки Петри, что обеспечивало большую площадь питания для развивающихся морфогенных структур.
Исследования показали, что увеличение площади питания на агаровой среде привело к нивелированию различий по показателям гаплопродукции в вариантах «пересадка» и «без пересадки» андрогенных структур на среду для регенерации (табл. 2). При использовании химически модифицированного крахмала Д-5а в индукционной среде в сочетании с пересадкой морфогенных структур на регенерационную среду с агаром отмечено существенное возрастание частоты регенерации зеленых растений. В то же время при обноєтапном получении гаплоидов эффективность регенерации была почти в 8 раз ниже.
Таблица 2 . Индукция морфогенных структур и регенерация растений в культуре пыльников in vitro линии ячменя ярового ДГ00-126 в зависимости от способа регенерации растений и гелеобразующего компонента питательной среды (2010 г.)
|
Среда |
Высажено пыльников, шт . |
Получено |
|||||
|
морфогенных пыльников |
зеленых растений-регенерантов |
растений-альбиносов |
|||||
|
шт. |
% |
шт. |
% |
шт. |
% |
||
|
NMSмод.2(п)1 |
304 |
144 |
47,36 |
81 |
26,64 |
16 |
5,26 |
|
NMSмод.2 (бп)2 |
382 |
187 |
48,95 |
99 |
25,91 |
13 |
8,15 |
|
NMS 5а (п)1 |
383 |
149 |
38,90 |
216 |
56,39 |
55 |
14,36 |
|
NMS 5а (бп)2 |
309 |
129 |
41,74 |
23 |
7,44 |
13 |
4,21 |
|
НСР 05 |
3,69 |
3,13 |
0,97 |
||||
Прим. NMSмод.2 - 0,8 % агар-агара; NMS5а – 12,0 % химически модифицированного крахмала Д-5а. 1 - морфогенные структуры пересаживали на среду для регенерации; 2 - регенерация происходила на индукционной среде без пересадки
Это было связано с тем, что гель из крахмала Д-5а обладал более низкой по сравнению с агаровым водоудерживающей способностью, и высыхание среды снижало частоту прорастания эмбриодов (не проросло более 45 % эмбриодов). Следует отметить, что на среде, содержавшей крахмалД-5а, формировались более мелкие эмбриоды, значительная часть которых прекращала развитие на глобулярной стадии (рис. 1). В варианте «пересадка» такие структуры переносили на агаровую среду для регенерации вместе с пыльником, что способствовало их дифференциации и прорастанию с формированием растений нормальной морфологии, лишенных, к тому же, признаков витрификации.
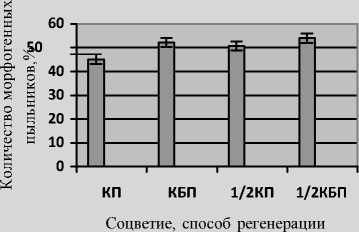
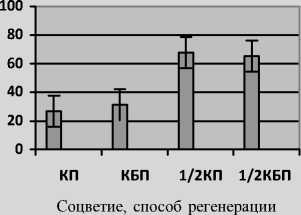
Ввиду высокой стоимости стерильных чашек Петри одноразового использования, был проведен эксперимент по изучению влияния на эффективность регенерации растений плотности инокуляции пыльников с применением в качестве культуральных сосудов пробирок. Как видно из результатов, представленных на рис. 2, при культивировании на среде с агар-агаром пыльников, изолированных из одного колоса с пересадкой полученных андрогенных структур на регенерационную среду (КП) и без пересадки (КБП), а также в аналогичных вариантах, но с инокуляцией на среду пыльников, вычлененных их половины колоса (½ КП и ½ КБП), получены сравнимые результаты по количеству морфогенных пыльников. Однако при снижении плотности высаженных пыльников (варианты ½ КП и ½ КБП) отмечено существенное увеличение частоты регенерации нормально пигментированных растений, обусловленное более благоприятными условиями для дифференции и прорастания эмбриоидов.
Впервые изучена возможность одноэтапного получения гаплоидов ячменя в культуре пыльников in vitro при использовании в качестве гелеобразо-вателей индукционной среды агар-агара, высоко-амилозного кукурузного крахмала из зерна линии-носителя мутантного гена структуры эндосперма su2 и химически модифицированного крахмала Д-5а. На средах с агар-агаром и кукурузным крахмалом в вариантах без пересадки морфогенных структур на регенерационную среду отмечен активный рост неэмбриогенного каллуса, что привело к снижению регенерационной способности культуры. Замена агар-агара химически модифицирован- ным крахмалом Д-5а угнетала дифференциацию и прорастание эмбриоидов на индукционной среде, но в то же время способствовала существенному увеличению частоты регенерации растений при пересадке морфогенных структур на регенерацион- ную среду с агар-агаром. Одноэтапное получение гаплоидов ячменя может быть достигнуто при снижении плотности инокуляции пыльников на агаровой среде.
а)
б)
Рис. 2. Индукция морфогенных структур (а) и регенерация растений (б) в культуре пыльников in vitro линии ячменя ярового ДГ00-126 в зависимости от плотности инокуляции пыльников на питательную среду и способа регенерации. К – изолированы пыльники одного колоса, ½ К – половины колоса; П – пересадка морфогенных структур; БП – без пересадки
Список литературы Эффективность получения андрогенных гаплоидов ячменя в зависимости от способа регенерации растений, состава питательной среды и плотности инокуляции пыльников
- Jähne-Gärtner A., Lörtz H. Protocols for anther and microspore culture of barley//Methods in Molecular Biology. Plant Cell Culture Protocols/Edit. R.D. Hall. Totowa: Yumana Press Inc., 1995. V. 111. P. 269-271.
- Szarejko I. Anther culture for doubled haploid production in barley (Hordeum vulgare L.)//Doubled haploid production in crop plants/Ed. M. Maluszynski, K.J. Kasha, B.P. Forster, I. Szarejko. Dordrecht: Kluwer academic publishers, 2003. P. 35-42.
- Батыгина Т.Б. Хлебное зерно/Отв. ред. М.С. Яковлев. Л.: Наука, 1987. 103 с.
- Белинская Е.В., Дульнев П.Г. Модифицированный крахмал как компонент питательной среды для получения гаплоидов ячменя в культуре пыльников in vitro//Физиология и биохимия культурных растений. 2007. Т. 39. № 2. С. 136-143.
- Белинская Е.В., Дульнев П.Г. Особенности морфогенеза в культуре in vitro пыльников ярового ячменя на средах с химически модифицированными крахмалами//Физиология и биохимия культурных растений. 2012. Т. 44. № 5. С. 440-448.
- Белинская Е.В., Тымчук С.М., Дульнев П.Г., Деребизова О.Ю. Использование высокоамилозного крахмала в питательной среде для культивирования пыльников ячменя//Физиология и биохимия культурных растений. 2009. Т. 41. № 6. С. 539-546.
- Бiлинська О.В. Застосування кукурудзяних крохмалiв з пiдвищеним вмiстом амiлози (мутацiї ае i su2) у складi штучного живильного середовища для одержання гаплоїдiв ярого ячменю у культурi пилякiв in vitro//Вiсник Харкiвського нацiонального унiверситету iм. В.Н. Каразiна. Серiя: бiологiя. 2010. Вип. 11 (№ 905). С. 60-65.
- Белинская Е.В. Влияние элементов технологии гаплоидной индукции на проявление генотипических особенностей морфогенеза в культуре пыльников in vitro ярового ячменя//Цитология и генетика. 2010. Т. 44. № 2. С. 38-44.
- Бiлинська О.В. Генотиповi особливостi iндукцiї гаплоїдiв ячменю (H. vulgare L.) методом культури пилякiв in vitro: Автореф. дис. … канд. бiол. наук. Харкiв, 1997. 19 с.
- Белинская Е.В. Наследование способности к андрогенезу in vitro у ярового ячменя//Цитология и генетика. 2008. Т. 41. № 4. С. 27-37.
- Murashige T., Skoog F. A revised medium for growth and bioassays with tobacco tissue cultures//Physiol. Plant. 1962. V. 15. P. 473-497.
- Плохинский Н.А. Биометрия. М.: Изд. Московского университета, 1964. 367 с.


