Эффективность применения биодобавки на основе регуляторов роста и микроэлементов при выращивании лекарственных растений
Автор: Дирина Е.Н., Винаров А.Ю., Осипов В.И., Быков В.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Регуляторы роста растений
Статья в выпуске: 3 т.42, 2007 года.
Бесплатный доступ
Изучали влияние разработанной ранее биодобавки Биогидропон - комплекса биологически активных компонентов (регуляторов роста и микроэлементов) на интенсивность роста растений и клеточный метаболизм фенольных соединений. В лабораторных и полевых экспериментах с лекарственными растениями определяли всхожесть и энергию прорастания семян, а также площадь ассимилирующей поверхности растений. При хроматографическом исследовании оценили влияние биодобавки на качественный состав и изменение содержания фенольных соединений в листьях кресс-салата как тестового растения.
Биодобавка для роста растений, регуляторы роста растений, кресс-салат, фенольные соединения, лекарственные растения
Короткий адрес: https://sciup.org/142133186
IDR: 142133186 | УДК: 633.88:631.8
Текст краткого сообщения Эффективность применения биодобавки на основе регуляторов роста и микроэлементов при выращивании лекарственных растений
Значительное число отечественных и зарубежных научных публикаций и патентов свидетельствует о практической значимости применения в растениеводстве биологически активных композиций как самостоятельно, так и в сочетании с традиционными органоминеральными удобрениями в виде биодобавок для роста растений (1-6).
Биодобавка Биогидропон относится к классу препаратов на основе стимуляторов (регуляторов) роста растений. Принципы разработки и экспериментального уточнения состава биодобавки с применением экспертного подхода к выбору и конструированию биопрепаратов, а также система их классификации по основному действующему веществу описаны нами ранее (6, 7). Биогидропон содержит комплекс стимуляторов роста, в том числе янтарную и лимонную кислоту, природные гиббереллины, а также набор микроэлементов (бор, молибден, цинк, марганец, медь и др.) для обеспечения ускоренного роста клеток. В состав биодобавки входит также активный регулятор клеточного роста — N-трис-(2-гидроксилэтил)аммонийная соль ортохлорфенилоксиуксусной кислоты. Состав биодобавки и соотношение компонентов защищены патентом РФ и международной заявкой РСТ (8); биотехнология производства согласно разработанному ТУ ¹ 2180-004-41082808-2004 предусматривает получение разных препаративных форм — порошка (при последовательном смешивании компонентов) либо водного раствора.
Цель настоящей работы — изучение влияния биодобавки Биогидропон на всхожесть, энергию прорастания семян и урожайность лекарственных растений, а также исследование ее воздействия на метаболические процессы в растениях.
Методика . Влияние биодобавки на энергию прорастания и всхожесть семян лекарственных растений изучали в лабораторных и полевых условиях на опытной базе Всероссийского института лекарственных и ароматических растений (ВИЛАР). Семена эхинацеи пурпурной ( Ehinacea purpurea ) и наперстянки шерстистой ( Digitalis lanata ) замачивали в 0,005 % растворе биодобавки из расчета 10 мл на 1 г семян (опыт) и в воде (контроль) в течение 5 ч; учитывали энергию прорастания и всхожесть семян, а также массу 10-суточных проростков по общепринятой методике (6).
В полевом опыте семена растений перед посевом замачивали в 0,001 % растворе препарата на 5 ч, вегетирующие растения опрыскивали 0,005 % рабочим раствором дважды — в фазу 2-4 настоящих листьев и через неделю. Площадь делянок 12 м2. Наперстянку шерстистую выращивали в течение мая-августа, учитывали площадь листовой поверхности, число листьев на растении и урожайность листа в контрольных и опытных вариантах. Статистическую обработку данных проводили с помощью программы OriginPro 7.5. Эффективность применения биодобавки оценивали по результатам определения всхожести и энергии прорастания семян, площади ассимилирующей поверхности и урожайности растений.
Накопление фенольных соединений в листьях растений изучали на базе лаборатории органической химии и химической биологии университета г. Турку (Финляндия) с применением авторского метода подготовки проб и хроматографического анализа (9). В качестве тест-растения служил кресс-салат ( Lepidium sativum ) — однолетняя культура из семейства крестоцветных, состав фенольных соединений в листьях которой изучался ранее (10, 11). Биодобавку вносили в прикорневой слой с поливной водой (0,001 % раствор). По окончании эксперимента состав и содержание фенольных соединений определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Для этого листья кресс-салата замораживали в жидком азоте, лиофилизировали и растирали до состояния порошка в вибромельнице (Retch GmbH&Co.KG) с частотой 30 Гц/с в течение 2 мин. Экстракцию метаболитов проводили последовательно 100 и 80 % ацетоном (по 2 раза) в течение 30 мин при комнатной температуре с постоянным перемешиванием (Vortex, Genie 2). Осадок отделяли центрифугированием («Eppendorf», Германия) в течение 15 мин при 2500 g . Объединенный супернатант выпаривали в вакуумном концентраторе 5301 («Eppendorf», Германия), сухой остаток растворяли в 1 мл смеси хлороформа с 80 % метанолом (1:1). Для разделения полярной и липофильной фракций метаболитов к раствору добавляли 0,5 мл 20 % водного метанола, тщательно перемешивали и центрифугировали 5 мин при 2900 g . Нижнюю фракцию (липофильные соединения) переносили в пробирки объемом 1,5 мл; обе фракции выпаривали в вакуумном концентраторе.
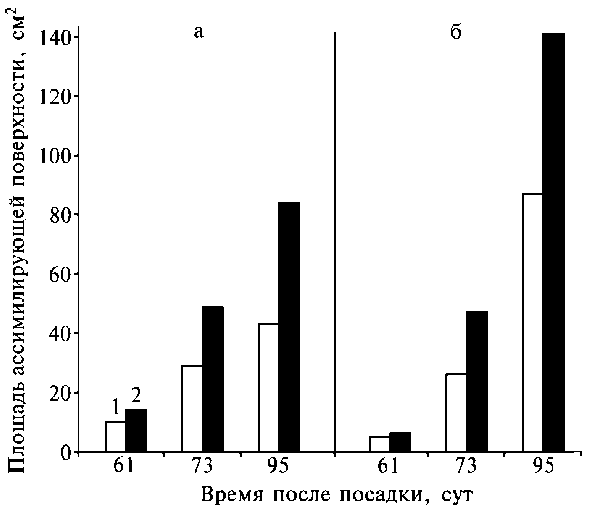
Рис. 1. Площадь ассимилирующей поверхности растений наперстянки шерстистой (а) и эхинацеи пурпурной (б) в контроле (1) и при обработке биодобавкой Биогидропон (замачивание семян и 2-кратное опрыскивание) (2).
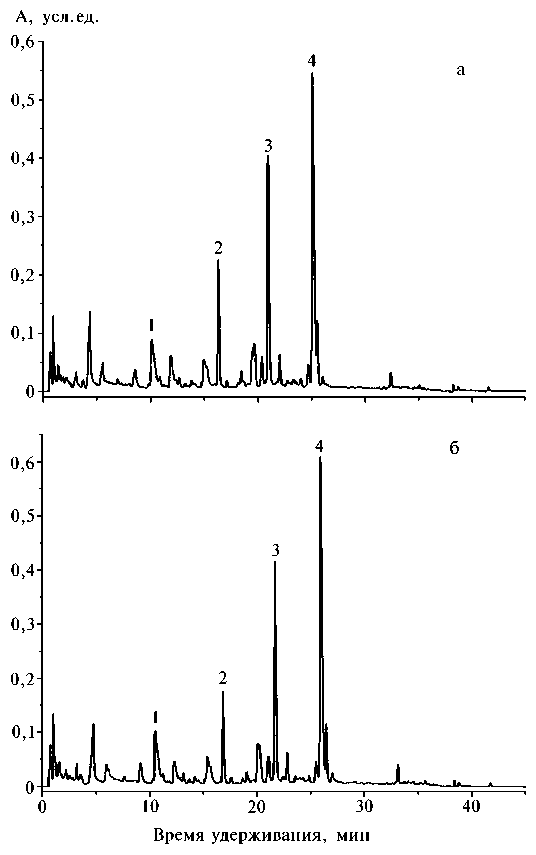
Рис. 2. ВЭЖХ фенольных соединений (полярная фракция) из растений кресс-салата, обработанных 0,001 % раствором биодобавки Биогидропон: а — контроль; б — опыт; 1 — оксибензойная кислота, 2 и 4 — производные оксикоричных кислот, 3 — флавоноид-С-гликозид (производное апигенина).
Сухой остаток полярных соединений растворяли в 0,5 мл воды. После центрифугирования в течение 10 мин при 2900 g 0,1 мл образца помещали в виалы автоматического пробоотборника ВЭЖХ-системы. Лип о фильную фракцию растворяли в 0,5 мл смеси метанола с ацетоном (9:1), после центрифугирования в течение 10 мин при 2900 g 0,1 мл образца также использовали для ВЭЖХ. ВЭЖХ-система («Merck-Hitachi», Япония) состояла из диодного детектора (diode array detector L-7455), насоса L-7100, автоматического пробоотборника L-7250 и интерфейса D-7000. Фенольные соединения разделяли на хроматографической колонке Superspher 100 RP-18, 75 x 4 мм («Merck», Германия). Для элюции использовали ацетонитрил (А) и 1 % муравьиную кислоту (Б). Линейный градиент растворителей (объем:объем) создавали в следующем режиме: 0-3-я мин — 2 % А в Б; 3-22-я мин — А от 2 до 15 %; 22-29-я мин — А от 15 до 20 %; 29-35-я мин — А от 20 до 30 %; 35-37-я мин — А от 30 до 70 %; 37-55-я мин — 70 % А в Б; скорость элюции — 1 мл/мин. УФ-спектры определялись автоматически при прохождении максимума каждого пика; регистрация — при X = 280 нм.
Результаты . В десяти параллельных лабораторных опытах показали, что у семян эхинацеи пурпурной и наперстянки шерстистой, замоченных в 0,005 % растворе биодобавки, энергия прорастания повышалась соответственно на 5,7 + 0,3 и 8,3 + 0,5 %; всхожесть — на 6,2 + 0,3 и 14,4 + 0,7 %; масса десяти проростков эхинацеи и наперстянки в опытных вариантах превышала контроль соответственно на 17,6 + 1,8 и 28,5 + 2,6 %.
В полевых условиях обработка семян наперстянки шерстистой 0,001 % раствором Биогидропона способствовала появлению всходов на 2-3 сут раньше, чем в контроле; густота стояния в опытном варианте превышала контрольную на 11-12 %; происходило усиление ростовых процессов (площадь листовой поверхности растения была на 39,2 % больше).
Последующая 2-кратная обработка вегетирующих растений повышала положительный эффект: площадь ассимилирующей поверхности возрастала в 1,7-2,0 раза по сравнению с контролем (рис. 1), причем не только за счет площади листовой пластинки, но и вследствие увеличения числа листьев на растении (по датам учета с 10-суточным интервалом соответственно 10,8 + 0,6 и 13,6 + 0,6 в опыте против 7,3 + 0,5 и 8,9 + 0,3 в контроле). По биомассе травы наперстянка шерстистая в первый год вегетации с применением Биогидропона показала прибавку урожая 38,2 % (4,7 ц/га против 3,4 ц/га).
Обработка семян эхинацеи пурпурной раствором Биогидропона способствовала более раннему, чем в контроле, появлению всходов (на 2-3 сут). В опытном варианте густота стояния превышала контроль на 15,5 + 2,6 %, площадь ассимилирующей поверхности растения — на 27,2 + 3,9 %. Обработка вегетирующих растений способствовала увеличению площади ассимилирующей поверхности: через 16 сут после второй обработки она была больше контрольной на 81,8 + 8,9 %, к концу периода вегетации — на 62,5 + 11,1 % (см. рис. 1).
Известна высокая информативность анализа фенольных соединений для оценки состояния метаболических процессов у растений (12, 13). Поскольку некоторые химические соединения при введении в состав биодобавок даже в минимальных количествах могут неблагоприятно сказываться на дальнейшем использовании растений, дополнительно оценили влияние Биогидропона на состав и содержание индивидуальных фенольных соединений у тестовой культуры — кресс-салата с помощью ВЭЖХ (рис. 2). Анализ УФ-спектров основных фракций не выявил достоверных качественных и количественных изменений фенольных компонентов (по сравнению с контролем) на фоне увеличения урожайности кресс-салата при выращивании с применением биодобавки, что свидетельствует об отсутствии заметного влияния Биогидропона на метаболизм фенольных соединений у этого растения (рис. 3).
Показано также, что фенольные соединения сосредоточены главным образом во фракции полярных метаболитов, а липофильная фракция содержит их следовые количества, которые можно не учитывать при дальнейшем анализе. До 50 % всех фенольных соединений у растений кресс-салата (как при выращивании с применением биодобавки, так и в контроле) приходилось на производные оксикоричных кислот (время удерживания 26 мин, УФмакс 244 и 326 нм; время удерживания 17 мин, УФмакс 242 и 331 нм), производное апигенина — флавоноид-С-гликозид (время удерживания 22 мин, УФмакс 243, 268 и 333 нм) и оксибензойные кислоты (время удерживания 11 мин, УФмакс 237 и 283 нм) (см. рис. 2, 3). Структура остальных фенольных соединений, содержание которых не превышало 1-2 % от общего количества, пока не установлена.
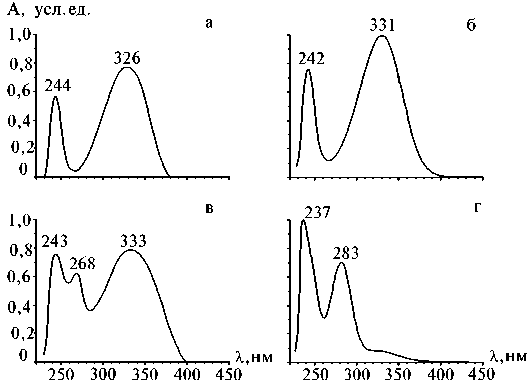
Рис. 3. УФ-спектры основных фенольных соединений из растений кресс-салата: а и б — производные оксикоричных кислот; в — производное апигенина — флавоноид-С-гликозид; г — оксибензойная кислота.
Таким образом, в лабораторных и полевых опытах показано существенное положительное влияние разработанной биодобавки Биогидропон на энергию прорастания и всхожесть семян, а также на урожайность лекарственных растений — наперстянки шерстистой и эхинацеи пурпурной. Обработка вегетирующих растений 0,005 % раствором биодобавки способствовала увеличению площади ассимилирующей поверхности листьев в 1,7-2,0 раза по сравнению с контролем. Хроматографический анализ количественных изменений содержания фенольных соединений в листьях тест-растений — кресс-салата свидетельствует об отсутствии заметного действия предложенной биодобавки на метаболизм фенольных соединений.
Л И Т Е Р А Т У Р А
-
1. W i t t e n m a y e r L., M e r b a c h W. Plant responses to drought and phosphorus deficiency: contribution of phytohormones in root-related proc
esses. J. of Plant Nutrition and Soil Sci., 2005, 168, 4: 531-540.
-
2. B a h y r y c z A., M a t s u b a y a s h i Yo., O g a w a M. e.a. Further analogues of plant peptide hormone phytosulfokine-alpha (PSK-alpha) and
their biological evaluation. J Pept. Sci., 2005, 11(9): 589-92.
-
3. Ц а в к е л о в а Е.А., К л и м о в а С.Ю., Ч е р д и н ц е в а Т.А. и др. Микробные продуценты стимуляторов роста растений и их практическое использованию Прикл. биохим. и микробиол., 2006, 42, 2: 133-143.
-
4. K e n n e d y I.R., C h o u d h u r y A.T.M.A., K e c s k e s M.L. Non-symbiotic bacterial diazotrophs in crop-farming systems: can their potential for plant growth promotion be better exploited? Soil Biol. & Biochem., 2004, 36, 8: 1229-1244.
-
5. B e i d o u X., G u o j u n Zh., H o n g l i a n g L. Process kinetics of inoculation composting of municipal solid waste. J. of Hazardous Materials, 2005, 124, 1: 165-172.
-
6. В и н а р о в А.Ю., Д и р и н а Е.Н., Ч е л н о к о в В.В. Биодобавки для роста растений и рекультивации почв. Экспертный подход к выбору и применению. М., 2006.
-
7. В и н а р о в А.Ю., Д и р и н а Е.Н., И в а ш к и н Ю.А. Разработка экспертной системы по выбору биодобавок для роста растений. М., 2006.
-
8. В и н а р о в А.Ю., Д ж а ф а р о в Ш.А., И п а т о в а Т.В. и др. Препарат для гидропонного выращивания растений. Патент РФ 2286668 от 01.12.2005.
-
9. O s s i p o v V., N u r m i K., L o p o n e n J. e.a. High-performance liquid chromatographic separation and identification of phenolic compounds from leaves of Betula pubescens and Betula pendula . J. Chromatog. A, 1996, 721: 59-68.
-
10. J u s t e s e n U. Negative atmospheric pressure chemical ionisation low-energy collision activation mass spectrometry for the characterization of flavonoids in extracts of fresh herbs. J. Chromatogr. A, 2000, 902: 369-379.
-
11. L a p c i k O., H o n y s D., K o b l o v s k a R. e.a. Isoflavonoids are present in Arabidopsis thaliana despite the absence of any homologue to known isoflavonoid synthases. Plant Physiol. and Biochem., 2006, 44: 106-114
-
12. З а п р о м е т о в М.Н. Фенольные соединения: Распространение, метаболизм и функции в растениях. М., 1993.
-
13. W a t e r m a n P.G., M o l e S. Analysis of Phenolic Plant Metabolites. Oxford, 1994.
Опубл. 10.11.2006. Бюл 31.


