Эффективность применения дженериков иматиниба у больных хроническим миелолейкозом
Автор: Лямкина Анна Сергеевна, Аутеншлюс Александр Исаевич, Мирошников Павел Николаевич, Дубровин Андрей Владимирович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.32, 2017 года.
Бесплатный доступ
У 55 пациентов, принимающих дженерик иматиниба Филахромин, была изучена остаточная концентрация иматиниба в сыворотке крови через 24±3 часа после последнего приема препарата (Сtrough). При остаточной концентрации иматиниба в сыворотке крови 900 и более нг/мл число больных, достигших ПЦГО и БМО, было достоверно выше (p
Хронический миелолейкоз, ингибиторы тирозинкиназы, концентрация иматиниба
Короткий адрес: https://sciup.org/14920195
IDR: 14920195 | УДК: 616.155
Текст научной статьи Эффективность применения дженериков иматиниба у больных хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) – тяжелое клональное миелопролиферативное заболевание, развивающееся в результате злокачественной трансформации в ранних предшественниках кроветворения [14, 15]. Наиболее изучен цитогенетический маркер ХМЛ, который получил название филадельфийской хромосомы (Ph+) – приобретенная хромосомная транслокация t (9; 22) (q34; q11) между 9 и 22 хромосомами, в результате чего на 22 хромосоме образуется химерный ген BCR-ABL. Продукт химерного гена BCR-ABL (белок с высокой тирозинкиназной активностью) – тирозинкиназа p210BCR-ABL способен к аутофосфорилированию, приводящему к автономной активности клетки и практически полной ее независимости от внешних регуляторных механизмов. После присоединения аденозинтрифосфорной кислоты (АТФ) BCR-ABL-тирозинкиназа начинает фосфорилирование различных белков, участвующих практически во всех процессах жизнедеятельности клетки. Активируется множество сигнальных путей как усиливающих пролиферацию клетки, так и подавляющих апоптоз [21–24, 29, 31]. Усиленная пролиферативная активность и снижение чувствительности к апоптотическим сигналам приводит к быстрому накоплению лейкемических клеток. Характерный признак ХМЛ – способность к выходу незрелых клеток в периферическую кровь. В исследованиях Durig J. и др. и Peled A. и др. показано, что в гемопоэтических клетках, экспрессирующих ген BCR-ABL, снижена способность к связыванию с фибронектином. Нарушение адгезии клеток со стромой является следствием взаимодействия F-актина с актинсвязывающим участком белка p210BCR-ABL, что, вероятно, приводит к ослаблению взаимодействия клетки с белками цитоскелета, снижению контакта со стромой в костном мозге и к выходу незрелых клеток в периферическую кровь [13, 28]. Таким образом, усиление пролиферативной активности опухолевых клеток, снижение чувствительности к апоптозу, нарушение процессов дифференцировки и повышенная способность незрелых гемопоэтических клеток-предшественников к выходу из костного мозга в периферическую кровь, постепенная полная потеря зависимости от BCR-ABL-тирозинки- назы являются основными характеристиками лейкемических клеток при хроническом миелолейкозе [23, 32].
Современная терапия ХМЛ стремится к нескольким целям: достижение полной клинико-гематологической ремиссии (КГР), полного цитогенетического ответа (ПЦО) и большого молекулярного ответа (БМО) (максимально возможное сокращение количества клеток опухолевого клона в костном мозге, более чем в 1000 раз, и предотвращение появления опухолевых клонов, независимых от белка p210BCR-ABL). Убедительно доказано, что получение цитогенетического ответа приводит к значительному увеличению выживаемости больных хроническим миелолейкозом [11, 12]. Получение БМО и стабильное снижение уровня транскрипта гена BCR-ABL является достоверным предиктором длительного сохранения КГР и ПЦО, тогда как нарастание уровня транскрипта указывает на увеличение клеток опухолевого клона и возможную потерю ПЦО [10, 25].
Появление новых лекарственных препаратов, ингибиторов атипичной тирозинкиназы (ИТК), коренным образом изменило прогноз течения заболевания у больных ХМЛ. Данный вид терапии сопоставим с аллогенной трансплантацией гемопоэтических стволовых клеток (ал-лоТГСК) по эффективности, а по безопасности – радикально превосходит ее [20]. Согласно данным ретроспективного анализа, в 2001 г. ХМЛ был наиболее частым показанием для проведения аллоТГСК, тогда как в 2005 г., вскоре после появления иматиниба, он стал занимать лишь 8-ое место среди других заболеваний, при которых проводилась трансплантация костного мозга. Согласно литературным данным, полный цитогенетический ответ удается добиться у 75–90% пациентов, получающих има-тиниб в качестве терапии первой линии [7, 8, 9, 18, 20, 26]. Расчетная медиана выживаемости при лечении има-тинибом составляет более 15 лет [26]. Лечение ИТК наиболее эффективно в хронической фазе заболевания, тогда как в фазе акселерации полный гематологический и цитогенетический ответ удается достичь лишь в 71 и 24% случаев соответственно, а в фазе бластного криза прогноз остается неблагоприятным, медиана выживаемости составляет всего 6–8 месяцев [5, 27, 15]. Анализ результатов терапии ХМЛ свидетельствует о том, что у части больных не удается достичь полного цитогенетического ответа (ПЦГО), или впоследствии он утрачивается.
При достижении полного цитогенетического ответа в фазу акселерации (ФА) или бластного криза (БК) риск цитогенетического рецидива и прогрессии болезни практически приближается к нулю, однако на фоне терапии иматинибом его получают только около половины пациентов. Еще более редки случаи достижения полного молекулярного ответа (ПМО). Клинические исследования по применению новых ингибиторов тирозинкиназы (ИТК) – нилотиниба и дазатиниба – в ХФ ХМЛ доказали их преимущество перед иматинибом в получении ПЦГО и БМО, а также и по снижению риска трансформации в ФА/БК и увеличению общей выживаемости [4, 30]. В настоящее время, согласно критериям J.E. Sokal [17] и EUTOS [16], выделяют группу низкого, промежуточного и высокого риска. ИТК показали эффективность в лечении больных всех групп риска, однако наилучшие результаты по- лучены при лечении пациентов из группы низкого риска. Двухлетняя выживаемость больных, относящихся к группе низкого риска составляет 98%, к группе промежуточного риска – 86,4% и к группе высокого риска – 35,6%. Трехлетняя выживаемость составляет 78,8, 55,6 и 23,8% соответственно [1]. У части больных с хроническим миелолейкозом из группы высокого риска, получающих монотерапию иматинибом, наблюдается первичная или вторичная резистентность к проводимой терапии. Среди механизмов развития резистентности к терапии имати-нибом главная роль отводится мутациям киназного домена гена BCR-ABL [19].
В России в последние годы вместо оригинальных препаратов иматиниба используются дженерики, эффективность и безопасность которых требует дополнительного изучения. Джен е рик (англ. generic drug ) – лекарственное средство, продающееся под международным непатентованным названием, либо под патентованным названием, отличающимся от фирменного названия разработчика препарата. Отличающиеся от оригинального препарата остаточная концентрация препарата или количество побочных эффектов могут приводить к развитию первичной и вторичной резистентности, снижению приверженности пациентов к лечению и, в итоге, к снижению эффективности терапии.
Одним из способов оценки вероятности достижения полного цитогенетического и большого молекулярного ответа, а также токсичности препарата является изучение остаточной концентрации в сыворотке крови через 24±3 часа после последнего приема препарата (Сtrough), то есть перед очередным приемом иматиниба. Значимость этого метода показана в исследованиях, проведенных ранее у пациентов, принимающих оригинальный иматиниб – Гливек® [2, 3, 6].
Широкий диапазон имеющихся в настоящее время ИТК требует создания единой программы помощи больным хроническим миелолейкозом, достаточного финансирования из средств федерального и регионального бюджета, своевременного проведения современных цитогенетических и молекулярных методов исследования не только для диагностики, но и для мониторирования эффективности терапии всеми видами используемых ингибиторов тирозинкиназы.
Целью данного исследования явилось изучение эффективности и безопасности применения дженерика иматиниба у больных хроническим миелолейкозом.
Материал и методы
С января 2004 по июль 2016 гг. в ГБУЗ Городской клинической больнице № 2 на учете состояли 104 больных хроническим миелолейкозом: в хронической фазе – 86 пациентов, в фазе акселерации – 11 человек и в фазе бластного криза – 7 человек.
В группу вошли 40,4% мужчин (42 человека) и 59,6% женщин (62 человека). Средний возраст больных составил 44,7 ±18,2 года (от 16 до 78 лет), из всей группы обследуемых 81 пациент (77,8%) начал принимать ингибиторы тирозинкиназы (ИТК) сразу после установления диагноза хронический миелолейкоз (в первые 6 месяцев), а 23 человека (22,1%) получали различную предшеству-
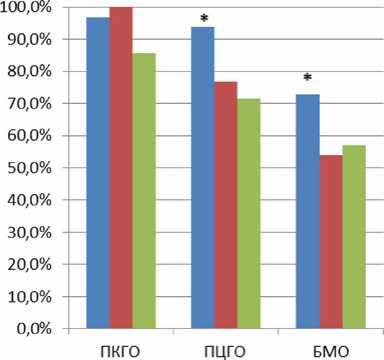
■ Группа 1: Ctrough 1000 и более нг/мл
■ Группа 2: Ctrough 700 -999 нг/мл
■ Группа 3: Ctrough 700 и менее нг/мл2
* - р<0,05
Рис. 1. Результаты лечения Филахромином (частота достижения полного клиникогематологического, полного цитогенетического и большого молекулярного ответа) в группе 1 по сравнению с группами 2 и 3
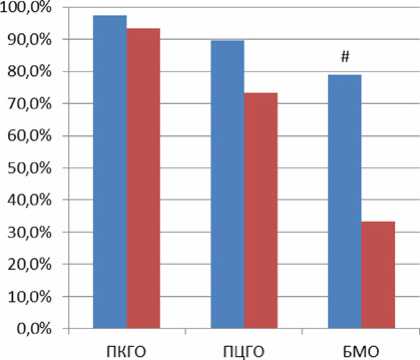
■ Группа А: исходно Гливек (12-36 мес.), потом Филахромин
■ Группа В: исходно Филахромин
#-р<0,05
Рис. 2. Результаты лечения иматинибом (частота достижения полного клиникогематологического, полного цитогенетического и большого молекулярного ответа) в группе А (исходно получающей Гливек, а потом переведенной на терапию Филахромином) по сравнению с группой В (исходно получающей Филахромин)
ле замены препарата Филахромин на препарат Имаглив степень выраженности побочных эффектов от терапии уменьшилась до уровня 0–1.
С целью мониторинга эффективности и безопасности препарата Филах-ромин у 55 пациентов была изучена остаточная концентрация иматиниба в сыворотке крови через 24±3 часа после последнего приема иматиниба (Фи-лахромина) (Сtrough) (то есть перед очередным приемом иматиниба) методом высокоэффективной жидкостной хроматографии с детекцией методом тандемной масс-спектрометрии.
Cтатистическая обработка полученных данных проводилась с использованием пакета прикладных программ Statistica 6.0 и электронных таблиц Exсel 2007. При оценке количественных признаков использовали вычисление средней арифметической (М) и ее ошибки (m). Значимость различий между между группами оценивалась с помощью критерия хи-квадрат, статистически значимыми считались различия при р<0,05.
Результаты и обсуждение
У 55 пациентов, продолжающих принимать иматиниба мезилат (Фи-лахромин), была изучена остаточная концентрация иматиниба в сыворотке крови через 24±3 часа после последнего приема (Сtrough), то есть перед очередным приемом иматиниба. Ранее уже было доказано влияние остаточной концентрации оригинального имати-ниба (Гливека) на эффективность терапии хронического миелолейкоза [2, 3, 6]. В данных клинических исследо-
ющую терапию (гидроксимочевиной, препаратами ИФ- α (Интрон, Реаферон), курсами малых доз цитоза-ра), так как диагноз ХМЛ им был установлен до 2005 г. Группа низкого риска по Sokal диагностирована у 39 человек (37,5%), промежуточного – у 34 (32,7%), высокого – у 31 (29,8%).
Иматиниб назначали в дозе 400–600 мг в сутки (в хронической фазе заболевания), 600–800 мг в сутки (в фазе акселерации), 800 мг в сутки в фазе бластного криза. С 2014 г. все пациенты с оригинального иматиниба (Гли-век) были переведены на препарат дженерик иматиниба: Филахромин, однако у 5 пациентов после перевода с Гли-века на Филахромин появились признаки непереносимости препарата: диспепсические явления, боли в мышцах, суставах (уровень токсичности 2–3), в связи с чем ухудшилась приверженность пациентов к лечению. Пос- ваниях показано, что имеются достоверные различия в вероятности достижения ПЦО и БМО при Сtroughменее 700 нг/мл, а также в диапазоне от 700 до 1000 нг/мл и более 1000 нг/мл. При более высоких концентрациях достоверных различий не было получено.
В исследуемой группе уровень остаточной концентрации иматиниба (Филахромина) варьировал от 390 до 4370 нг/мл, средний уровень составил 1496,9 нг/мл. С целью оценки эффективности терапии у больных, получающих Филахромин, все пациенты были разделены на 3 группы: с уровнем концентрации менее 700 нг/мл, 700– 999 нг/мл и 1000 и более нг/мл. У двух первично резистентных пациентов концентрация иматиниба составила 4340 и 4370 нг/мл, эти больные регулярно нарушали режим и дозу приема препарата, в связи с вероятным нарушением правил подготовки и забора крови для проведения исследования у этих больных их результаты было решено исключить из дальнейшего анализа. Полученные результаты сравнивались с результатами аналогичных исследований по изучению концентрации Гливека [2, 3, 6].
В группу 1 с остаточной концентрацией иматиниба в сыворотке крови через 24±3 часа после последнего приема (Сtrough) более 1000 нг/мл вошли 33 человека (62,3%), средняя концентрация иматиниба мезилата составила 1787,27 нг/мл. В данной группе полный клинико-гематологический ответ (ПКГО) получен у 32 человек (96,9%), полный цитогенетический ответ (ПЦГО) – у 31 (93,9%), большой молекулярный ответ (БМО) – у 24 (72,7%). Согласно данным литературы, в группе пациентов, принимающих Гливек, ПЦГО получен у 81,3% больных, а БМО – у 81,5% [2, 3, 6].
В группу 2 с остаточной концентрацией иматиниба в сыворотке крови через 24±3 часа после последнего приема (Сtrough) 700–999 нг/мл вошли 13 человек (24,5%), средняя концентрация иматиниба составила 906,92 нг/мл. В этой группе ПКГО получен у всех обследованных, ПЦГО – у 10 из 13 (76,9%), БМО – у 7 (53,8%). По данным литературы – у 100, 77,5 и 65,2% соответственно.
В группу 3 с остаточной концентрацией иматиниба в сыворотке крови через 24±3 часа после последнего приема (Сtrough) менее 700 нг/мл вошли 7 человек (13,2%), средняя концентрация иматиниба 521,42 нг/мл. ПКГО в этой группе получен у 6 человек из 7 (85,7%), ПЦГО – у 5 (71,4%), БМО – у 4 (57,1%). По данным литературы, ПЦГО у 48,1%, БМО – у 43,2% обследованных.
Таким образом, при концентрации иматиниба (Фи-лахромина) в сыворотке крови через 24±3 часа после последнего приема (Сtrough) 1000 и более нг/мл число больных, достигших ПЦГО и БМО, статистически значимо выше (с<0,05).
Гематологические (тромбоцитопения, нейтропения, анемия легкой и средней степени) и не гематологические побочные эффекты (периорбитальные отеки и отечность лица, задержка жидкости, диспепсия, боли в мышцах, суставах, дерматит, сыпь) встречались в группе 1 у 20 больных (54,1%), из них степень тяжести II – III у 3 человек (8,1%). В группе 2 побочные эффекты встречались у 11 пациентов (68,8%), а степень тяжести II – III наблюдалась у 4 больных (25%). Более высокая частота побочных эффектов от приема иматиниба и более высокая частота степени тяжести II – III в группе 2 могут привести к нарушению режима приема препарата пациентами, к снижению остаточной концентрации иматиниба в сыворотке крови и снижению эффективности терапии.
Все пациенты (53 человека) также были разделены на 2 группы (А и В) по длительности заболевания: больные из группы А болели 4 и более лет, они получали в первые 18 месяцев после диагностики заболевания препарат Гли-век, на котором были достигнуты ответы (ПКГО, ПЦГО, БМО), а потом были переведены на Филахромин. Пациенты из группы В болели 1–3 года, получали исходно терапию Филахромином.
В группе А (38 пациентов) полный клинико-гематологический ответ достигнут у 37 человек (97,4%), полный цитогенетический ответ – у 34 (89,5%), большой молекулярный ответ – у 30 больных (78,9%). В группе В (15 человек) полный клинико-гематологический ответ достигнут у 14 человек (93,3%), полный цитогенетический от- вет – у 11 (73,3%), большой молекулярный ответ – у 5 больных (33,3%).
Частота встречаемости гематологических (тромбоцитопения, нейтропения, анемия легкой и средней степени) и не гематологических (периорбитальные отеки и отечность лица, задержка жидкости, диспепсия, боли в мышцах, суставах, дерматит, сыпь) побочных эффектов составляла в группе А – 55,2% (21 человек), при этом до перевода на терапию Филохромином побочные эффекты наблюдались только у 17 больных (44,7%), получающих терапию Гливеком.
В группе В, получающей только терапию дженериком иматиниба Филахромином, побочные эффекты встречались у 66,6% больных (10 человек). Выраженная степень токсичности (2 или 3), требующая замены препарата на препарат второго поколения или другого производителя, в группе А встречалась у 4 больных (10,5%), в группе В – у 5 (33,3%).
Заключение
При исходном лечении оригинальным препаратом иматиниба Гливеком и дженериком Филахромином вероятность достижения полного клинико-гематологического ответа одинаковая, вероятность достижения полного цитогенетического ответа незначительно выше при лечении Гливеком (89,5% и 73,3% соответственно), однако статистически значимого различия не выявлено. Частота достижения большого молекулярного ответа достоверно выше при терапии Гливеком, чем при применении Филахромина (78,9% и 33,3% соответственно, с<0,01). Побочные эффекты при применении Филахромина встречаются чаще (у 66,6% больных), чем при применении оригинального препарата (44,7%).
Выводы
Появление ингибиторов тирозинкиназы принципиально изменило наше представление о возможностях консервативной терапии Ph+ хронического миелолейкоза. Контроль за соблюдением больным режима приема ИТК, а также за биодоступностью лекарственных препаратов можно осуществлять с помощью исследования остаточной концентрации уровня иматиниба в сыворотке крови через 24 часа после последнего приема препарата. При сравнении эффективности и безопасности применения оригинального иматиниба и дженериков оригинальный препарат демонстрирует большую эффективность на молекулярном уровне и меньшее количество побочных эффектов при использовании. Эффективность и безопасность применения дженериков иматиниба при хроническом миелолейкозе нуждается в дальнейшем изучении.
Список литературы Эффективность применения дженериков иматиниба у больных хроническим миелолейкозом
- Абдулкадыров К.М., Бессмельцев С.С., Рукавицын О.А. Хронический миелолейкоз. -СПб.: СпецЛит, 1998. -464 с.
- Куцев С.И. Генетический мониторинг таргетной терапии хронического миелоидного лейкоза: автореф. дисс.. докт. мед. наук. -М., 2009. -45 с.
- Куцев С.И., Оксенюк О.С., Кравченко Е.Г. и др. Лекарственный мониторинг терапии хронического миелолейкоза иматинибом//Клиническая онкогематология. Фундаментальные исследования и клиническая практика. -2010. -Т. 3, № 1. -С. 1-9.
- Ломаия Э.Г., Зарицкий А.Ю. Нилотиниб -новый этап успеха в терапии хронического миелолейкоза.//Современная онкология, экстравыпуск. -С. 7-12.
- Лорие С.С., Курова Е.С., Семочкин С.В., Туркина А.Г. и др. Эффективность и безопасность терапии иматиниб мезилатом (Гливеком) больных хроническим миелолейкозом в фазе акселерации//Вопросы гематологии/онкологии и иммунопатологии в педиатрии. -2002. -Т. 1, № 2. -С. 66-67.
- Оксенюк О.С. Влияние концентрации иматиниба в плазме крови на эффективность терапии хронического миелоидного лейкоза//Автореферат диссертации на соискание ученой степени кандидата медицинских наук. -М., 2011. -26 с.
- Туркина А.Г., Хорошко Н.Д. Практические рекомендации по лечению больных хроническим миелолейкозом. -М., 2005. -С. 4-5.
- Туркина А.Г., Хорошко Н.Д. Практические рекомендации по лечению больных хроническим миелолейкозом. -М., 2008. -С. 3-6.
- Туркина А.Г., Хорошко Н.Д., Дружкова Г.А. и др. Эффективность терапии иматиниба мезилатом (Гливеком) в хронической фазе миелолейкоза//Терапевтический архив. -2003. -Т. 75, № 8. -С. 62-67.
- Туркина А.Г., Челышева Е.Ю. Цитогенетический и молекулярный ответ -ранние маркеры эффективности терапии Гливеком больных Ph+ хроническим миелолейкозом//Фарматека. -2004. -№ 18. -С. 48-54.
- Хорошко Н.Д., Туркина А.Г., Кузнецов С.В. и др. Хронический миелолейкоз -успехи современного лечения и перспективы//Гематология и трансфузиология. -2001. -№ 4. -С. 7-12.
- Allan N.C., Richards S.M., Sheperd P.C.A. et al. UK Medical Research Council randomised multicentre trial of interferon-a in chronic myeloid leukemia: improved survival irrespective of cytogenetic response//The Lancet. -1995. -Vol. 345. -P. 1392-139.
- Durig J., Rosenthal S., Elmaagacli A. et al. Biological effects of stroma-derived factor-1 alpha on normal and CML CD34+ haemopoietic cells//Leukemia. -2000. -Vol. 14 (9). -P. 1652-1660.
- Fialkow P.J., Jacobson R.J., Papayannoulou T. Chronic myelocytic leukemia: clonal origin in a stem cell common to the granulocyte, erythrocyte, platelet and monocyte/macrophage//Am. J. Med. -1997. -Vol. 63. -P. 125-130.
- Gordon M.Y. Cellular and molecular mechanisms in chronic myeloid leukemia: biology and treatment//Brit. J. Haematol. -1996. -Vol. 95. -P. 10-20.
- Hasford J., Pfirrmann M., Hehlmann R. et al. A new prognostic score for survival of patients with chronic myeloid leukemia//Blood. -2011. -Vol. 118 (3). -P. 686-92.
- Sokal J.E., Cox E.B., Baccarani M. et al.//Blood. -1984. -Vol. 63. -P. 789-799.
- Kantarjian H.M., Cortes J.E., O,Brien S. et al. Imatinib mesylate therapy in newly diagnosed patients with Phyladelphya chromosome-positive chronic myelogenous leukemia: high incidence of early complete and major cytogenetic responses//Blood. -2003. -Vol. 101. -P. 97-100.
- Kantarjian H.M., Hochhaus A., Cortes J. et al. Высокая эффективность и безопасность Нилотиниба у пациентов в хронической фазе хронического миелоидного лейкоза с резистентностью к иматинибу или непереносимостью иматиниба//Blood. -2007. -Vol. 110. -226a (abs.735).
- Kantarjian H.M., Talpaz M., O,Brien S. et al. Imatinib mesylate for Phyladelphya chromosome-positive chronic-phase myeloid leukemia after failure of interferon-alpha: follow-up results//Clin. Cancer Res. -2002. -Vol. 8. -P. 2177-2187.
- Kloetzer W.S., Kurzrock R., Smith L. et al. The human cellular abl gene product in the chronic myelogenous leukemia cell line K-562 has associated tyrosine protein kinase activity//Virology. -1985. -Vol. 140. -P. 230-238.
- Kurzrock R., Kantarjian H.M., Druker B.J. et al. Philadelphia chromosome-positive leukemias: from basic mechanisms to molecular therapeutics//Ann. Intern. Med. -2003. -Vol. 138 (10). -P. 819-830.
- Lugo T.G., Pendergast A.M., Muller A.J. et al. Tyrosin kinase activity and transformation potency of bcr-abl oncogene products//Science. -1990. -Vol. 247. -P. 1079-1082.
- McWhirter J.R., Wang J.Y. Activation of tyrosinase kinase and microfilament-binding functions of c-abl by bcr sequences in bcr/abl fusion proteins//Mol. Cell. Biol. -1992. -Vol. 11. -P. 1553-1565.
- Moravkovа et al. Polymerase Chain Reaction Analyses Should Be Used as a Basis for Clinical Decision Making in Patients With Chronic Myelogenous Leukemia//Blood. -1999. -Vol. 94. -P. 3609-11.
- O,Brien S.G., Guilhot F., Larson R.A. et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia//N. Engl. J. Med. -2003. -Vol. 348. -P. 994-1004.
- O’Brien S., Guilhot F., Larson R. et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia//N. Engl. J. Med. -2003. -Vol. 348. -P. 994-1004.
- Peled A., Hardan I., Trakhtenbrot L. et al. Immature leukemic CD34+CXCR4+ cells from CML patients have lower integrin-dependent migration and adhesion in response to the chemokine SDF-1//Stem cells. -2002. -Vol. 20 (3). -P. 259-266.
- Rowley J.D. A new consistent chromosomal abnormality in chronic myelogenous leukemia giemsa starting//Nature. -1973. -Vol. 243. -P. 290-303.
- Soverini S., Colarossi S., Gnani A. et al. Contribution of ABL kinase domain mutations to imatinib resistance in different subsets of Philadelphiapositive patients: by the GIMEMA Working Party on Chronic Myeloid Leukemia//Clin. Cancer Res. -2006. -Vol. 12 (24). -P. 7374-7379.
- Steelman L.S., Pohnert S.C., Shelton J.G. et al. JAK/STAT, Raf/MEK/ERK, P13K/Akt and BCR-ABL in cell cycle progression and leukemogenesis//Leukemia. -2004. -Vol. 18 (2). -P. 189-218.
- Van Etten R.A. Cycling, stressed-out and nervous of c-abl//Trend Cell. Biol. -1999. -Vol. 9. -P. 179-186.


