Эффективность применения современных технологий в раннем восстановительном периоде у пациентов перенесших инсульт
Автор: Мизиева З.М., Ширшова Е.В.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.9, 2018 года.
Бесплатный доступ
В работе приведены результаты исследования эффективности механизированных комплексов «Armeo», «Amadeo» у 61 пациента после инсульта в раннем восстановительном периоде с нарушением двигательной функции верхней конечности. Дана сравнительная характеристика эффективности применения при геморрагическом и ишемическом инсультах. В результате исследования сделаны выводы о положительном влиянии использования роботизированных технологий в реабилитации пациентов с инсультом.
Инсульт, реабилитация, двигательные функции верхней конечности, роботизированная механотерапия "armeo"
Короткий адрес: https://sciup.org/143166523
IDR: 143166523 | DOI: 10.17816/clinpract09110-17
Текст научной статьи Эффективность применения современных технологий в раннем восстановительном периоде у пациентов перенесших инсульт
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Инсульт – ведущая причина приобретенной инвалидности среди взрослого населения во всем мире [12]. Многочисленные исследования демонстрируют, что до 86% пациентов испытывают сенсомоторные нарушения, и до 65% – ограничения подвижности верхней конечности в рамках повседневной деятельности [5]. Несмотря на то, что многие пациенты восстанавливают способность к самостоятельному передвижению, у большого числа сохраняются затруднения при движениях в верхней конечности [11]. Лечение этих нарушений играет особенно важную роль, с учетом того, что их степень тяжести тесно связана с общим уровнем функционирования пациента в долгосрочной перспективе [2, 9].
Роботизированные технологии все чаще применяют для оценки степени выраженности и лечения двигательных нарушений верхней конечности в неврологии [1]. Роботизированная терапия позволяет обеспечить высокую интенсивность тренировок, что является одним из ключевых факторов в восстановлении двигатель- ной функции. В сочетании с традиционной восстановительной терапией [10], роботизированная реабилитация позволяет достичь благоприятных результатов в отношении улучшения двигательного контроля, уменьшения двигательных нарушений и повышения способности к выполнению повседневной деятельности [11].
Повышение качества движений верхней конечности связывают с интенсивной двигательной активностью, которая позволяет восстановить и укрепить нейрональные проводящие пути, а также способствует процессам нейрональной пластичности [8]. Помимо интенсивной двигательной тренировки, необходимым фактором для успешной реабилитации является ориентированная на достижение цели и выполнение специализированных задач программа тренировок [3, 6]. Улучшения двигательной функции удается достичь за счет целенаправленных функциональных тренировок. Вариации повторяемых движений и элементы виртуальной реальности играют важную роль в мотивации пациентов, позволяя повысить интенсивность и эффективность тренировок [4, 7].
Применение роботизированных устройств в качестве возможной реабилитационной стратегии, направленной на восстановление двигательной функции верхней конечности, основывается на благоприятном влиянии на обучение двигательным навыкам, однако в настоящее время не изучена роль роботизированной реабилитации на динамику тревожнодепрессивной симптоматики у пациентов, отсутствуют четкие критерии оценки степени двигательных нарушений и эффективности проводимых восстановительных мероприятий, до конца не выяснена роль факторов, влияющих на процесс восстановления, крайне малочисленны сведения об отдаленных результатах лечения и качестве жизни постинсультных больных. Кроме того, проведено недостаточное число исследований для создания дифференцированного подхода к использованию роботизированных тренажеров в реабилитации пациентов в различные периоды инсульта.
Цель исследования: изучение эффективности применения механизированных комплексов с программным обеспечением и встроенной пациент-специфичной обратной связью «Armeo» и «Amadeo» у пациентов в раннем реабилитационном периоде.
Материалы и методы исследования
В исследование был включен 61 пациент раннего восстановительного периода инсульта (1-6 мес после ОНМК). Все пациенты были разделены на две группы: 31 (50,8%) пациентов составили основную группу, которой, кроме стандартной терапии, был назначен комплекс занятий на роботизированных тренажерах и 30 (49,2%) человек вошли в контрольную группу. В основной группе пациентов было 17 (54,8%) мужчин и 14 (45,2%) женщин в возрасте 61,89±9,65 лет, в контрольной – 18 (60%) мужчин и 12 (40%) женщин в возрасте 68,33±9,5 лет. Средний возраст пациентов составил 64,96±10,07 лет.
По характеру инсульта пациенты были распределены следующим образом: Инфаркт головного мозга (ИМ) был у 46 (75,4%) пациентов, геморрагический инсульт (ГИ) – у 15 (24,6%)
Всем пациентам был проведен неврологический осмотр с балльной оценкой по шкале NIHSS (National Institutes of Health Stroke Scale), оценка функциональных возможностей – по шкале Renkin, индексу мобильности Ривермид, индексу Bartel, пятибалльной шкале мышечной силы. Исследование психического статуса проводилось с помощью шкалы самооценки депрессии Бека (Beck Depression Inventory, BDI), госпитальной шкалы тревоги и депрессии (The hospital anxiety and depression scale – HADS) и краткой шкалы оценки психического статуса (Mini mental State Examination – MMSE). Оценка речевого статуса пациентов проводилась логопедом до и после курса лечения. Оценивалась импрессивная и экспрессивная стороны речи в баллах.
Все пациенты получали стандартное лечение, соответствующее стандартам оказания медицинской помощи больным с инсультом. Кроме того применялись и немедикаментозные методы терапии (массаж, физиолечение, игло-рефлексотерапия, ЛФК, психотерапия, логопедические занятия).
Пациенты основной группы в дополнение к общей терапии получали комплекс занятий на роботизированных тренажерах для восстановления движений верхней конечности «Армео» и «Амадео», основанные на биологической обратной связи. Курс лечения составил 18 дней, режим пассивный и пассивно-активный. Длительность каждой процедуры – 20 мин. Занятия проводились 1 раз в день по 2 процедуры (на комплексах «Армео» и «Амадео») каждому пациенту.
Результаты исследования
1. Оценка результатов лечения в раннем восстановительном периоде.
Неврологическая симптоматика преимущественно была представлена гемипарезом, негрубыми координаторными расстройствами, асимметрией лица, анизорефлексией, гемиги-пестезией. После курса проведенного лечения наблюдалось достоверное улучшение в обеих группах в виде уменьшения тяжести неврологических расстройств и улучшения повседневного функционирования, что, прежде всего, проявлялось в увеличении объема и силы движений в верхней конечности, а также улучшении в ней координации движений. При этом, тяжесть состояния пациентов после реабилитации, которым было проведено лечение с использованием роботизированных тренажеров, была достоверно менее выражена, по сравнению с пациентами, получавшими стандартное лечение (p<0,05).
Тяжесть инсульта по шкале NIHSS уменьшилась в 1,38 раза у пациентов с ИИ в I-й группе (p<0,05), и в 1,14 раза – во II-й группе (p>0,05), а при ГИ динамика неврологического дефицита была достоверно значима в обеих группах: улучшение в 1,23 и 1,16 раза в I-й и II-й группах соответственно. У пациентов с ИИ в I-й группе баллы по шкале NIHSS были в 1,14 раза ниже, чем у пациентов с ИИ во II-й группе (p<0,05).
Степень улучшения функционального исхода по индексу мобильности Ривермид была более выражена у пациентов I-й группы как с ИИ (1,53 раза; p<0,05), так и с ГИ (1,54 раза; p<0,05). Во II-й группе улучшения были менее выражены: 1,19 раза – при ИИ инсульте (p>0,05) и в 1,17 раза – при ГИ (p>0,05).
По завершению курса реабилитации прирост среднего суммарного числа баллов по шкале Бартел был высоким как при ИИ, так и при ГИ в обеих группах. Однако, у пациентов II-й группы с ГИ выявлена более существенная зависимость от посторонних лиц, а также более значимое ограничение бытовых возможностей по сравнению с пациентами с ГИ I-й группы (1,4 раза; p<0,05). Также у пациентов с ИИ показатели уровня бытовой независимости по шкале Бартел были лучше в I-й группе (p<0,05).
В I-й группе пациентов мышечная сила в верхней конечности увеличилась в 1,56 и 2,0 раза при ИИ и ГИ (p<0,05), а в нижней конечности – в 1,64 и 1,69 раза соответственно (p<0,05). Во II-й группе также выявлено увеличение мышечной силы как в верхней (в 1,25 и 1,22 раза при ИИ и ГИ), так и в нижней конечности (в 1,20 и 1,10 раза при ИИ и ГИ), однако данное увеличение не было статистически достоверным (p>0,05). У пациентов I группы с ИИ мышечная сила верхней конечности после курса реабилитации была
Таблица 1
Динамика по оцениваемым шкалам в зависимости от типа инсульта
|
Баллы по шкалам |
I группа |
II группа |
||
|
ИИ |
ГИ |
ИИ |
ГИ |
|
|
NIHSS |
||||
|
До лечения |
11,68±2,10 |
11,50±1,31 |
10,96±1,97 |
11,60±1,52 |
|
После лечения |
8,48±1,76# |
9,38±1,30# |
9,65±1,77* |
10,0±1,0# |
|
Ривермид |
||||
|
До лечения |
4,64±2,78 |
4,38±1,19 |
4,74±2,47 |
4,80±2,05 |
|
После лечения |
7,08±2,16# |
6,75±1,28# |
5,65±2,48* |
5,60±1,34 |
|
Бартел |
||||
|
До лечения |
25,4±13,7 |
15,0±10,4 |
24,3±10,6 |
18,0±15,3 |
|
После лечения |
59,6±15,8# |
55,6±13,5# |
47,0±18,8#,* |
39,0±12,0#,* |
|
Мышечная сила (верхняя конечность) |
||||
|
До лечения |
1,44±0,87 |
1,25±0,71 |
1,57±1,04 |
1,8±1,1 |
|
После лечения |
2,24±1,05# |
2,5±0,93# |
1,96±1,07* |
2,2±0,84 |
|
Мышечная сила (нижняя конечность) |
||||
|
До лечения |
1,76±0,93 |
1,63±0,74 |
1,91±1,08 |
2,0±1,0 |
|
После лечения |
2,88±0,88# |
2,75±0,71# |
2,3±1,11 |
2,2±0,84 |
* — p<0,05 — достоверные различия между пациентами I и II группы # — p<0,05 — достоверные различия до и после лечения
Таблица 2
Динамика по оцениваемым шкалам в зависимости от локализации инсульта
|
Баллы по шкалам |
I группа |
II группа |
||
|
Левое полушарие |
Правое полушарие |
Левое полушарие |
Правое полушарие |
|
|
NIHSS |
||||
|
До лечения |
12,00±1,77 |
11,25±2,05 |
11,53±1,77 |
8,63±1,75 |
|
После лечения |
8,76±1,68# |
10,36±1,91 |
10,12±1,73#,* |
9,09±1,38 |
|
Ривермид |
||||
|
До лечения |
4,41±2,45 |
4,75±2,57 |
4,18±1,63 |
5,64±3,08 |
|
После лечения |
7,0±2,06# |
7,0±1,93# |
5,12±1,65* |
6,45±2,95 |
|
Бартел |
||||
|
До лечения |
19,1±8,9 |
22,9±14,0 |
20,6±16,5 |
29,6±13,6 |
|
После лечения |
58,2±15,4# |
59,1±13,6# |
42,7±15,7#,* |
50,0±10,7# |
|
Мышечная сила (верхняя конечность) |
||||
|
До лечения |
1,29±0,85 |
1,5±0,82 |
1,41±0,87 |
1,91±1,22 |
|
После лечения |
2,29±1,11# |
2,31±0,95# |
1,76±0,97* |
2,36±1,03 |
|
Мышечная сила (нижняя конечность) |
||||
|
До лечения |
1,65±0,86 |
1,81±0,91 |
1,71±0,99 |
2,27±1,10 |
|
После лечения |
2,82±0,81# |
2,88±0,89# |
2,0±0,94 |
2,73±1,10 |
* — p<0,05 — достоверные различия между пациентами I и II группы # — p<0,05 — достоверные различия до и после лечения выше, чем в группе пациентов II группы с ИИ в 1,14 раза (p<0,05) (табл. 1).
При оценке динамики неврологического дефицита в зависимости от локализации инсульта, было выявлено, что у пациентов I-й группы при правополушарной локализации инсульта наблюдалась тенденция к регрессии неврологической симптоматики по шкале NIHSS (1,09 раза; p>0,05), тогда как во II-й группе наблюдалось незначительное улучшение (1,05 раза; p>0,05).
Улучшение по индексу мобильности Ривер-мид было статистически достоверным у пациентов I-й группы, как при левополушарной (1,59 раза; p<0,05), так и при правополушарной локализации инсульта (1,47 раза; p<0,05), тогда как во II-й группе улучшения не были столь выражены: в 1,22 и 1,14 раза выше при право- и левополушарной симптоматике соответственно (p>0,05).
При левополушарной локализации инсульта у пациентов I-й группы средний балл по индексу Бартел увеличился в 3,0 раза (p<0,05), а при правополушарной – в 2,6 раза (p<0,05), тогда как во II-й группе – в 2,1 и 1,7 раза соответственно (p<0,05). Восстановление бытовой активности у пациентов с левополушарной локализацией инсульта I-й группы было в 1,4 раза лучше, чем у пациентов II-й группы с соответствующей локализацией (p<0,05).
В I-й группе пациентов мышечная сила верхней конечности увеличилась после курса лечения в 1,78 раза при левосторонней (p<0,05) и в 1,54 раза при правосторонней локализации инсульта (p<0,05). Мышечная сила нижней конечности также достоверно увеличилась – в 1,71 и 1,59 раза при левосторонней и правосторонней локализации инсульта соответственно (p<0,05). Во II-й группе увеличение мышечной силы в конечностях наблюдалось как при левосторонней локализации инсульта – в 1,25 и 1,17 раза в руке и ноге соответственно, так и при правосторонней – в 1,24 и 1,20 раза. Однако, данное улучшение не было статистически достоверным (p>0,05) (табл. 2).
Самую тяжелую степень неврологического дефицита имели пациенты с верифицированным обширным инфарктом. Как видно из таблицы 3, вне зависимости от локализации инсульта у пациентов I-й группы наблюдалось статистически достоверное уменьшение функционального дефицита по шкале NIHSS в 1,93 при лакунарном (p<0,05), в 1,29 при среднем (p<0,05) и 1,41 раза при обширном объеме поражения (p<0,05). Менее значимое улучшение наблюдалось у пациентов II-й группы, где улучшение было лишь в 1,08 – при лакунарном (p>0,05), 1,13 – при среднем (p>0,05) и 1,17 раза при обширном объеме поражения (p>0,05).
Таблица 3
Динамика по шкале NIHSS в зависимости от объема инсульта
|
Баллы |
I группа |
II группа |
||||
|
Лакунарный |
Средний |
Обширный |
Лакунарный |
Средний |
Обширный |
|
|
NIHSS |
||||||
|
До лечения |
8,67±1,16 |
11,47±1,73 |
12,75±1,28 |
8,67±1,16 |
10,71±1,57 |
12,75±1,28 |
|
После лечения |
4,5±0,71# |
8,87±1,64# |
9,06±1,0# |
8,0±1,0* |
9,47±1,42 |
10,88±1,64* |
|
Ривермид |
||||||
|
До лечения |
13,0±0 |
4,47±1,51 |
3,63±0,72 |
8,33±1,16 |
4,76±2,39 |
3,38±0,74 |
|
После лечения |
13,5±0,71 |
6,73±1,1# |
6,44±1,03# |
8,33±1,16* |
5,88±2,37 |
4,13±1,13* |
|
Бартел |
||||||
|
До лечения |
62,5±4,6 |
22,3±8,8 |
15,9±2,9 |
58,3±12,8 |
22,9±18,1 |
13,8±8,8 |
|
После лечения |
97,5±3,5 |
57,3±12,5# |
55,0±11,3# |
73,3±11,5 |
45,3±16,2#,* |
35,6±12,1#,* |
|
Мышечная сила (верхняя конечность) |
||||||
|
До лечения |
3,5±0,71 |
1,33±0,72 |
1,19±0,54 |
3,67±0,58 |
1,53±0,87 |
1,0±0 |
|
После лечения |
4,0±1,41 |
2,4±0,83# |
2,0±0,97# |
3,67±0,58 |
2,0±0,94 |
1,38±0,52* |
|
Мышечная сила (нижняя конечность) |
||||||
|
До лечения |
4,0±0 |
1,8±0,68 |
1,38±0,62 |
3,67±0,58 |
2,0±0,94 |
1,13±0,35 |
|
После лечения |
5,0±0 |
2,73±0,59# |
2,69±0,70# |
3,67±0,58 |
2,41±1,0 |
1,5±0,54* |
* — p<0,05 — достоверные различия между пациентами I и II группы # — p<0,05 — достоверные различия до и после лечения
У пациентов I-й группы достоверное улучшение показателей мобильности по шкале Ривер-мид после курса реабилитации наблюдалось при среднем и обширном объеме поражения – в 1,51 и 1,77 раза соответственно (p<0,05), чего не было у пациентов II-й группы. У пациентов с обширным инсультом в I-й группе состояние было в 1,56 раза лучше, чем во II-й (p<0,05).
В обеих группах наблюдалось достоверное улучшение показателей по индексу функциональной активности Бартел при среднем объеме инсульта: в 2,6 и 2,0 раза в I-й и II-й группах соответственно (p<0,05), а также при обширном поражении: в 3,5 и 2,6 раза в I-й и II-й группах соответственно (p<0,05). При этом, к концу реабилитационного курса средний балл у пациентов I-й группы с обширным инсультом был в 1,5 раза выше, чем у пациентов II-й группы, что демонстрирует меньшую зависимость в повседневной деятельности у данной группы пациентов.
Более значимое увеличение мышечной силы после проведенного курса реабилитации отмечалась у пациентов I-й группы со средним (в 1,80 и 1,52 раза в верхней и нижней конечностях; p<0,05) и обширным объемом инсульта (в 1,68 и 1,95 раза в верхней и нижней конечностях; p<0,05). Во II-й группе динамики мышечной силы при лакунарном инсульте не наблюдалось, а при среднем и обширном объемах поражения она была минимальна (в 1,31 и 1,38 раза в верхней конечности; p>0,05 и в 1,21 и 1,33 раза в нижней конечности; p>0,05). Различия между группами выявлены среди пациентов с обширным объемом поражения как в верхней (в 1,45 раза; p<0,05), так и в нижней конечности (в 1,79 раза; p<0,05) (Табл. 3).
Корреляционный анализ выявил наличие отрицательной взаимосвязи мышечной силы верхней и нижней конечностей после лечения с объемом поражения головного мозга (r=-0,451; p<0,001 и r=-0,420; p<0,001).
Показатели психического статуса были проанализированы у 46 пациентов: у 24 (72,7%) из I группы и 22 (78,6%) – из II-й.
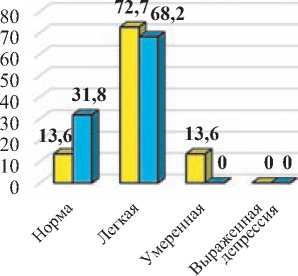
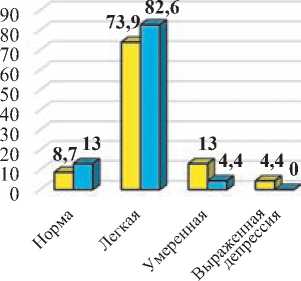
Средний балл по шкале депрессии Бека у пациентов I-й и II-й групп не различался до начала лечения и составил 13,6±2,7 и 13,6±3,4 баллов соответственно (p>0,05). После лечения более выраженные улучшения наблюдались у пациентов I-й группы (средний балл составил 10,6±1,8; p<0,05), что было достоверно лучше, чем у пациентов I-й группы, у которых средний балл после проведенного лечения был 12,1±2,4.
После проведенного лечения в I-й группе достоверно увеличилось число пациентов, у которых отсутствовали признаки депрессивной симптоматики по шкале Бека (с 13,6% до 31,8%
До лечения После лечения
I группа
Рис. 1. Динамика депрессивной симптоматики по шкале Бека
До лечения После лечения
II группа
– в 2,3 раза; p<0,01), тогда как во II-й группе не было выявлено статистически достоверных улучшений (с 8,7% до 13,0%; p>0,05). При этом, после лечения пациентов без признаков депрессии было достоверно больше в I-й группе по сравнению со II-й (31,8% и 13,0% – в 2,4 раза (p<0,01) (рис. 1).
Различий по типу, локализации и объему поражения инсульта и депрессивной симптоматикой по шкале Бека между группами выявлено не было. Выраженность депрессивных расстройств уменьшалась по мере роста функциональной независимости и мобильности.
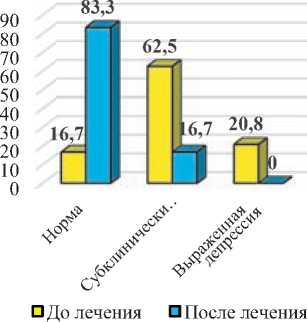
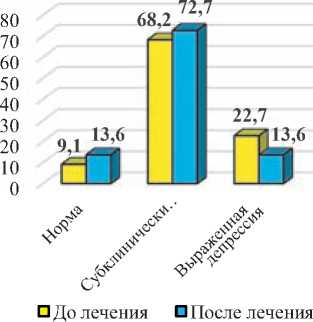
Средний балл при оценке уровня депрессии по шкале HADS до начала лечения у пациентов I-й группы составил 9,0±1,6 баллов, а у пациентов II-й группы – 9,6±1,3 балла. После лечения наблюдалось достоверное снижение уровня депрессии у пациентов I-й группы (до 7,0±1,0 баллов; p<0,05), тогда как во II-й группе динамика была минимальна и средний балл после проведенного лечения составил 9,2±1,3 балла (p>0,05). При этом показатели депрессивной симптоматики у пациентов I-й группы были в 1,3 раза менее выражены, чем у пациентов II-й группы (p<0,05) (рис. 2).
После лечения в I-й группе достоверно увеличилось число пациентов без признаков депрессии по шкале HADS в 5,0 раза (p<0,001), а также уменьшилось число пациентов с субклинически выраженной депрессивной симптоматикой в 3,7 раза (p<0,01), чего не наблюдалось у пациентов II-й группы. При этом число пациентов без признаков депрессии и с субклинически выраженными признаками депрессии в I-й группе было достоверно больше, чем среди пациентов II-й группы в 6,1 и 4,4 раза (p<0,001).
Нарушения речевой функции в виде афазии (сенсорной или моторной) и/или дисфазии выявлены у 27 пациентов в раннем восстановительном периоде: у 15 (55,6%) в I-й группе и 12 (44,4%) во II-й группе.
I группа
II группа
Рис. 2. Динамика депрессивной симптоматики по шкале HADS
Таблица 4
Динамика речевого статуса
|
Речевой статус |
I группа (n=15) |
II группа (n=12) |
||
|
До начала лечения |
После лечения |
До начала лечения |
После лечения |
|
|
Импрессивная сторона речи |
||||
|
Понимание речи в диалоге |
14,9±7,6 |
26,3±5,0 |
15,1±8,2 |
19,1±7,8 |
|
Понимание инструкций |
10,2±8,2 |
21,3±4,6 |
11,6±8,0 |
15,7±7,6* |
|
Понимание слов, обозначающих предметы |
7,5±2,1 |
20,7±5,0 |
9,5±9,1 |
14,6±7,8* |
|
Понимание слов, обозначающих глаголы |
5,0±2,3 |
13,9±7,2 |
6,6±2,6 |
10,5±8,7 |
|
Понимание фраз, логикограмматических и предложных конструкций |
6,1±2,4 |
17,4±5,5 |
6,4±2,6 |
11,7±2,3* |
|
Экспрессивная сторона речи |
||||
|
Ответы в диалоге |
9,2±2,0 |
19,5±5,5 |
8,7±2,1 |
15,8±7,7 |
|
Называние предметов |
7,1±1,9 |
23,3±3,8 |
7,0±2,4 |
16,3±6,3* |
|
Называние действий |
5,6±1,9 |
23,0±4,0 |
6,0±2,2 |
15,8±6,5* |
|
Составление фраз по картинкам |
3,1±1,5 |
13,9±6,3 |
2,9±1,7 |
8,3±6,5 |
|
Общее количество баллов |
68,8±17,5 |
179,3±33,5 |
73,9±20,17 |
127,8±17,8* |
* – p<0,05 – достоверные различия между пациентами I и II группы
У таких пациентов наблюдались поиски артикуляции при выполнении артикуляторных проб различной степени выраженности, смешения близких по артикуляции звуков, не всегда доступное воспроизведение их по акустическому образцу сразу после предъявления, ограничения в сфере речевой коммуникации, вследствие имеющихся трудностей артикулирования, словарного дефицита и невозможности оперативного конструирования фраз.
После курса логопедических занятий у пациентов повысилась речевая активность, они стали способны составлять не только простые, но и сложные по структуре предложения, восстановилась фразовая речь, стали доступны некоторые формы дезавтоматизированной речи (табл. 4).
При этом динамика улучшений речи у пациентов I-й группы была достоверно лучше, чем у пациентов II-й группы. При оценке импрес-сивной стороны речи различия наблюдались по таким характеристикам как понимание инструкций (в 1,36 раза; p<0,05), понимание слов, обозначающих предметы (в 1,42 раза; p<0,05) и понимание фраз, логикограмматических и предложных конструкций (в 1,49 раза; p<0,05). При оценке экспрессивной стороны речи различия наблюдались по таким критериям как называние предметов (в
1,43 раза; p<0,05) и называние действий (в 1,46 раза; p<0,05).
В целом динамика в I-й группе составила 110,5±43,3, а во II-й – 53,9±20,5 (p<0,05) и общая сумма баллов у пациентов I-й группы была в 2,1 раза больше, чем во II-й (p<0,05).
Таким образом, реабилитация с использованием роботизированных тренажеров в раннем восстановительном периоде инсульта способствует, помимо улучшения двигательных функций, более выраженному улучшению речевого статуса по сравнению с комплексом стандартных лечебных мероприятий. Пациенты, которые занимались на роботизированном комплексе с программным обеспечением и встроенной пациент-специфичной обратной связью «Armeo» и роботизированном механокомплексе «Amadeo», достигали востребованных в бытовой деятельности и более разнообразных целей реабилитации.
Выводы
Применение роботизированного комплекса с программным обеспечением и встроенной пациент-специфичной обратной связью «Armeo» и роботизированного механокомплекса «Amadeo» в восстановлении неврологических функций верхней конечности у больных в ран- нем восстановительном периоде инсульта в значительной степени повышает эффективность реабилитационных мероприятий по сравнению со стандартными методами восстановительной терапии. Наиболее благоприятным прогнозом в улучшении двигательных функций верхней конечности обладают пациенты с инфарктом мозга, левосторонней локализацией и лакунарным или обширным объемом поражения.
Применение роботизированного комплекса «Armeo» и «Amadeo» у пациентов в раннем восстановительном периоде инсульта способствует более значимому улучшению речевого статуса на фоне занятий с логопедом (как экспрессивной, так и импрессивной стороны речи) по сравнению с комплексом стандартных лечебных мероприятий.
Включение курса тренировок механизированных комплексов с программным обеспечением и встроенной пациент-специфичной обратной связью «Armeo» и «Amadeo» у пациентов в раннем восстановительном периоде инсульта способствует достоверному снижению выраженности депрессивного синдрома, чего не наблюдается при использовании стандартных методов восстановительной терапии.
Список литературы Эффективность применения современных технологий в раннем восстановительном периоде у пациентов перенесших инсульт
- Альтман Д.А., Карпова М.И., Долганов М.В. и др. Опыт применения виртуальной реальности в восстановлении двигательной функции верхней конечности в остром периоде инсульта в Челябинской областной клинической больнице. Вестник Челябинской областной клинической больницы. 2016; 1 (31): 52-55.
- Румянцева С.А., Силина Е.В., Орлова А.С., Болевич С.Б. Оценка реабилитационного потенциала у коморбитных больных с инсультом. Вестник восстановительной медицины. 2014; 3: 91-2.
- Хатькова С.Е., Акулов М.А., Орлова О.Р., Орлова А.С. Современные подходы к реабилитации больных после инсульта. Нервные болезни. 2016; 3: 27-33.
- Ястребцева И.П., Николаева С.В., Баклушина Е.А. Восстановление функциональной активности верхней конечности у пациентов с церебральным инсультом. Доктор.Ру. 2016; 12-2 (129): 27-30.
- Buma F., Kwakkel G., Ramsey N. Understanding upper limb recovery after stroke. Restor Neurol Neurosci. 2013; 31(6): 707-22.
- Bruni M.F., Melegari C., De Cola M.C. et al. What does best evidence tell us about robotic gait rehabilitation in stroke patients: A systematic review and meta-analysis. J Clin Neurosci. 2018 Feb; 48: 11-17.
- Contu S., Hussain A., Kager S. et al. Proprioceptive assessment in clinical settings: Evaluation of joint position sense in upper limb post-stroke using a robotic manipulator. PLoS One. 2017; 12(11): e0183257
- Kiper P., Szczudlik A., Venneri A. et al. Computational models and motor learning paradigms: Could they provide insights for neuroplasticity after stroke? An overview. J Neurol Sci. 2016; 369: 141-148.
- Kim J.O., Lee J., Lee B.H. Effect of Scapular Stabilization Exercise during Standing on Upper Limb Function and Gait Ability of Stroke Patients. J Neurosci Rural Pract. 2017; 8(4): 540-544.
- Lo K., Stephenson M., Lockwood C. Effectiveness of robotic assisted rehabilitation for mobility and functional ability in adult stroke patients: a systematic review. JBI Database System Rev Implement Rep. 2017; 15(12): 3049-3091.
- Mazzoleni S., Duret C., Grosmaire A.G., Battini E. Combining Upper Limb Robotic Rehabilitation with Other Therapeutic Approaches after Stroke: Current Status, Rationale, and Challenges. Biomed Res Int. 2017; 2017: 8905637.
- Feigin V.L., Norrving B., Mensah G.A. Global Burden of Stroke. Circ Res. 2017; 120(3): 439-448.


