Эффективность протеаз панкреатина и трипсина при ферментативном гидролизе коллагена
Автор: Семенычева Людмила Леонидовна, Егорихина Марфа Николаевна, Часова Виктория Олеговна, Валетова Наталья Борисовна, Митин Александр Вячеславович, Кузнецова Юлия Леонидовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.12, 2020 года.
Бесплатный доступ
Проведен анализ молекулярно-массовых характеристик (ММХ) (молекулярной массы (ММ) и коэффициента полидисперсности (КП)) гидролизата высокомолекулярного рыбного коллагена (РК) в процессе ферментативного гидролиза двумя протеолитическими ферментами: панкреатином и трипсином при комнатной температуре. Показана высокая эффективность ферментов: основная часть РК гидролизуется в течение первой минуты как в случае панкреатина, так и трипсина, при этом образуется несколько фракций гидролизата РК. В случае трипсина наблюдается небольшая олигомерная фракция. Коэффициент полидисперсности Мw/Мn для фракций в процессе гидролиза имеет значения преимущественно не более 1,2, что свидетельствует об однородности фракций коллагена по ММ. Исходный нативный РК с ММ ~ 300 кДа во фракциях гидролизата отсутствует. Эти данные свидетельствуют о высокой скорости гидролиза в присутствии указанных ферментов. Для обоих ферментов наблюдается образование двух низкомолекулярных фракций гидролизата с близкими значениями ММ ~ 17 кДа и ~ 9 кДа, причем доля последней фракции в растворе больше 80 %. Последующий контроль ММХ показал, что происходит медленное уменьшение доли всех фракций до практически полного исчезновения за трое суток, кроме низкомолекулярной фракции с ММ ~ 9 кДа, содержание которой постепенно увеличивается. Вид кривых молекулярно-массового распределения (ММР) для разных ферментов практически одинаков, однако наблюдается небольшое различие в соотношениях фракций гидролизатов на разных стадиях гидролиза при использовании указанных ферментов, связанное с незначительной разницей в эффективности использованных ферментов, которое может отразиться на строении скаффолда в процессе его формирования. Различия в значениях ММ и соотношении фракций с разной ММ свидетельствуют о влиянии природы ферментов на процесс гидролиза высокомолекулярного коллагена. Представленные результаты хорошо согласуются с известными литературными данными о природе ферментов панкреатина. Протеолитические ферменты, входящие в состав панкреатина, - трипсин, пепсин и химотрипсин - катализируют гидролиз пептидных связей, образованных остатками аминокислот аргинина и лизина. Ярко выраженная ограниченная субстратная специфичность ферментов приводит к практически количественному образованию в процессе гидролиза узкодисперсного олигомера с ММ ~ 9 кДа. В совокупности с результатами исследований действия ферментов на другие компоненты конструкции скаффолдов, а также биомиметическими испытаниями они позволят моделировать состав, строение и важнейшие характеристики скаффолдов с оптимизированными свойствами. Это особенно важно, если в процессе формирования скаффолдов и биомедицинских клеточных продуктов используются реакции ферментативного гидролиза, так как получаемая в результате клеточная матрица формируется не из нативных молекул, а из их гидролизатов.
Биополимеры, скаффолды, высокомолекулярный рыбный коллаген, панкреатин, трипсин, эффективность гидролиза
Короткий адрес: https://sciup.org/147233159
IDR: 147233159 | УДК: 547.964:544.169 | DOI: 10.14529/chem200108
Текст научной статьи Эффективность протеаз панкреатина и трипсина при ферментативном гидролизе коллагена
Развитие реконструктивной медицины на базе тканевой инженерии связано прежде всего с созданием новых материалов высокой функциональности, способных имитировать биологические, структурные и физические функции естественных тканей организма. В настоящее время существует высокая потребность в продуктах тканевой инженерии, в том числе в продуктах скаффолд-технологий. Основная технология использования скаффолдов – заселение клетками непосредственно перед имплантацией или во время нее [1–7]. В то же время одной из ключевых проблем при использовании даже идеального источника клеточного материала является необходимость создания подходящего искусственного биомиметического матрикса. В связи с этим основной задачей тканевой инженерии является создание клеточных матриц (скаффолдов) с последующим образованием сложных клеточных композиций, подобных ткани или органу, для дальнейшей трансплантации их пациенту взамен поврежденных или утраченных. Для создания скаф-фолдов предлагают использовать природные и синтетические полимеры. Чаще других в случае биополимеров используют белки, такие как коллаген, фибрин, фиброин шелка и др. При получении скаффолдов применяют протеолитические ферменты [8–11], гидролизующие пептидную связь белков с целью образования новых связей уже в скаффолде, при этом отмечается влияние молекулярно-массовых характеристик (ММХ) используемого полимера на свойства получаемых матриц [12–14]. Изменения молекулярных и надмолекулярных параметров биополимеров клеточных матриц при формировании скаффолдов, влияние этих параметров на биомиметические свойства при построении тканеинженерных конструкций зависят не только от природы используемого белкового материала, но и от природы фермента [15, 16]. Варьирование фермента может позволить при построении тканеинженерных конструкций моделировать характеристики скаф-фолдов.
Разрабатываемые клеточные матрицы, имитирующие естественный внеклеточный матрикс, должны обеспечивать достаточную временную механическую поддержку для развития ткани и обладать физиологической активностью, достаточной для развития межклеточных контактов, но в то же время подвергаться естественной резорбции с трансформацией в натуральный внеклеточный матрикс [3, 17]. Использование коллагена I типа широко распространено при создании скаффолдов, так как он имеет несколько преимуществ, позволяющих использовать данный биополимер для получения продуктов тканевой инженерии: биосовместимость, волокнистая структура, хорошая сочетаемость с другими материалами, биодеградируемость [2, 3, 18, 19].
Однако нативный коллаген представляет собой быстро разлагаемый биополимер из-за своей фибриллярной волокнистой структуры. Но в сочетании с другими синтетическими и природными полимерами этот недостаток с легкостью устраняется, более того, наблюдается увеличение жесткости и упругости гибридного материала в условиях ферментативного разрушения нативных молекул белка [13, 20, 21]. Ранее было установлено, что при гидролизе нативного высокомолекулярного коллагена I типа, выделенного из кожных покровов разных животных, в стандартных условиях в присутствии панкреатина происходит гидролиз с достаточно высокой скоростью [22].
Целью данного исследования является сравнение ММХ рыбного коллагена (РК) в процессе гидролиза в присутствии многокомпонентного фермента панкреатина, в состав которого входят протеолитические ферменты трипсин, пепсин, и химотрипсин, а также только трипсина в условиях, близких к условиям формирования скаффолдов [23]. Главной задачей при этом стал контроль ММХ гидролизата коллагена в течение длительного времени.
Экспериментальная часть
В работе использовали коммерческие ферменты: панкреатин [Хубей Максфарм Индастриз Ко. Лтд (Китай)], трипсин [ООО НПП «ПанЭко»], AcOH (ХЧ). Высокомолекулярный рыбный коллаген (РК) выделяли по методу [24].
При проведении ферментативного гидролиза использовали 1%-ный раствор РК. К раствору высокомолекулярного РК добавляли 1М NaOH для достижения нейтральной среды и доводили дистиллированной водой до определенного объема. Гидролиз в присутствии ферментов проводили при фермент-субстратном соотношении коллаген : фермент = 10:1, добавляя к полученной смеси фермент. Из реакционной среды брали пробы (1 мл) через определенные промежутки времени после добавления фермента. Для прерывания гидролиза в пробы приливали 4%-ный раствор AcOH.
Молекулярно-массовые характеристики проб гидролизата РК определяли методом ГПХ с применением высокоэффективного жидкостного хроматографа фирмы Shimadzu CTO20A/20AC (Япония) с программным модулем LC-Solutions-GPC. Разделение проводили с применением колонки Tosoh Bioscience TSKgel G3000SWxl с диаметром пор 5 мкм. В качестве детектора применяли низкотемпературный светорассеивающий детектор ELSD-LT II. Элюентом служил 0,5 М раствор уксусной кислоты. Скорость потока 0,8 мл/мин. Для калибровки использовали узкодисперсные образцы декстрана с диапазоном молекулярных масс (ММ) 1 000– 410 000 Да (Fluca).
Обсуждение результатов
В соответствии с п ос та в л енной в исследовании целью проводили анал и з М МХ (ММ и КП) г идроли за т а Р К в п роц е с с е ферментативного гидролиза при комнатной тем п е ра ту ре . Ок а за лось, ч т о ос н овн ая час ть в ыс о комол екулярного РК гидролизуется в течение первой ми н уты к а к в с л учае панкреатина, так и три п с и н а (ри с . 1 ) . При использовании панкреатина образуется три фракции ги д ролиза та Р К с ММ мен е е 70 к Д а ( 13 –15 %), с ММ ~ 17,5 кДа (2,0–3,5 %) и ММ ~ 9 кДа (83–84 %), в с лу ча е ж е три п с и на н аблюдается еще небольшая олигомерная фрак ц и я (~ 1,0 %) с ММ ~ 300 Да , а фр а к ц ия и с ход н ого н а ти в н о го Р К с М М ~ 300 кДа отсутствует. То есть действ и е п а н к ре а ти н а и три п с ин а п риводит к полному разрушению исходного на ти в н ого Р К д о н и зкомол е к у лярн ых фра к ц и й у же в течение первой минуты, что свидетельствует о высокой эффективн ости ги дрол иза в п ри с у тс тв и и у к а за н н ых ферме н т ов .
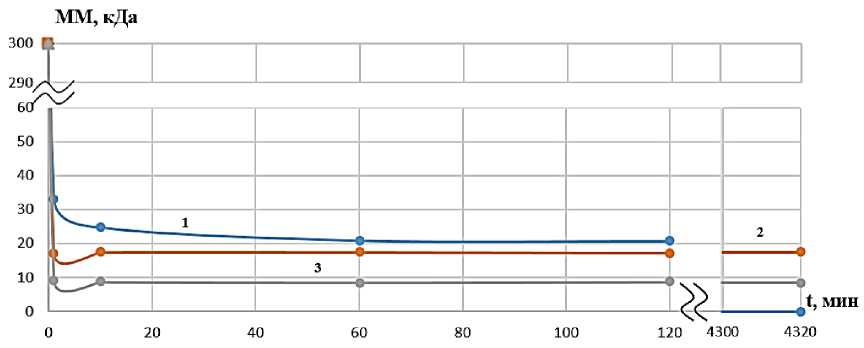
Рис. 1. Изменение молекулярной массы разных фракций при гидролизе РК панкреатином: 1 – фракция с ММ выше 17 кДа; 2 – фракция с ММ ~ 17 кДа; 3 – фракция с ММ ~9 кДа
Интересно о т ме ти ть, что наблюдается образование двух низкомолекулярн ых фрак ц и й ги д р олизата со значениями ММ ~ 17 кДа и ~ 9 кДа для обоих ферментов, при че м д оля п о с ле дн ей ф ра кци и в ра створе боль ш е 80 % (рис. 1, 2). Последующий контроль ММХ в течение трех часов показа л ( с м. ри с. 1, 2) , что п роисходит медленное уменьшение первой фрак ц и и с М М в ы ше 17 к Да д о полн ог о и с че з н ов е ния за трое суток (кривые 1 на рис. 3, 4), соде ржа н ие в торой фра кции с ММ ~ 1 7 кД а н е много у в еличивается вначале и для панкреатина, и дл я т ри п с и н а , х отя конц ентраци я фр а к ц и и н е много различается в образцах гидролизата разными ф е рме н та ми ( к ри в ы е 2 н а ри с . 3, 4) , а за те м и зме н яе т ся мало, содержание низкомолекулярной фр а к ц и и с ММ ~ 9 кДа п осте п е н н о ув е л и чи вае тся ( к ри в ые 3 н а ри с . 1, 2) . Оли гоме рн а я фрак ц и я в растворе с трипсином со в ре ме не м и с че з а е т, в ид и мо, за счет разрушения до неконтролируемых ме тод ом а ми н ок и слот (к ри в а я 4 н а ри с . 4) . В обра зц а х через трое суток в растворе с панкреатином ос та е т с я толь к о гидр оли з ат Р К с ММ ~ 9 к Да ( с м. ри с . 1) в с лу ча е гидролиза трипсином доля его составляет ~ 90 % (~ 10 % РК с ММ ~ 17 кДа ) . Т о ес ть н а блю да е тс я ра зру ш е н и е и с ход н о го высокомолекулярного коллагена с о б ра зов а н и ем д в ух низкомолекулярных фракций (рис. 5, 6). О б ращает на себя внимание небольшое различие в с оотношениях фракций гидролизатов на разн ых ста д и ях ги д ро ли за п ри и с п ол ьзовани и у к а зан н ых ферментов, которое может отразиться на строе н и и ск а ф фол д а в п роц е сс е его форми ров ани я (рис. 1, 2). В табл. 1, 2 приведены значения ММ и КП в процессе гидролиза, свидетель с тв у ю щ и е об о д н ород н о с ти фрак ц и й – коэффициенты полидисперсности (К П ) имею т значени я п реи му щ е с тв е н н о н е б ол е е 1,2.
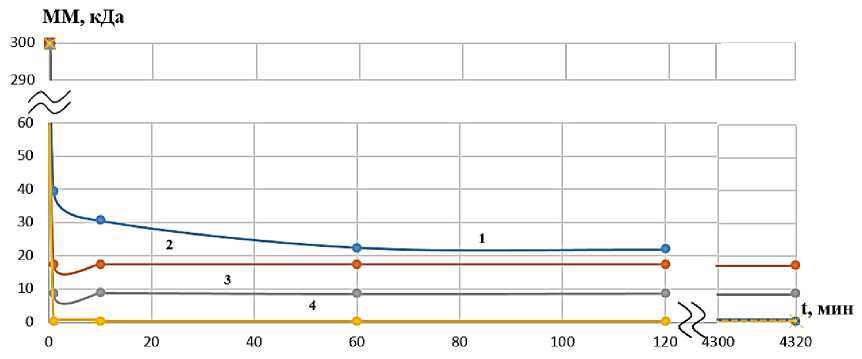
Рис. 2. Изменение молекулярной массы разных фракций при гидролизе РК трипсином: 1 – фракция с ММ выше 17 кДа; 2 – фракция с ММ ~ 17 кДа; 3 – фракция с ММ ~ 9кДа;
4 – олигомерная фракция с ММ ~ 0,3 кДа
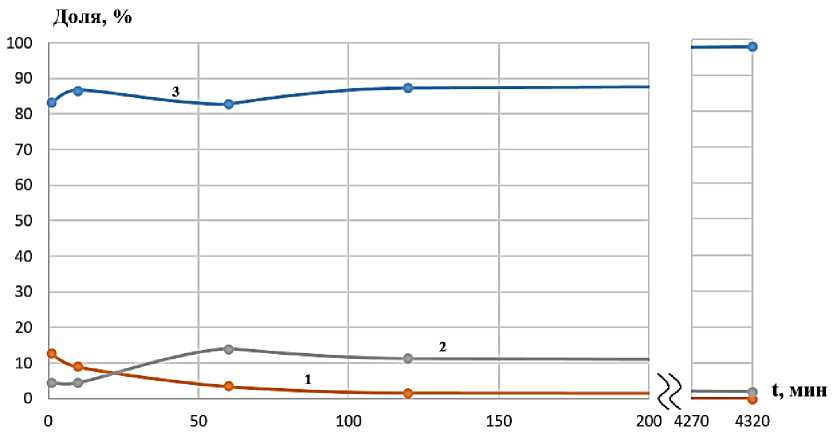
Рис. 3. Доля разных фракций при гидролизе РК панкреатином: 1 – фракция с ММ выше 17 кДа; 2 – фракция с ММ ~ 17 кДа;
3 – фракция с ММ ~ 9кДа
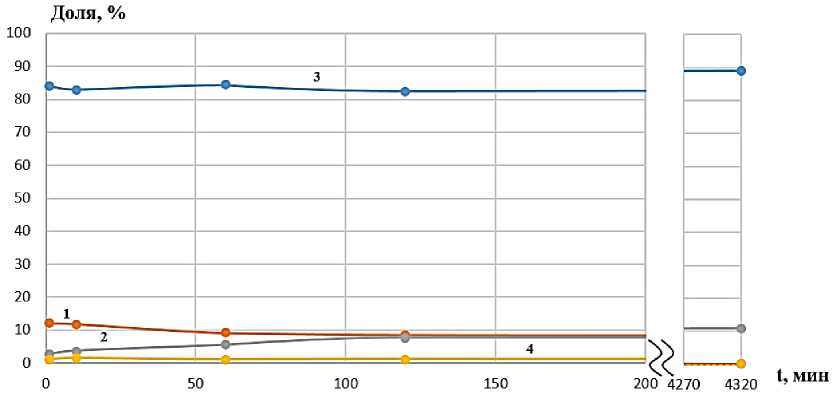
Рис. 4. Доля разных фракций при гидролизе РК трипсином: 1 – фракция с ММ выше 17 кДа; 2 – фракция с ММ ~ 17 кДа; 3 – фракция с ММ ~ 9кДа; 4 – олигомерная фракция с ММ ~ 0,3кДа
Таблица 1
Молекулярно-массовые параметры РК при ферментативном гидролизе панкреатином в течение 3 суток
|
№ п/п |
Значения ММХ во время гидролиза |
|||||||||
|
мин |
3 суток |
|||||||||
|
1 |
10 |
60 |
120 |
|||||||
|
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
|
|
1 |
33,1 |
1,2 |
24,9 |
1,1 |
21 |
1,0 |
20,8 |
1,0 |
– |
– |
|
2 |
17,5 |
1,0 |
17,5 |
1,0 |
17,3 |
1,0 |
17,5 |
1,0 |
17,2 |
1,0 |
|
3 |
9,2 |
1,0 |
8,7 |
1,0 |
8,5 |
1,0 |
8,7 |
1,0 |
8,3 |
1,0 |
Таблица 2
|
№ п/п |
Значения ММХ во время гидролиза |
|||||||||
|
мин |
3 суток |
|||||||||
|
1 |
10 |
60 |
120 |
|||||||
|
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
М w ·10–3 |
М w /М n |
|
|
1 |
39,5 |
1,3 |
30,7 |
1,2 |
22,5 |
1,0 |
21,9 |
1,0 |
– |
– |
|
2 |
17,4 |
1,0 |
17,4 |
1,0 |
17,4 |
1,0 |
17,4 |
1,0 |
17,1 |
1,0 |
|
3 |
8,6 |
1,0 |
8,8 |
1,0 |
8,6 |
1,0 |
8,7 |
1,0 |
8,6 |
1,0 |
|
4 |
0,3 |
1,4 |
0,3 |
1,5 |
0,3 |
1,3 |
0,3 |
1,3 |
– |
– |
Различия в значениях ММ и соотношении фракций с разной ММ свидетельствуют о влиянии природы ферментов на процесс гидролиза высокомолекулярного коллагена. Представленные результаты хорошо согласуются с известными литературными данными о природе ферментов панкреатина (в его составе протеолитические ферменты трипсин, пепсин и химотрипсин), которые катализируют гидролиз пептидных связей, образованных остатками аминокислот аргинина и лизина [25]:
Н2О панкреатин, тромбин
R-Arg-Lys-R, ------* R~Arg—ОН + HlvsR,, где R и R1 – аминокислотные последовательности фрагментов коллагена.
Эта ярко выраженная ограниченная субстратная специфичность ферментов приводит к практически количественному образованию (более 80 % от исходного) в процессе гидролиза узкодисперсного (КП~ 1,1) низкомолекулярного полимера с ММ~9 кДа и небольшого количества его димера – олигомера с М w ~ 17–18 кДа (КП~ 1,1). Незначительные различия в значениях ММ первой, более высокомолекулярной в сравнении с олигомерными, фракции в присутствии двух разных ферментов связаны, видимо, с различиями в природе и эффективности, связанной с расположением аминокислот каталитических центров ферментов, что характерно для катализаторов любого происхождения [25].
Заключение
Таким образом, проведен ферментативный гидролиз коллагена, выделенного из покровных тканей трески, в условиях, близких к таковым при формировании скаффолдов, разными ферментами – панкреатином, трипсином. Анализ молекулярно-массовых характеристик гидролизатов коллагена методом гель-проникающей хроматографии в течение трех суток процесса показал, что разрушение белка происходит с образованием двух низкомолекулярных фракций сразу после 1-й минуты гидролиза, ММ которых независимо от природы фермента имеют значения Мw~9 кДа (M w /M n ~ 1,1) (более 80 % в смеси) и М w ~ 17–18 кДа (M w /M n ~ 1,1). Высокая эффективность панкреатина и трипсина приводит к тому, что в растворе сразу после первой минуты отсутствует высокомолекулярная фракция, ферменты разрушают коллаген до фрагментов не более 40 кДа. Однако заметно небольшое различие в характеристиках продуктов гидролиза и их соотношении, что обусловлено природой каталитических центров ферментов. Полученные данные представляют интерес для разработки матриц на основе коллагена в присутствии ферментов разной природы. В совокупности с результатами исследований действия ферментов на другие компоненты конструкции скаффолдов, а также биомиметическими испытаниями они позволят моделировать состав, строение и важнейшие характеристики скаффолдов с оптимизированными свойствами. Это особенно важно, если в процессе формирования скаффолдов и биомедицинских клеточных продуктов используются реакции ферментативного гидролиза и получаемая в результате клеточная матрица формируется не из нативных молекул, а из их гидролизатов.
Работа выполнена с использованием оборудования ЦКП «Новые материалы и ресурсосберегающие технологии» НИИХ ННГУ.
Список литературы Эффективность протеаз панкреатина и трипсина при ферментативном гидролизе коллагена
- Lu, T. Techniques for Fabrication and Construction of Three-dimensional Scaffolds for Tissue Engineering / T. Lu, Y. Li, T. Chen // Int. J. Nanomedicine. - 2013. - № 8. - P. 337-350. DOI: 10.2147/IJN.S38635
- Introduction to Tissue Engineering and Application for Cartilage Engineering / N. de Isla, C. Huseltein, N. Jessel et al. // Biomed. Mater. Eng. - 2010. - V. 20, № 3. - P. 127-133. DOI: 10.3233/BME-2010-0624
- Zhang, L. The Role of Tissue Engineering in Articular Cartilage Repair and Regeneration / L. Zhang, J. Hu, K.A. Athanasiou // Crit Rev. Biomed. Eng. - 2009. - V. 37, № 1. - P. 1-57.
- Rajangam, T. Fibrinogen and Fibrin Based Micro and Nano Scaffolds Incorporated with Drugs, Proteins, Cells and Genes for Therapeutic Biomedical Applications / T. Rajangam, S.S.A. An // Int. J. Nanomedicine. - 2013. - V. 8. - P. 3641-3662. DOI: 10.2147/IJN.S43945
- Fibrin Scaffold as a Carrier for Mesenchymal Stem Cells and Growth Factors in Shoulder Rotator Cuff Repair / A. Voss, McCarthy M. Beth, D. Allen et al. // Arthrosc. Tech. Arthroscopy Association of North America. - 2016. - V. 5, № 3. - P. e447-e451. DOI: 10.1016/j.eats.2016.01.029
- Osathanon, T. Immobilization of Alkaline Phosphatase on Microporous Nanofibrous Fibrin Scaffolds for Bone Tissue Engineering / T. Osathanon, C.M. Giachelli, M.J. Somerman // Biomaterials. - 2009. - V. 30, № 27. - P. 4513-4521.
- DOI: 10.1016/j.biomaterials.2009.05.022
- Riopel, M. Fibrin, a Scaffold Material for Islet Transplantation and Pancreatic Endocrine Tissue Engineering / M. Riopel, M. Trinder, W. Rennian // Tissue Eng. Part B Rev. - 2015. - V. 21, № 1. - P. 33-44.
- DOI: 10.1089/ten.teb.2014.0188
- Fibrin Gel as an Injectable Biodegradable Scaffold and Cell Carrier for Tissue Engineering / Y. Li, H. Meng, Y. Liu, B.P. Lee // Sci. World J. - 2015. - № 2015. - P. 1-10.
- DOI: 10.1155/2015/685690
- Терещенко, В.П. Матрицы-носители в тканевой инженерии костной ткани / В.П. Терещенко, И.А. Кирилова, П.М. Ларионов // Успехи современного естествознания. - 2015. - № 8. - С. 66-70.
- Yan, M. Purification and Structural Aspects of Type I Collagen from Walleye Pollock (Theragrachalcogramma) / M. Yan, S. Qin, B. Li // J. Aquat. Food Prod. Technol. - 2017. - V. 26, № 10. - P. 1166-1174.
- DOI: 10.1080/10498850.2015.1011797
- Effect of Enzymatic Hydrolysis on Surface Activity and Surface Rheology of Type I Collagen / A. Kezwoń, I. Chromińska, T. Fraczyk, K. Wojciechowski // Colloids Surf., B. - 2016. - № 137. - P. 60-69.
- DOI: 10.1016/j.colsurfb.2015.05.017
- Соколова, А.И. Зависимость биологических свойств скаффолдов из фиброина шелка и желатина от состава и технологии изготовления / А.И. Соколова, М.М. Боброва, Л.А. Сафронова // Современные технологии в медицине. - 2016. - Т. 8, № 3. - С. 6-15.
- DOI: 10.17691/stm2016.8.3.01
- Incorporation of Fibrin into a Collagen-glycosaminoglycan Matrix Results in a Scaffold with Improved Mechanical Properties and Enhanced Capacity to Resist Cell-mediated Contraction / C.M. Brougham, T.J. Levingstone, S. Jockenhoevel et al. // Acta Biomater. - 2015. - № 26. - P. 205-214.
- DOI: 10.1016/j.actbio.2015.08.022
- Bio-printing of Collagen and VEGF-releasing Fibrin Gel Scaffolds for Neural Stem Cell Culture / Y.B. Lee, S. Polio, W. Lee et al. // Exp. Neurol. - 2010. - V. 223, № 2. - P. 645-652.
- DOI: 10.1016/j.expneurol.2010.02.014
- Константиновская, М.А. Подбор условий получения ферментативного гидролизата из бульона, образующегося при производстве костной муки / М.А. Константиновская, А.А. Красноштанова // Техника и технология пищевых производств. - 2014. - № 4 (35). - С. 32-33.
- Закономерности гидролиза сывороточных белков экзо- и эндопротеазами / Т.Н. Головач, Н.В. Гавриленко, Н.К. Жабанос, В.П. Курченко // Труды БГУ. - 2008. - Т. 3 (1). - С. 85-98.
- Ma, P.X. Biomimetic Materials for Tissue Engineering / P.X. Ma // Adv. DrugDeliv. Rev. - 2008. - № 60. - P. 184-198.
- DOI: 10.1016/j.addr.2007.08.041
- Biocompatibility of Hydrogel-based Scaffolds for Tissue Engineering Applications / S. Naahidi, M. Jafari, M. Logan et al. // Biotechnol. Adv. Elsevier. - 2017. - V. 35, № 5. - P. 530-544.
- DOI: 10.1016/j.biotechadv.2017.05.006
- Zhu, J. Biomimetic Hydrogels as Scaffolds for Tissue Engineering / J. Zhu // J. Biochips Tissue Chips. - 2012. - V. 2, № 43. - P.1000e119.
- DOI: 10.4172/2153-0777.1000e119
- Viscoelastic, Physical, and Bio-degradable Properties of Dermal Scaffolds and Related Cell Behaviour / V. Sharma, N. Patel, N. Kohli et al. // Biomed. Mater. - 2016. - V. 11, № 5. - P. 1-12.
- DOI: 10.1088/1748-6041/11/5/055001
- Rowe, S.L. Microstructure and Mechanics of Collagen-fibrin Matrices Polymerized Using Ancrod Snake Venom Enzyme / S.L. Rowe, J.P. Stegemann // J. Biomech. Eng. - 2009. - V. 131, № 6. - P. 061012.
- DOI: 10.1115/1.3128673
- Молекулярно-массовые параметры коллагена из разного сырья и динамика их изменения при ферментативном гидролизе панкреатином / Л.Л. Семенычева, Н.Б. Валетова, В.О. Часова и др. // Все материалы. Энцикл. Справочник. - 2019. - № 4. - С. 27-33.
- DOI: 10.31044/1994-6260-2019-0-4-27-33
- Пат. 2653434 Российская Федерация. Способ создания биорезорбируемого клеточного скаффолда на основе фибрина плазмы крови / М.Н. Егорихина, Г.Я. Левин, И.Н. Чарыкова, Д.Я. Алейник, Л.Н. Соснина; заявитель и патентообладатель ФГБУ "Приволжский федеральный медицинский исследовательский центр" Министерства здравоохранения РФ. - № 2017112424; заявл. 11.04.2017; опубл. 08.05.2018, Бюл. № 13. - 13 с.
- Пат. 2567171 Российская Федерация. Способ получения уксусной дисперсии высокомолекулярного рыбного коллагена / Л.Л. Семенычева, М.В. Астанина, Ю.Л. Кузнецова, Н.Б. Валетова, Е.В. Гераськина, О.А. Таранкова; заявитель и патентообладатель ООО "Системы качества жизни". - № 2014140300/13; заявл. 06.10.2014; опубл. 10.11.2015, Бюл. № 31. - 11 с.
- Бендер, М. Биоорганическая химия ферментативного катализа / М. Бендер, Р. Бергерон, М. Комияма. - М.: Мир, 1987. - 352 с.


