Эффективность синтеза -фруктофу-ранозидазы дрожжами debaryomyceshansenii при культивировании на питательной среде из мелассы
Автор: Ле Ань Туан, Канарский А.В., Канарская З.А., Свиридова Т.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 1 (67), 2016 года.
Бесплатный доступ
Распространение D. h a nsenii в различных субстратах можно объяснить достаточно высокой гидролитической активностью, что является предпосылкой их применения в биотехнологии для получения различных биопродуктов, в частности литических ферментов. В работе определена продуктивность и эффективность синтеза внеклеточного фермента β-фруктофуранозидазы дрожжами D. hansenii на питательной среде из мелассы. Показано, что эффективность культивирования дрожжей D. hansenii на питательной среде из мелассы зависит, прежде всего, от штамма. Установлено, что наиболее продуктивным и эффективно синтезирующим внеклеточный фермент β-фруктофуранозидазу являются дрожжи D. hansenii штамм Н4651. Наибольшая продуктивность и эффективность синтеза внеклеточного фермента β-фруктофуранозидаза у дрожжей D. hansenii штамм Н4651 проявляется при культивировании на питательной среде из мелассы без дополнительных биогенных веществ при температуре 20 oC. Установлено, что потребление редуцирующих веществ не адекватно количеству синтезируемой биомассы дрожжей D. hansenii. Содержание редуцирующих веществ после 50 час культивирования дрожжей D. hansenii Н4651 начинает увеличиваться. Полученную закономерность увеличения РВ в культуральной жидкости можно объяснить синтезом дрожжами D. hansenii внеклеточного фермента β - фруктофуранозидаза, которая гидролизует сахарозу в питательной среде. Наибольшая удельная скорость роста наблюдается у дрожжей D. hansenii Н4651 при температурах культивирования 15 и 20 oС. Выход биомассы дрожжей D. hansenii Н4651 превышает выход биомассы при культивировании дрожжей D. hansenii штаммов Н433 и Н18-3.
Меласса, дрожжи debaryomyces hansenii, культивирование, β - фруктофуранозидаза
Короткий адрес: https://sciup.org/14043245
IDR: 14043245 | УДК: 57.083.133 | DOI: 10.20914/2310-1202-2016-1-191-197
Текст научной статьи Эффективность синтеза -фруктофу-ранозидазы дрожжами debaryomyceshansenii при культивировании на питательной среде из мелассы
DOI:
Наиболее распространенный вид аско-мицетовых дрожжей – это телеоморфные аскос-поровые дрожжи Debaryomyces hansenii , которые обнаруживаются в почвенно-растительных субстратах. Дрожжи D . hansenii находят в помете растительноядных животных [1], в гниющей древесине [2] на скорлупе яиц птицы [3], в воде с высоким содержанием солей [4].
В значительных количествах дрожжи D . hansenii обнаруживается в соленых богатых белком животного происхождения продуктах питания: сыре, колбасных изделиях [5]. D . Hansenii участвует в традиционной ферментации растительного сырья, в частности оливок [6].
Присутствие D . h a nsenii в субстратах с высоким содержанием солей связано с наличием у них галотолерантности. Этот наиболее солеустойчивый вид дрожжей способен расти при концентрации NaCL более 10 % [7].
Дрожжи D . h a nsenii обладают широкими пределами толерантности по отношению к кислотности среды, что обусловливает широкое распространение этих дрожжей в разнообразных местах обитания. Некоторые штаммы D . h a nsenii способны расти при pH 10 и более, что позволяет относить эти дрожжи к умеренно ал-калотолератным видам [8]. Отмечается, что D . h a nsenii устойчивы к дегидротации [9]. Установлено, что для дыхания некоторых штаммов D . H a nsenii, в частности штамма BKM Y-2482, оптимальным для роста является температура от 15 до 25 o C и pH от 6, 8 до 7,2 [10]. В этих условиях дрожжи D . H a nsenii способны окислять субстрат, содержащий до 25 % солей.
Распространение D . h a nsenii в различных субстратах можно объяснить достаточно высокой гидролитической активностью. Рассмотренные особенности экологии D . h a nsenii являются предпосылкой их применения в биотехнологии для получения различных биопродуктов, в частности литических ферментов [11, 12, 13].
Цель настоящей работы – определение продуктивности и эффективности синтеза внеклеточного фермента β-фруктофуранозидазы дрожжами D. hansenii на питательной среде из мелассы.
Для достижения данной цели определено влияние температуры и продолжительности культивирования на рост клеток дрожжей, количество биомассы дрожжей, потребление редуцирующих веществ и синтез внеклеточной β-фруктофуранозидазы. На основании полученных результатов были рассчитаны кинетические и экономические факторы роста дрожжей D. hansenii на питательной среде из мелассы.
Методическая часть
В работе использованы штаммы дрожжей D. Hansenii:
– Н 433 , предоставленный Всероссийской коллекцией непатогенных микроорганизмов сельскохозяйственного назначения ГНУ Всероссийского научно-исследовательского института сельскохозяйственной микробиологии (г. Пушкин);
– Н 4651 – предоставленный коллекцией кафедры «Бионанотехнология и биоорганический синтез» Московского государственного университета пищевых производств;
– Н 18-3 – предоставленный коллекцией кафедры биологии почв Московского государственного университета им. М.В. Ломоносова. Штамм выделен 6.06.2011из купола муравейника колонии муравьев Formica aquilonia в Новосибирской области.
Культуры дрожжей выращивали на питательной среде, приготовленной из мелассы при pH 5,5 с начальным содержанием редуцирующих веществ 0,9 ± 0,1 % с добавлением и без добавления биогенных веществ. Определение редуцирующих сахаров проводили по методике, приведенной в работе [14]. К 120 мкл исследуемой пробы добавляли 1200 мкл дистиллированной воды и 600 мкл DNSA. Выдерживали пробы 10 минут при 100 °С, затем 5 мин. при 0 °С. Далее добавляли во все пробы по 6 мл дистиллированной воды и измеряли оптическую плотность при 540 нм при ширине кюветы 5мм. В контрольный образец вместо пробы добавляли дистиллированную воду – 120 мкл.
Кроме начального содержания редуцирующих веществ в питательной среде определяли общее содержание редуцирующих веществ. Для этого проводили гидролиз всех углеводов питательной среды в закрытых пробирках при pH 12 нагреванием до температуры кипения в течение 60 мин. Общее содержание редуцирующих веществ в экспериментах составляло 15 ± 1 %.
Предварительно разбавленную мелассу стерилизовали в автоклаве при 120˚С в течение 20 минут. Затем в стерилизованный раствор мелассы добавляли (NH 4 ) 2 SO 4 и KH 2 PO 4 исходя из начального содержания редуцирующих веществ и выхода дрожжей. В питательной среде pH составило 6,65.
Культивирование осуществлялось в колбах Эрленмейера объемом 100 мл при 15±1 o C; 20±1 о С; 25±1 o C при непрерывном перемешивании на шейкере инкубатора ЕS-20 в течение 5 суток. Отбор проб проводили каждые 24 часа.
Определение биомассы дрожжей проводили фотометрическим методом с предварительным построением калибровочного графика. Оптическую плотность биомассы дрожжей определяли при длине волны 540 нм и ширине кюветы 5 мм [15]. Для определения количества дрожжевых клеток использовали камеру Горяева – Тома [16].
Активность β-фруктофуранозидазы определяли по скорости ферментативной реакции гидролиза сахарозы, которую устанавливали по количеству образовавшегося инверта в реакционной жидкости [17].
Удельную скорость роста, продолжительность генерации и выход дрожжей рассчитывали согласно рекомендациям в работе [18].
Результаты и обсуждение
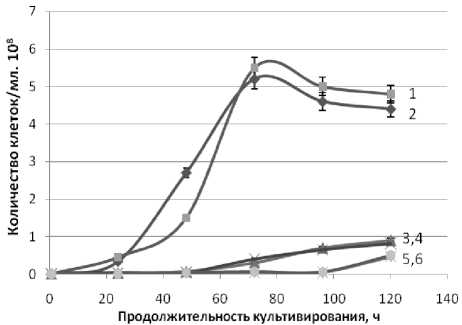
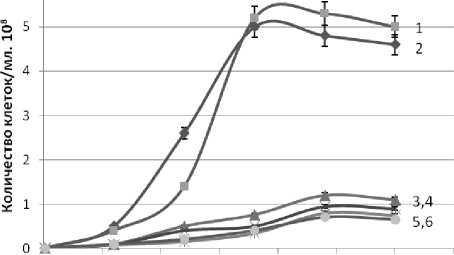
Как видно из представленных на рисунках 1 и 2 результатов исследования, эффективность культивирования дрожжей D. hansenii на питательной среде из мелассы зависит, прежде всего, от штамма. В частности, у дрожжей D. hansenii Н 4651 непродолжительные периоды лаг-фазы и экспоненциального роста. При этом в экспоненциальный период роста дрожжей D. hansenii штамма Н 4651 наблюдается более интенсивное накопление клеток и их биомассы по сравнению с штаммами Н 433 и Н 18-3.
a)
О 20 40 60 80 100 120 140
Продолжительность культивирования, ч b)
О 20 40 60 80 100 120 140
Продолжительность культивирования, ч c)
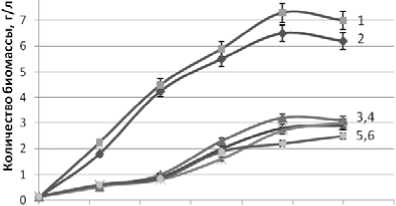
Рисунок 1. Влияние продолжительности и температуры (a -15 oC, b – 20 oC, c – 25 oC) культивирования дрожжей D. hansenii на питательной среде из мелассы на рост числа клеток.
2a, 1b, 2c – Н 4651 с дополнительными биогенными веществами
1a, 2b, 1c – Н 4651 - без дополнительных биогенных веществ
3a, 5b, 3c – Н 433 с дополнительными биогенными веществами
4a, 3b, 4c – Н 433 без дополнительных биогенных веществ
6a, 6b, 5c – Н 18-3 с дополнительными биогенными веществами
5a, 4b, 6c – Н 18-3 без дополнительных биогенных веществ
Максимальное количество клеток накапливается дрожжами D. hansenii штамма Н 4651 также за менее продолжительный период культивирования на этапе линейного роста, чем штаммами Н 433 и Н 18-3 . При равной продолжительности культивирования накопление количество биомассы на данном этапе культивирования также происходит интенсивней дрожжами D. hansenii штамма Н 4651 .
На продолжительность линейной фазы роста и последующую фазу замедленного роста дрожжей D. hansenii влияет температура культивирования. Наиболее благоприятная температура культивирования дрожжей D. hansenii штамма Н 4651 20 o C. При этой температуре культивирования наблюдается максимальное накопление клеток и количество биомассы этим штаммом дрожжей за более короткий период культивирования, чем при температурах 15 o C и 25 o C. Следует отметить, что дрожжи D. hansenii штамма Н 4651 выходят на стационарную фазу роста за более короткий период культивирования и с максимальным количеством клеток и биомассы при температуре 20 o C по сравнению со штаммами Н 433 и Н 18-3 .
Биогенные вещества, дополнительно внесенные в питательную среду, существенного влияния на рассмотренные фазы роста клеток дрожжей D. hansenii и рост биомассы не оказывает. Видимо, присутствующих в мелассе соединений азота, калия и фосфора достаточно для жизнедеятельности всех использованных в настоящей работе штаммов дрожжей D. hansenii .
a)
О 20 40 60 80 100 120 140
Продолжительность культивирования, ч b)
О 20 40 60 80 100 120 140
Продолжительность культивирования, ч
c)
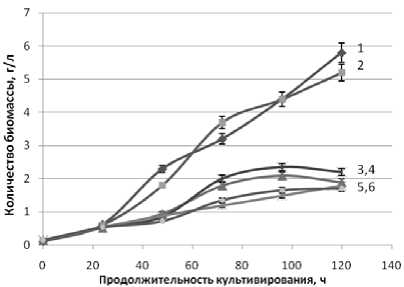
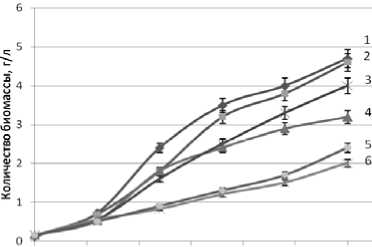
Рисунок 2. Влияние продолжительности и температуры (a -15oC, b – 20 oC, c – 25 oC) культивирования дрожжей D. hansenii на питательной среде из мелассы на синтез биомассы.
1a, 1b, 1c – Н 4651 с дополнительными биогенными веществами
2a, 2b, 2c – Н 4651 - без дополнительных биогенных веществ 4a, 4b, 3c – Н 433 с дополнительными биогенными веществами
3a, 3b, 4c – Н 433 без дополнительных биогенных веществ 5a, 6b, 5c – Н 18-3 с дополнительными биогенными веществами
6a, 5b, 6c – Н 18-3 без дополнительных биогенных веществ
c)
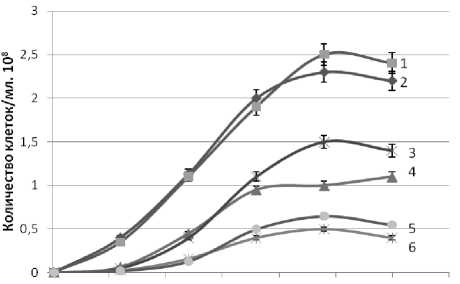
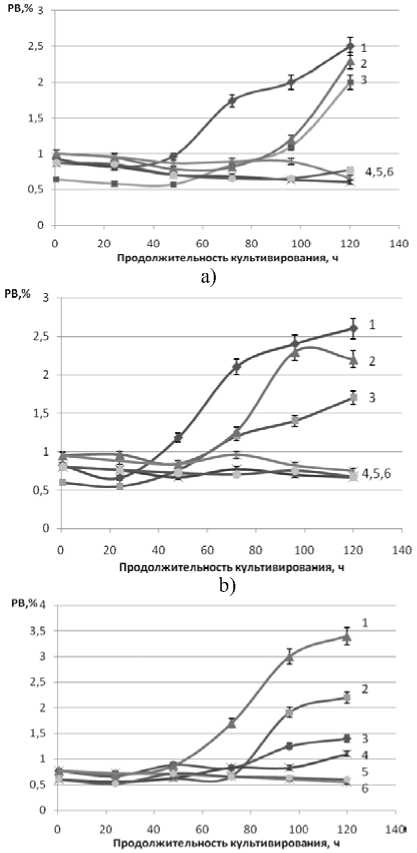
Рисунок 3. Влияние продолжительности и температуры (a -15 oC, b – 20 oC, c – 25 oC) культивирования дрожжей D. hansenii на питательной среде из мелассы на содержание редуцирующих веществ в культуральной жидкости
3a, 3b, 2c – Н 4651 с дополнительными биогенными веществами
1a, 1b, 3c – Н 4651 - без дополнительных биогенных веществ 6a, 5b, 4c – Н 433 с дополнительными биогенными веществами
2a, 2b, 1c – Н 433 без дополнительных биогенных веществ 4a, 6b, 5c – Н 18-3 с дополнительными биогенными веществами
5a, 4b, 6c – Н 18-3 без дополнительных биогенных веществ
При культивировании дрожжи D. hansenii потребляют редуцирующие вещества. Однако, как показали исследования, потребление редуцирующих веществ не адекватно количеству синтезируемой биомассы дрожжей D. hansenii. Содержание редуцирующих веществ после 50 ч культивирования дрожжей D. hansenii Н4651 и Н433 начинает увеличиваться (рисунок 3). На образование дополнительных РВ этими штаммами дрожжей существенного влияния температура культивиро- вания не оказывает. Присутствие в питательной среде дополнительных биогенных веществ влияет не однозначно на образование РВ веществ. Следует заметить, что увеличение содержания РВ в культуральной жидкости сочетается с ростом числа клеток до примерно 70 часов культивирования и практически накоплением биомассы до окончания культивирования дрожжей D. hansenii Н4651 и Н433. Дрожжи D. hansenii Н18-3 в рассматриваемых условиях культвирования практически не склонны к образованию в культуральной жидкости избыточного количества РВ.
Установленную закономерность увеличения РВ в культуральной жидкости можно объяснить синтезом дрожжами D. hansenii внеклеточного фермента β – фруктофуранозидаза, которая гидролизует сахарозу в питательной среде. Анализ результатов, представленных в таблице 1 показывает, что наибольшая активность внеклеточного фермента β – фруктофуранозидаза наблюдается в культуральной жидкости при культивировании дрожжей D. hansenii Н 4651 при температуре 20 o C. При этом внесение дополнительных биогенных веществ в питательную среду приводит к снижению активности внеклеточного фермента β – фруктофуранозидаза.
Активность внеклеточного фермента β-фруктофуранозидаза, ситезируемового дрожжами D. hansenii Н 433 , ниже, чем активность этого фермента, синтезируемого дрожжами D. hansenii Н 4651 . При культивировании дрожжей D. hansenii Н 433 с внесением дополнительных биогенных веществ β – фруктофуранозидазная активность в культуральной жидкости не наблюдается. И, наконец, дрожжи D. Hansenii Н 18-3 не синтезируют внеклеточный фермент β – фруктофуранозидаза, активность это фермента в культуральной жидкости отсутствует и, соответственно, в культуральной жидкости не наблюдается увеличение РВ при культивировании этих дрожжей (рисунок 3).
Т а б л и ц а 1
Активность внеклеточной β – фруктофуранозидазы, синтезируемой дрожжами D. Hansenii, при культи- вировании на питательной среде из мелассы
|
Штамм дрожжей D. Hansenii |
Активность β-фруктофуранозидазы, мкмоль/мл культуральной среды при температуре культивирования, о С |
||
|
15 |
20 |
25 |
|
|
Н 433 |
0,94/0,00 |
1,63/0,00 |
1,15/0,00 |
|
Н 4651 |
1,32/0,15 |
3,50/0,46 |
1,62/0,09 |
|
Н 18-3 |
0,00/0,00 |
0,00/0,00 |
0,00/0,00 |
* числитель – культивирование без дополнительных биогенных веществ;
знаменатель – культивирование с внесением дополнительных биогенных веществ
Продолжительность культивирования дрожжей 120 час.
Наибольшая удельная скорость роста наблюдается у дрожжей D. hansenii Н 4651 при температурах культивирования 15 и 20 o С. Применение дополнительных биогенных веществ существенно на этом показателе не сказывается. Продолжительность генерации дрожжей D. hansenii Н 4651 значительно ниже продолжительности генерации дрожжей D. hansenii штаммов Н 433 и Н 18-3.
Выход биомассы дрожжей D. hansenii Н 4651 при культивировании без дополнительных биогенных веществ при температурах культивирования 15 и 20 o С значительно превышает выход биомассы при культивировании дрожжей D. hansenii штаммов Н 433 и Н 18-3 . Как показано выше, культивирование дрожжей D. hansenii Н 4651 на питательной среде из мелассы без дополнительных биогенных веществ при температуре 20 o С являются благоприятными условиями синтеза этими дрожжами внеклеточного фермента β – фруктофуранозидазы.
Т а б л и ц а 1
Кинетические и экономические факторы культивирования дрожжей D. hansenii на питательной среде из мелассы*
|
Наименование штамм |
Факторы** |
Температура культивирования, о С |
||
|
15 |
20 |
25 |
||
|
Н 433 |
Удельная скорость роста μ, ч-1 |
0,015/ 0,016 |
0,02/ 0,018 |
0,016/ 0,020 |
|
Продолжительность генерации Q, ч-1 |
46,20/ 43,30 |
34,60/ 38,50 |
43,30/ 34,60 |
|
|
Выход биомассы, % |
30,00/ 39,20 |
17,00/ 35,00 |
14,00/ 28,60 |
|
|
Н 4651 |
Удельная скорость роста μ, ч-1 |
0,030/ 0,026 |
0,031/ 0,032 |
0,028/ 0,027 |
|
Продолжительность генерации Q, ч-1 |
23,10/ 26,60 |
22,30/ 21,70 |
24,70/ 25,70 |
|
|
Выход биомассы, % |
55,00/ 56,00 |
49,40/ 19,00 |
25,00/ 60,00 |
|
|
Н 18-3 |
Удельная скорость роста μ, ч-1 |
0,013/ 0,013 |
0,017/ 0,015 |
0,012/ 0,014 |
|
Продолжительность генерации Q, ч-1 |
53,30/ 53,30 |
40,70/ 46,20 |
57,70/ 49,50 |
|
|
Выход биомассы, % |
18,00/ 24,20 |
22,50/ 31,50 |
10,00/ 15,00 |
|
* числитель – культивирование без дополнительных биогенных веществ;
Знаменатель – культивирование с внесением дополнительных биогенных веществ
**общая продолжительность культивирования 120 час.
Выводы
-
1. Установлено, что наиболее продуктивным и эффективно синтезирующим внеклеточный фермент β-фруктофуранозидазу являются дрожжи D. hansenii штамм Н 4651.
-
2. Показано, что наибольшая продуктивность и эффективность синтеза внеклеточного
Список литературы Эффективность синтеза -фруктофу-ранозидазы дрожжами debaryomyceshansenii при культивировании на питательной среде из мелассы
- Abranches J., Valente P., Nóbrega H.N., Fernandez F.A.S. et al. Yeast diversity and killer activity dispersed in fecal pellets from marsupials and rodents in a Brazilian tropical habitat mosaic//FEMS Microb. Ecol. 1998. V. 26. P. 27-33.
- Zhang H.B., Yang M.X., Tu R., Gao L. et al. Fungal communities in decaying sapwood and heartwood of a conifer Keteleeria evelyniana//Curr Microbiol 2008. V. 56. № 4. P. 358-362.
- Musgrove M.T., Jones D.R., Hinton A.Jr., Ingram K.D. et al. Identification of Yeasts Isolated from Commercial Shell Eggs Stored at Refrigerated Temperatures//J. Food Protection. 2008. V. 71. №. 6. P. 1258-1261
- Butinar L, Santos S., Spencer-Martins I., Oren A. et al. Yeast diversity in hypersaline habitats//FEMS Microbiol Lett. 2005. V. 244. P. 229-34.
- Capece A., Romano P. «Pecorino di Filiano» cheese as a selective habitat for the yeast species, Debaryomyces hansenii//International Journal of Food Microbiology. 2009. V. 132. № 2-3. P. 180-184.
- Arroyo-López F.N., Querol A., Bautista-Gallego J., Garrido-Fernández A. Role of yeasts in table olive production//Int J Food Microbiol. 2008. V. 128. № 2. P. 189-96.
- Prista C., Loureiro-Dias M.C., Montiel V., García R. et al. Mechanisms underlying the halotolerant way of Debaryomyces hansenii//FEMS Yeast Res. 2005. V. 5. P. 693-701.
- Kurita O., Yamazaki E. Growth under alkaline conditions of the salt-tolerant yeast Debaryomyces hansenii IFO10939//Curr Microbiol. 2002. V. 45. № 4. P. 277-280.
- Khroustalyova G., Adler L., Rapoport A. Exponential growth phase cells of the osmotolerant yeast Debaryomyces hansenii are extremely resistant to dehydration stress//Process Biochemistry. 2001. V. 36. № 12. P. 1163-1166.
- Юдина Н.Ю., Арляпов В.А. Зайцева А.С, Решетилов А.Н. Влияние времени культивирования, состава исследуемых проб и условий анализа на окислительную активность дрожжей Debaryomyces hansenii//Естественные науки. 2012. Вып.3. С.186-197.
- Breuer U. H, Harms Debaryomyces hansenii -an extremophilic Yeast with biotechnological potential//Yeast. 2006. V. 23. P. 415-437.
- Чернов И.Ю. Дрожжи в природе. М.: Товарищество научных изданий КМК. 2013. 336 с.
- Бабьева И.П., Чернов И.Ю. Биология дрожжей. М.: Наука, 2004, 221 с.
- Морозова Ю.А., Скворцов Е.В., Алимова Ф.К., Канарский А.В. Биосинтез ксиланаз и целлюлаз грибами рода Trichoderma на послеспиртовой барде//Вестник Казанского технологического университета. 2012. Т. 15. № 19. С. 120-122.
- Чакчир Б.А., Алексеева Г.М. Фотометрические методы анализа: Методические указания. СПб.: Изд-во СПХФА, 2002. 44 с.
- Нетрусов А.И., Егорова М.А., Захарчук Л.М. и др.: Практикум по микробиологии: учеб. пособие для студ. высш. учеб. заведений. М.: Издательский центр «Академия», 2005. 608 с.
- Полыгалина Г.В., Чередниченко В.С., Римарева Л.В. Определение активности ферментов. Справочник. М.: ДеЛи принт, 2003. 375 с.
- Скиба Е.А. Технология производства дрожжей: учебное пособие. Бийск: Изд-во Алт. гос. техн. ун-та, 2010. 121 с.


