Эффективность стентирования диффузного атеросклеротического поражения коронарного русла сиролимус-элюирующими стентами
Автор: Марков В.В., Баев А.Е., Варваренко В.И., Гольцов С.Г., Крылов А.Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.25, 2010 года.
Бесплатный доступ
Цель исследования: изучить отдаленную эффективность применения сиролимус-элюирующих стентов (СЭС) при стентировании длинных стенозов у больных с диффузным атеросклеротическим поражением коронарных артерий (КА). Обследованы 180 больных ИБС со стенокардией, резистентной к антиангинальной терапии, распределили на 2 группы. В 1-ю (n=101) вошли пациенты с диффузным поражением КА c длиной стентируемого участка более 20 мм, во 2-ю (n=79) - больные с локальными поражениями и длиной стентируемого участка менее 20 мм. Эффективность оценивали на протяжении 12 мес. в процессе клинического и ангиографического наблюдения. Средняя длина стентированного участка составила 28,5±0,9 мм в 1-й группе и 13,4±0,5 мм - в группе контроля (p
Ишемическая болезнь сердца, сиролимус-элюирующие стенты, длинные поражения коронарных артерий
Короткий адрес: https://sciup.org/14919284
IDR: 14919284 | УДК: 616.132.2-007.271-089.819.5-07
Текст научной статьи Эффективность стентирования диффузного атеросклеротического поражения коронарного русла сиролимус-элюирующими стентами
Проблема лечения ИБС остается одной из наиболее актуальных и приоритетных задач мирового и отечественного здравоохранения. Адекватное восстановление коронарного кровотока в зонах ишемизированного миокарда является основным патогенетическим методом лечения, позволяющим эффективно улучшить качество жизни пациента и отдаленный прогноз заболевания.
Несмотря на значительные достижения инвазивной кардиологии в последние десятилетия, многие аспекты эндоваскулярной реваскуляризации миокарда остаются недостаточно изученными. Одной из наиболее сложных категорий больных являются пациенты с диффузным поражением КА, характеризующимся наличием участков поражения длиной более 20 мм. Наличие протяженного стеноза предполагает имплантацию длинных стентов либо выполнение последовательной имплантации нескольких стентов. Возможности хирургической (коронарное шунтирование, КШ) и эндоваскулярной коррекции в данной когорте больных ограничены. Это обусловлено как морфологически неблагоприятным поражением КА, затрудняющим процедуру шунтирования, так и наличием тяжелой сопутствующей патологии, повышающей риск операции.
В настоящее время почти 2/3 чрескожных вмешательств выполняются у больных ИБС с распространенным атеросклеротическим поражением [2, 9]. Тем не менее, проблема выбора оптимальной (КШ, эндоваскулярная реваскуляризация, консервативное ведение) тактики лечения при диффузном коронарном атеросклерозе до сих пор является предметом дискуссий в современной научной литературе.
Цель исследования: изучить отдаленную эффективность применения СЭС при стентировании длинных стенозов у больных с диффузным атеросклеротическим поражением КА.
Таблица 1
Клинические и демографические характеристики обследованных (М±m; %)
|
Показатели |
1-я группа, длина участка поражения >20 мм (n=101) |
2-я группа, длина участка поражения <20 мм (n=79) |
p |
|
Возраст, годы |
53,4±0,8 |
55,1±0,9 |
<0,16 |
|
Гендерное соотношение, м/ж |
88 (87,1%)/13 (12,9%) |
71 (89,9%)/8 (10,1%) |
0,56 |
|
Давность ИБС, мес. |
42,0±6,2 |
57,5±6,3 |
<0,08 |
|
Стенокардия напряжения: II ФК |
5 (14,9%) |
17 (21,5%) |
– |
|
III ФК |
48 (47,5%) |
31(39,2%) |
0,47 |
|
IV ФК |
2 (2,0%) |
– |
– |
|
Нестабильная стенокардия |
15 (14,9%) |
13 (16,5%) |
– |
|
ИМ, подострый период |
16 (15,8%) |
15 (19,0%) |
– |
|
Безболевая ишемия |
5 (4,9%) |
3 (3,8%) |
– |
|
Перенесенный ИМ |
69 (68,3%) |
39 (49,4%) |
0,01 |
|
КШ в анамнезе |
11 (10,9%) |
1 (1,3%) |
0,01 |
|
ХСН по NYHA: I ФК |
4 (4,0%) |
6 (7,6%) |
0,04 |
|
II ФК |
41 (40,5%) |
44 (55,7%) |
– |
|
III ФК |
56 (55,5%) |
29 (36,7%) |
– |
|
СД-2 |
18 (17,8%) |
4 (5,1%) |
0,009 |
|
Гиперхолестеринемия |
92 (91,1%) |
65 (82,3%) |
0,08 |
|
АГ I-III степени |
94 (93,1%) |
64 (81,0%) |
0,01 |
|
Ожирение I-III степени |
41 (40,6%) |
23 (29,1%) |
0,11 |
Примечание: М±m (среднее значение±стандартная ошибка среднего); p – уровень статистической значимости; м – мужчины, ж – женщины; ИБС – ишемическая болезнь сердца; ИМ – инфаркт миокарда; ФК – функциональный класс; ИМ – инфаркт миокарда; КШ – коронарное шунтирование; СД-2 сахарный диабет 2-го типа; ХСН – хроническая сердечная недостаточность; АГ – артериальная гипертония – здесь и далее.
Материал и методы
Больные обеих групп фактически не различались по возрасту, полу, основному заболеванию и сопутствующей патологии (табл. 1).
На момент включения в исследование у пациентов обеих групп преобладали симптомы стенокардии напряжения высоких функциональных классов (ФК) – III-IV ФК и нестабильной стенокардии. Более половины пациентов 1-й группы ранее перенесли инфаркт миокарда (ИМ) – 68,3% против 49,4% во 2-й; р=0,01. Предшествующая коррекция ИБС посредством КШ выполнена у 10,9% пациентов 1-й группы против 1,3% во 2-й (p=0,01). Симптомы сердечной недостаточности I-III ФК (по NYHA) сопутствовали проявлениям коронарной недостаточности у всех включенных в исследование больных. Однако симптомы хронической сердечной недостаточности, соот- ветствующие более тяжелому III ФК, в 2 раза чаще диагностированы у больных 1-й группы. У подавляющего большинства больных 1-й группы ИБС протекала на фоне артериальной гипертонии (93,1% в 1-й группе против 81,0% во 2-й; р=0,01). Сахарный диабет также в 3 раза чаще встречался в группе с диффузным поражением КА.
При проведении ангиографии у большинства пациентов 1-й группы диагностировано многососудистое сте- нозирующее поражение коронарного русла. Стенозы >75% двух КА выявлены в 36,6% случаях, трех КА – в 34,7%, в то время как в контрольной группе чаще (64,6%; p<0,001) регистрировалось однососудистое поражение. При анализе ангиографических показателей в обследуемых группах не выявлено статистически значимых различий по факторам риска рестеноза стента (рис. 1).
Перед выполнением
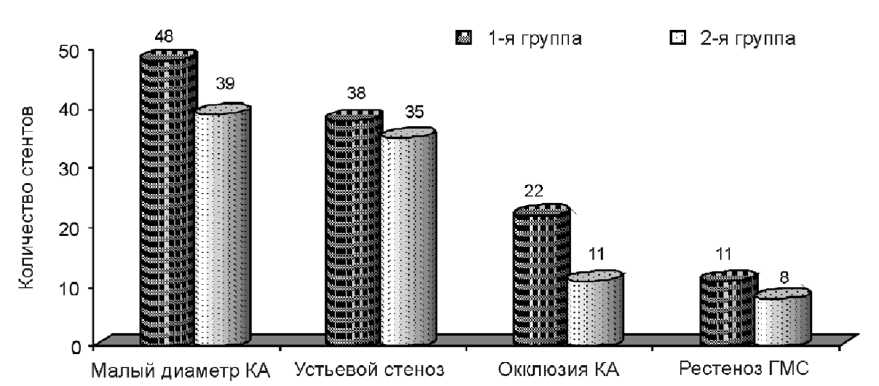
Рис. 1. Ангиографические факторы риска рестеноза стента у пациентов 1-й и 2-й групп
Таблица 2
Ангиографическая характеристика стентируемых КА и параметры эндоваскулярных вмешательств
|
Показатель |
p |
F |
Длина участка поражения |
М±m |
|
Диаметр артерии, мм |
<0,43 |
>20 мм<20 мм |
3,02±0,023,06±0,04 |
|
|
Длина участка поражения, мм |
<0,001 |
230,7 |
>20 мм<20 мм |
28,5±0,913,4±0,5 |
|
Диаметр стеноза артерии, мм |
<0,09 |
>20 мм<20 мм |
0,58±0,030,64±0,03 |
|
|
Стеноз артерии,% |
<0,09 |
>20 мм<20 мм |
81,4±0,979,2±1,0 |
|
|
Диаметр стента, мм |
<0,29 |
>20 мм<20 мм |
3,10±0,023,13±0,02 |
|
|
Длина стента, мм |
<0,0001 |
149,4 |
>20 мм<20 мм |
25,6±0,4317,6±0,47 |
|
Остаточный стеноз, мм |
<0,07 |
>20 мм<20 мм |
0,23±0,310,17±0,02 |
|
|
Остаточный стеноз,% |
<0,02 |
139,4 |
>20 мм<20 мм |
7,37±1,015,17±0,74 |
Примечание: F – критерий Фишера.
стентирования всем пациентам назначался аспирин в дозе 125 мг/сут. Клопидогрель в дозе 75 мг/сут назначался за 5 суток до стентирования либо 300 мг однократно перед процедурой. Протокол ведения пациентов после реваскуляризации предусматривал использование двойной антитромбоцитарной терапии (аспирин в дозе 125 мг/сут и клопидогрель в дозе 75 мг/сут продолжительностью до 12 мес.) и антикоагулянтной терапии (гепарин 800–1000 ЕД/ч внутривенно в течение первых суток).
Контроль за эффективностью лечения и естественным течением ИБС осуществлялся через 12 мес. после реваскуляризации. При обострении ИБС (нестабильной стенокардии, ИМ, нарушениях ритма сердца, прогрессировании ХСН и др.) пациенты поступали в клинику независимо от контрольных точек. Все неблагоприятные события (клинические, коронарные и сердечно-сосудистые в целом), которые возникали после эндоваскулярного вмешательства, регистрировались в протоколе наблюдения.
Полученные результаты обрабатывались с помощью пакета прикладных программ “Statistica, версия 6.0 for Windows”. Характер распределения полученных данных оценивали, используя критерий нормальности Колмогорова–Смирнова, а также визуальную проверку методом гистограмм. В условиях нормального распределения анализируемого признака достоверность различий определяли с помощью t-критерия Стьюдента. При отсутствии нормального распределения признака в сформирован- ной выборке использовался непараметрический критерий Манна–Уитни. Для определения различий качественных переменных проводился анализ таблиц сопряженности с применением критерия χ2 и точного теста (ϕ) Фишера. Различия величин считали достоверными при уровне p<0,05. Количественные данные представлены как М±m (среднее значение±стандартная ошибка среднего).
Результаты
В группе с диффузным поражением КА 101 пациенту имплантировано 156 СЭС, в среднем составив 1,5±0,1 стента на одного пациента. Во 2-й группе 79 пациентам имплантировано 114 стентов, в среднем 1,4±0,1 стента на пациента. Среднее число пораженных артерий в расчете на одного пациента составило 2,1±0,1 в 1-й группе против 1,5±0,1 – во 2-й; p<0,0001. Средняя длина стентированного сегмента была в 2 раза выше у больных с диффузным поражением КА. Длина имплантируемого стента была выше в 1,5 раза у больных 1-й группы и в среднем достигала 25,6±0,43 мм против 17,6±0,47 мм во 2-й; р<0,0001 (табл. 2). Степень остаточного стеноза после успешной имплантации стентов составляла 7,37±1,01% в 1-й группе и 5,17±0,74% – во 2-й (p<0,02).
Неосложненное течение периоперационного периода наблюдалось у 95,1% больных с протяженными стенозами КА и у 97,4% в группе контроля (p=0,40). Различные по характеру и тяжести осложнения зарегистрированы лишь в 4,9% и 2,6% случаев (табл. 3). Все осложнения были успешно устранены. Летальных исходов за время первичной госпитализации не зарегистрировано.
В отдаленном периоде наблюдения (12,1±0,3 мес.) рецидив симптомов стенокардии зарегистрирован у 23 (22,8%) больных 1-й группы и у 8 (10,1%) пациентов группы контроля (p=0,037). Еще в 9 (8,9%) и 2 (2,5%) случаях соответственно диагностированы проявления безболевой ишемии миокарда. Основной причиной рецидива являлось прогрессирование атеросклероза на не-стентированных участках КА. Так, в 1-й группе прогрессирование ранее выявленных стенозов с <50% до ≥ 70% обнаружено в 23,8% (рис. 2).
В контрольной группе прогрессирование атеросклероза встречалось в 2,5 раза реже (p=0,012). Рестеноз стента ≥ 70% диагностирован только у 6,9% пациентов 1-й группы и 2,5% больных 2-й; p=0,18. Еще в одном случае в 1-й группе диагностировано сочетание рестеноза стента с прогрессированием атеросклероза. Результаты контрольной ангиографии через 12 мес. представлены в таблице 4.
Таким образом, ведущей причиной возврата ишемии в отдаленном периоде после стентирования у больных 1-й группы являлось прогрессирование атеросклероза на нестентированных участках. Клинически значимый рестеноз СЭС ( ≥ 70%) встречался в 3,5 раза реже (p=0,0009).
Выживаемость в отдаленном периоде наблюдения достигала 99,0% в 1-й группе и 100% – во 2-й (табл. 5). Летальный исход в результате повторного ИМ зарегистрирован у 1 (1,0%) пациента 1-й группы на 3-м мес. наблюдения. Причиной фатального ИМ, подтвержденного аутопсией, являлось прогрессирование атеросклероза на нестентируе-мом участке КА.
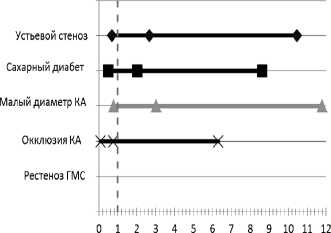
Для оценки влияния клинических и анатомических факторов риска формирования рестеноза стента у больных с диффузным поражением КА мы определили значение относительного риска рестеноза (рис 3).
Как следует из представленных данных, у пациентов с протяженными стенозами риск развития рестеноза стента возрастает в 2 раза при сахарном диабете и устьевом поражении. Стентирование артерий малого диаметра (<3 мм) увеличивает шансы формирования рестеноза в 3 раза. Имплантация длинных СЭС в рестеноз голометаллического стента и хроническую окклюзию КА не оказывает влияния на риск рестеноза.
Таблица 3
Процедуральные и послеоперационные осложнения *
|
Осложнение/ проведенное лечение |
1-я группа, длина участка поражения >20 мм (n=101) |
2-я группа, длина участка поражения <20 мм (n=79) |
|
Краевая диссекция КА/ дополнительное стентирование |
2 (1,9%) |
– |
|
Нарушение ритма сердца/ дефибрилляция |
– |
1 (1,3%) |
|
Наружное кровотечение/ гемотрансфузия |
1 (1,0%) |
– |
|
Ложная аневризма БА/ ушивание сосуда |
– |
1 (1,3%) |
|
ПНМК/консервативная терапия |
1 (1,0%) |
– |
|
Подострый тромбоз стента, ИМ/ повторное стентирование |
1 (1,0%) |
– |
|
Всего |
5 (4,9%) |
2 (2,6%) |
Примечание: КА – коронарная артерия, БА – бедренная артерия; ПНМК – преходящее нарушение мозгового кровообращения.
Таблица 4
Результаты контрольной ангиографии через 12 мес. после стентирования
|
Показатели |
1-я группа, длина участка поражения >20 мм (n=156) |
2-я группа, длина участка поражения <20 мм (n=114) |
p |
|
Поздняя потеря, мм |
0,38±0,04 |
0,34±0,03 |
<0,041 |
|
Поздняя потеря,% |
11,75±1,36 |
9,10±1,20 |
<0,08 |
|
Рестеноз е ≥ 50% |
7 (4,4%) |
2 (1,8%) |
0,22 |
|
Рестеноз e ≥ 70% |
5 (3,2%) |
1 (0,9%) |
0,20 |
|
Окклюзия стента |
4 (2,6%) |
1 (0,9%) |
0,31 |
|
Всего рестенозов и окклюзий |
16 (10,3%) |
4 (3,6%) |
0,036 |
Примечание: n – количество стентов.
Таблица 5
Отдаленные результаты эндоваскулярной реваскуляризации у больных ИБС с протяженным стенозирующим поражением венечного русла стентами Cypher по данным 12-месячного проспективного наблюдения
|
Показатели |
1-я группа, длина участка поражения >20 мм (n=101) |
2-я группа, длина участка поражения <20 мм (n=79) |
p |
|
Рецидив стенокардии |
23 (22,8%) |
8 (10,1%) |
0,037 |
|
Безболевая ишемия |
9 (8,9%) |
2 (2,5%) |
0,08 |
|
Инфаркт миокарда |
1 (1,0%) |
0 |
0,38 |
|
ОНМК |
1 (1,0%) |
0 |
0,38 |
|
Общая смертность |
1 (1,0%) |
0 |
0,38 |
|
Повторная ангиопластика |
22 (21,8%) |
6 (7,6%) |
0,009 |
|
– рестеноза стента |
7 (6,9%) |
2 (2,5%) |
0,17 |
|
–стеноза КА |
15 (14,8%) |
4 (5,1%) |
0,03 |
|
КШ |
2 (1,9%) |
0 |
0,21 |
Примечание: n – количество больных; ОНМК – острое нарушение мозгового кровообращения.
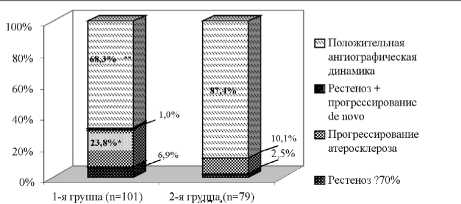
Рис. 2. Результаты контрольной коронарографии у больных 1-й и 2-й группы через год после стентирования; * – p<0,05;
*0Ш 2,66 (ДИ 0,68-10,46)
-НОШ 2,03 (ДИ 0,48-8,62)
*0Ш 3,02 (ДИ 0,77-11,80)
Рис. 3. Влияние факторов риска на развитие гемодинамически значимого рестеноза длинных стентов Cypher
** – p<0,01
Обсуждение
Наличие у пациента протяженного стенозирующего атеросклеротического поражения КА считается прогностически неблагоприятным и создает проблему для оперативного лечения. Осуществление адекватной реваскуляризации миокарда посредством КШ у пациентов с диффузным коронарным атеросклерозом, зачастую отягощенным вовлечением в патологический процесс дистальных сегментов КА, не всегда технически возможно (Ю.В. Белов, Е.В. Санай; 2003).
В работах, посвященных особенностям морфологии и гемодинамики, показано, что структура патологических изменений при таком типе поражения приводит к частому развитию острых осложнений [7, 8, 10, 13]. В исследованиях, посвященных изучению эффективности ангиопластики длинных стенозов КА [5, 6, 12, 15], установлено, что эндоваскулярная реваскуляризация у пациентов чаще осложняется диссекциями и “эластическим спадением” сосудистой стенки, повышая риск развития тромбозов, формирования рестенозов и рецидивов ишемии в отдаленном периоде наблюдения. Y. Cobayashi и соавт. показали, что большая длина стентированного сегмента является независимым предиктором рестеноза и развития неблагоприятных сердечно-сосудистых событий при имплантации голометаллических стентов [14]. Высокая частота рестенозов металлических стентов (40% через 6 мес.) после стентирования протяженных поражений КА показана в исследованиях A. Сolombo и соавт. [4].
Создание стентов с антипролиферативным лекарственным покрытием открыло новую эру в кардиологии. Результаты рандомизированных исследований демонстрируют явное превосходство стентов с лекарственным покрытием перед голометаллическими стентами по частоте рестенозов. Однако нет убедительных данных о влиянии стентов с покрытием на продолжительность жизни пациентов с протяженным многососудистым поражением КА. Особый интерес представляют отдаленные клинические и ангиографические результаты стентирования больных ИБС высокого риска развития неблагоприятных сердечно-сосудистых событий, в частности у больных, перенесших ИМ, пациентов с многососудистым стенозирующим коронарным атеросклерозом [1].
В нашем исследовании изучена безопасность и эффективность имплантации СЭС при диффузном пораже- нии коронарного русла в присутствии длинных стенозов и множественных участков поражения со степенью сужения <50%.
Включенные в исследование пациенты представляли собой крайне тяжелую в клиническом и морфологическом плане группу. У подавляющего большинства пациентов клинике коронарной недостаточности сопутствовала тяжелая сердечная недостаточность, а поражение венечного русла носило диффузный и морфологически неблагоприятный характер. Несмотря на это уровень осложнений в периоперационном периоде не превышал 5% (4,9% в группе с протяженными стенозами против 2,6% в группе контроля; p=0,40). По данным контрольной ангиографии, выполненной через 12 мес. после стентирования, поздняя потеря диаметра просвета стентированного сегмента в 1-й группе составила 0,38±0,04 мм против 0,31±0,03 мм в контрольной группе (р<0,041). Тем не менее, поздняя потеря при имплантации СЭС у больных с диффузным протяженным поражением КА была значительно ниже по сравнению с ранее проведенными исследованиями применения стентов без лекарственного покрытия [3, 11, 14]. Частота клинически значимого рестеноза статистически значимо не различалась и не превышала 5,8 и 1,8% от числа имплантируемых стентов в 1-й и 2-й группах соответственно. Причиной возврата ишемии в подавляющем большинстве случаев являлось прогрессирование атеросклероза и появление клинически значимых бляшек на нестентированных участках КА.
Данные нашего исследования убедительно демонстрируют безопасность и высокую эффективность имплантации длинных СЭС у больных с диффузным стенозирующим поражением венечного русла. Применение стентов Cypher позволило существенно уменьшить потенцирующее влияние протяженности стеноза на формирование рестеноза в отдаленном периоде. Однако риск возникновения рестенозов существенно возрастал при сочетании протяженного стенозирующего поражения (>20 мм) и дополнительных факторов риска.
Заключение
Полученные в настоящем исследовании результаты позволяют сделать заключение о высокой эффективности коррекции длинных стенозов стентами с лекарственным покрытием. Повышение риска развития рестенозов при имплантации длинных стентов в протяженные по- ражения КА обусловлено сопутствующими факторами риска: малым диаметром стентированной артерии, устьевым стенозом и сахарным диабетом 2-го типа. Снижение клинической эффективности стентирования при диффузном поражении КА обусловлено в основном прогрессированием атеросклероза на нестентируемых участках КА.
Список литературы Эффективность стентирования диффузного атеросклеротического поражения коронарного русла сиролимус-элюирующими стентами
- Тепляков А.Т., Тарасов Н.И., Торим Ю.Ю. и др. Сравнительная оценка антиишемической эффективности коронарного стентирования у больных ишемической болезнью сердца со сниженной фракцией выброса левого желудочка и консервативной медикаментозной терапии//Сибирский медицинский журнал -2008. -Т. 23, № 1, выпуск 2. -С. 5-10.
- Cultip D.E., Chhabra A.G., Baim D.S. et al. Beyond restenosis: five year clinical outcomes from second generation coronary stent trials//Circulation. -2004. -No. 110. -P. 1226-1230.
- Cobayashi Y., DeGregorio J, Kobayashi N. et al. Stented segment length as independent predictor of restenosis//J. Am. Coll. Cardiol. -1999. -No. 34. -P. 651-659.
- Colombo A., Tobis J. Long lesions in arteries with diffuse disease. In "Techniques in coronary artery stenting". -Martin Dunitz Ltd., 2000. -P. 141-159.
- Detre K., Holubkov R., Kelsey S. et al. Percutaneous transluminal coronary angioplasty in 1985-1986 and 1977-1981: The National Heart, Lung and Blood Registry//N Engl J Med. -1988. -No. 318. -P. 265-270.
- De Feyter P.J., van den Brand M., Jaarman G.J. et al. Acute coronary artery occlusion during and after percutaneous transluminal coronary angioplasty: Frequency, predictions, clinical course, management and follow-up//Circulation. -1991. -No. 83. -P. 927-936.
- Ellis S., Roubin G., King S. et al. Angiographic and clinical predictors of acute closure after native vessel coronary angioplasty//Circulation. -1988. -No. 77. -P. 372-379.
- Feldman R., Nichols W., Pepine C. Hemodynamic significance of the length of the coronary arterial narrowing//Am J Cardiol. -1978. -No. 41. -P. 865-871.
- Gowda R.M., Khan L.A., Vasavada В.С. et al. Efficacy and safety of endovascular intracoronary brachytherapy//J. Am. Coll. Cardiol. -2004. -No. 93 (1). -P. 1-5.
- Meier B., Gruentzig A., Hollman J. et al. Does length or eccentricity of coronary stenoses influence the outcome of transluminal dilatation?//Circulation. -1983. -No. 67. -P. 497-499.
- Oemrawsingh P.V., M'mtz G.S., Schalij M.J. et al. lntravascular ultrasound guidance improves angiographic and clinical outcome of stent implantation for long coronary artery stenosis; final results of a randomized comparison with angiographic guidance (TULIP Study)//Circulation. -2003. -No. 107. -P. 62-67.
- Ong А. Т., Serruys P.W., Mohr F.W. et al. The Synergy between Percutaneous Coronary Intervention with Taxus and Cardiac Surgery (SYNTAX) Study: design, rationale, and run-in phase//Am. Heart J. -2006. -No. 151. -P. 1194-1204.
- Savage M., Coldberg S., Hirshfeld J. et al. Clinical and angiographic determinants of primary coronary angioplasty success. M-HEART investigators//J. Am. Coll. Cardiol. -1991. -No. 17. -P. 22-28.
- Serruys P.W., Foley D.P., Suttorp M.J. et al. A radomized comparison of the value of additional Stenting after optimal balloon angioplasty for long coronary lesions: final results of the additional value of NIR stents for treatment of long coronary lesions (ADVANCE) study//J. Am. Coll. Cardiol. -2002. -No. 39. -P. 393-399.
- Serruys P.W., Ong А.Т., Моnсе М.С. et al. Arterial Revascularisation Therapies Study Part II: Sirolimus-eluting stents for the treatment of patients with multivessel de novo coronary artery lesions//Euro intervention. -2005. -No. 1. -P. 147-156.


