Эффективность стентирования у больных с рецидивом стенокардии после коронарного шунтирования. Результаты 3-летнего проспективного наблюдения
Автор: Тепляков А.Т., Гракова Е.В., Крылов А.Л., Веснина Ж.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2-1 т.26, 2011 года.
Бесплатный доступ
Изучена отдаленная эффективность эндоваскулярной реваскуляризации миокарда у больных ИБС с рецидивом стенокардии после перенесенного КШ. Выявлено, что через 71 мес. после перенесенного КШ причиной нарастания коронарной недостаточности является закрытие шунтов (в 58,1% - аутовенозных и в 46,2% - артериальных) и в 88,2% - гемодинамически значимое стенозирование нативных КА. Через 3 года после повторной реваскуляризации посредством стентирования нативных КА и шунтов сохраняется высокая антиишемическая эффективность, проявляющаяся снижением частоты и тяжести стенокардии, возрастанием физической толерантности, регрессом ремоделирования ЛЖ и улучшением показателей внутрисердечной гемодинамики. Повторная эндоваскулярная реваскуляризация у этой тяжелой категории больных безопасна и высокоэффективна, при этом клиническая эффективность вмешательства сопоставима с первичным стентированием коронарных артерий, достигая 67,6%.
Стентирование, повторная реваскуляризация, коронарное шунтирование
Короткий адрес: https://sciup.org/14919451
IDR: 14919451 | УДК: 616[127-005.8+12-008.46-036.12]-089:616.71-018.46
Текст научной статьи Эффективность стентирования у больных с рецидивом стенокардии после коронарного шунтирования. Результаты 3-летнего проспективного наблюдения
Реваскуляризация ишемизированного миокарда является одним из наиболее эффективных методов лечения больных с различными формами ИБС [1–5]. Широкому внедрению инвазивных методов лечения ИБС в России препятствует достаточно высокая стоимость самого вмешательства и периоперационной медикаментозной терапии. Вместе с тем эффективность прямых методов коронарной реваскуляризации, особенно у больных ИБС с тяжелым многососудистым атеросклерозом венечных артерий, не вызывает сомнений. При этом следует учитывать, что хирургические вмешательства на коронарных артериях (КА) хотя и являются, по сути, важным патогенетическим методом лечения больных ИБС, но полностью не излечивают атеросклероз. Это, согласно современной стратегии вторичной профилактики ИБС, требует проведения агрессивной консервативной тактики в от- ношении прогрессирования атеросклероза КА. Широкое применение в клинике операции коронарного шунтирования (КШ) выдвинуло на передний план новую актуальную проблему, касающуюся повышения эффективности коррекции коронарной недостаточности, возникающую у пациентов в отдаленные сроки после операции и обусловленную, чаще всего, прогрессированием стенозирующего атеросклероза нативных КА, либо нарушением функции шунтов (чаще всего венозных) [6–8].
До недавнего времени методами выбора для лечения больных данной категории являлись консервативная терапия или повторная хирургическая реваскуляризация миокарда. Необходимость в повторном КШ колеблется от 2 до 4% через 5 лет, от 7 до 15% через 10 лет после первичного хирургического вмешательства [9]. Симптоматическое клиническое улучшение после повторной операции происходит у 60–70% пациентов, в то время как после первого КШ оно составляет 80–90% [10, 11]. При этом после повторного КШ 5-летняя выживаемость снижается до 75–86%, против 80–91% – после первичного. Возврат стенокардии III–IV ФК через 5 лет после повторного КШ регистрируется практически у половины пациентов [12, 13]. На сегодняшний день альтернативой КШ является использование менее травматичного и высокоэффективного метода эндоваскулярной реваскуляризации посредством стентирования КА и/или шунтов. Это позволяет существенно снизить уровень операционного риска и улучшить качество жизни пациентов [14]. При этом частота успешной эндоваскулярной реваскуляризации (ЭР) составляет 80–90%, что несколько ниже, чем в случае первичной ангиопластики у пациентов с многососудистым поражением КА без предшествующего КШ (89–93%) [15].
По данным Л.А. Бокерия, отдаленные результаты (через 6–60 мес.) проспективного наблюдения после многососудистой коронарной ангиопластики у пациентов, перенесших КШ, демонстрируют симптоматическое улуч- шение в 80–90% случаев, снижение поздней летальности (в пределах 0–12%), при этом необходимость повторной ЭР может составлять от 6 до 38% [16]. Анализ результатов исследований, касающихся эффективности как непосредственных, так и отдаленных результатов повторных вмешательств у больных, перенесших КШ, свидетельствует о перспективности применения эндоваскулярной коронарной реваскуляризации у этой особой, клинически тяжелой, когорты пациентов.
Цель исследования: изучить отдаленную (3 года) клинико-ангиографическую эффективность эндоваскулярной коронарной реваскуляризации миокарда у больных ИБС с рецидивом стенокардии после перенесенного КШ на фоне тяжелого многососудистого стенозирующего коронарного атеросклероза.
Материал и методы
Обследовано 110 больных (92,7% мужчин) с многососудистым стенозирующим коронарным атеросклерозом в возрасте 51,2±6,4 лет, которым была успешно выполнена операция эндоваскулярной реваскуляризации миокарда (табл. 1). Пациенты рандомизированы в 2 группы: в 1-ю гр. вошли пациенты (n=34) с рецидивом стенокардии через 71,3±18,53 (26,0; 80,0) мес. после АКШ, которым осуществляли ангиопластику и стентирование стенозированных коронарных шунтов или нативных КА; во 2-ю гр. включены пациенты (n=76), реваскуляризация миокарда у которых выполнялась посредством первичного стентирования КА. Большинство пациентов – 66(60%) – ранее перенесли Q-образующий инфаркт миокарда (ИМ); нестабильная стенокардия и безболевая ишемия регистрировались в 32 (29,1%) и 3 (2,7%) случаях соответственно. У 12 (10,9%) пациентов диагностировалась постинфарктная аневризма ЛЖ. Компенсированный сахарный диабет (СД) 2 типа выявлен у 26 (23,6%), ожирение – у 34 (31,8%), сопутствующая АГ – у 100 (90,9%) обследованных.
Таблица 1
Клинико-демографическая характеристика больных
|
Показатели |
1-я группа (n=34), КШ+ЭР |
2-я группа (n=76), ЭР |
||||
|
исх. (n=34) |
12 мес. (n=34) |
36 мес. (n=30) |
исх. (n=76) |
12 мес. (n=76) |
36 мес. (n=76) |
|
|
Возраст, годы |
- |
50,6±6,8 |
- |
52,5±5,2 |
- |
|
|
Рецидив стенок, чел. |
- |
8 (23,5)* |
14 (41,2) |
15 (19,7)*# |
29 (38,2) |
|
|
Мужчины, % |
32 (94,2) |
- |
- |
70 (92,1) |
- |
- |
|
Ангинозные боли не беспокоят |
0 |
2 (5,9) |
2 (5,9) |
0 |
9 (11,8)# |
7 (9,2) |
|
Стенокардия ФК I–II |
2 (5,9) |
15 (44,1)** |
12 (35,3)* |
7 (9,2) |
38 (50)** |
36 (47,4)* |
|
Стенокардия ФК III–IV |
20 (58,8) |
9 (26,5) |
14 (41,2)** |
36 (47,4) |
16 (21,1) |
18 (23,7)**# |
|
Нестабильная стенокардия |
9(26,5) |
8 (23,5) |
6 (17,6) |
23 (30,3) |
13 (17,1)** |
14 (18,4)* |
|
Безболевая ишемия |
2 (5,9) |
0 |
0 |
1 (1,3) |
0 |
1 (1,3) |
|
Подострый ИМ |
1 (2,9) |
- |
- |
9 (11,8) |
- |
- |
|
Аневризма ЛЖ |
5 (14,7) |
- |
- |
7 (9,2) |
- |
- |
|
ПИКС |
22 (64,7) |
- |
- |
44 (57,9) |
- |
- |
|
АГ |
30 (88,2) |
- |
- |
70 (92,1) |
- |
- |
|
СД 2 типа |
9 (26,5) |
- |
- |
17 (22,4) |
- |
- |
|
Ожирение |
9 (26,5) |
- |
- |
26 (34,2) |
- |
- |
|
Летальность |
- |
1 (2,9) |
3 (8,8)# |
- |
0 |
1 (1,3) |
Примечание: КШ – коронарное шунтирование; ЭР – эндоваскулярная реваскуляризация; ФК – функциональный класс; ИМ – инфаркт миокарда; ПИКС – постинфарктный кардиосклероз; АГ – артериальная гипертензия; ЛЖ – левый желудочек; СД – сахарный диабет; * – внутригрупповые различия; # – межгрупповые различия; * и # – p<0,05; ** – p<0,01.
По данным селективной КГ, у подавляющего большинства (70,1%) больных диагностированы гемодинамически значимые стенозы ( ≥ 75%) трех и более КА, окклюзии КА – у 33 (30%), таблица 2.
Перед эндоваскулярной реваскуляризацией пациентам назначалась профилактическая комбинированная терапия дезагрегантами: клопидогрелем в “нагрузочной” дозе 300 мг, а затем в поддерживающей дозе 75 мг/сут и кардиомагнилом 75 мг/сут. Пролонгированные нитраты получали 35,5%, иАПФ – 35,5%, селективные β -адреноб-локаторы – 36,4%, антагонисты кальция – 44,5% больных. Статины назначали 63,6% пациентам, а приверженность к их приему составила в 1-й гр. 47,1% и во 2-й – 54,6%.
Критериями исключения из исследования считали ОИМ и последующие 7 дней его течения, тяжелую СН IV ФК (NYHA), обострение тяжелой сопутствующей патологии: декомпенсация СД 2-го типа, печеночная, почечная недостаточность (креатинин сыворотки крови >260 мкмоль/л), а также наличие активного воспалительного процесса или некорригированных электролитных нарушений.
Коронарную ангио- и шунтографию выполняли из феморального доступа по стандартной методике M. Judkins (1967 г.). Оценивали количество пораженных КА, локализацию стенозов, а также максимальный процент стенозирования сосудов и анастомозов. Всего было имплантировано 282 стента, из них 32,1% составили стенты с антипролиферативным покрытием (Cypher), причем в аортокоронарные шунты стенты устанавливали в 11,8% случаев (табл. 3).
Полную анатомическую реваскуляризацию осуществляли в 28,9% случаев стентирования нативных КА и в 41,2% случаев стентирования коронарных шунтов, что соответствует данным, которые приводят отечественные и зарубежные исследователи (табл. 3) [16, 17]. Контрольную коронарографию (КГ) через 1 и 3 года после реваскуляризации проводили 94 (85,4%) и 66 (60%) пациентам из 1-й и 2-й групп соответственно. Стентирование расценивали как успешное, если остаточный стеноз целевой
КА или шунта составлял менее 50% диаметра сосуда и не возникало серьезных осложнений (смерть, острая окклюзия с развитием ИМ, экстренное КШ). Рестенозом считали стеноз внутри или по краям стента >50%. Гемодинамически значимые сужения КА другой локализации, выявленные в контрольные сроки наблюдения, рассматривали как проявления прогрессирования атеросклероза, не связанные с выполненными ранее процедурами коронарной реваскуляризации.
Липидный спектр сыворотки крови, в частности содержание общего холестерина (ОХ) и триглицеридов (ТГ) определяли ферментативным методом с использованием наборов фирмы “Biocon” на полуавтоматическом анализаторе фирмы “Labsystems” FP-900 (Финляндия). Холестерин липопротеинов высокой плотности (ХС ЛПВП) определяли в супернатанте после полионионной преципитации реагентом фирмы “Biocon”. Содержание ХС-ЛПНП рассчитывали по формуле W. Friedwald. В качестве контроля использовали сыворотки “Precinorm L”, “Precipath L” той же фирмы. Нормальными уровни липидов в крови считали: ОХ<4,5 ммоль/л; ТГ<1,7 ммоль/л; ХС ЛПВП>1,0 ммоль/л; ХС ЛПНП<2,5 ммоль/л [18].
Первичной конечной точкой исследования считали: смерть от сердечно-сосудистой причины и инфаркта миокарда (ИМ) в течение 36 мес. проспективного наблюдения; вторичной конечной точкой – определенные и вероятные тромбозы стентов (согласно критериям Academic Research Consortium), смерть от любой причины, развитие повторного нефатального ИМ и тяжелой СН, мозговые инсульты, прогрессирование коронарной и СН [19].
Статистический анализ полученных данных проводился с использованием пакета программ STATISTICA for Windows 6.0 (StstSoft). Количественные данные представлены в виде Медианы (Ме), а также верхнего и нижнего квартилей (LQ; UQ), качественные признаки – в виде n, % (число больных с данным признаком, процент от их количества в группе). Статистическая значимость различий между двумя независимыми количественными перемен-
Таблица 2
Ангиографическая характеристика больных
|
Показатели |
1-я группа (n=34) |
2-я группа (n=76) |
|
Вид шунтов (только венозные), чел. (%) |
15 (44,1) |
- |
|
Вид шунтов (артериальные+венозные), чел. (%) |
19 (55,8) |
- |
|
“Возраст” шунтов: |
||
|
6–12 мес. |
8,8% |
- |
|
более 12 мес. |
91,2% |
- |
|
Проходимость шунтов венозные/артер. (53,3/46,7% – |
арт. 53,8% |
- |
|
данные ВНЦХ им. А.Н. Бакулева) |
вен. 41,9% |
- |
|
Количество больных с хроническими окклюзиями КА |
8 (23,5) |
25 (32,9%) |
|
Количество имплантированных стентов |
2,74±1,09 |
1,95±0,63 |
|
Осложнение процедуры, чел. (%) |
2 (5,9%) |
2 (2,5) |
|
Вид стента (СЛП/ГМС), чел. (%) |
13 (38,2) /8 (23,6) |
19 (25) /13 (17,1) |
|
Вид стента (СЛП+ГМС), чел. (%) |
13 (38,2) |
44 (57,9) |
|
Стентирование ствола ЛКА, чел. (%) |
2 (5,9) |
2 (2,6) |
|
Стентирование окклюзий КА, чел. (%) |
5 (14,7) |
14 (18,4) |
|
Стентирование стенозов >90%, чел. (%) |
5 (14,7) |
18 (23,7) |
|
Осложнение процедуры, чел. (%) |
2 (5,9)* |
2 (2,6) |
Примечание: ЭР – эндоваскулярная реваскуляризация; СЛП – стенты с лекарственным покрытием; ГМС – голометаллические стенты; ЛКА – левая коронарная артерия; * – p<0,05.
ными оценивалась с помощью U-критерия Mann–Whitney. Анализ повторных измерений проводился путем вычисления критерия Wilcoxon (сравнение двух значений признака, установленных до и после лечения). Для выявления различий между группами по выделенным качественным градациям какого-либо признака использовались точный критерий Fisher. Статистически значимыми считали различия при р<0,05.
Результаты
Исходно по клинико-демографическим и ангиографическим показателям группы не имели статистически значимых раз-
Таблица 3
Клинико-ангиологическая характеристика в отдаленном периоде после стентирования КА (до 3 лет)
|
Показатели |
1-я группа, КШ+ЭР |
2-я группа, ЭР |
||||
|
исх. (n=34) |
12 мес. (n=34) |
36 мес. (n=30) |
исх. (n=76) |
12 мес. (n=76) |
36 мес. (n=76) |
|
|
Стентирование: |
30 (88,2) |
- |
- |
76 (100) |
- |
- |
|
нативных КА шунтов Реваскуляризация |
4 (11,8) |
0 |
||||
|
– полная анатомическая |
14 (41,2) |
- |
- |
22 (28,9) |
- |
- |
|
– функциональная |
20 (58,8) |
54 (71,1) |
||||
|
ВНЦХ |
38,2% |
- |
- |
- |
- |
- |
|
Число больных без ИМ и/или |
22 (73,3) |
62 (81,6) |
||||
|
последующих вмешательств |
- |
27 (79,4) |
15 (50) |
- |
57 (75) |
43 (56,6) |
|
ВНЦХ |
- |
- |
61,8–64% |
- |
- |
- |
|
Контрольная КВГ, чел. (%) |
- |
28 (82,4) |
15 (50) |
- |
66 (86,8) |
51 (67,1) |
|
ВНЦХ Рестеноз стентов в шунтах, кол-во |
76% |
|||||
|
ГМС (%) |
- |
0 |
1 (25) |
- |
- |
- |
|
СЛП (%) |
- |
0 |
0 |
|||
|
Рестеноз стентов, чел. (%) |
- |
5 (14,7) |
2 (13,3) |
- |
8 (10,5) |
5 (6,6) |
|
ВНЦХ Окклюзия стентов, к-во (%) |
до 18% |
|||||
|
ГМС |
- |
0 |
3(11,1) |
- |
2 (4,5) |
0 |
|
СЛП |
0 |
0 |
0 |
1(3,3) |
||
|
Повторная реваскул-ция, чел. |
7 (20,6) |
8 (26,6) |
- |
14 (18,4) |
19 (25) |
|
|
КШ/аневризм-эктомия, (%) |
- |
0 |
1 (3,3) |
- |
1 (1,3) |
3 (3,9) |
|
РТСА/ЭР, (%) |
- |
5 (14,7) |
4 (13,3) |
- |
8 (10,5) |
14 (18,4) |
|
Стент в стент или БАП стента, (%) |
- |
2 (5,9) |
3(10) |
- |
5 (6,6) |
4 (5,3) |
|
ВНЦХ |
- |
- |
27% |
- |
- |
- |
Примечание: ВНЦХ – ВНЦХ им. А.Н. Бакулева; ЭР – эндоваскулярная реваскуляризация; КВГ – коронаровентрикулография; РТСА – баллонная ангиопластика; ГМС – голометаллический стент, СЛП – стент с лекарственным покрытием; * – p<0,05.
личий, хотя число пациентов с более тяжелыми ФК стенокардии, перенесших до вмешательства инфаркт миокарда (ИМ) с зубцом Q и формированием постинфарктной аневризмы ЛЖ, чаще регистрировали у больных 1-й гр. (табл. 1). Стенокардию напряжения III ФК, нестабильную стенокардию диагностировали у 20 (58,8%) и 9 (26,5%) больных. На момент стентирования давность КШ более 12 мес. имела место в 91,2% случаев. Удовлетворительная функция артериальных и венозных шунтов была установлена в 53,8 и 41,9% случаев соответственно (табл. 2). Всего в 1-й гр. в среднем было имплантировано 1,95±0,63 стента на пациента, в 11,4% случаев стентированию подвергались коронарные шунты. При этом в данной группе в ходе стентирования статистически значимо чаще по сравнению со 2-й гр. регистрировали периоперационные осложнения (p<0,05).
В госпитальном периоде и через 1 мес. после стентирования рецидив стенокардии, связанный, по мнению Д.Г. Иоселиани (1979), с техническими особенностями таких операций, отмечали у 7,1% больных (табл. 4) [20]. В процессе 6–12-месячной проспекции после вмешательства рецидив стенокардии возник у 7 (23,5%), а через 12 мес. – у 7 (50%) обследованных 1-й группы. В целом по группе к этому сроку частота приступов стенокардии снизилась на 30,8% и 51% (р<0,05), при этом ангинозные боли вообще отсутствовали у 2 (5,9%); у 67,6% пациентов отмечалось снижение на 2 класса ФК стенокардии. Переносимость физических нагрузок (ТФН) возросла по сравнению с исходным уровнем на 33,2%. Этому соответствовало уменьшение объемов ишемических дефектов пер- фузии (ДП) миокарда на 29,1% (р<0,01), без значимой динамики стабильных ДП (рис. 1 на 3-й стр. обложки). Показатели липидного спектра сыворотки крови имели лишь тенденцию к улучшению, что было обусловлено недостаточно высокой приверженностью пациентов к приему статинов – 54%. При этом частота прогрессирования атеросклероза достигала 50%, рестенозы стентов диагностировали у 14,7%, а повторная реваскуляризация миокарда потребовалась у 7 (20,6%) больных (табл. 3). По данным вентрикулографии, в этой группе больных через 12 мес. после вмешательства отмечены положительные изменения показателей внутрисердечной гемодинамики – КДД ЛЖ снизилось на 30,4% (р<0,05), рисунок 2. За 12-месячный период наблюдения погиб 1 пациент от повторного ИМ.
Через 3 года после вмешательства ангинозные боли отсутствовали у 2 (5,9%) пациентов 1-й гр., рецидивы стенокардии возникли у 41,2% больных, причем по результатам контрольной КГ в 10% случаев их причиной, являлись рестенозы стентов в шунтах или нативных КА. Тяжесть ФК стенокардии уменьшилась у 67,6% обследованных. ТФН возросла от исходного уровня на 20,4%. Приверженность к приему статинов составила 60,7%, при этом у 57,1% пациентов не удалось достигнуть целевых значений ХС ЛПНП (табл. 5).
В целом в обеих группах показатели липидного спектра статистически значимо не отличались от данных исходного периода. Сердечно-сосудистая смерть к концу проспективного срока наблюдения была зафиксирована еще у трех (8,8%) пациентов этой группы. Частота вто-
Таблица 4
Динамика функционального класса стенокардии у пациентов после операции реваскуляризации
|
Показатели |
1-я группа (n=34) |
2-я группа (n=76) |
ВНЦХ |
|
рецидив стенок, чел. (%) |
14 (41,2) |
29 (38,2) |
28–30% |
|
через 1 мес. |
1 (2,9) |
2 (2,6) |
до 7% |
|
через 1 год |
6 (17,6) |
13 (17,1)* |
15–20% |
|
более 1 года |
7 (20,6) |
14 (18,4) |
8–10% |
Примечание: * – p<0,05; ЭР – эндоваскулярная реваскуляризация.
Таблица 5
Частота достижения целевых уровней показателей липидного спектра, %
|
Показатели |
1-я группа, КШ+ЭР (n=34) |
2-я группа, ЭР (n=76) |
||
|
через 12 мес. |
через 36 мес. |
через 12 мес. |
через 36 мес. |
|
|
ОХС |
0 |
57,1 |
17,1 |
17,6 |
|
ТГ |
42,9 |
34,3 |
46,2 |
20,7 |
|
ХС ЛПВП |
52,4 |
57,1 |
54,6 |
48 |
|
ХС ЛПНП |
57,1 |
42,9 |
21,4 |
27,2 |
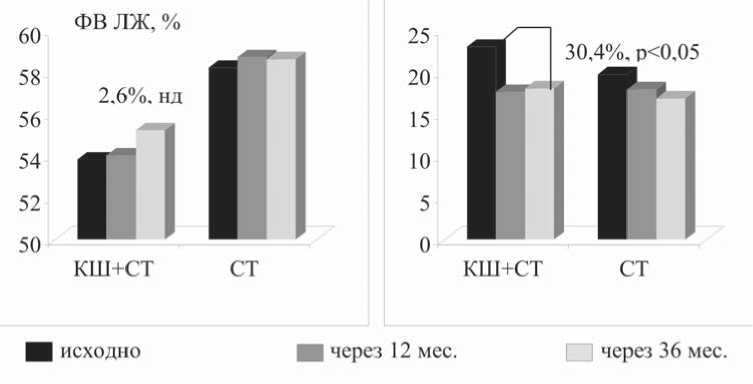
Рис. 2. Динамика ФВ ЛЖ и КДД ЛЖ у пациентов 1-й (КШ+ЭР) и 2-й (ЭР) групп: исходно, через 12 мес. и 36 мес. после вмешательства. Примечание: КШ – коронарное шунтирование, СТ – стентирование, ФВ – фракция выброса ЛЖ, КДД – конечно-диастолическое давление ЛЖ
ричной конечной точки составила 50%, в 4,3% случаев выявляли определенные или вероятные тромбозы стентов. Во 2-й гр. до стентирования стенокардия напряжения III ФК и нестабильная стенокардия диагностировались у 47,4 и 30,3% больных соответственно. На одного пациента в среднем было имплантировано 2,7стента.
Рецидивы стенокардии через 1 мес. после вмешательства возникли у 6,9% больных, через 6 мес. – у 13 (44,8%), а спустя 12 мес. – у 14 (48,3%) больных. При этом частота приступов стенокардии через год после стентирования оказалась ниже исходных показателей на 51% (р<0,05), а ангинозные боли вообще отсутствовали у 9 (11,8%) пациентов. Физическая толерантность по сравнению с исходным уровнем возрастала на 34,9% (р<0,05), а объем транзиторных ДП уменьшился на 34,8% (р<0,01). По данным контрольной ангиографии, рестенозы стентов выявляли в 10,5%, прогрессирование атеросклероза – в 35,9% случаев; повторная реваскуляризация осуществлялась у 19 (25%) больных. Случаи летального исхода на данном этапе наблюдения среди больных 2-й гр. не выявлялись.
Через 3 года после вмешательства рецидивы стенокардии возникали у 29 (38,2%) пациентов, при этом частота ангинозных болей была ниже исходного уровня в 2 раза. На данном этапе проспективного наблюдения ангинозные боли отсутствовали у 7 (9,2%) пациентов, а ТФН возросла в целом по группе на 30% (р<0,05). Приверженность к приему статинов составила 54,6%, причем уровень показателей липидного спектра статистически значимо не отличался от данных исходного периода. По данным ОЭКТ миокарда с 199Tl, средний объем преходящей ишемии миокарда по сравнению с исходным периодом уменьшился на 15,5%. Рестенозы стентов через 3 года после эндоваскулярной реваскуляризации диагностировали в 6,6% случаев, рисунок 3 (на 3-й стр. обложки) и 4.
К концу срока проспективного наблюдения во 2-й гр. зарегистрирован 1 (1,3%) случай летального исхода в результате повторного ИМ, причиной которого явился очень поздний тромбоз стента с лекарственным покрытием. Частота вторичной конечной точки к этому сроку достигла 39,4%.
Обсуждение
Причиной рецидива стенокардии, развития повторных нефатальных ИМ и коронарной смерти пациентов после КШ являются стенотические и/или окклюзионные поражения шунтов и нативных КА вследствие прогрессирования атеросклероза.
Таким пациентам необходимо проведение повторных хирургических операций, направленных на коронарную реваскуляризацию ишемизированного миокарда, которые сопряжены с большим операционным риском и часто с серьезным неблагоприятным прогнозом. Это особенно актуально в особых когортах больных – у пациентов пожилого возраста, имеющих многочисленные факторы риска прогрессирования коронарной и сердечной недостаточности [21].
Более широкое внедрение в кардиологическую практику эндоваскулярных вмешательств на КА и шунтах расширяют возможности для эффективной и безопасной коррекции тяжелой коронарной недостаточности, обес-
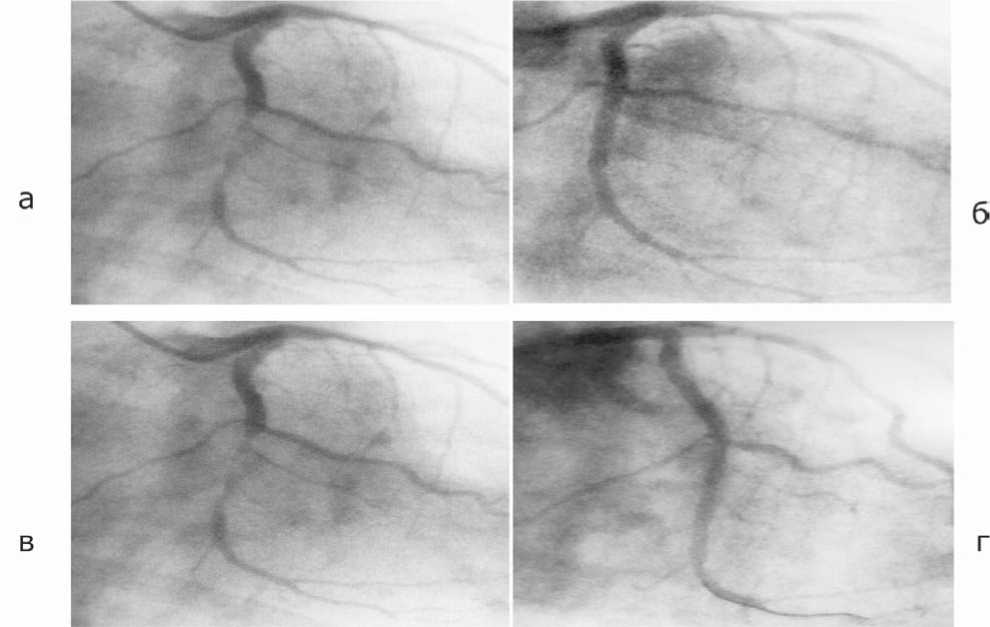
Рис. 4. Результаты коронарографии пациента Л. (47 лет): а) до стентирования (стеноз ОА>75%, указано стрелкой); б) после установки стента – восстановление просвета ОА; в) стеноз дистальной трети ОА с распространением на проксимальную часть стента (указано стрелкой); г) восстановление кровотока в ОА после повторной эндоваскулярной реваскуляризации (баллонная дилатация стента)
печивая улучшение качества жизни и выживаемости у больных ИБС после проведенного АКШ с рецидивами стенокардии и угрозой развития фатальных осложнений (рис. 5).
У этой категории пациентов частота рестенозирования в течение 1 года после имплантации стентов в КА или в шунты сопоставима и колеблется в пределах 13– 22% [22]. Через 5 лет после повторной эндоваскулярной ангиопластики у больных, подвергшихся ранее КШ, последующие вмешательства осуществляются в 27–35% случаев в венечных артериях, ранее не имевших гемодинамически значимых стенозов, и в 41–60% – в коронарных шунтах [16, 23].
По данным ACC/AHA/SCAI (2005), на современном этапе потребность в повторных процедурах коронарной реваскуляризации с использованием новых технологий ангиопластики и стентирования КА после хирургической реваскуляризации миокарда довольно высока (10,5–27%), при этом риск неблагоприятных исходов и частота осложнений при повторных интервенционных вмешательствах явно выше по сравнению с пациентами без предшествующего АКШ [24]. В нашем исследовании через 1 год после эндоваскулярной реваскуляризации частота повторных вмешательств в 1-й гр. (после КШ) и во 2-й гр. больных (с первичной ангиопластикой) составила 25 и 20,6% соответственно; через 3 года этот показатель возрастал в большей мере у пациентов, перенесших хирур- гическую реваскуляризацию. Это служит основанием для более широкого использования повторных эндоваскулярных вмешательств (в частности, стентирования), направленных на устранение после проведенного АКШ рецидивов стенокардии, вызванных стенозированием нативных КА или шунтов.
В разные сроки после эндоваскулярной реваскуляризации рецидив стенокардии обусловлен влиянием разных причин, каждая из которых вносит особый вклад на определенном этапе [20]. Так, в госпитальном периоде и через 1 мес. после стентирования он в основном связан с техническими особенностями, в период 1–6 мес. – чаще всего обусловлен гиперпролиферацией интимы КА, а в последующем – прогрессированием атеросклероза в нативных КА или аутовенозных шунтах. В нашем исследовании на всех этапах проспективного наблюдения рецидив стенокардии чаще возникал у больных, перенесших ранее КШ: до 1 мес. в 1-й и 2-й гр. – в 7,1% и 6,9% случаев, через 6 мес. – у 7 (50%) и 13 (44,8%), а через 12 мес. и более – у 6 (42,9%) и 14 (48,3%) больных соответственно. При этом через 12 мес. после стентирования количество больных без рецидива ИМ и повторных вмешательств достигало в 1-й гр. 79,4% и 75% во 2-й. По данным контрольной ангиографии, прогрессирование атеросклероза и рестенозы стентов также чаще диагностировали у больных 1-й гр. – 50% и 14,7% против 35,9% и 10,5% во 2-й гр. соответственно ( χ 2=7,026, df=2, р=0,029).
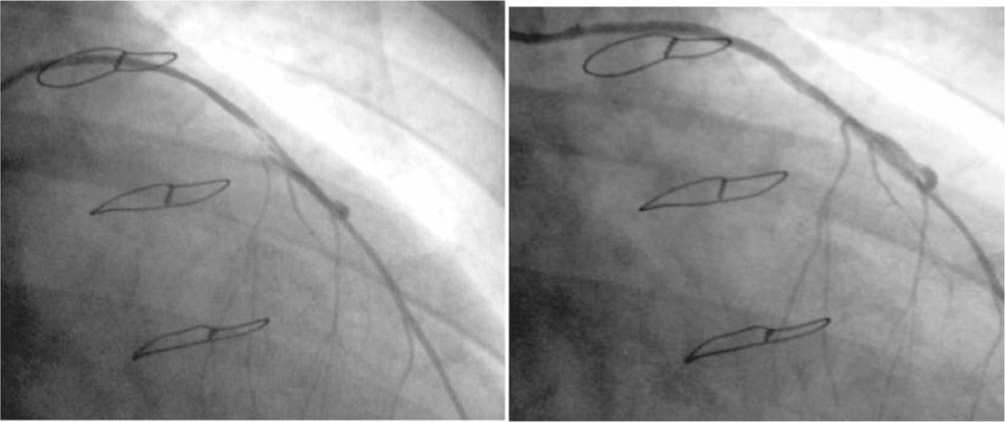
Рис. 5. Пример успешного стентирования артериального шунта к передней нисходящей артерии у пациента В (49 лет): а) – гемодинамически значимый стеноз маммарокоронарного шунта к ПНА, выявленный через 6 лет после КШ; б) – маммарокоронарный шунт проходим через 12 мес. после эффективной имплантации стента VCBX
Через 3 года после вмешательства ангинозные боли отсутствовали у 2 (5,9%) и 7 (9,2%) пациентов 1-й и 2-й групп ( χ 2=7,026, df=2, р=0,029), а их частота в среднем была ниже исходного уровня в 2 раза. Вместе с тем, к концу проспективного наблюдения в обеих группах имела место тенденция к нарастанию симптомов коронарной недостаточности, более выраженная в группе после КШ. Это проявилось увеличением потребности в приеме нитратов на 38,1% ( χ 2=4,68, df=1, р=0,031), снижением уровня физической толерантности на 14,3%, увеличением числа фатальных ИМ, приведших к сердечно-сосудистой смерти с 1,3% до 8,8% (р<0,05), что, вероятно, было обусловлено рестенозированием стентов и прогрессированием коронарного атеросклероза в нативных КА и шунтах. Более частое прогрессирование атеросклероза у больных 1-й гр. (после КШ) в сравнении с пациентами 2-й гр. (первичное стентирование) обусловлено, вероятнее всего, более тяжелым поражением коронарного русла, выражавшегося в большей частоте хронических окклюзий. Приверженность к приему статинов на этом этапе наблюдения в 1-й и 2-й группах была на уровне 60,7 и 54,6% ( χ 2=26,8, df=4, р=0,0006), что не позволило у 57,1 и 72,8% пациентов достигнуть целевых значений ХС ЛПНП. Количество больных без рецидивов ИМ и повторных вмешательств достигало 50% в 1-й гр. и 63,2% – во 2-й (р<0,05), таблица 3, в то время как потребность в повторной реваскуляризации миокарда возникала у 8 (26,6%) и у 14 (18,4%) больных соответственно (р<0,05).
За 36 мес. наблюдения всего умерли 5 пациентов – 4 (11,8%) больных, перенесших ранее КШ, и один пациент (1,3%) после первичной эндоваскулярной реваскуляризации (χ2=3,68, df=1, р=0,049). В 1-й гр. один пациент умер через 12 мес. и трое других – через 36 мес. после повторной реваскуляризации (3 случая повторного фатального ИМ, 1 – внезапная остановка сердца); во 2-й группе через 12 мес. был зарегистрирован 1 (1,3%) летальный исход в период повторного ИМ, причиной ко- торого явился тромбоз стента с лекарственным покрытием.
Таким образом, данные настоящего исследования свидетельствуют о том, что при рецидиве коронарной недостаточности у больных с тяжелым стенозирующим коронарным атеросклерозом, перенесших Q-ИМ и подвергшихся ранее прямой реваскуляризации миокарда, стентирование нативных КА и шунтов по объективным причинам (пожилой возраст, манифестирующий сахарный диабет 2-го типа, ХСН, дефицит аутотрансплантатов для коронарных шунтов) является средством выбора. Повторная эндоваскулярная реваскуляризация у этой тяжелой категории больных безопасна и высокоэффективна. В отдаленные сроки после вмешательства (через 3 года) сохраняется высокая антиишемическая эффективность, проявляющаяся снижением частоты и тяжести стенокардии на 31%, уменьшением потребности в НТГ в 2 раза, возрастанием физической толерантности на 20,4% (p<0,05), обеспечивая регресс ремоделирования ЛЖ и улучшение показателей внутрисердечной гемодинамики.
Выводы
-
1. У больных ИБС с рецидивом тяжелой стенокардии в отдаленные сроки (6 лет) после КШ причиной нарастания коронарной и сердечной недостаточности является закрытие шунтов (в 58,1% аутовенозных и в 46,2% – артериальных) и в 88,2% – гемодинамически значимое стенозирование нативных коронарных артерий.
-
2. У больных ИБС с рецидивом коронарной недостаточности после хирургической реваскуляризации ишемизированного миокарда альтернативным эффективным и безопасным способом выбора повторной реваскуляризации является эндоваскулярное стентиро-
- вание целевых коронарных шунтов и нативных артерий; клиническая эффективность вмешательства сопоставима с первичным стентированием КА, достигая 67,6%.
-
3. Эффективность вторичной профилактики прогрессирования коронарного атеросклероза с использованием статинов в исследованной когорте пациентов характеризуется удовлетворительной приверженностью к приему холестеринкорригирующей терапии (в 1-й гр. – 60,7%, во 2-й – 54,6%). Использование более агрессивной современной тактики холестеринкорриги-рующей терапии с достижением целевых уровней ОХ (<4,5 ммоль/л) и атерогенного холестерина ЛПНП (<2,0 ммоль/л) способно предотвратить прогрессирование стенозирующего атеросклероза коронарных артерий и шунтов в популяции больных, перенесших коронарную реваскуляризацию.
Список литературы Эффективность стентирования у больных с рецидивом стенокардии после коронарного шунтирования. Результаты 3-летнего проспективного наблюдения
- Ferguson T.B. Jr., Hammill B.G., Peterson E.D. et al. A decade of change -risk profiles and outcomes for isolated coronary artery bypass grafting procedures//Ann. Thorac. Surg. -2002. -Vol. 73. -P. 480-489.
- Sedrakyan A., Wu A.W., Parashar A. et al. Offpump surgery is associated with reduced occurrence of stroke and other morbidity as compared with traditional coronary artery bypass grafting: a meta#analysis of systematically reviewed trials//Stroke. -2006. -Vol. 37. -P. 2759-2769.
- Jones R.H., Kesler K., Phillips H.R. 3rd et al. Longterm survival benefits of coronary artery bypass grafting and percutaneous transluminal angioplasty in patients with coronary artery disease//J. Thorac. Cardiovasc. Surg. -1996. -Vol. 111. -P. 1013-1025.
- Dzavik V., Ghali W.A., Norris C. et al. Longterm survival in 11, 661 patients with multivessel coronary artery disease in the era of stenting: a report from the Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease (APPROACH) Investigators//Am. Heart. J. -2001. -Vol. 142. -P. 119-126.
- Карпов Р.С., Дудко В.А. Атеросклероз. Патогенез, клиника, функциональная диагностика, лечение. -Томск: STT, 1998. -736 c.
- Pocock S. Meta-analisis of randomized trials comparing coronary angioplasty with bypass surgery//Lancet. -1995. -Vol. 344. -P. 1184-1189.
- Тепляков А.Т., Аптекарь В.Д., Рыбальченко Е.В. и др. Эволю# ция коронарной недостаточности и ишемической дисфункции левого желудочка и возможности эффективной вторичной их профилактики у больных после реваскуляризации ишемиизированного миокарда (10-летнее проспективное наблюдение)//Сибирский медицинский журнал (Томск). -2007. -T. 22, № 3. -C. 24-29.
- Тепляков А.Т., Мамчур С.Е., Вечерский Ю.Ю. Коронарное шунтирование: оптимизация восстановительного лечения. -Томск: Изд-во Том. ун-та, 2006. -360 c.
- Weintraub W. Eightyear mortality in the Emory Angioplasty versus Surgery Trial (EAST)//J. Am. Coll. Cardiol. -2000. -Vol. 35. -P. 1116-1121.
- Loop F.D., Cosgrove D.M. Repeat coronary bypass surgery: selection of cases, surgical risks and longterm outlook//Mod. Consepts. Cardiovasc. Dis. -1986. -Vol. 55. -P. 31-36.
- Schaff H.V., Orzulak T.A., Gersh B.J. The morbidity and mortality of re#operation for coronary artery disease and analysis of late results with use of actuarial estimate of eventfree interval//J. Thorac. Cardiovasc. Surg. -1983. -Vol. 85. -P. 508-515.
- Честухин В.В. Инвазивная диагностика и интервенционное лечение. -М.: Принт-Ателье, 2006. -187 с.
- Тепляков А.Т., Ахмедов Ш.Д., Мамчур С.Е. и др. Клиническая диагностика ишемической дисфункции при минимально инвазивной реваскуляризации миокарда. -Томск: Изд-во Том. ун-та, 2002. -300 c.
- Kapur A., Hall R.J., Malik, I.S., et al. Randomized Comparison of Percutaneous Coronary Intervention With Coronary Artery Bypass Grafting in Diabetic Patients: 1-Year Results of the CARDia (Coronary Artery Revascularization in Diabetes)//Trial. J. Am. Coll. Cardiol. -2010. -Vol. 55. -P. 432-440.
- King S.B., Lembo N.J., Hall E.C. et al. For the EAST Investigators. The Emory Angioplasty vs Surgery Trial (EAST): analysis of baseline characteristics//Am. J. Cardiol. -1995. -Vol. 75. -P. 42-59.
- Бокерия Л.А., Алекян Б.Г., Коломбо А. и др. Интервенционные методы лечения ИБС. -М.: Изд-во НЦХ им. А.Н. Бакулева, 2002. -417 с.
- Bourassa M.G., Detre K.M., Johnston J.M. et al. Effect of prior revascularization on outcome following percutaneous coronary intervention. NHLBI Dynamic Registry//Eur. Heart J. -2002. -Vol. 23. -P. 1546-1555.
- Кухарчук В.В., Аксенов В.А., Аронов Д.М., с соавт. Национальные рекомендации по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза // Кардиоваскулярная терапия и профилактика. 2007. Т. 6. № 6 S3.
- Applegate R.J., Matthew T.S., William C.L. et al. Incidence of Coronary Stent Thrombosis Based on Academic Research Consortium Definitions//Am. J. Cardiol. -2008. -Vol. 102 (Issue 6). -P. 683-688.
- Иоселиани Д.Г. ИБС в аспекте хирургического лечения (клинико-ангиографические, гемодинамические и анатомические исследования): автореф. дис.... докт. мед. наук. -М., 1979. -31 с.
- Тепляков А.Т., Кузнецова А.В., Степачева Т.А. и др. Влияние атерогенной дислипопротеидемии на состояние коронарного русла, проходимость коронарных шунтов после хирургической реваскуляризации и гиполипидемическая эффективность длительной (12-36 мес.) вторичной профилактики ингибитором ГМК-КоА-редуктазы симвастатином//Сибирский медицинский журнал (Томск). -2006. -№ 2. -С. 12-21.
- Fenton B.H., Fishman D.L., Savage M.P. et al. Long#term angiographic end clinical outcome after implantation of balloonexpandable stents in aortocoronary saphenous vein grafts//Am. J. Cardiol. -1994. -Vol. 63. -Р. 1187-1191.
- Ivert T., Holmgren A., Landou C.H. Exercise tolerance five years after coronary bypass surgery in relation to clinical and angiographic findings//J. Thorac. Cardiovasc. Surg. -1981. -Vol. 15, No. 2. -Р. 179-186.
- Алекян Б.Г. Бузиашвили Ю.И., Власов Г.П. и др. Транслюминальная баллонная ангиопластика у больных с возвратом стенокардии после операции аортокоронарного шунтирования//Грудная и сердечно-сосудистая хирургия. -1996. -№ 6. -С. 23.


