Эффективность таргетной терапии ALK-позитивных опухолей на примере использования препарата кризотиниб у больного распространенным раком желудка
Автор: Пайчадзе Анна Александровна, Болотина Лариса Владимировна, Карпенко Елена Юрьевна, Устинова Татьяна Васильевна, Корниецкая Анна Леонидовна, Каприн Андрей Дмитриевич, Феденко Александр Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Многие известные на данный момент молекулярные мишени характеризуются достаточной органной специфичностью, но могут быть выявлены в различных типах опухолей. Своевременное использование молекулярных методов диагностики позволит осуществить отбор пациентов, применение таргетной терапии у которых приведет к получению наилучшего результата в отношение контроля над заболеванием. Описание клинического случая. Пациенту, 38 лет, в декабре 2014 г по поводу распространенного низкодифференцированного аденогенного рака антрального отдела желудка с диссеминацией по брюшине по витальным показаниям выполнена паллиативная субтотальная резекция желудка. В послеоперационном периоде проведены 18 курсов ПХТ по схеме XELOX с последующей ДЛТ на область ворот печени. В феврале 2017 г выполнена чрескожная чреспеченочная холангиостомия левого долевого протока, в мае 2017 г в связи с развитиями картины стеноза - стентирование общего желчного протока. Через 3 мес диагностировано прогрессирование заболевания в виде билобарного метастатического поражения печени. Начата МХТ препаратом паклитаксел в еженедельном режиме. Через 3 мес после определения в опухоли перестройки ALK консилиумом врачей больному рекомендована терапия кризотинибом. Длительность лечения при удовлетворительной переносимости составила 8 мес. Заключение. Имеющийся на данный момент опыт применения препарата кризотиниб позволяет рассматривать его как эффективное средство в лечении ALK-позитивных опухолей.
Химиотерапия, таргетная терапия, кризотиниб, генерализованный рак желудка
Короткий адрес: https://sciup.org/140254316
IDR: 140254316 | УДК: 618.33-006.6-08:615.28 | DOI: 10.21294/1814-4861-2020-19-1-141-146
Текст научной статьи Эффективность таргетной терапии ALK-позитивных опухолей на примере использования препарата кризотиниб у больного распространенным раком желудка
Все клинические испытания, проводимые в онкологии, подразумевают набор пациентов со злокачественными новообразованиями определённой локализации и/или гистологического строения. Углубление представлений о биологии опухолей послужило основанием для пересмотра подходов к планированию будущих клинических исследований: от анатомической локализации, распространения и морфологической структуры к использованию молекулярно-генетических факторов, против которых и должно быть направлено лечение. Надо отметить, что большинство известных на данный момент молекулярных мишеней характеризуется достаточной органной специфичностью, но могут быть представлены и в различных типах опухолей. При этом инициация клинического протокола для каждой отдельной нозологии представляется практически невыполнимой задачей. В 2015 г. Hyman et al. опубликовали результаты исследования, которое включало пациентов с различными злокачественными новообразованиями на основе единственного критерия – наличия активирующей мутации в гене BRAF [1]. Для таких исследований недавно появился новый термин: «basket trials» («корзинное исследование»). В данной работе на достаточно репрезентативном материале (n=122) была показана эффективность препарата вемурафениб при карциномах легкого, а также у пациентов с гистиоцитозом клеток Лангерганса или болезнью Erdheim-Chester. В том же 2015 г. стали доступными сведения наших российских коллег об эффективности вемурафениба в отношении BRAF-мутированной светлоклеточной саркомы [2].
В 1990-х гг. ХХ века у пациентов с анапластической крупноклеточной лимфомой был выделен химерный белок, образованный в результате слияния киназы анапластической лимфомы (ALK) и ну-клеофосмина (NPM) [3–6]. В последующем были выявлены различные хромосомные транслокации, ведущие к слиянию ALK с различными генами и активации ALK при других злокачественных новообразованиях: раке молочной железы, плоскоклеточном раке пищевода, колоректальном раке, диффузной В-клеточной лимфоме, нейробластоме, немелкоклеточном раке легкого, воспалительных миофибробластических опухолях [7–11]. Было доказано, что активированная тирозинкиназа ALK запускает передачу сигналов через определенные сигнальные пути, наиболее значимыми и хорошо изученными из которых являются Ras-ERK и PI3K-Akt. Таким образом, ALK-опосредованная передача сигналов может играть ключевую роль в развитии и прогрессировании заболевания независимо от первичной локализации [12]. К методам обнаружения мутаций гена ALK относят иммуногистохимическое исследование (ИГХ), полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР) и флюоресцентную гибридизацию in situ (FISH). В клинических исследованиях чаще всего используют одобренный FDA метод FISH. При патоморфологическом исследовании тканей, удаленных во время оперативного вмешательства, широко применяется ИГХ.
В 2007 г. был создан таблетированный селективный ингибитор рецепторных тирозинкиназ c-Met и ALK, конкурентно связывающий АТФ – кризотиниб (Ксалкори®). Данный препарат зарекомендовал себя как высокоэффективное средство, позволяющее достичь наступления быстрого ответа на лечение, характеризующегося значимой продолжительностью. Кризотиниб обладает благоприятным профилем безопасности и хорошей переносимостью. Наиболее часто встречающимися нежелательными явлениями были гастроинтестинальная токсичность и нарушение зрения, представленные преходящими расстройствами адаптации к свету, мерцанием в глазах, вспышками света и т. д. Прекращение лечения вследствие развития неблагоприятного явления наблюдается редко, даже при длительном приеме препарата. Кроме того, на фоне приема кризотиниба пациенты отмечают быстрое облегчение симптомов заболевания, что непосредственно отражается на качестве жизни.
Опыт применения препарата кризотиниб позволяет рассматривать его как эффективное средство в терапии ALK-позитивных опухолей. Важно своевременно использовать молекулярные методы диагностики, направленные на отбор пациентов, у которых применение таргетной терапии позволит получить максимальный выигрыш в контроле над болезнью. В отечественной литературе по «basket trials» существует довольно ограниченное число публикаций. Надеемся, что наше клиническое наблюдение поможет широкому кругу практикующих онкологов выбирать оптимальную схему диагностических и лечебных мероприятий в каждом индивидуальном случае.
Клинический случай
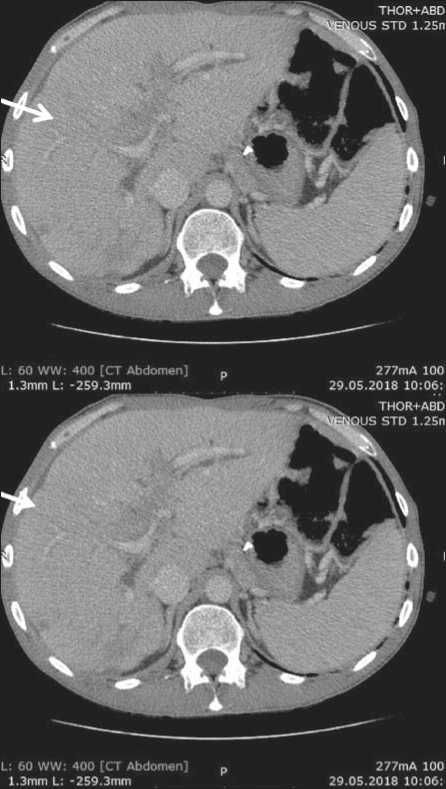
Рис. 1. СКТ органов брюшной полости до начала таргетной терапии
Fig. 1. SKT of the abdominal organs before the start of targeted therapy
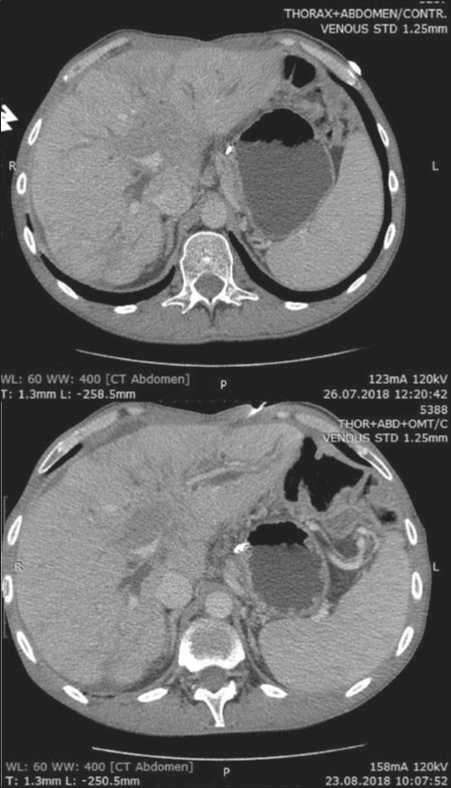
Рис. 2. CКТ органов брюшной полости через 1 и 2 мес после таргетной терапии
Fig. 2. CT of the abdominal organs one and two months after the start of targeted therapy
лизирован в отделение абдоминальной онкологии онкодиспансера по месту жительства. В феврале 2017 г. выполнена чрескожная чреспеченочная холангиостомия левого долевого протока, а в мае 2017 г. в связи с развитиями картины стеноза – стентирование общего желчного протока. При контрольном обследовании в августе 2017 г. диагностировано прогрессирование заболевания в виде билобарного метастатического поражения печени. После чрескожного чреспеченочного наложения холангиостомы в сентябре 2017 г. пациенту начата монохимиотерапия препаратом паклитаксел в еженедельном режиме. Данное лечение реализовано больному с марта по май 2018 г. Пациент изъявил желание провести полногеномное молекулярно-генетическое тестирование в рамках программы OncoDNA, которое выявило наличие в опухоли перестройки ALK. Для решения вопроса о тактике дальнейшего лечения обратился в МНИОИ. Тактика ведения пациента была обсуждена на консилиуме. Рекомендовано проведение лекарственной терапии препаратом кризотиниб в дозе 250 мг два раза в день per os до прогрессирования или развития клинически значимой неконтролируемой токсичности.
В июне 2018 г. начата рекомендованная таргетная терапия. К моменту проведения контрольного обследования (через 8 нед) пациента перестали беспокоить жалобы на боли тянущего характера в правом подреберье, нормализовался сон. При контрольной СКТ органов грудной и брюшной полостей с внутривенным контрастированием в августе 2018 г. отмечена стабилизация течения опухолевого процесса (рис. 1, 2). Лечение не сопровождалось развитием клинически значимых токсических реакций. Терапия кризотинибом была продолжена. Длительность лечения при удовлетворительной переносимости составила 8 мес. В последующем у пациента развилась картина прогрессирования заболевания в виде увеличения количества метастатических очагов в печени. В настоящее время больной получает лекарственное лечение препаратом рамуцирумаб. Наблюдение за пациентом продолжается.
Список литературы Эффективность таргетной терапии ALK-позитивных опухолей на примере использования препарата кризотиниб у больного распространенным раком желудка
- Hyman D.M., Puzanov I., Subbiah V., Faris J.E., Chau I., Blay J.Y., Wolf J., Raje N.S., Diamond E.L., Hollebecque A., Gervais R., Elez-Fernandez M.E., Italiano A., Hofheinz R.D., Hidalgo M., Chan E., Schuler M., Lasserre S.F., Makrutzki M., Sirzen F., Veronese M.L., Tabernero J., Baselga J. Vemurafenib in Multiple Nonmelanoma Cancers with BRAFV600 Mutations. N Engl J Med. 2015 Aug 20; 373(8): 726-36. DOI: 10.1056/NEJMoa1502309
- Protsenko S.A., Semionova A.I., Komarov Y.I., Aleksakhina S.N., Ivantsov A.O., Iyevleva A.G., Imyanitov E.N. BRAF-mutated clear cell sarcoma is sensitive to vemurafenib treatment. Invest New Drugs. 2015 Oct; 33(5): 1136-43. DOI: 10.1007/s10637-015-0280-0
- Shiota M., Mori S. The clinicopathological features of anaplastic large cell lymphomas expressing p80NPM/ALK. Leuk Lymphoma. 1996; 23: 25-32. DOI: 10.3109/10428199609054798
- Morris S.W., Kirstein M.N., Valentine M.B., Dittmer K.G., Shapiro D.N., Saltman D.L., Look A.T. Fusion of а kinase gene, ALK, to a nucleolar protein gene, NPM, in non-Hodgkin/s lymphoma. Science. 1994; 263: 1281-4. DOI: 10.1126/science.8122112
- Bischof D., Pulford K., Mason D.Y., Morris S.W. Role of the nucleophosmin (NPM) portion of the non-Hodgkin/s lymphoma-associated NPM-anaplastic lymphoma kinase fusion protein in oncogenesis. Mol Cell Biol. 1997; 17: 2312-25. DOI: 10.1128/mcb.17.4.2312


