Эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами в лечении метастатических и первичных опухолей печени
Автор: Звздкина Е.А., Кедрова А.Г., Лебедев Д.П., Красильников С.Э., Греян Т.А., Панченков Д.Н., Степанова Ю.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.14, 2023 года.
Бесплатный доступ
Обоснование. При лечении опухолей печени все активнее применяется трансартериальная химиоэмболизация, одним из вариантов которой является применение лекарственно насыщаемых микросфер. Однако на текущий момент нет систематизированных исследований, отвечающих на вопросы, какова роль метода в схеме лечения пациентов с первичным и метастатическим поражением печени и на каком этапе его следует применять. Цель исследования - оценить эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами для лечения метастатических и первичных злокачественных опухолей печени на разных стадиях заболевания. Методы. Ретроспективное наблюдательное неконтролируемое исследование 65 пациентов с метастатическим поражением печени (группа 1) и 10 пациентов с первичными злокачественными опухолями печени (группа 2), которым проведено 102 операции трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами. Для планирования трансартериальной химиоэмболизации и оценки её эффективности применялись компьютерная и магнитно-резонансная томография каждые 8-9 недель в процессе лечения. Результаты. После двух контролей трансартериальной химиоэмболизации (через 8-9 недель и 16-17 недель) 51 (79%) пациент в группе 1 ответил на лечение, 14 (21%) - не ответили. Среди ответивших на терапию к 16-й неделе отмечалось уменьшение объёма опухолевой массы печени с 12,4 [4,7; 24,6] до 5,2 см3 [2; 15,5] для колоректального рака, с 26 [18; 35] до 19 см3 [13; 25] для нейроэндокринного рака, с 12 [4; 20] до 4 см3 [0,6; 9] для аденокарцином разных локализаций. В группе 2 прогрессирования не было, при этом к 16-й неделе отмечалось уменьшение объёма опухоли со 142 [51; 206] до 68 см3 [23; 185] для гепатоцеллюлярного рака, с 465 [330; 600] до 187 см3 [137; 237] для внутрипечёночной холангиокарциномы. При повторных процедурах трансартериальной химиоэмболизации также отмечалось уменьшение объёма опухолевой массы, при этом время без прогрессии сокращалось с 303 [170; 369] до 180 [105; 225] дней в группе 1 и с 266 [200; 367] до 120 [62; 215] дней в группе 2. Заключение. Трансартериальная химиоэмболизация лекарственно насыщаемыми микросферами является эффективным методом лечения первичных и метастатических опухолей печени. Её следует рассматривать как паллиативую терапию, которая позволяет добиться хорошего противоопухолевого ответа на разных стадиях онкологического заболевания.
Химиоэмболизация, микросфера, метастаз печени, гепатоцеллюлярный рак, холангиокарцинома
Короткий адрес: https://sciup.org/143180550
IDR: 143180550 | DOI: 10.17816/clinpract562713
Текст научной статьи Эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами в лечении метастатических и первичных опухолей печени
Звездкина Е.А., Кедрова А.Г., Лебедев Д.П., Красильников С.Э., Греян Т.А., Панченков Д.Н., Степанова Ю.А. Эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами в лечении метастатических и первичных опухолей печени. Клиническая прак тика. 2023;14(3):27–35. doi:
Zvezdkina EA, Kedrova AG, Lebedev DP, Krasilnikov SE, Greyan TA, Panchenkov DN, Stepanova YuA. Efficiency of Transarterial Chemoembolization with Drug-Eluting Microspheres in the Treatment of Metastatic and Primary Liver Tumors. Journal of Clinical Practice . 2023;14(3):27–35.
doi:
Submitted 19.07.2023
Revised 31.07.2023
Published 29.09.2023
ОБОСНОВАНИЕ
При лечении опухолей печени в последние 20 лет в клиническую практику активно внедряется локорегионарная терапия. Она стала альтернативной противоопухолевой опцией в нерезектабель-ных случаях у пациентов с высоким операцион- но-анестезиологическим риском и соматически отягощённым состоянием [1].
Методы локорегионарной терапии, к которым относится трансартериальная химиоэмболизация (ТАХЭ), внесены в схему лечения гепатоцеллюлярного рака [2–4]. В 2021 году Европейское сообщест- во кардиоваскулярных и интервенционных радиологов (Cardiovascular and Interventional Radiological Society of Europe, CIRSE) расширило показания для трансартериальной химиоэмболизации печени, включив внутрипечёночную холангиокарцино-му, метастатический колоректальный и нейроэндокринный рак [5]. В то же время есть работы об успешном применении метода в лечении метастатического поражения печени при раке молочной железы, опухолях других локализаций [6–12].
Трансартериальная химиоэмболизация является эндоваскулярной хирургической операцией, одним из вариантов которой стало применение лекарственно насыщаемых микросфер. Это полимерные микрочастицы, которые впитывают раствор цитостатика, увеличивая при этом свой объём в десятки раз. Попадая в афферентные сосуды злокачественного новообразования, микросферы оседают и закупоривают их, а непосредственно в очаге под воздействием плазмы крови в течение нескольких недель высвобождается цитостатик. Сами лекарственно насыщаемые микросферы при этом уменьшаются в размере и покидают сосудистое русло [13, 14]. Таким образом, лечение становится двухкомпонентным: опухоль ишемизируется за счёт закупорки её сосудов, а цитостатик нарушает клеточный метаболизм.
На текущий момент нет систематизированных исследований, отвечающих на важные вопросы, в частности, какова роль метода в схеме лечения пациентов с первичным и метастатическим поражением печени и на каком этапе его следует применять.
Цель исследования — оценить эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами для лечения метастатических и первичных злокачественных опухолей печени на разных стадиях заболевания.
МЕТОДЫ
Дизайн исследования
Ретроспективное наблюдательное открытое исследование, включающее 65 пациентов с метастатическим поражением печени (группа 1) и 10 пациентов с первичными злокачественными опухолями печени (группа 2), которым проведено суммарно 102 операции трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами. В группе 1 было выполнено 65 первичных и 22 повторных ТАХЭ, в группе 2 — 10 и 5 соответственно. Для контроля результатов операции были составлены базовые диагностические протоколы, включающие компьютерную томографию (КТ) брюшной полости (протокол 1) и магнитно-резонансную томографию (МРТ) гепатобилиарной зоны (протокол 2) с внутривенным контрастированием, которые следовало выполнить в строго лимитированные сроки: не позднее 2 недель до проведения ТАХЭ, через 8–9 недель и 16–17 недель после вмешательства. Всего в исследование включены 105 КТ брюшной полости с внутривенным контрастированием и 195 МРТ гепатобилиарной зоны с внутривенным контрастированием.
Дизайн исследования представлен на рис. 1.
102 трансартериальные химиоэмболизации лекарственно насыщаемыми микросферами
|
1 группа: n =65 метастазы печени |
2 группа: n =10 первичные опухоли печени |
|||
|
Диагностический протокол 1: n =25 Диагностический протокол 2: n =60 |
Диагностический протокол 1: n =10 Диагностический протокол 2: n =5 |
|||
|
Диагностический контроль 0 |
Диагностический контроль 0 |
|||
|
Трансартериальная химиоэмболизация ( n =87) 65 первичных, 22 повторных |
Трансартериальная химиоэмболизация ( n =15) 10 первичных, 5 повторных |
|||
|
8–9 недель |
8–9 недель |
|||
|
Диагностический контроль 1 |
Диагностический контроль 1 |
|||
|
, 16–17 недель |
16–17 недель |
|||
|
Диагностический контроль 2 |
Диагностический контроль 2 |
|||
Рис. 1. Дизайн исследования.
Fig. 1. Study design.


Критерии соответствия
Критерии включения: гистологически верифицированные злокачественные опухоли печени; нерезектабельное поражение печени; выполнение минимального диагностического протокола (КТ или МРТ) не позднее чем за 14 дней до ТАХЭ; соблюдение сроков контрольных исследований: 8–9 недель, 16–17 недель после ТАХЭ.
Критерии исключения: отказ пациента от операции ТАХЭ; несоблюдение сроков контрольных обследований; предшествующее трансартериальное воздействие на печень в виде химиоинфузии, эмболизации печёночных артерий.
Пациенты включались в исследование с момента принятия решения о выполнении ТАХЭ.
Условия проведения
Операции трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами выполнялись в ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий» Федерального медико-биологического агентства России одним рентгенохирургом.
Диагностические исследования проводились в центрах системы ФМБА России, а также по месту жительства пациентов с дистанционным консультированием результатов одним рентгенологом.
Лечение пациентов до и после ТАХЭ выполнялось в ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий» Федерального медико-биологического агентства России, ФГБУ «Национальный медицинский исследовательский центр имени академика Е.Н. Мешалкина» Минздрава России, а также онкологических учреждениях по месту жительства пациентов.
Продолжительность исследования
Набор пациентов проводился в период с сентября 2017 по январь 2023 года, отслеживалась динамика по состоянию на 30.06.2023.
Описание медицинского вмешательства
Изначально всем пациентам планировалась одна процедура ТАХЭ. Повторные операции выполнялись пациентам, ответившим на терапию, при прогрессировании процесса.
Трансартериальная химиоэмболизация метастазов печени. Для насыщения микросфер подготавливали раствор иринотекана или доксо- рубицина (в зависимости от гистологического типа опухоли), количество которого рассчитывалось онкологом по формулам. В нашей работе использованы микросферы с рабочим размером после насыщения 200–400 мкм, микрокатетерная техника. Объём микросфер выбирался в зависимости от предполагаемой ёмкости сосудистого русла, ориентируясь на объём опухолевого поражения, рассчитанный по диагностическим методам.
Сначала выполняли аортографию, селективную ангиографию ветвей чревного ствола и верхней брыжеечной артерии, печёночных артерий. На этом этапе определялись источники афферентов опухоли. Вторым этапом производили суперселективную катетеризацию соответствующих сегментарных ветвей печёночных артерий и введение в них насыщенных цитостатиком микросфер. Обработку опухолевого поражения печени выполняли посегмен-тарно, осуществляли до достижения контрольной точки, что оценивалось с помощью артериографии.
Диагностические исследования. Базовый протокол КТ брюшной полости. Для ТАХЭ требуется КТ брюшной полости с болюсным внутривенным контрастированием йод-содержащим контрастным препаратом; сканирование должно быть выполнено в нативную, артериальную, венозную и отсроченную фазы контрастирования; толщина реконструируемого среза не более 2,5 мм, интервал между срезами не более 2,5 мм.
Базовый протокол МРТ гепатобилиарной зоны. Минимальные требования, предъявляемые к МРТ гепатобилиарной зоны, были следующие: МР-томограф не менее 1,5 Тесла; обязательные программы сканирования: T2-взвешенные изображения (ВИ) в аксиальной и коронарной проекциях, Т1-ВИ в аксиальной плоскости, диффузионно-взвешенная импульсная последовательность (ДВИ) в аксиальной плоскости с построением карт измеряемого коэффициента диффузии (ИКД); внутривенное контрастирование в артериальную, венозную и отсроченную фазы гадолиний-содержащим контрастным препаратом.
Постпроцессинговая обработка данных. На универсальной рабочей станции томографа AW Server 3.2 (GE Medical Systems, США) выполнялось измерение суммарного объёма опухолевых очагов с применением базовых методик автоматической сегментации. С помощью инструмента Auto Contour проводилось оконтуривание всех новообразований печени, их вырезание из окружающей ткани в качестве 3D-модели, с вычислением её суммарного объёма в см3.
Данные из других лечебных учреждений предварительно импортировались с электронного носителя на рабочую станцию томографа для постобработки.
Основной исход исследования
В ходе исследования оценивались «суррогатные» количественные конечные точки (суммарный объём опухоли и время без прогрессии по печени), на основании которых делались выводы об эффективности локорегионарной терапии. Показатели рассчитывались по данным КТ или МРТ, выполняемых в регламентированные исследованием сроки.
Этическая экспертиза
Протокол выполнения манипуляции одобрен этическим комитетом ФГБУ «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России (протокол 83-ДК-с-I от 23.06.2017) и утверждён на заседании учёного совета ФГБУ «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России (протокол № 5 от 12.12.2017).
Статистический анализ
Статистический анализ выполняли в среде разработки RStudio 2022.02.1 build 461 (Rstudio PBC) с помощью языка программирования R версии 4.2.0. Нормальность распределения количественных переменных проверяли с помощью критерия Шапиро–Уилка. Так как распределение переменных отличалось от нормального, в ходе анализа применяли непараметрические методы. Для количественных переменных рассчитывали медианы и квартили. Расчёт размера выборки не производился.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
У всех пациентов с опухолями печени показанием к трансартериальной химиоэмболизации было нерезектабельное поражение.
У пациентов группы 1 (n=65) были следующие варианты метастатического поражения: колоректальный рак (n=40; 62%), нейроэндокринный рак (n=10; 15%), аденокарциномы разных локализаций (n=15; 23%). У большинства пациентов (n=48; 74%) было множественное очаговое билобарное поражение печени, у 7 (11%) — множественные очаги в пределах одной доли печени, у 5 (7%) — единичные очаги в обеих долях печени, у 3 (5%) — единичный центральный очаг в одной доле печени, у 2 (3%) — инфильтративные зоны поражения. У 30 (46%) пациентов печень была единственным поражённым органом-мишенью, у 35 (54%) — в сочетании с метастатическим поражением костей, лёгких, лимфоузлов, селезёнки. У 42 (65%) пациентов первичный очаг был удалён, у 23 (35%) — не удалён.
Метастатическое поражение печени у 24 (37%) пациентов появилось сразу или в ближайшие месяцы с момента выявления первичного очага, у 41 (63%) — в период свыше 6 месяцев и до 5 лет.
В группе 2 первичные новообразования печени были представлены гепатоцеллюлярным раком ( n =8) и внутрипечёночной холангиокарциномой ( n =2). Во всех случаях в печени отмечались множественные узлы и/или сливные инфильтраты, вовлекающие обе ( n =7; 70%) или одну ( n =3; 30%) долю печени. Гепатоцеллюлярный рак у 5 пациентов развился на фоне цирроза печени, у 3 — в цирротически неизменённой печени. Внутрипечёночная холангиокарцинома развилась на неизменённой печени.
Основные результаты исследования
В группе 1 после двух контролей ТАХЭ (через 8–9 недель и 16–17 недель) 51 (79%) пациент ответил на лечение, 14 (21%) — не ответили.
Среди ответивших на лечение пациентов анализировалось изменение суммарного объёма опухолевой массы в печени при разных видах вторичного поражения (рис. 2). Во всех категориях опухолей отмечалось постепенное сокращение объёма новообразований в течение 16 недель после ТАХЭ, при этом у 5 (8%) пациентов к 8–16-й неделе отмечался полный регресс очагов (у 2 с колоректальным раком, у 2 с нейроэндокринным раком, у 1 с раком молочной железы).
В то же время отсутствие полного регресса очагов вовсе не означает слабого ответа на терапию, поскольку в 4 случаях была достигнута стабилизация на период от 1,5 до 4,5 лет; пациенты живы и наблюдение продолжается (рис. 3).



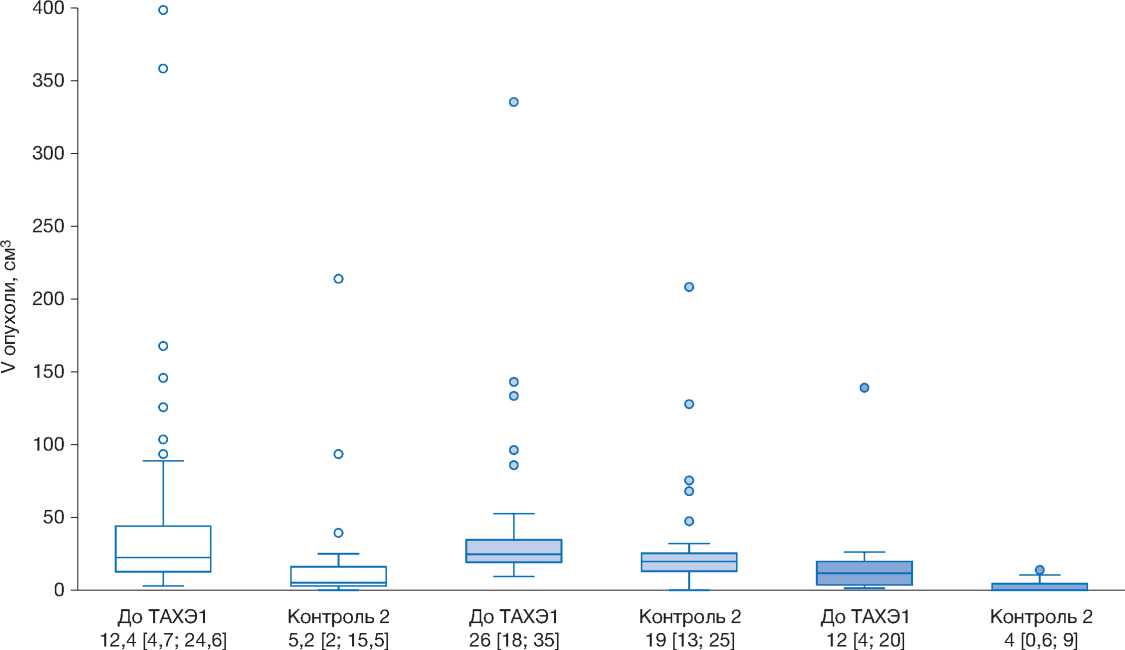
Колоректальный рак
Нейроэндокринный рак
Аденокарциномы разных локализаций
Me [LQ; UQ], см3
Рис. 2. Изменение суммарного объёма метастатического поражения печени (см3) при разных гистологических типах опухолей в группе 1.
Fig. 2. Change in the total volume of metastatic liver damage (cm3) with different histological types of tumors in Group 1.
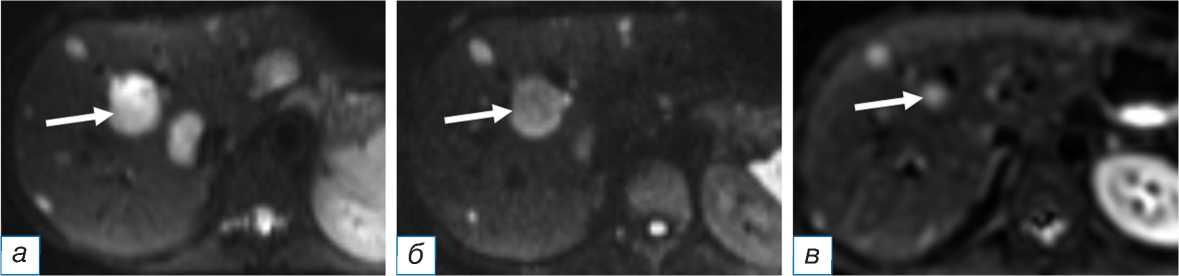
Рис. 3. Пациентка, 28 лет, нейроэндокринный рак тонкой кишки, первичный очаг не удалён: а — магнитно-резонансная томография в режиме ДВИ до трансартериальной химиоэмболизации демонстрирует множественное очаговое поражение печени (контрольный очаг обозначен стрелкой); б — через 16 недель после трансартериальной химиоэмболизации отмечается регресс части очагов, уменьшение в размерах контрольного очага (стрелка); в — через 4 года после повторной трансартериальной химиоэмболизации полного регресса очагов не достигнуто, контрольный очаг уменьшился на 80% (стрелка), прогрессирования нет.
Fig. 3. A 28-year-old female patient with neuroendocrine cancer of the small intestine, the primary focus has not been removed: Magnetic resonance imaging in the DW Iregime before transarterial chemoembolization ( а ) demonstrates multiple focal lesions of the liver (the control focus is indicated by an arrow); 16 weeks after transarterial chemoembolization ( б ), the regression of some of the foci, and a decrease in the size of the control lesion (arrow) are noted; 4 years after repeated transarterial chemoembolization ( в ), the complete regression of lesions had not been achieved, the control lesion decreased by 80% (arrow), there was no progression.
Среди ответивших на лечение пациентов группы 1 при прогрессировании процесса было выполнено 15 ТАХЭ2, 5 — ТАХЭ3, 2 — ТАХЭ4. При повторных операциях ТАХЭ отмечалось сокращение времени без прогрессии по печени в 2 раза
(с 303 [170; 369] до 180 [105; 225] дней ), что отражено на рис. 4.
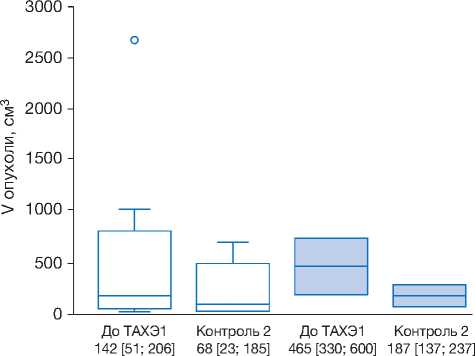
В группе 2 прогрессирования процесса не отмечалось ни у одного из пациентов, но и полного регресса тоже не было. Изменение суммарного объё- m" 400

ТАХЭ1 ТАХЭ повторные
303 [170; 369] 180 [105; 225]
Me [LQ; UQ], дни
Гепатоцеллюлярный рак Холангиокарцинома
Me [LQ; UQ], см3
Рис. 4. Динамика времени без прогрессии после первой и повторных трансартериальных химиоэмболизаций в группе 1.
Fig. 4. Dynamics of the time without progression after the first and repeated transarterial chemoembolization in Group 1.
ма новообразований при обоих видах первичных опухолей печени после ТАХЭ показано на рис. 5.
В группе 2 при прогрессировании процесса ТАХЭ2 была выполнена 4 пациентам, ТАХЭ3 — 1. При повторных операциях ТАХЭ, как и в группе 1, отмечалось сокращение времени без прогрессии по печени в 2 раза (с 266 [200; 367] до 120 [62; 215] дней), что отражено на рис. 6.
Нежелательные явления
После ТАХЭ отмечались явления постэмболизационного синдрома (тошнота, субфебрильная температура, боль в правом подреберье), потребовавшие симптоматической терапии и разрешившиеся у всех пациентов в течение 1–3 дней.
ОБСУЖДЕНИЕ
Внедрение методов локорегионарной терапии при нерезектабельных опухолях печени увеличивает продолжительность жизни пациентов. Так, включение ТАХЭ в схему лечения гепатоцеллюлярного рака увеличило общую выживаемость пациентов до 2,5 лет, а также показало другие возможные сферы применения этой методики (в частности, down-stage терапия) [14, 15]. Однако разнородность внутри группы локорегионарного лечения затрудняет понимание роли каждого метода в схеме терапии злокачественных поражений печени.
В представленной работе для лечения метастатических и первичных злокачественных ново-
Рис. 5. Изменение суммарного объёма первичных опухолей печени (см3) при разных гистологических типах в группе 2.
Fig. 5. Change in the total volume of primary liver tumors (cm3) with different histological types in Group 2.
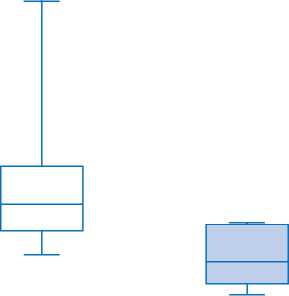
ТАХЭ1 ТАХЭ повторные
266 [200; 367]
120 [62; 215]
Me [LQ; UQ], дни
Рис. 6. Динамика времени без прогрессии после первой и повторных трансартериальных химиоэмболизаций в группе 2.
Fig. 6. Dynamics of the time without progression after the first and repeated transarterial chemoembolization in Group 2.
образований печени применялся единственный вариант — ТАХЭ лекарственно насыщаемыми микросферами. Набор пациентов в исследование проводился без привязки к какому-либо гистологическому типу опухоли, с исключением предварительного локорегионарного воздействия на печень, что позволило понять роль ТАХЭ в схеме лечения пациентов на разных стадиях процесса. При этом мы отметили, что в большинстве случаев не до-

кт ГА
стигается полного регресса очагов, однако это не следует рассматривать как отсутствие эффекта. Уменьшение общего объёма опухолевой нагрузки в печени, которое мы наблюдали в обеих группах пациентов, сочетается с довольно продолжительным временем без прогрессии по печени, что не может не сказаться на качестве жизни пациентов и эффективности лечения других локализаций опухолевого поражения.
Таким образом, ТАХЭ в качестве паллиативной терапии демонстрирует хорошие результаты. В то же время не следует предъявлять к методу завышенные требования — ТАХЭ не исключает прогрессирования опухолевого поражения. С другой стороны, по нашим данным, при повторных процедурах ТАХЭ демонстрирует не меньшую эффективность в уменьшении объёма опухолевой массы, при этом время без прогрессирования сокращается, что характерно для течения онкологического процесса в целом.
Ограничения исследования
Ограничением исследования являются его ретроспективный характер и отсутствие контрольной группы. В то же время эффективность ТАХЭ изучалась на гистологически гетерогенной группе больных, у которых в части случаев первичный очаг не был удалён, и прогноз выживаемости хуже, а некоторые из них уже перешагнули одно- и пятилетний порог выживаемости. Это даёт представление о возможностях метода на разных стадиях заболевания и в разных клинических ситуациях без привязки к гистологическому типу опухоли.
ЗАКЛЮЧЕНИЕ
Резюмируя вышесказанное, ТАХЭ является эффективным методом лечения первичных и метастатических опухолей печени. ТАХЭ прежде всего следует рассматривать как паллиативую терапию, которая, однако, позволяет добиться хорошего противоопухолевого ответа на разных стадиях онкологического заболевания.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Авторы заявляют об отсутствии финансирования проведённого ис- следования.
Список литературы Эффективность трансартериальной химиоэмболизации лекарственно насыщаемыми микросферами в лечении метастатических и первичных опухолей печени
- Долгушин Б.И., Косырев В.Ю. Радиочастотная термоаблация опухолей / под ред. М.И. Давыдова. Москва: Практическая медицина, 2015. 192 с. [Dolgushin BI, Kosyrev VYu. Radiofrequency thermal ablation of tumors. Ed. by M.I. Davydov. Moscow: Practical Medicine; 2015. 192 p. (In Russ).]
- Yoshino T, Cervantes A, Bando H, et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the diagnosis, treatment and follow-up of patients with metastatic colorectal cancer. ESMO Open. 2023;8(3):101558. doi: 10.1016/j.esmoop.2023.101558
- Рак печени (гепатоцеллюлярный). Клинические рекомендации. Ассоциация онкологов России, Междисциплинарное общество специалистов по опухолям печени, Общероссийская общественная организация «Российское общество клинической онкологии», Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов», 2022. [Liver cancer (hepatocellular). Clinical recommendations. Association of Oncologists of Russia, Interdisciplinary Society of Specialists in Liver Tumors, All-Russian Public Organization «Russian Society of Clinical Oncology», All-Russian Public Organization for the Promotion of Radiation Diagnostics and Therapy «Russian Society of Radiologists and Radiologists»; 2022. (In Russ).]
- Vogel A, Cervantes A, Chau I, et al. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018;29(4):238–255. doi: 10.1093/annonc/mdy
- Lucatelli P, Burrel M, Guiu B, et al. CIRSE standards of practice on hepatic transarterial chemoembolisation. Cardiovasc Intervent Radiol. 2021;44:1851–1867. doi: 10.1007/s00270-021-02968-1
- Van Cutsem E, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol. 2016;27(8):1386–422. doi: 10.1093/annonc/mdw235
- Лаптева М.Г., Сергеева О.Н., Шориков М.А., и др. МРТ-оценка эффективности трансартериальной химиоэмболизации печени у пациентов с метастазами нейроэндокринных опухолей // Онкологический журнал. 2019. Т. 2, № 3. С. 21–30. [Lapteva MG, Sergeeva ON, Sharikov MA, et al. MRI-evaluation of the effectiveness of transarterial chemoembolization of the liver in patients with neuroendocrine tumor metastases. Oncological J. 2019;2(3):21–30. (In Russ).]
- Schicho A, Pereira PL, Pützler M, et al. Degradable starch microspheres transcatheter arterial chemoembolization (DSMTACE) in intrahepatic cholangiocellular carcinoma (ICC): Results from a National multi-center study on safety and efficacy. Med Sci Monit. 2017;23:796–800. doi: 10.12659/msm.902901
- Vogl TJ, Marko C, Langenbach MC, Naguib N. Transarterial chemoembolization of colorectal cancer liver metastasis: Improved tumor response by DSM-TACE versus conventional TACE, a prospective, randomized, single-center trial. Eur Radiol. 2021;31(4):2242–2251. doi: 10.1007/s00330-020-07253-2
- Pavel M, Baudin E, Couvelard A, et al. ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2012;95:157–176. doi: 10.1159/000335597
- Fjallskog ML, Janson ET, Falkmer UG, et al. Treatment with combined streptozotocin and liposomal doxorubicin in metastatic endocrine pancreatic tumors. Neuroendocrinology. 2008;88:53–58. doi: 10.1159/000117575
- Wang M, Zhang J, Ji S, et al. Transarterial chemoembolization for breast cancer with liver metastasis: A systematic review. Breast. 2017;36:25–30. doi: 10.1016/j.breast.2017.09.001
- De Baere T, Plotkin S, Yu R, et al. An in vitro evaluation of four types of drug-eluting microspheres loaded with doxorubicin. J Vasc Interv Radiol. 2016;27(9):1425–1431. doi: 10.1016/j.jvir.2016.05.015
- Kennoki N, Saguchi T, Sano T, et al. Long-term histopathologic follow-up of a spherical embolic agent; observation of the transvascular migration of HepaSphere TM. BJR Case Rep. 2019;5(1):20180066. doi: 10.1259/bjrcr.20180066
- Котив Б.Н., Дзидзава И.И., Алентьев С.А., Смородский А.В. Комплексное лечение при гепатоцеллюлярном раке на ранней (BCLC-A) и промежуточной (BCLC-В) стадии // Анналы хирургической гепатологии. 2020. Т. 25, № 2. С. 55–66. [Kotiv BN, Dzidzava II, Alentyev SA, Smorodsky AV. Complex treatment for hepatocellular cancer at an early (BCLCA) and intermediate (BCLC-B) stage. Ann Surg Hepatol. 2020;25(2): 55–66. (In Russ).] doi: 10.16931/1995-5464.2020255-66


