Эффективность водорастворимой формы гиперицина при радиационном воздействии на Drosophila melanogaster
Автор: Юшкова Елена Александровна, Старцева Ольга Александровна, Зайнуллин Владимир Габдуллович, Рочева Лилия Кирилловна, Пунегов Василий Витальевич, Зайнуллин Геннадий Габдуллович, Боднарь Ирина Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 5-5 т.16, 2014 года.
Бесплатный доступ
Оценена биологическая активность и радиомодифицирующие свойства водорастворимой формы гиперицина на примере Drosophila melanogaster. Показано, что введение в диету хронически облученных (3,5 мГр/ч) дрозофил тестируемого препарата вызывает неоднозначные, зависящие от концентрации вещества, временных характеристик влияния каждого из факторов и генотипических особенностей животных, ответные реакции (по уровню плодовитости, выживаемости и частоте повреждений ДНК). В условиях совместного влияния облучения и гиперицина выход разрывов ДНК в клетках как линии дикого типа Oregon-R (при концентрации препарата 10 и 100 мкМ), так и линии Sod Delta02/+ (при концентрациях, не превышающих 100 мкМ) достоверно ниже уровня, индуцированного раздельным их действием. По показателям жизнеспособности наблюдали лишь единичные достоверные изменения в ответ на взаимодействие изучаемых агентов. Представленные данные свидетельствуют, что гиперицин обладает антиоксидантным действием в клетках облученных особей, имеющих нарушения в продукции Mn-содержащей супероксиддисмутазы.
Дрозофила, ионизирующее излучение, водорастворимая форма гиперицина, уровень повреждений днк, выживаемость, митохондриальная супероксиддисмутаза (mnsod)
Короткий адрес: https://sciup.org/148203469
IDR: 148203469 | УДК: 575.167:57.04/57.017.3
Текст научной статьи Эффективность водорастворимой формы гиперицина при радиационном воздействии на Drosophila melanogaster
Однако современные препараты, содержащие гиперицин, малоэффективны вследствие низкой растворимости пигмента, эффективность которого увеличивается только в комбинации с другими химическими агентами (токсическими растворителями, водно-маслянными эмульсиями). Отметим, что на сегодняшний день нет данных о модифицирующих свойствах гиперицина по отношению к действию облучения.
Новый, исследуемый нами, экспериментальный образец гиперицина, выделенный из надземной массы зверобоя, был переведен в гидрофильную форму путем иммобилизации его на наночастицах неорганической матрицы.
В настоящем исследовании мы изучили эффективность экспериментального образца гиперицина в модификации эффектов хронического облучения у дрозофилы, принимая во внимание возможность его роли в системе антиоксидантной защиты, участвующей в снижении уровня повреждений ДНК [5].
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали дрозофил дикого типа (линия Oregon-R) и особей (линия SodDelta02/+) с мутацией гена митохондриальной Mn-супероксиддисмутазы, участвующей в работе антиоксидантной системы защиты [10]. Исследуемые генотипы развивались на питательной сахаро-агаровой дрожжевой среде, обработанной растворами гиперицина в разных концентрациях (1, 10, 20 и 100 мкМ). Время экспозиции гиперицина для всех выбранных концентраций зависело от анализируемого показателя и составило 5 (для оценки параметров предимагинальной выживаемости и частоты ДНК-разрывов в нейробластах личинок) и 6 (для оценки репродуктивного показателя) суток. Одновременно проводили хроническое облучение при мощности экспозиционной дозы 3,5 мГр/ч. Источником г-излучения служил 226Ra (56 мГр/ч). Все варианты содержали в одинаковых условиях: при температуре 25 ± 1 °С, 12-ти часовом режиме освещения.
Анализ эффективности гиперицина у облученных дрозофил определяли по уровню плодовитости, предимагинальной выживаемости и частоте цитогенетических нарушений (ДНК-разрывов), оцениваемый методом «ДНК-комет» в нейтральной версии рН [5]. Выживаемость, плодовитость дрозофил оценивали с применением стандартных методик [4, 8]. Совместное влияние гиперицина и облучения оценивали по коэффициенту взаимодействия K w , который определяется как отношение инкремента ответной реакции организма на одновременное воздействие факторов к сумме инкрементов эффектов при их раздельном действии [1].
Статистический анализ данных проводили с использованием программы Statistica (версия 7.0.61.0, StatSoft, Inc., США, лицензия № 3145689012). Нормальность распределения показателей оценивали по Колмогорову-
Смирнову. Статистическую значимость различий показателей определяли с использованием процедуры ANOVA.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно [5], что водорастворимая форма гиперицина имеет высокую биологическую эффективность и обладает антиоксидантной активностью, осуществляемая преимущественно через MnSod-активацию. Эти сведения легли в основу исследования действия гиперицина по отношению к облучению на мутантах дрозофилы, характеризующихся сниженным уровнем синтеза Mn-супероксиддисмутазы. Экспериментальные данные показывают (рис.), что гидрофильная форма гиперицина практически при любой концентрации оказывает токсическое действие на интактные соматические клетки изучаемых генотипов D. melanogaster . В нейробластах особей линии дикого типа Oregon-R достоверное увеличение разрывов ДНК наблюдали при обработке препаратом во всех концентрациях (кроме 20 мкМ) и в клетках мутантной линии Sod Delta0 2/+ – только в концентрациях, не превышающих 20 мкМ. При этих же дозах гиперицина уровень предимаги-нальной выживаемости (табл. 2) и плодовитости (табл. 1) необлученных особей либо не имел достоверно значимых отличий от контрольных величин, либо был повышен примерно в 1,5-2 раза.
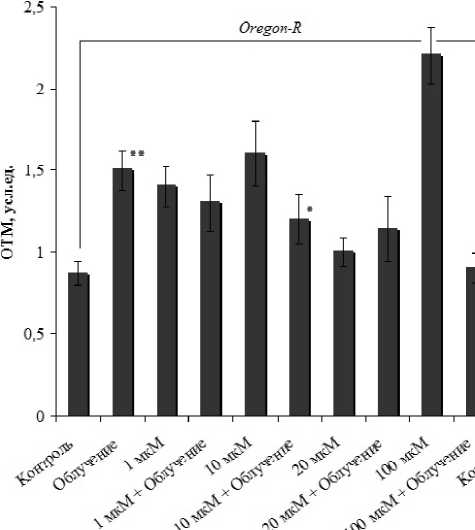
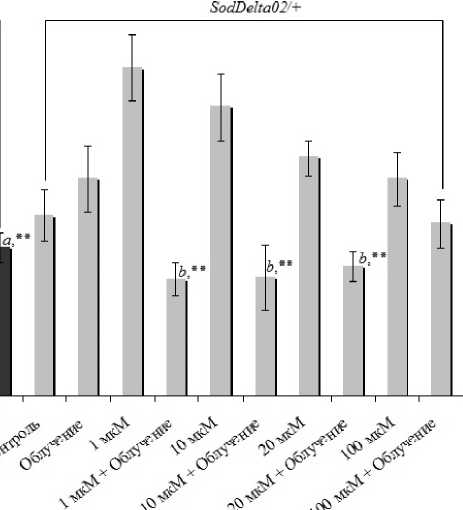
Условия эксперимента
Рис. Уровень повреждений ДНК в нейробластах дрозофилы в контроле и при совместном/раздельном воздействии гиперицина и облучения.
Примечание: *р < 0,05, ** р < 0,001 по сравнению с соответствующим контролем и ар < 0,05, bр < 0,01 – относительно облученного варианта (0 мкМ).
При облучении биологическая эффективность гиперицина сильно отличается от его действия без физического фактора и зависит от концентрации. В результате цитогенетического анализа выявлено, что снижение радиационно-индуцированных в нейробластах ДНК-нарушений по сравнению с собственным контролем и облученным вариантом (без обработки гиперицином), а также с таковыми вариантами линии дикого типа Oregon-R отмечается при введении в диету дрозофил линии SodDelta02/+ гиперицина в низких (1 мкМ) и медианных концентрациях (10-20 мкМ). По показателям жизнеспособности, оценивающие реакции животных на уровне организма, согласно дисперсионному анализу наблюдали лишь единичные достоверные изменения в ответ на совместное действие облучения и гиперицина. При этом взаимодействие химического и радиационного факторов выявлено преимущественно у особей, имеющих низкий уровень эндоген- ных антиоксидантов (SodDelta02/+). По сравнению с облученным вариантом (0 мкм) у особей, в диету которых входило 10 мкМ гиперицина, репродуктивный потенциал в условиях хронического облучения был достоверно (р < 0,05) выше примерно в 1,7 раза (табл. 1). В то время как при той же концентрации гиперицина выживаемость животных, находящихся на ранних стадиях индивидуального развития, была снижена в 1,4 раза (табл. 2). Исходя из этих данных, помимо антиоксидантных свойств, в механизмах радиомодифицирующего действия гиперицина, по-видимому, определенную роль может играть его влияние на пролиферативную и функциональную активность эмбриональных клеток. Отметим, что именно на ранних стадиях развития клетки дрозофил испытывают массовую пролиферацию и дифференциацию, что обусловливает их повышенную радиочувствительность [2, 3].
Таблица 1. Плодовитость (кол-во эмбрионов на самку) после воздействия гиперицина и хронического облучения при мощности 3.5 мГр/ч (накопленная доза за 12 дней составила 1 Гр).
|
Концентрация, мкМ |
Линия |
|||
|
Oregon-R |
Sod Delta02 /+ |
|||
|
Контроль |
Облучение |
Контроль |
Облучение |
|
|
0 |
21.5 ± 3.0 |
32.5 ± 1.6* |
18.7 ± 0.9 |
12.4 ± 0.7* |
|
1 |
27.9 ± 2.2 |
39.8 ± 1.9* |
18.0 ± 1.3 |
11.6 ± 1.1* |
|
10 |
21.9 ± 1.9 |
34.7 ± 1.7* |
25.4 ± 1.5 а |
20.5 ± 0.9 с |
|
20 |
40.7 ± 4.7 b |
30.8 ± 3.2 |
20.1 ± 1.5 |
15.7 ±1.4* |
|
100 |
20.0 ± 2.3 |
33.3 ± 1.0* |
23.4 ± 1.4 |
12.0 ± 1.0* |
Отличия достоверны от контроля при ар < 0.05; b ,* р < 0.01 и облученного варианта (0 мкМ) – при ср < 0.05.
Таблица 2. Предимагинальная выживаемость особей (%) после воздействия гиперицина и хронического облучения при мощности 3,5 мГр/ч (накопленная доза за 10 дней составила 0.84 Гр).
|
Концентрация, мкМ |
Линия |
|||
|
Oregon-R |
Sod Delta02 /+ |
|||
|
Контроль |
Облучение |
Контроль |
Облучение |
|
|
0 |
82.2 ± 6.4 |
93.8 ± 1.7 |
47.4 ± 2.7 |
76.3 ± 5.6** |
|
1 |
86.4 ± 3.4 |
82.6 ± 3.5 |
61.6 ± 5.4 а |
70.6 ± 7.7 |
|
10 |
74.3 ± 4.4 |
92.2 ± 2.0** |
45.5 ± 3.9 |
55.4 ± 7.5 с |
|
20 |
87.4 ± 3.8 |
91.3 ± 4.2 |
38.2 ± 1.6 |
86.5 ±2.8** |
|
100 |
84.2 ± 6.6 |
97.0 ± 1.0* |
50.1 ± 3.1 |
66.6 ± 8.2* |
Отличия достоверны от контроля при а, * р < 0.05; ** р < 0.01 и облученного варианта (0 мкМ) – при ср < 0.05.
Оцениваемый на основе коэффициента взаимодействия (Kw) биологический эффект совместного действия гиперицина и облучения носит преимущественно антогонистический характер как для частоты повреждений ДНК, так и для изменения предимагинальной выживаемости особей обеих линий дрозофилы практически для всех выбранных концентраций водорастворимой формы вещества (табл. 3). Для репродуктивного показателя антогонистический эффект наблюдали лишь в одном варианте (при концентрации 20 мкМ) совместного действия факторов. Оказалось, Delta02
в отличие от мутантного генотипа (Sod /+) значительно меньшее влияние на плодовитость дрозофил линии Oregon-R оказывает гиперицин и эффект его взаимодействия с облучением. Это подтверждается результатами, свидетельствующими о том, что для всех концентраций, кроме 20 мкМ, значения Kw близки к единице. На частоту фрагментации ДНК достоверное влияние оказы- вают оба фактора, при этом относительный вклад химического воздействия в их индукцию выше. В условиях совместного действия изучаемых агентов выход разрывов ДНК достоверно ниже уровня, индуцированного раздельным их действием.
Для некоторых изученных вариантов совместного действия факторов по показателям «плодовитости» и «выживаемости» может наблюдаться синергический тип взаимодействия указанных агентов. Для линии дикого типа Oregon-R достоверно значимый синергический эффект зарегистрирован при сочетанном влиянии облучения и гиперицина только в концентрации 10 мкМ, и только по параметру предимагинальной выживаемости. Для мутантной линии SodDelta02/+ высокие значения Kw (р < 0,001) обнаружены при комбинации радиационного воздействия и гиперицина в следующих концентрациях: 10 и 100 мкМ – по репродуктивному показателю и 20 мкМ – по изменению выживаемости особей, находящихся на ранних стадиях онтогенеза. Следовательно, для достижения синергического эффекта необходимо одновременное увеличение времени воздействия обоих действующих агентов. Отметим, что к моменту анализа репродуктивной спо- собности для облученных особей накопленная доза за 12 суток составила 1 Гр, при этом обработка гиперицином длилась 6 дней. При оценке уровня предимагинальной выживаемости время экспозиции гиперицина было таким же, как и при определении плодовитости, однако облучение проводили на протяжении 10 дней (накопленная доза 0,84 Гр). В цитогенетическом исследовании использовали особей, испытывающих химическое и радиационное воздействие в течение 5 дней, в этом случае накопленная доза составила 0,42 Гр, что примерно в два раза ниже накопленных доз облучения для вышеуказанных показателей. Считают [9, 11, 13], что основными механизмами формирования синергических эффектов при комбинированном действии химического и радиационного факторов являются: совместное взаимодействие повреждений ДНК и мембран; снижение эффективности работы восстановительных систем за счет химической модификации и конформационных преобразований биомолекул, участвующих в синтезе ферментов репарации; стимуляция митотической активности и сокращения времени для восстановления ДНК-нарушений.
Таблица 3. Значения коэффициентов взаимодействия при совместном действии гиперицина и г-излучения мощностью 3,5 мГр/ч.
|
Концентрация гиперицина, мкМ |
Коэффициент взаимодействия |
|||||
|
Повреждения ДНК, усл. ед. |
Репродуктивный показатель, кол-во эмбрионов/самку |
Предимагинальная выживаемость, % |
||||
|
Линия Ore-gon-R |
Линия Sod- Delta0 2 /+ |
Линия Oregon-R |
Линия Sod Delta0 2 /+ |
Линия Ore-gon-R |
Линия Sod Delta0 2 /+ |
|
|
1 |
٭٭ 0.38 |
٭٭ 0.36- |
1.05 |
1.01 |
٭٭ 0.02 |
٭٭ 0.54 |
|
10 |
٭٭ 0.24 |
٭ 0.45- |
1.16 |
٭٭ 4.50 |
٭٭ 2.70 |
٭٭ 0.29 |
|
20 |
٭٭ 0.35 |
٭ 0.58- |
٭٭ 0.31 |
٭ 0.61 |
٭ 0.54 |
٭٭ 1.98 |
|
100 |
٭٭ 0.01 |
٭٭ 0.14- |
1.24 |
٭٭ 4.20 |
1.08 |
٭ 0.61 |
٭٭ ٭
Нелинейные эффекты достоверны: р < 0.01; р < 0.001.
Представленные в работе данные достаточно убедительно показывают, что в низких и медианных концентрациях гиперицин обладает антиоксидантным действием в условиях длительного облучения. Возможно, указанный эффект связан с его способностью улавливать свободные радикалы и образовывать менее токсичные соединения в клетках с нарушенной антиоксидантной системой защиты.
Таким образом, результаты биологической активности гиперицина при радиационном воздействии дрозофил показывают, что степень выраженности радиомодифицирующего эффекта препарата существенно зависит от его концентрации, временных характеристик влияния каждого из факторов и генетических особенностей организма. Изменение хотя бы одного из параметров может привести к значимому изменению ответной реакции животных. В основе наблюдаемых радиомодифицирующих свойств гиперицина лежит его влияние на эффективность восстанови- тельных систем клетки и развитие неспецифических реакций, индуцируемых облучением.
Работа выполнена при финансовой поддержке гранта Уральского отделения РАН (№ 12-П-34-2009).
Список литературы Эффективность водорастворимой формы гиперицина при радиационном воздействии на Drosophila melanogaster
- Евсеева Т.И. Сочетанное действие факторов радиационной и нерадиационной природы на традисканцию/Т.И. Евсеева, С.А. Гераськин. Екатеринбург: УрО РАН, 2001. С. 45-53.
- Зайнуллин В.Г. Современные аспекты радиобиологии Drosophila melanogaster/В.Г. Зайнуллин, М.В. Шапошников, А.А. Москалев, А.И. Таскаев. Екатеринбург. УрО РАН, 2001. 101 с.
- Левин В.Л. Новые данные о детерминации клеток в развитии дрозофилы/В.Л. Левин, П.Я. Шварцман//Цитология. 1980. Т. 22, № 11. С. 1259-1283.
- Моссэ И.Б. Радиация и наследственность: Генетические аспекты противорадиационной защиты. Мн.: Университетское, 1990. С. 103-111.
- Юшкова Е.А. Цитогенетические эффекты водорастворимой формы гиперицина у дефицитных по антиоксидантной защите особей Drosophila melanogaster/Е.А. Юшкова, В.Г. Зайнуллин, В.В. Пунегов, Г.Г. Зайнуллин//Изв. Самар. НЦ РАН. 2013. Т. 15, № 3 (1). С. 575-578.
- Экологическая и космическая генетика. Селекция/. Т. 3. М.: Наука, 2001. 437 с.
- Agostinis P. Hypericin in cancer treatment: more light on the way/P. Agostinis, A. Vantieghem, W. Merlevede, P.A.de Witte//Int. J. Biochim. Cell Biol. 2002. Vol. 34, № 3. P. 221-241.
- Ashburner M. Drosophila: A laboratory handbook. Cold. Spr. Harb. Lab. Press., 1989. 1331 p.
- Brekke O.-L. Butylated hydroxyanisole inhibits tumor necrosis factor-induced cytotoxicity and arachidonic acid release/O.-L. Brekke, T. Espevik, K.S. Bjerve//Lipids. 1994. Vol. 29. P. 91-102.
- Flybase/A database of Drosophila genes & genomes. Revision 3. , 2003. URL: http://flybase.bio.indiana.edu./
- Kolman A. Combined effects of г-radiation and ethylene oxide in human diploid fibroblast/A. Kolman, M. Chovanec//Mutagenesis. 2000. Vol. 12, № 2. P. 99-104.
- Mennini T. The antidepressant mechanism of Hipericum perforatum/T. Mennini, M. Gobbi//Life Sci. 2004. Vol. 75, № 9. P. 1021-1027.
- Mьller W.-U. Time factors in combined exposures of mouse embryos to radiation and mercury/W.-U. Mьller, C. Streffer//Radiat. Environmen. Biophys. 1988. Vol. 27, № 2 P. 115-121.
- Saddiqe Z. A review of the antibacterial activity of Hipericum perforatum L./Z. Saddiqe, I. Naeem, A. Maimoona//J. Ethnopharmacol. 2010. Vol. 131, № 3. Р. 511-521.


