Эколого-физиологический мониторинг прибрежных экосистем Каспийского моря: состояние ихтиофауны Сиязаньского региона
Автор: Юсифова С.Л., Мамедова Г.Р., Палатников Г.М.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Естественные науки
Статья в выпуске: 8 т.11, 2025 года.
Бесплатный доступ
Представлены результаты морского мониторинга, проведенного в Сиязаньской прибрежной зоне Азербайджанского сектора Каспийского моря. В рамках исследования осуществлен генотоксический анализ эритроцитов периферической крови и гистологическое исследование жабр и печени выловленных рыб. Генотоксическое исследование эритроцитов выявило ряд морфологических аберраций, включая микроядра, деформацию ядер, их атипичное внутриклеточное смещение и изменение нормальной формы эритроцитов, но выявленные показатели генотоксических нарушений находились в пределах референсных значений. Гистологический анализ жабр продемонстрировал такие изменения, как гиперплазия и искривление вторичных ламелл, адгезии и сращение апикальных участков вторичных ламелл. Результаты гистопатологического исследования печени исследованных видов рыб выявили такие альтерации как гипертрофия гепатоцитов, дилатация синусоидов, венозный застой и скопления меланомакрофагов. Обнаруженные изменения в эритроцитах крови и гистологические сдвиги в жабрах и печени исследованных рыб могут быть интерпретированы как реакции защитно-приспособительного характера, отражающие воздействие факторов среды обитания.
Сиязаньская прибрежная зона, рыбы, генотоксичность, жабры, печень
Короткий адрес: https://sciup.org/14133498
IDR: 14133498 | УДК: 597:504.4.054 | DOI: 10.33619/2414-2948/117/15
Текст научной статьи Эколого-физиологический мониторинг прибрежных экосистем Каспийского моря: состояние ихтиофауны Сиязаньского региона
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №8 2025
UDC 597:504.4.054
Последнее столетие ознаменовалось широким размахом деятельности человека во всех сферах экономики, что повлекло за собой глубокое и повсеместное ухудшение состояния окружающей среды и привело к критическому истощению природных ресурсов, в числе которых находится Каспийское море [1].
Этот крупнейший в мире континентальный водоем подвержен целому спектру серьезных экологических проблем. Однако среди всех негативных факторов, включая изменение уровня моря и потерю биоразнообразия, ключевой и доминирующей угрозой его экосистеме является загрязнение [2].
Активизация шельфовых работ, связанных с разведкой и добычей нефти и газа, несомненно играет значимую роль в контаминации [3].
Существенный вклад в увеличение токсикологической нагрузки вносят промышленные стоки предприятий химической и нефтехимической отраслей, а также диффузное загрязнение, обусловленное неконтролируемым применением агрохимикатов (удобрений и пестицидов) в сельскохозяйственном производстве [4].
Данная проблема приобретает особую актуальность для прибрежных территорий Азербайджана, характеризующихся высокой плотностью населения и развитой рекреационной инфраструктурой, включающей жилые массивы, санаторно-курортные комплексы, сезонные жилые постройки, детские оздоровительные учреждения и пляжные зоны [5].
Эксплуатация водных биологических ресурсов (гидробионтов) и рекреационное использование акватории местным населением и прибывающими туристами создает прямые пути экспозиции, что неизбежно приводит к потенциальному воздействию загрязнения морской среды на здоровье человека [6].
Внедрение очистных сооружений способствовало некоторому снижению концентраций ряда загрязняющих веществ. Тем не менее, динамическая нестабильность экологической обстановки в Каспийском море подчеркивает острую необходимость в проведении регулярных, систематических исследовательских экспедиций в его прибрежные зоны [7].
В контексте сложившейся экологической обстановки, Министерством экологии и природных ресурсов Азербайджанской Республики реализуется программа систематического мониторинга состояния морской среды Каспийского моря. В мае 2021 года в рамках реализации стратегии экологического мониторинга был проведен целенаправленный анализ различных участков прибрежной зоны Каспийского моря , включая Сиязаньский район. Основная цель исследования заключалась в оценке текущего экологического состояния водной среды с использованием биоиндикации на основе изучения здоровья рыб. Следует отметить, что рыбы широко используются в качестве биоиндикаторов в токсикологических исследованиях. Это обусловлено их высокой чувствительностью к изменениям параметров окружающей среды, что позволяет эффективно отслеживать загрязнение и другие стрессовые факторы [8].
Реализация поставленных задач осуществлялась посредством применения комплекса современных методов, направленных на генотоксикологическую и гистопатологическую оценку состояния различных тканей рыб. Генотоксический анализ, часто используемый в мониторингах, включает оценку ядерных аберраций в качестве достоверных маркеров цитотоксических эффектов [9].
Гистопатологические изменения в органах-мишенях, в частности в жабрах и печени, выполняющих у рыб функции дыхания и детоксикации ксенобиотиков, являются общепризнанными биомаркерами в программах мониторинга состояния окружающей среды
Материал и методы исследования
-
1. Сбор биологического материала. В ходе морского мониторинга Сиязаньской прибрежной зоны Каспийского моря был осуществлен траловый отлов рыб. Всего было отловлено 46 особей рыб. Видовой состав и количество отловленных особей был следующим: 12 особей кефали ( Liza saliens ), 13 особей бычка ( Neogobius fluvialitis ), 10 особей каспийской воблы ( Rutilus rutilus caspicus ) и 11 особей каспийского пузанка ( Alosa caspia caspia ). Все протоколы обращения с животными проводились в соответствии с Европейской директивой 2010/63/EU и были одобрены местным этическим комитетом.
-
2. Отбор и первичная фиксация образцов. Сразу после отлова рыба помещалась в резервуары с водным раствором MS-222 (трикаин метасульфонат, Sigma-Aldrich) для анестезии. Для проведения генотоксического анализа осуществлялся забор крови из каудальной вены. С целью предотвращения коагуляции крови использовались гепаринизированные инъекционные шприцы с иглами. Полученные мазки крови высушивались на воздухе при комнатной температуре и фиксировались в абсолютном метаноле. Для последующего гистологического исследования были отобраны жабры со второй жаберной дуги, а также образцы печени. Извлеченные образцы жабр и печени незамедлительно фиксировались в 4%-ном растворе нейтрального забуференного формалина (phosphate-buffered formalin).
-
3. Транспортировка образцов. Подготовленные мазки крови и фиксированные образцы жабр и печени транспортировались в лабораторию Института физиологии для последующей обработки и исследования.
-
4. Методы генотоксического исследования крови. Мазки крови окрашивались по Романовскому-Гимза с использованием набора реагентов производства Sigma. Оценка цитопатологических изменений ядер эритроцитов проводилась методом световой микроскопии с применением иммерсионной оптики при общем увеличении ×1200 (объектив ×100, окуляр ×12). Частоту встречаемости клеток с патологическими ядрами (ПЯ) рассчитывали по следующей формуле: ПЯ = n/N × 100%, где n — количество клеток с патологическими ядрами, N — общее количество подсчитанных клеток (1000 клеток на каждом слайде). Фотодокументирование осуществлялось при помощи цифровой микроскопической камеры Motic.
-
5. Методы гистологического исследования тканей. Для выполнения гистологического исследования фиксированные образцы жабр и печени подвергались стандартной процедуре гистологической проводки, включающей последовательную дегидратацию в спиртах возрастающей концентрации и последующую заливку в парафин. С помощью санного микротома были изготовлены серийные гистологические срезы толщиной 7 мкм. Депарафинизация срезов осуществлялась путем последовательной инкубации в ксилоле и растворах этанола убывающей концентрации. Полученные срезы были окрашены
гематоксилином и эозином и заключены под покровное стекло с использованием монтирующей среды Canadian balsam [11].
Микроскопическое исследование гистологических препаратов проводилось на световом микроскопе NU-2 (Karl Zeiss, Jena) с последующим фотодокументированием изображений с использованием цифровой камеры Motic.
Результаты и обсуждение
При микроскопии препаратов крови исследованных рыб были обнаружены различные генотоксические сдвиги. В частности, фиксировалось наличие микроядер в отдельных клетках, деформация ядер, их атипичное смещение в клетке, изменение нормальной формы эритроцитов. Количественное содержание выявленных патологий находилось в диапазоне от 1,52% до 2,6% (Таблица).
Таблица
ПРОЦЕНТНОЕ СОДЕРЖАНИЕ ПАТОЛОГИЧЕСКИХ КЛЕТОК В ЭРИТРОЦИТАХ РЫБ
|
Виды рыб |
Процентное содержание патологических ядер в эритроцитах крови рыб (на 1000 эритроцитов) |
|
Кефаль ( Liza saliens) |
1.65 ± 0.13 |
|
Бычок ( Neogobius fluvialitis) |
2.05 ± 0.63 |
|
Вобла ( Rutilus rutilus caspicus) |
2.31 ± 0.32 |
|
Пузанок ( Alosa caspia caspia) |
1.84 ± 0.17 |
Результаты гистопатологического анализа жаберного аппарата исследованных видов рыб выявили ряд морфологических изменений, свидетельствующих о воздействии факторов окружающей среды.
У особей кефали наряду с нормальной организацией жабр, были зарегистрированы такие отклонения, как гиперплазия дыхательного эпителия, искривление вторичных лепестков, а также их сращение (Рисунок 1).
При анализе жабр особей бычка-песочника были обнаружены выраженное утолщение и гиперплазия вторичных ламелл, отслоение дыхательного эпителия, а также искривление и отек вторичных ламелл (Рисунок 2).
Следует отметить, что в ряде случаев значительная гиперплазия дыхательного эпителия приводила к сращению (слипанию) соседних жаберных ламелл, нарушая нормальную респираторную поверхность. Гистопатологическое исследование жабр каспийской воблы также выявило ряд характерных изменений, включая искривление и отек вторичных ламелл, отслоение дыхательного эпителия, а также специфическое сращение апикальных участков ламелл по одной линии (Рисунок 3).
У особей пузанка были зафиксированы отслоение дыхательного эпителия у основания первичных ламелл, сращение апикальных участков вторичных ламелл, а также искривление и отек (Рисунок 4).
Гистопатологический анализ печени рыб выявил ряд морфологических изменений сходной по степени выраженности. У всех четырёх видов рыб были отмечены в основном увеличение размеров гепатоцитов, скопление макрофагов в паренхиме печени, расширение синусоидов и застойные явления в кровяных сосудах (Рисунок 5, 6).
В ходе микроскопического анализа препаратов мазков крови рыб, отловленных в акватории района Сиязань, был выявлен ряд морфологических аномалий эритроцитов. Спектр наблюдаемых изменений включал наличие микроядер, деформацию ядер, атипичное их смещение в клетке, а также альтерации формы эритроцитов. В то же время, суммарная частота встречаемости всех зарегистрированных патологий во всех исследованных образцах не превышала установленного порогового значения нормы в 5%.
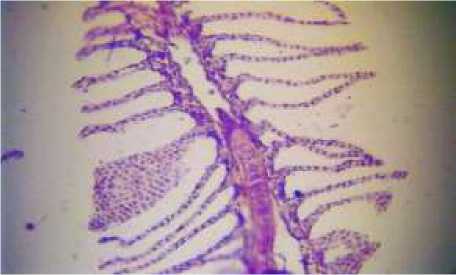
Рисунок 1. Жабры кефали. Неравномерная гиперплазия респираторного эпителия, искривление и сращение апикальных участков вторичных ламелл (Х200)
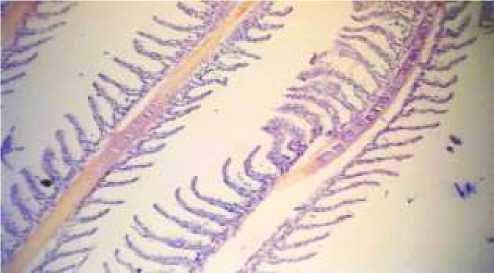
Рисунок 2. Жабры бычка. Утолщение и гиперплазия вторичных ламелл (Х200)
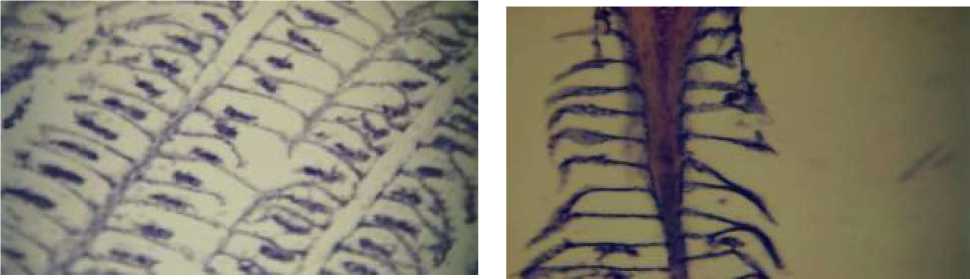
Рисунок 3. Жабры воблы. Отслоение респираторного эпителия и слияние апикальных участков вторичных ламелл в одну линию (Х400)
Рисунок 4. Жабры пузанка. Сращение апикальных участков вторичных ламелл, искривление вторичных ламелл, отёки (Х200)
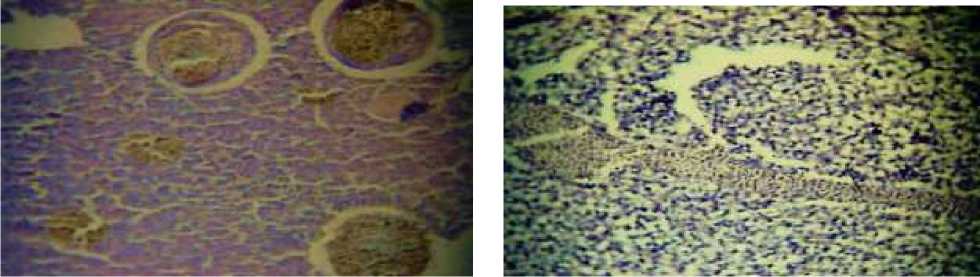
Рисунок 5. Меланомакрофаговые центры и расширение синусоидов (x400)
Рисунок 6. Гипертрофия гепатоцитов и стагнация крови в сосудах печени (x400)
Параллельно проведенное комплексное гистопатологическое исследование жабр и печени у тех же рыб продемонстрировало наличие морфологических изменений в тканях обоих органов. Установлено, что выявленные патологические изменения носят преимущественно сходный, однотипный характер как в жабрах, так и в печени исследованных особей.
Спектр обнаруженных изменений в жабрах включал отслоение и гиперплазию дыхательного эпителия, искривление и сращение вторичных ламелл, отёки. Наиболее часто встречаемыми и выраженными патологическими изменениями в жабрах являлись отслоение эпителия и гиперплазия вторичных ламелл. Известно, что данные патологии приводят к увеличению диффузионного барьера между кровеносным руслом и водной средой, что потенциально затрудняет процессы газообмена в респираторном эпителии. Аналогичные функциональные последствия могут возникать вследствие слияния смежных ламелл и адгезии апикальных участков вторичных ламелл, что приводит к уменьшению дыхательной поверхности вторичных ламелл, и, следовательно, к затруднению дыхания рыб [12].
Отек является частью воспалительной реакции на повреждение тканей, вызванное стрессором. Хотя отек может временно снижать поступление вредных веществ, он также нарушает нормальный газообмен и ионный баланс. На ранних стадиях оно может способствовать изоляции поврежденной области и запуску процессов восстановления. Тот факт, что выявленные изменения классифицируются как патологии I степени, предполагает их потенциальную обратимость при оптимизации условий окружающей среды [13].
В печени были зафиксированы такие изменения, как гипертрофия гепатоцитов, стагнация крови в кровяных сосудах, расширение синусоидов, мелано-макрофагальные центры. Расширение просвета печеночных синусоидов и венозный застой может указывать на нарушение микроциркуляции, что является следствием воздействия загрязняющих веществ [14].
Меланомакрофаги представляют собой клетки иммунной системы, скопление которых может свидетельствовать об иммунном ответе на различные стрессовые факторы или патогены [15].
Данные морфологические изменения, согласно литературным данным, часто носят обратимый характер при устранении воздействия неблагоприятных факторов окружающей среды и могут рассматриваться как адаптивные реакции организма на условия обитания [16].
Вместе с тем, наличие данных патологий может указывать на воздействие различных стрессоров, включая химическое загрязнение, гипоксию или инфекционные агенты, и требует дальнейшего комплексного исследования для определения их этиологии и потенциальных последствий для физиологического состояния рыб [17].
Таким образом, наблюдаемые гистопатологические изменения в жабрах и печени, наряду с выявленными эритроцитарными аномалиями, служат индикаторами стрессовой реакции организма рыб на текущие условия обитания в исследуемой акватории.
Полученные результаты согласуются с результатами мониторинга северной и южной части дельты реки Кура [18].
Заключение
Микроскопический анализ крови и гистопатологическое исследование жабр и печени рыб, выловленных в акватории района Сиязань, выявил ряд изменений в изученных тканях. Несмотря на то, что частота встречаемости морфологических аномалий эритроцитов не превышает значения нормы, обнаруженные изменения в виде микроядер, деформации и атипичного смещения ядер, являются потенциальными индикаторами генотоксического воздействия. Большинство зафиксированных патологий в жабрах и печени классифицируются как адаптивные, но их наличие указывает на присутствие стрессоров в акватории. Согласованность полученных результатов с данными мониторинга дельты реки Кура подчеркивает региональный характер проблемы и необходимость дальнейшего комплексного изучения факторов, вызывающих наблюдаемые патологические изменения.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №8 2025


