Экспериментальная модель опухоли головы и шеи для потенциальной таргетной терапии
Автор: Решетов И.В., Дайхес Н.А., Каркищенко Н.Н., Стрельцова Е.А., Степанов С.О., Семнов Х.Х., Волченко Н.Н., Славнова Е.Н., Савостикова М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (35), 2009 года.
Бесплатный доступ
Создана экспериментальная модель опухоли головы и шеи, которая отвечает требованиям для проведения опытов по изучению возможностей биотерапии этих злокачественных опухолей головы и шеи. Методика эксперимента заключается в следующем: трансгенным животным (бестимусные мыши) в искусственно созданный дефект костей черепа имплантируется образец опухоли человека. Было прооперировано 40 животных. Имплантируемая опухолевая ткань прижилась. На 7-40-е сутки животные выводились из эксперимента, морфологический анализ имплантируемой опухоли продемонстрировал сохранение её биологических свойств.
Злокачественные новообразования головы и шеи, экспериментальные опухоли
Короткий адрес: https://sciup.org/14055182
IDR: 14055182 | УДК: 616.21+616.31+
Текст научной статьи Экспериментальная модель опухоли головы и шеи для потенциальной таргетной терапии
Проблема лечения злокачественных опухолей головы и шеи (ОГШ) – одна из наиболее трудных в современной онкологии. Известно, что их клиническое течение отличается крайней агрессивностью, ОГШ плохо поддаются лекарственному лечению, а возможности лучевой терапии имеют определенные ограничения в связи с анатомической близостью жизненноважных структур. Представляются актуальными поиск новых и/ или более эффективных режимов химиотерапии, принципиально новых цитостатиков, а также попытка внедрения иных – эффекторных (таргет-ных) механизмов воздействия. Перспективным представляется использование моноклональных антител в качестве средств направленного противоопухолевого воздействия [8].
Концепция направленной терапии обсуждается уже на протяжении многих десятилетий, однако только в последнее время, благодаря достижениям в молекулярной биологии, появились новые знания о биологии опухолей и клеточных мишенях [1]. Целью таргетной терапии является избирательное поражение опухоли и ограничение выраженности побочных эффектов химиотерапии. Потенциальные клеточные мишени включают в себя мембраносвязанные антигены (CD20 или опухольспецифические идиотипы), места связывания ферментов (рецептор тирозинкиназы) или прямые генетические цели (bcl-2) [2].
Использование моноклональных антител (МА) относится к методам пассивной иммуно- терапии злокачественных опухолей. В 1975 г. был разработан метод получения гибридом от слияния нормальных лимфоцитов иммунизированных животных с клетками миеломных штаммов [3]. Гибридомная технология позволяет продуцировать неограниченное количество МА к разнообразным антигенам. Их можно применять как препараты диагностического или лечебного назначения [4, 16].
Достаточные для изготовления препаратов количества моноклональных антител получают из жидкости, которая вырабатывается в брюшной полости лабораторных мышей в ответ на введение гибридом. Таким способом получают МА к определенным антигенам бактерий или вирусов, опухолевых клеток, лимфоцитов, гормонам, ферментам, медиаторам и т.д. В настоящее время известно три класса цитотоксических моноклональных антител: неконъюгированные антитела, которые сами способны вызывать гибель опухолевых клеток, два других класса – конъюгированные антитела: токсинами и изотопами [7]. Механизм противоопухолевого действия моноклональных антител включает следующие этапы: комплементзависимая цитотоксичность, антителозависимая цитотоксичность, Ab2 вакцины, фагоцитоз, блокада рецепторов, апоптоз, внутриклеточные эффекты. При реализации комплементзависимой цитотоксичности после связывания антителом антигена на поверхности опухолевой клетки активируется многоэтапная система комплемента. На последнем ее этапе образуется белок С9, способный формировать отверстия в клеточной мембране, что приводит клетку к гибели. При антителозависимой цитотоксичности моноклональное антитело своим гипервариабельным доменом связывается с соответствующим антигеном на поверхности опухолевой клетки, а постоянным доменом – с Fc-рецептором цитотоксического лимфоцита, которые синтезируют и выделяют белки – перфорины и сериновые протеазы, повреждающие клеточную мембрану. Механизм Ab2 вакцины реализуется при использовании моноклональных антител, содержащих чужеродный белок. В ответ на его введение образуются в организме собственные антиидиотипические антитела, способные связываться с поверхностным опухолевым антигеном и запускать один из меха- низмов цитотоксичности [11, 12]. За последние несколько лет был одобрен целый ряд новых противоопухолевых МА, в том числе антитела, «вооруженные» токсинами и радионуклеотидами. Первым МАТ, одобренным для применения в онкологии, стал ритуксимаб (химерическое МАТ иммуноглобулина IgG1к), предназначенный для лечения неходжкинской лимфомы [5–7, 10, 13]. До сих пор наилучшие результаты иммунотерапия давала в лечении гематологических видов рака, так как в этом случае клетки более доступны для воздействия, чем при солидных опухолях [7]. Еще одним важным направлением деятельности является конструирование «иммунотоксинов» – иммунных комплексов МКА с токсинами растительного или животного происхождения, губительными для злокачественных клеток. МКА при этом выступают в роли носителя токсинов. Это воплощение идеи «волшебной пули», которая настигает и поражает опухоль даже если ее невозможно определить [14, 15]. Первым «очеловеченным» антителом, допущенным к лечению твердых опухолей, стал препарат Herceptin. Препарат предназначался для лечения рака молочной железы с метастазами. Позже были одобрены еще два МАТ для лечения рака толстой кишки: Erbitux (2003 г.), химерическое МАТ, действующее на рецептор эпидермального фактора роста, иAvastin (2004 г.) – антитело к сосудисто-эндотелиальному фактору роста, применяемое в сочетании с химиотерапией 5-FU [9].
Цель работы – создание экспериментальной модели для отработки методов направленной биотерапии опухолей головы и шеи препаратами на основе МАТ.
Материал и методы
Использовано 8 образцов опухолей от различных пациентов (3 случая РМЖ, 2 случая аденокарциномы околоушной слюнной железы, 2 случая рака слизистой альвеолярного отростка нижней челюсти, 1 случай – рак языка). Во всех случаях проводилась предоперационная морфологическая оценка HER2/NEU-рецепторного статуса пациента.
Для работы использованы иммунодепрессивные лабораторные животные (бестимусные мыши). Общее количество животных в экс- перименте – 60. Все животные равномерно распределены в 3 группы, 2 из которых опытные, 1 контрольная. Все группы животных не отличаются по основным биологическим характеристикам (вид, возраст, физиологическое состояние). С учётом поставленных задач животным имплантируется человеческий образец опухоли с экспрессией HER2/NEU. После имплантации опухоли на 3–7–12-е сут проводится контроль роста опухоли во всех группах. Обработка результатов эксперимента проводится с использованием статистических параметров для обеспечения результативности и достоверности.
Методика имплантации опухоли на твёрдую мозговую оболочку (ТМО) животного
-
1. Подготовка животного к операции (временная изоляция, проведение иммунносупрессивной терапии при необходимости, анестезиологическое пособие, подготовка операционного поля, адекватная фиксация).
-
2. Оперативный доступ осуществляется через продольный срединный разрез кожи в лобно-теменной области, позволяющий максимально быстро сформировать надкостничный лоскут. В зависимости от вида животного и объёма имплантируемой опухоли необходим участок теменной кости с надкостницей от 0,1 до 0,6 мм2.
-
3. С учётом размеров биологической модели (вес не более 25 г), объёма имплантируемого материала, технически сложного выполнения операции проведение всех этапов оптимально с использованием оптического увеличения.
-
4. Для формирования надкостничного лоскута использован метод гидропрепаровки тканей (под надкостницу при помощи инсулиновой иголки вводили необходимое количество изотонического раствора хлорида натрия).
-
5. Создание дефекта кости черепа проводится при помощи бора. Необходимо отметить, что при формировании дефекта стоит учитывать анатомию крупных венозных синусов животного, поэтому с целью минимализации риска кровотечения дефект формируется на расстоянии 2–5 мм от срединного шва черепа, дном дефекта является твердая мозговая оболочка (ТМО).
-
6. На сформированный дефект производится подсадка культуры опухоли. Размер дефекта и объём имплантируемой ткани должны быть конгруэнтны.
-
7. Имплантируемая опухоль укрывается заранее сформированным надкостничным лоскутом, который фиксируется отдельными узловыми швами по периметру дефекта.
-
8. Производится послойное ушивание раны с осуществлением надёжного гемостаза.
-
9. Животное помещается в отдельное помещение для мониторинга послеоперационного периода, исследователем осуществляется ежедневный контроль состояния послеоперационной раны
На 3–7–12-е сут проводится визуальный и инструментальный контроль динамики роста опухоли (морфологический контроль, оценка скорости роста трансплантата с помощью стандартизированной методики).
Оценка скорости роста трансплантатов
В качестве критерия скорости роста трансплантата было выбрано относительное изменение (за 6 сут) площади, занимаемой им на твёрдой мозговой оболочке (Vs): Vs=S1-S0, где S0 – исходная площадь трансплантата, равная произведению двух его максимальных диаметров,
-
S1 – конечная площадь трансплантата, высчитываемая сходным образом.
Для определения EGFR (clone 30) использовались реактивы фирмы DAKO (Дания) в титре 1:25; 1:50; для определения c-erbB-2 (HER2/ NEU) –реактивы фирмы DAKO (Дания) в титре 1:250: 1:350.
Для рутинных цитологических исследований используется микроскоп LEICA OMLS. Готовые препараты визуализируются под увеличением х100, х1000.
Для иммуноцитохимии используется метод UltraVision. Метод обеспечивает увеличение чувствительности и упрощение исследования. Двухзначная полимерная система составлена из малых полимерных субъединиц, что уменьшает конфликт при связывании с мишенью. Уменьшение конфликта связывания даёт более постоянное окрашивание и усиление сигнала. Требуется меньше первых антител, чтобы по- лучить оптимальное соотношение сигнала к шуму. Набор не содержит биотина, что исключает фоновое окрашивание за счёт эндогенного биотипа, как при использовании биотиновых систем. Система для визуализации UltraVision выявляет специфический иммуноглобулин, связанный антигенами на тканевых срезах. Место, где находятся специфические антитела, выявляется с помощью универсальных вторичных антител, конъюгированных с полимером, меченным энзимом, который распознает мышиные и кроличьи иммуноглобулины. Полимерный комплекс затем выявляется с помощью системы субстрат-хромаген.
Последовательность метода:
-
- фиксация в ацетоне 1–2 мин;
-
- промывание в трис-буфере – 10 мин;
-
- Нydrogen Peroxide Block – 10–15 мин;
-
- промывание в трис-буфере – 10 мин;
-
- Ultra V Block – 5 мин;
-
- промывание в трис-буфере – 10 мин;
-
- нанесение первичных антител (от 30 мин);
-
- промывание в трис-буфере –10 мин;
-
- нанесение реагента для усиления первичных антител (Primary Antibody Enhancer) – 20 мин;
-
- промывание в трис-буфере – 10 мин;
-
- HRP Polymer – 30 мин;
-
- промывание в трис-буфере –10 мин;
-
- DAB – 10–15 мин;
-
- вода дистиллированная (3 позиции: 1, 2 – круговыми движениями руки, 3 – промыть – 10 мин);
-
- окраска гематоксилином – 1–3 сек;
-
- вода дистиллированная и аммиачная (круговыми движениями руки, 3–4 раза).
Специфичность и чувствительность в выявлении антигена зависят от специфичности используемых первичных антител.
Статистический анализ результатов in vivo
Результаты, полученные при проведении экспериментов, подвергаются статистической обработке с целью установления степени вариабельности вычисленных показателей и достоверности выявленных различий. При статистической обработке результатов опытов, про- веденных на опухолях, характер роста которых подчиняется законам нормального распределения, возможно применение параметрических методов статистики (метод Стьюдента-Фишера, критерий Т, доверительный интервал). Для опухолей, рост которых не подчиняется законам нормального распределения, используется любой из доступных непараметрических методов статистической обработки результатов биологического эксперимента (критерий U, критерий Вилкоксона и т.п.). Различия можно считать достоверными при р<0,05.
Результаты и обсуждение
Все пересаженные трансплантаты опухоли живы. Использованы различные фенотипы опухоли: протоковый рак молочной железы, аденокарцинома околоушной слюнной железы, плоскоклеточный рак языка, плоскоклеточный рак слизистой альвеолярного отростка нижней челюсти. Во всех случаях определялся мембранный антиген и уровень его экспрессии. Для трансплантации использовались случаи протокового рака молочной железы с экспрессией HER2/NEU от слабоположительной (++) до выраженной (++++). Протоковый рак молочной железы был выбран как модель клинически агрессивного заболевания, с высокой потенциальной способностью к метастазированию, как регионарному, так и отдалённому. Было отмечено приживление трансплантатов опухоли, высокая скорость роста (от 27 до 37 %) за 30-дневный период наблюдения. При феноти-пировании аденокарциномы околоушной слюнной железы уровень экспрессии HЕR2/NEU составил +++, скорость роста было несколько ниже (25 %), однако также отмечено 100 % приживление трансплантатов, отсутствие послеоперационной летальности за контрольный срок наблюдения. При имплантации образцов плоскоклеточного рака (рак языка и слизистой альвеолярного отростка нижней челюсти), уровень экспрессии EGFr составил +++, скорость роста трансплантата за контрольный период наблюдения составила 50 %, послеоперационная летальность отсутствует.
Разработана методика эксперимента, позволяющая стандартизировать забор донорского материала, его фенотипирование и успешную
Результаты эксперимента
Таблица
|
Фенотип опухоли |
Кол-во животных |
Размеры трансплантата, мм2 |
Скорость роста трансплантата, % |
Послеоперационная летальность животных, % |
|
|
до |
после |
||||
|
Рак молочной железы, протоковый вариант, HER2/NEU ++ |
2 |
3 |
3,8 |
27 |
0 |
|
Рак молочной железы, протоковый вариант, HER2/ NEU +++ |
3 |
3 |
3,9 |
30 |
33,3 |
|
Рак молочной железы, протоковый вариант, HER2/ NEU ++++ |
15 |
3 |
4,11 |
37 |
20 |
|
Рак околоушной слюнной железы, аденокарцинома, HER2/ NEU +++ |
3 |
2 |
2,5 |
25 |
0 |
|
Рак языка, плоскоклеточный вариант, EGFR +++ |
1 |
3 |
4,5 |
50 |
0 |
|
Рак слизистой дна полости рта, плоскоклеточный вариант, EGFR +++ |
12 |
3 |
4,5 |
50 |
0 |
|
Всего |
36 |
36,5 |
8,83 |
||

Рис. 1. Внешний вид животного из контрольной группы на 21-е сут после имплантации опухоли (обозначена стрелкой)
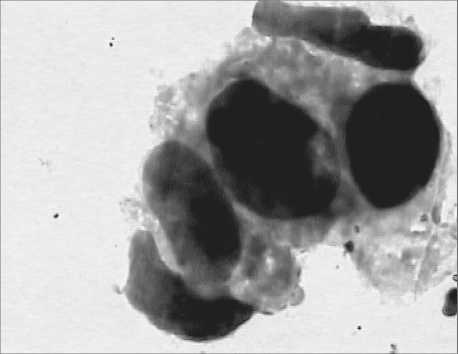
Рис. 2. Цитологическая картина опухоли выведенного из эксперимента на 14-е сут животного контрольной группы – отчётливо определяются клетки рака молочной железы
подсадку. У всех трансплантатов обнаружены и определены мембранные антигены мишени для биотерапии (таблица). При проведении исследования нами обнаружено, что при им-мунофенотипировании аденогенного рака околоушной слюнной железы определяется достаточно высокий уровень экспрессии c-erb-2 (+++), что позволило включить вышеуказанную локализацию в эксперимент. Объём и локализация операционной раны хорошо переносились экспериментальными животными, так как не было случаев гибели на операционном столе и отмечена низкая летальность в ближайшем послеоперационном периоде. Расположение трансплантата в глубоких слоях тканей головы в теменной области способствует хорошему его приживлению и удобству динамического наблюдения и замеров, одновременно исключая аутофагию и травму послеоперационной раны. Хорошее кровоснабжение твёрдой мозговой оболочки и мягких тканей головы обеспечивают высокую жизнеспособность трансплантата (рис. 1), в результате чего у нас не было случаев потери трансплантата, одновременно с этим организм бестимусных животных не оказывал влияния на фенотип опухоли.
Таким образом, создана и апробирована в эксперименте модель первичных и метастатических злокачественных опухолей головы и шеи для изучения эффективности противоопухолевых препаратов моноклональных антител; при этом модель сохраняет биологические свойства опухоли, что и является адекватным для оценки результатов эксперимента (рис. 2).
Работа выполнена при одобрении локального этического комитета ФГУ НКЦ оториноларингологии Росздрава и утверждена протоколом Учёного совета к исполнению.


