Экспериментальная модель остеоартроза коленного сустава у крыс на фоне внутрисуставного введения обогащенной тромбоцитами аутологичной плазмы
Автор: Демкин С.А., Маланин Д.А., Рогова Л.Н., Снигур Г.Л., Григорьева Н.В., Байдова К.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология
Статья в выпуске: 1 (49), 2016 года.
Бесплатный доступ
В эксперименте на 30 половозрелых крыс линии Wistar проведена оценка морфологических изменений в структуре гиалинового хряща коленного сустава при экспериментальном остеоартрозе после внутрисуставного введения ОТП. При моделировании остеоартроза в коленном суставе выявлено возникновение грубых структурных изменений суставного хряща, вплоть до его полного разрушения, сопровождающегося сосудистой пролиферацией и гранулематозным воспалением. Введение ОТП на фоне развившегося остеоартроза сопровождается снижением выраженности дегенеративно-дистрофических изменений, улучшением показателей тинкториальных свойств матрикса суставного хряща.
Остеоартроз, суставной хрящ, обогащенная тромбоцитами плазма
Короткий адрес: https://sciup.org/142149160
IDR: 142149160 | УДК: 616.71-008.1:616.71-003.93
Текст научной статьи Экспериментальная модель остеоартроза коленного сустава у крыс на фоне внутрисуставного введения обогащенной тромбоцитами аутологичной плазмы
Деформирующий остеоартроз – гетерогенная группа заболеваний суставов различной этиологии, но с идентичными биологическими, морфологическими и клиническими признаками и исходом, связанным с потерей гиалинового хряща и сопутствующим поражением других анатомических структур и тканей сустава (субхондральная кость, синовиальная оболочка, связки, капсула сустава, околосуставные сухожилия и мышцы).
Гиалиновый хрящ содержит относительно небольшое количество клеток, окруженных большим количеством межклеточного матрикса. Хондроциты участвуют в регуляции синтеза и деградации компонентов хрящевого матрикса, причем в норме эти процессы находятся в равновесии [5].
Под воздействием множества факторов баланс процессов деградации и репарации нарушается, что впоследствии обуславливает развитие остеоартроза, проявляющегося дегенеративно-дистрофическими изменениями в структуре гиалинового хряща и субхондральной кости, воспалением в окружающих мягких тканях, нарушением физико-химических свойств синовиальной жидкости [5, 9].
Возможность управления биологическим потенциалом собственного организма и использования его в лечебном процессе представляется весьма перспективным и уже находит подтверждение в ряде работ, посвященных обогащенной тромбоцитами плазме (ОТП). Содержание в ОТП большого количества факторов роста, которые могут одномоментно или постепенно выделяться в окружающие ткани, предполагает возможность воздействия на течение воспалительного процесса в суставе и ремоделирование гиалинового хряща [2, 9]. Существующие экспериментальные исследования на этот счет остаются дискутабельными и пока не позволяют составить целостное представление о патоморфозе структурных изменений хрящевой ткани после применения ОТП на фоне остеоартроза [4, 7, 8].
ЦЕЛЬ РАБОТЫ
Оценить морфологические изменения в структуре гиалинового хряща коленного сустава при экспериментальном остеоартрозе после внутрисуставного введения ОТП.
МЕТОДИКА ИССЛЕДОВАНИЯ
Материалом для экспериментального исследования послужили 30 половозрелых крыс линии Wistar массой (250 ± 2,2) г.
При работе с лабораторными животными соблюдали требования, изложенные в правилах лабораторной практики (GLP), «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985), приказе МЗ РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики», Минздрава СССР № 755 от 12.08.1977.
Лабораторные животные были распределены на 3 группы по 10 животных в каждой (2 экспериментальные и 1 контрольная). Все манипуляции у животных 3 групп были выполнены под общим обезболиванием с использованием препарата «Рометар» по методике, описанной фирмой-производителем.
В двух экспериментальных группах моделировали остеоартроз путем внутрисуставного введения 10%-й суспензии стерильного талька [1].
Через 30 дней после моделирования остеоартроза животным экспериментальной группы № 2 проводили двухкратное внутрисуставное введение 0,2 мл ОТП с периодичностью 1 раз в 21 день [9].
Животным контрольной группы проводили однократное внутрисуставное введение 0,2 мл 0,9%-го раствора NaCl.
Все внутрисуставные инъекции осуществляли из стандартного передневнутреннего доступа в левый коленный сустав (табл. 1).
Таблица 1
|
Порода животных |
Линия Wistar |
||||
|
Возраст животных |
Половозрелые |
||||
|
Масса животных |
250 ± 2,2 г |
||||
|
Вводимый препарат Группы |
0,9%-й раствор NaCl |
10%-я суспензия стерильного талька |
ОТП |
ГК |
|
|
Контрольная |
0,2 мл однократно |
– |
– |
– |
|
|
Экспериментальная № 1 |
– |
0,5 мл однократно |
– |
– |
|
|
Экспериментальная № 2 |
– |
0,5 мл однократно |
0,2 мл 1 раз в неделю, трехкратно, спустя 30 дней после введения талька |
– |
|
|
Все препараты вводили в левый коленный сустав |
|||||
Характеристика экспериментальных групп животных
Через 1 месяц после проведения внутрисуставных инъекций животных выводили из эксперимента путем введения летальной дозы рометара, вычленяли левую бедренную кость для последующего морфологического исследования.
Хрящевую ткань с субхондральной костью фиксировали в 10%-м растворе нейтрального забуференного формалина (рН 7,4) в течение 24 часов (Newell K. J., et al., 2001). Проводили бескислотную декальцинацию в растворе этилендиаминтетраацетате натрия стандартной концентрации. После полного удаления из костной ткани минерального компонента выполняли стандартную гистологическую проводку по спиртам возрастающих концентраций и препараты заключали в парафин, после чего изготовляли срезы толщиной 6–8 микрон, окрашивали гематоксилином и эозином по Маллори (Киясов А. П., 2001; Коржевский Д. Э., 2005).
Фотопротоколирование микроскопических изменений производили с использованием комплекса, включающего микроскоп «Axio Scope» (Carl Zeiss, Германия) и цифровую фотокамеру «Power Shot» (Canon, Япония).
Морфометрический анализ осуществляли с помощью компьютерной программы «Видео ТестМорфо-4» (Россия). Для оценки морфологических показателей определяли толщину суставного хряща (L, мкм) и объемную долю хондроцитов по отношению к матриксу (ОД, %).
Результаты экспериментов обрабатывали методами базисного статистического анализа с использованием программ «Видео Тест-Морфо-4» (Microsoft, США) и «STATISTICA 6.0» (Stat Soft Inc., США).
Анализ параметров при нормальном распределении значений проводили с помощью критерия Стьюдента, анализ непараметрических количественных признаков – с помощью критерия Манна-Уитни. Для сравнения качественных признаков использовали критерии χ2 и Фишера. Значимыми считали различия, если вероятность ошибки не превышала р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
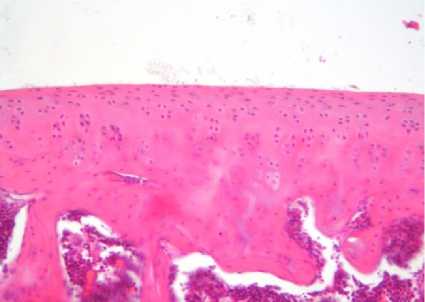
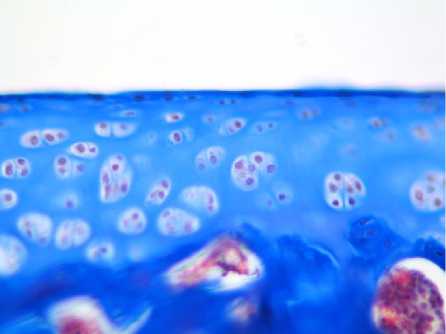
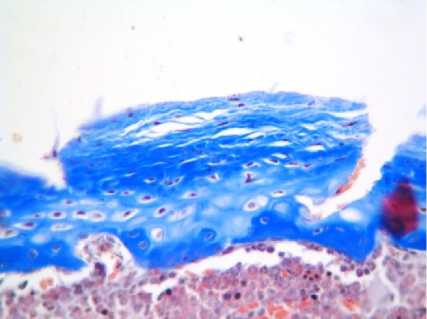
Проведенное исследование показало, что в контрольной группе животных суставной гиалиновый хрящ имел толщину (330 ± 17,3) мкм и характерное гистологическое строение. Поверхностные хондроциты характеризовались уплощенной формой и располагались поодиночке в хрящевом матриксе. Хондроциты переходной и базальной зон имели округлую форму и располагались в составе изогенных групп рядами, ориентированными перпендикулярно к суставной поверхности. Объемная доля хондроцитов составляла (13,7 ± 1,1) % (табл. 2). Морфологические признаки дегенеративнодистрофических процессов не визуализировались (рис. 1 а). Иммунохимическая реакция по Маллори выявляла равномерное расположение коллагеновых волокон, отсутствие очагов оссификации (рис. 2 а).
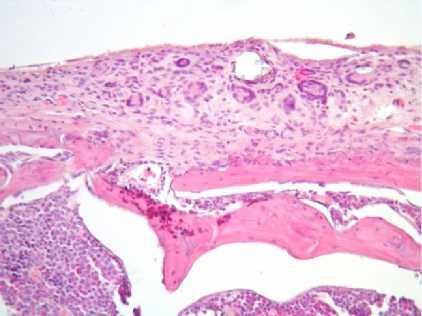
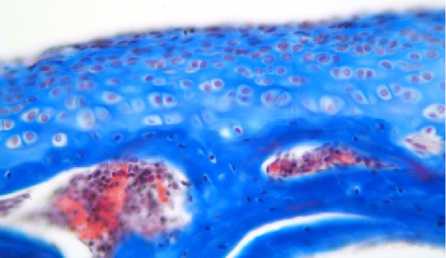
После моделирования остеоартроза происходило уменьшение толщины суставного хряща до (121 ± 20,4) мкм (р < 0,05) и снижение объемной доли хондроцитов до (1,2 ± 0,6) % (р < 0,05). Во всех зонах были отмечены множественные «пустые лакуны» и хондроциты с кариопикнозом, обширные участки деструкции суставной поверхности с разрастанием соединительной ткани, в толще которой определялось гранулематозное воспаление с выраженной гистиомакрофагальной инфильтрацией и гигантскими многоядерными клетками типа инородных тел, полнокровием кровеносных сосудов и неравномерным отеком межклеточного вещества (рис. 1 б).
При гистохимическом исследовании в суставном хряще отмечали неравномерность окрашивания коллагеновых волокон с выраженным нарушением тинкториальных свойств матрикса хрящевой ткани. В участках склероза волокна коллагена были окрашены наиболее интенсивно (рис. 2 б).
После введения ОТП на фоне экспериментального остеоартроза морфометрически было установлено увеличение толщины суставного хряща до (275 ± 18,9) мкм (р < 0,05) и объемной доли хондроцитов до (18,4 ± 2,0) % (р < 0,05).
Различали три отграниченные друг от друга зоны с типичными для остеоатроза дегенеративными изменениями, но выраженными в меньшей степени. В поверхностной зоне контуры суставной поверхности выглядели ровными.
Несмотря на наличие «пустых» лакун и хондроцитов с признаками распада и образованием апоптозных телец, определяли увеличение количества как отдельно расположенных хондроцитов, так и их изогенных групп во всех зонах (рис. 1 в).
В промежуточной зоне происходила очаговая оссификация межклеточного вещества, что было особенно заметно при окраске по Маллори. Равномерность распределения коллагеновых волокон и тинкториальные свойства хрящевого матрикса сохранялись во всех зонах (рис. 2 в).
б
Рис. 1. Различная степень выраженности дегенеративно-дистрофических изменений суставного гиалинового хряща у крыс экспериментальных групп.
Окраска гематоксилином и эозином. Увеличение ×200:
а – контрольная группа;
б – экспериментальная группа № 1;
в – экспериментальная группа № 2
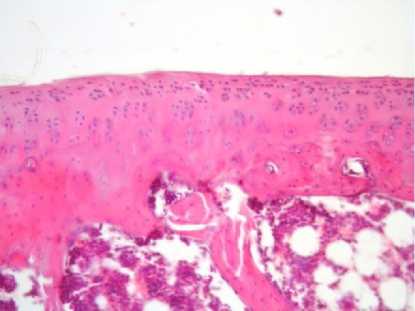
в
Таблица 2
|
Экспериментальные группы |
Толщина, мкм |
Объемная доля хондроцитов, % |
|
Контрольная |
330 ± 17,3 |
13,7 ± 1,1 |
|
Экспериментальная № 1 |
121 ± 20,4* |
1,2 ± 0,6* |
|
Экспериментальная № 2 |
275 ± 18,9** |
18,4 ± 2,0** |
* Достоверные изменения по отношению контрольной группы (р < 0,05);
** достоверные изменения по отношению к группе с остеоартрозом (р < 0,05).
Морфометрические параметры суставного гиалинового хряща у животных экспериментальных групп
а
б
в
Возникновение и прогрессирование гонарт-роза обусловлено структурными изменениями в суставном хряще и других тканях коленного сустава.
В нормальном суставном хряще процессы деструкции и репарации тканей происходят достаточно медленно, строго контролируются, находятся в равновесии и являются основой физиологического ремоделирования [5].
На сегодняшний день в клинической практике предпринимаются разносторонние попытки воздействия на течение воспалительного процесса в суставе и дегенеративно-дистрофических изменений в гиалиновом хряще.
Роль тромбоцитов в патогенезе остеоартроза, по всей видимости, более многогранна, чем мы сегодня это представляем. Тромбоциты содержат большое количество
Рис. 2. Изменения тинкториальных свойств матрикса хрящевой ткани у крыс экспериментальных групп.
Окраска по Маллори.
Увеличение х400:
а – контрольная группа;
б – экспериментальная группа № 1;
в – экспериментальная группа № 2
быстро высвобождаемых веществ, которые участвуют в первой фазе воспаления, влияя на течение воспалительного процесса в суставе, модулируя его длительность и активность. Кровяные пластинки активируют процессы миграции и активации лейкоцитов, а также репарацию в тканях, что определяет перспективу широкого применения содержащих их лекарственных форм в клинической практике.
Высокий уровень бета-тромбоглобулина, тромбоцитарного фактора 4 в ОТП стимулирует воспалительный ответ, активируя миграцию нейтрофилов. В тоже время ОТП может разрешать воспаление, восстанавливая эндотелиальный барьер путем высвобождения гепатоци-тарного фактора роста, VEGF и TGF-b [6, 10]. Высвобождение биологически активных веществ из гранул тромбоцитов, с одной стороны, подавляет активность металлопротеиназ, а с другой – стимулирует пролиферацию, что обуславливает хондропротективное действие ОТП. Из литературных источников известно также, что ОТП in vitro стимулирует выработку хондроцитами коллагена II типа, снижает уровень апоптоза хондроцитов [7].
Полученные результаты не вступают в противоречие с теоретическими данным о влиянии ГК как ингибитора экссудации, образования провоспалительных медиаторов и как составляющей метаболизма матрикса. Применение ОТП, обладающей двояким действием как на про-, так и на противовоспалительные цитокины, и значительно увеличивающей концентрацию различных факторов роста, в кратчайший срок повышает пролиферативную активность грануляционной ткани и приводит к активации поврежденной ткани хряща, таким образом разрешая воспалительный процесс.
ЗАКЛЮЧЕНИЕ
При моделировании остеоартроза в коленном суставе у половозрелых крыс линии Wistar возникают грубые структурные изменения в суставном хряще, вплоть до его полного разрушения, сопровождающегося сосудистой пролиферацией и гранулематозным воспалением.
Введение ОТП на фоне развившегося остеоартроза сопровождается снижением выраженности дегенеративно-дистрофических изменений, улучшением показателей тинкториальных свойств матрикса суставного хряща.
Список литературы Экспериментальная модель остеоартроза коленного сустава у крыс на фоне внутрисуставного введения обогащенной тромбоцитами аутологичной плазмы
- Котельников Г. П., Ларцев Ю. В., Махова А. Н. Сравнительная оценка структурных изменений тканей сустава при различных моделях экспериментального артроза//Казанский медицинский журнал. -2006. -№ 1. -С. 31-35.
- Обогащенная тромбоцитами аутологичная плазма в лечении пациентов с гонартрозом III стадии/Д. А. Маланин, В. В. Новочадов, С. А. Демкин и др.//Травматология и ортопедия России. -2014. -№ 3. -С. 52-59.
- Andia I., Sanchez M., Maffulli N. Joint pathology and platelet-rich plasma therapies//Expert Opin. Biol. Ther. -2012.-Vol. 1, № 1. -P. 7-22.
- Guner S., Buyukbebeci O. Analyzing the effects of platelet gel on knee osteoarthritis in the rat model. Clin. Appl. Thromb. Hemost. -2013. -Vol. 19. -P. 494-498.
- Hedbom E., Hauselmann H. J. Molecular aspects of pathogenesis in osteoarthritis: the role of inflammation//Cell. Mol. Life Sci. -2002. -Vol. 59. -P. 45-53.
- High molecular weight hyaluronic acid down-regulates the gene expression of osteoarthritis-associated cytokines and enzymes in fibroblast-like synoviocytes from patients with early osteoarthritis/C. T. Wang, Y. T. Lin, B. L. Chiang, et al.//Osteoarthr. Cartil. -2006. -Vol. 12. -P. 1237-1247.
- Influence of platelet-rich plasma on chondrogenic differentiation and proliferation of chondrocytes and mesenchymal stem cells/A. Drengk, A. Zapf, E. K. Sturmer, et al.//Cells Tissues Organs. -2009. -Vol. 189, № 5. -P. 317-326.
- Kwon D. R., Park G. Y., Lee S. U. The effects of intra-articular platelet-rich plasma injection according to the severity of collagenase induced knee osteoarthritis in a rabbit model//Ann. Rehabil. Med. -2012. -Vol. 6, № 4. -P. 458-465.
- Platelet-rich plasma: why intra-articular? A systematic review of preclinical studies and clinical evidence on PRP for joint degeneration/G. Filardo, E. Kon, A. Roffi, et al.//Knee Surg. Sports Traumatol. Arthrosc. -2015. -Vol. 23. -P. 2459-2474.
- Walshe T. E., Dole V. S., Maharaj A. S. R. Inhibition of VEGF or TGF-beta signaling activates endothelium and increases leukocyte rolling//Arterioscler. Thromb. Vasc. Biol. -2009. -Vol. 29. -P. 1185-1192.


