Экспериментальная оценка свойств костнозамещающих материалов на основе Ca3(PO4)2 на модели критического дефекта бедренной кости крысы
Автор: Щербаков И.М., Евдокимов П.В., Ларионов Д.С., Путляев В.И., Шипунов Г.А., Данилова Н.В., Ефименко А.Ю., Новоселецкая Е.С., Дубров В.Э.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.31, 2025 года.
Бесплатный доступ
Введение. В современной травматологии и ортопедии остро стоит проблема замещения дефектов костной ткани. Достижения современного материаловедения позволяют создавать широкий спектр костнозамещающих материалов, однако выбор наиболее эффективных из них является актуальной задачей биомедицинских исследований. Цель работы — определение влияния трехмерной структуры и размера пор костнозамещающих материалов на основе трикальциевого фосфата на их остеокондуктивные свойства на модели критического диафизарного дефекта бедренной кости крысы. Материалы и методы. В эксперименте под наркозом воспроизводили монокортикальный дефект средней трети диафиза бедренной кости крыс на протяжении 7 мм, который заполняли блоками одного из четырех материалов на основе трикальциевого фосфата, различающихся количеством, размером и направлением пор. В каждую из групп включено по 16 животных. Через 3 и 6 мес. по 8 крыс из каждой группы выводили из эксперимента, после чего при гистологическом исследовании проводили оценку площади новообразованной костной ткани с последующим сравнением результатов между группами с использованием статистических методов. Результаты. Во всех группах отмечено прорастание костной ткани в зону дефекта по порам материала. Через 3 и 6 мес. площадь новообразованной костной ткани в соотношении к площади дефекта составила: в группе Цилиндры — (11 ± 4) % и (31 ± 6) % соответственно; в группе Гироид — (14 ± 5) % и (29 ± 4) %; в группе Гироид-150 мкм — (39 ± 5) % и (41 ± 7) %; в группе Гироид-50 мкм — (17 ± 7) % и (27 ± 8 %. Площадь новообразованной костной ткани в группе Гироид-150 мкм статистически значимо больше по сравнению с остальными группами (p < 0,05, критерий Kruskal – Wallis). Обсуждение. Оценка влияния типа архитектуры блока костнозамещающего материала, размера пор и их взаимоотношений в настоящее время является темой многих исследований, в которых показано, что наличие пор большого диаметра (более 600 мкм) улучшает остеокондуктивные свойства, однако верхний предел пористости ограничен снижением механических свойств блока. Подтверждается превосходство структуры Гироид над другими типами архитектур, как в теоретических, так и в прикладных исследованиях. Однако изучению структур с порами различного размера посвящено мало работ, в связи с чем результаты нашего исследования позволяют ответить на вопрос о целесообразности применения таких сложных структур и их роли в замещении костной ткани. Заключение. Трехмерная структура костнозамещающих материалов на основе трикальциевого фосфата оказывает влияние на остеокондуктивные свойства, при этом добавление к структуре Гироид дополнительной моды пор диаметром 150 мкм приводит к статистически значимо большему врастанию костной ткани в образец материала в эксперименте.
Травматология, репарация костной ткани, костнозамещающие материалы, 3d-печать
Короткий адрес: https://sciup.org/142245102
IDR: 142245102 | УДК: 004.94:616.718.45-004.8-089.844-74:666.3-127:616-092.9 | DOI: 10.18019/1028-4427-2025-31-2-226-236
Текст научной статьи Экспериментальная оценка свойств костнозамещающих материалов на основе Ca3(PO4)2 на модели критического дефекта бедренной кости крысы
Проблема замещения дефектов костной ткани посттравматической и послеоперационной этиологии по-прежнему является актуальной в современной травматологии и ортопедии [1–5]. Возможности аутопластики ограничены по объёму, поэтому продолжается активная работа по поиску алло- и ксенотрансплантатов [6–11]. Достижения современного материаловедения позволяют создавать широкий спектр костнозамещающих материалов, однако выбор наиболее оптимальных из них является задачей биомедицинских исследований [3, 7, 12–17].
Для разработки новых костнозамещающих материалов применяют различные химические вещества, различающиеся как по своим механическим свойствам, так и по биорезорбируемости [12, 18–21]. Для процесса замещения материала костной тканью не меньшее значение имеет трехмерная структура материала, которая определяет процесс новообразования костной ткани и его скорость [22, 23]. Однако в литературе нет четких критериев, позволяющих выбирать архитектуру материала для ускорения процесса прорастания костью. Сама губчатая костная ткань представляет собой сложную нерегулярную трехмерную структуру с пористостью от 50 до 90 % и размером пор от 300 до 500 мкм с негомогенными анизотропными свойствами [24]. Одной из оптимальных структур с точки зрения компромисса между проницаемостью и прочностью является структура на основе трехмерной периодической минимальной поверхности типа Гироид, в то же время она обладает высокой относительной жесткостью [25].
Цель работы — определение влияния трехмерной структуры и размера пор костнозамещающих материалов на основе трикальциевого фосфата на их остеокондуктивные свойства на модели критического диафизарного дефекта бедренной кости крысы.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемые биорезорбируемые материалы представляют собой макропористые керамические 3D-конструкции нового поколения на основе ортофосфата кальция Ca 3 (PO 4 ) 2 . Для синтеза высокопористых керамических материалов на его основе использовали фотоотверждаемые эмульсии. Для их получения применяли ранее описанную методику [25]. В качестве исходной архитектуры использовали материал Цилиндры. В этом материале общая пористость по объему составляла около 55 %, размер основных пор — 300 мкм, а переходы между ними — 50 мкм, при этом поры располагались без четкой организации.
Для формирования материалов с заданной архитектурой типа Гироид была выбрана стереолитографическая ЗD-печать с помощью DLP-принтера Ember (Autodesk, США), а трехмерные модели структур были созданы с помощью компьютерных программ Monolith (Autodesk, США) и Fusion 360 (Autodesk, США). Общая пористость созданного материала (материал Гироид) по объему составляет около 70 %, основные каналы имеют размеры 1250 мкм, и переходы между ними — 750 мкм, что обеспечивает максимальную проницаемость таких архитектур (рис. 1, слева). Использование фотоотверждаемых эмульсий позволяет задавать дополнительную моду пор в заданном керамическом 3D-каркасе. В данной работе исследованы материалы с дополнительной модой пор со средним размером 50 (материал Гироид-50 мкм) и 150 мкм (материал Гироид-150 мкм) (рис. 1, справа). Общая пористость созданных материалов по объему составляет около 85 %.

Рис. 1. Трехмерная структура созданных костнозамещающих материалов. Слева — графическая компьютерная модель структуры материала Гироид. Справа — сканирующая электронная микрофотография материала Гироид-150 мкм (увеличение 50 крат). Вид из основной поры. Определяются переходы между основными порами диаметром до 750 мкм (синие стрелки) и поры дополнительной моды диаметром 150 мкм (черные стрелки)
Работа получила одобрение Комиссии по биоэтике МГУ им. М.В. Ломоносова (одобрено на заседании 11.02.2021, рег. № 123-ж). Исследование проводили в соответствии с «Руководством по содержанию и уходу за лабораторными животными» (Межгосударственный стандарт ГОСТ 33216-2014 «Правила содержания и ухода за лабораторными грызунами и кроликами»).
Исследование выполнено на 66 самцах крыс Rattus norvegicus линии Wistar в возрасте 20–22 нед. из ЦКП «SPF-виварий» ИЦиГ СО РАН (Институт цитологии и генетики СО РАН). Животных содержали в виварии по 3 особи в клетке. Доступ крыс к воде и корму был не ограничен. Формирование дефекта и заполнение его изучаемым материалом (рис. 2) проводили по описанной ранее методике [16].
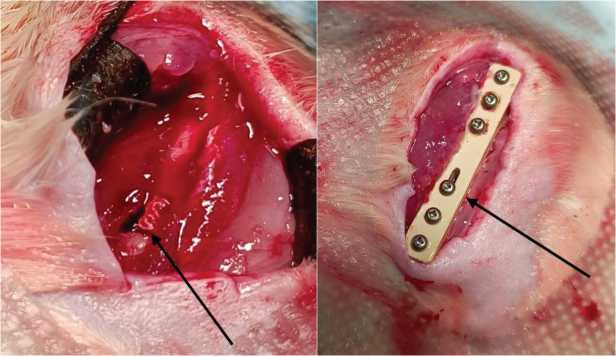
Рис. 2. Ход операции: вид операционной раны с дефектом, заполненным имплантированным материалом (слева, указан стрелкой), и фиксация кости полиэ-фирэфиркетоновой пластиной и титановыми винтами (справа, пластина указана стрелкой)
Животные распределены на 4 группы по 16 особей в каждой в зависимости от имплантируемого материала. Через 3 и 6 мес. после выполнения операции по 8 крыс из каждой группы выводили из эксперимента по стандартной методике с использованием СО 2 -камеры с последующим забором материала (бедренная кость с дефектом) для гистологического исследования. Подготовку образцов для гистологического исследования осуществляли по стандартной методике [16].
Для оценки результатов проводили слепой гистометрический анализ. Изображения гистологических препаратов получали с помощью светового микроскопа Leica DM LB2 (Carl Zeiss) и цифровой камеры AxioCam ICc3 (Carl Zeiss). Оцифрованные изображения переводили в формат JPEG. Гистометрическую оценку проводили с помощью программы Fiji [26] на увеличении в 10 раз с измерением площади новообразованной костной ткани в лакунах материалов в процентах от общей площади дефекта. Для каждого образца проводили вычисление на двух препаратах, всего для каждого срока в каждой группе получали 16 значений. Результаты каждой группы представляли в виде среднего и стандартного отклонений. Для установления статистической значимости различий использовали вычисление непараметрического критерия Kruskal – Wallis с помощью программы StatSoft Statistica 10.0 (2011) отдельно для групп со сроком вывода 3 мес. и со сроком вывода 6 мес.
РЕЗУЛЬТАТЫ
В ходе проведения эксперимента от осложнений, связанных с наркозом, погибло два животных. Остальные животные перенесли оперативное вмешательство и дожили до вывода из эксперимента без особенностей. Средняя масса крыс на моменте ввода в эксперимент — (488 ± 54) г, на момент вывода через 3 мес. — (611 ± 32) г, через 6 мес. — (653 ± 56) г. Значимая разница между группами по массе и её приросту не зафиксирована (табл. 1).
Таблица 1
Масса животных в группах на момент проведения операции и вывода из эксперимента
|
Группа |
Масса на момент включения в эксперимент, г |
Масса на момент вывода из эксперимента, г |
|
|
через 3 мес. |
через 6 мес. |
||
|
Цилиндры |
460 ± 38 |
606 ± 59 |
649 ± 71 |
|
Гироид |
453 ± 42 |
616 ± 45 |
645 ± 83 |
|
Гироид-50 мкм |
513 ± 26 |
620 ± 34 |
709 ± 72 |
|
Гироид-150 мкм |
507 ± 36 |
589 ± 40 |
692 ± 74 |
Поведение животных в послеоперационном периоде не менялось, все крысы перемещались на четырех лапах без попыток ограничивать нагрузку. Гнойных осложнений раневого процесса и осложнений механического характера со стороны имплантата и кости не выявляли.
В группе Цилиндры через 3 мес. на гистологических срезах в зоне дефекта определяли прямоугольное образование серого цвета, по структуре соответствующее имплантированному материалу. В области имплантата были участки округлой формы, лишенные заполнения, что соответствовало местам резорбции материала. В порах имплантата выявляли участки врастания костной ткани (рис. 3). Через 6 мес. в области имплантата отмечено увеличение площади участков, лишенных заполнения, что соответствовало местам резорбции материала, особенно в половине, примыкающей к мягким тканям. Отмечена утрата четкости контуров имплантата, появление их сглаженности на фоне резорбции. В порах имплантата выявляли участки врастания костной ткани (рис. 3), максимальное количество которых отмечено в области костнозамещающего материала, примыкающего к костномозговому каналу. В динамике по сравнению с 3 мес. можно отметить увеличение прорастания кости в поры материала.
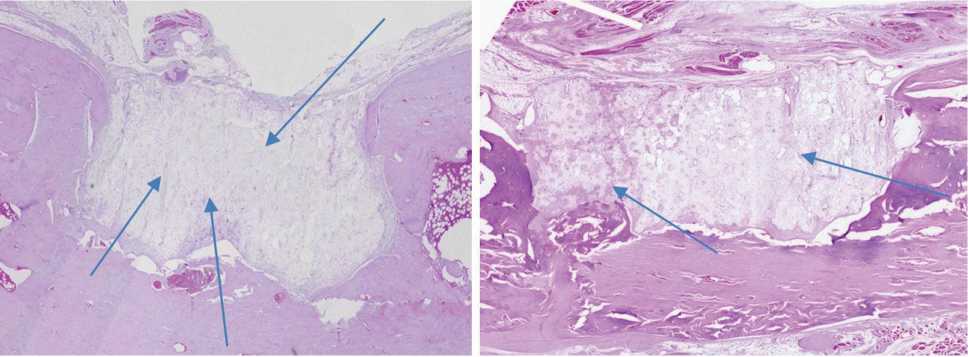
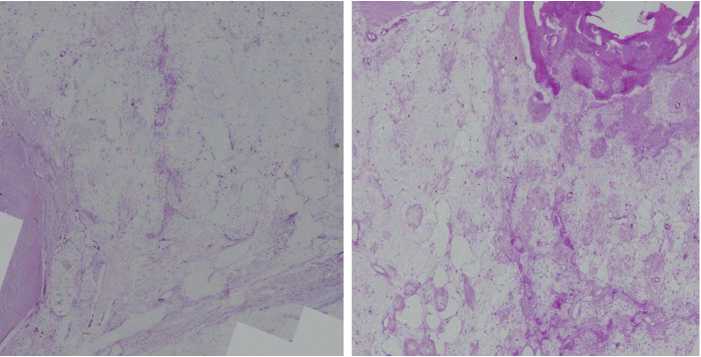
Рис. 3. Верхний ряд: гистологический препарат продольного разреза зоны монокортикального дефекта бедренной кости через 3 мес. (слева) и через 6 мес. (справа) после имплантации материала «Цилиндры», окраска гематоксилином и эозином, ×10. Нижний ряд: те же препараты соответственно, участки новообразованной костной ткани, ×40. Стрелками указаны островки костной ткани, вросшей в поры материала
В группе Гироид через 3 мес. в зоне дефекта отмечали зоны сохраненной структуры материала, представленные серыми полями с единичными клетками по периметру и крупными порами на месте резорбции материала. В имплантат врастала со стороны мягких тканей жировая и соединительная ткань, а со стороны кости — компактная костная ткань. Поры материала заполнены соединительной тканью с единичными врастаниями костной ткани. Со стороны костномозгового канала материал ограничен компактной костной тканью (рис. 4). Через 6 мес. в зоне дефекта можно было различить крупноячеистую сеть пустот, оставшуюся на месте материала после декальцинации. По всей площади среза отмечали прорастание костной ткани мелкими островками, повторяющими контуры пор (рис. 4).
В группе Гироид-150 мкм через 3 мес. отмечено врастание кости в поры между элементами материала, повторяющее архитектуру имплантата. В зоне, прилегающей к костномозговому каналу, отмечена массивная резорбция материала и замещение его зрелой костной тканью. Через 6 мес. отмечено врастание кости в поры материала, однако его резорбции не отмечено, поэтому статистически значимого различия в площади новообразованной костной ткани по сравнению с образцами через 3 мес. не выявлено (рис. 5).
В группе Гироид-50 мкм через 3 мес. четко прослеживается имплантированный материал с врастанием со стороны костномозгового канала островков костной ткани (рис. 6). Со стороны дефекта отмечено врастание в материал соединительной ткани.
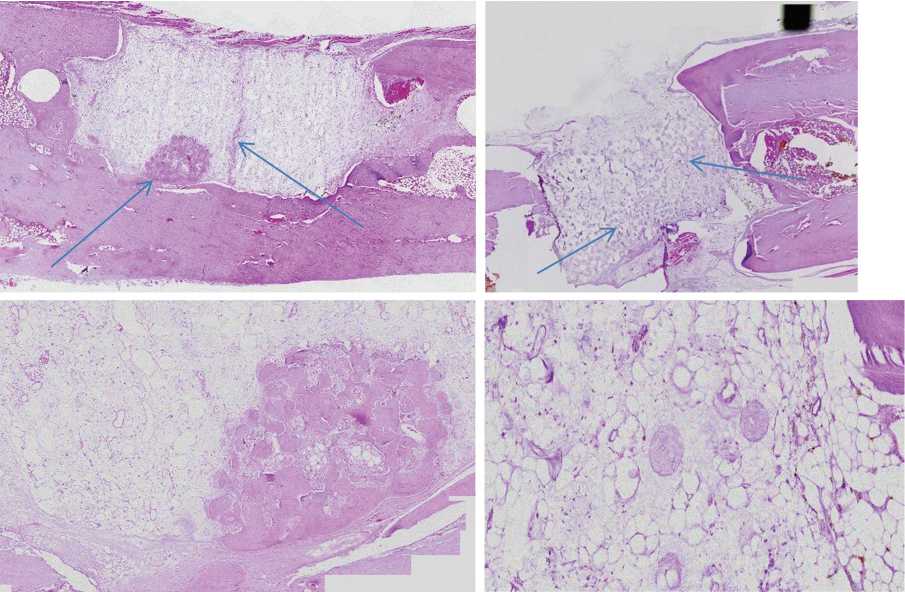
Рис. 4. Верхний ряд: гистологический препарат продольного разреза зоны монокортикального дефекта бедренной кости через 3 месяца (слева) и через 6 месяцев (справа) после имплантации материала Гироид, окраска гематоксилином и эозином, ×10. Нижний ряд: те же препараты соответственно, участки новообразованной костной ткани, ×40. Стрелками указаны очаги врастания костной ткани в имплант
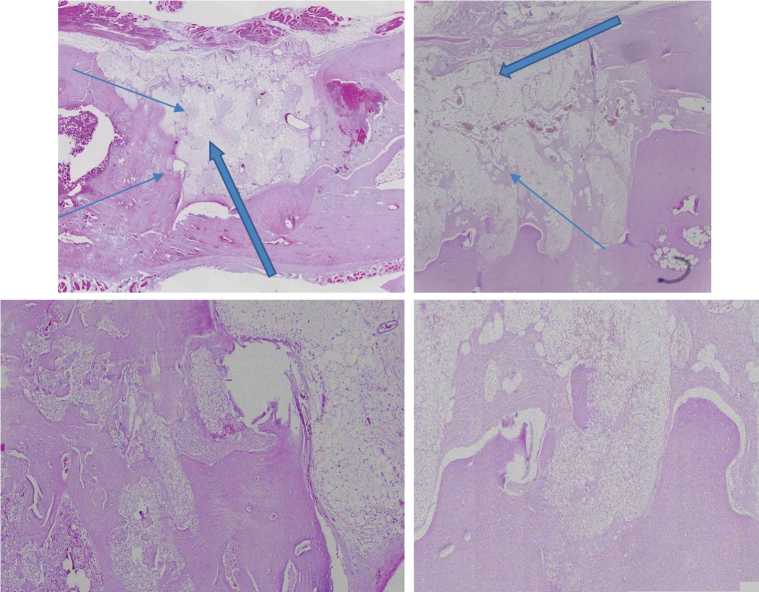
Рис. 5. Верхний ряд: гистологический препарат продольного разреза зоны монокортикального дефекта бедренной кости через 3 мес. (слева) и через 6 мес. (справа) после имплантации материала Гироид-150 мкм, окраска гематоксилином и эозином, ×10. Нижний ряд: те же препараты соответственно, участки новообразованной костной ткани, ×40. Тонкими стрелками указаны островки костной ткани, вросшей в поры материала, толстыми стрелками обозначены зоны материала
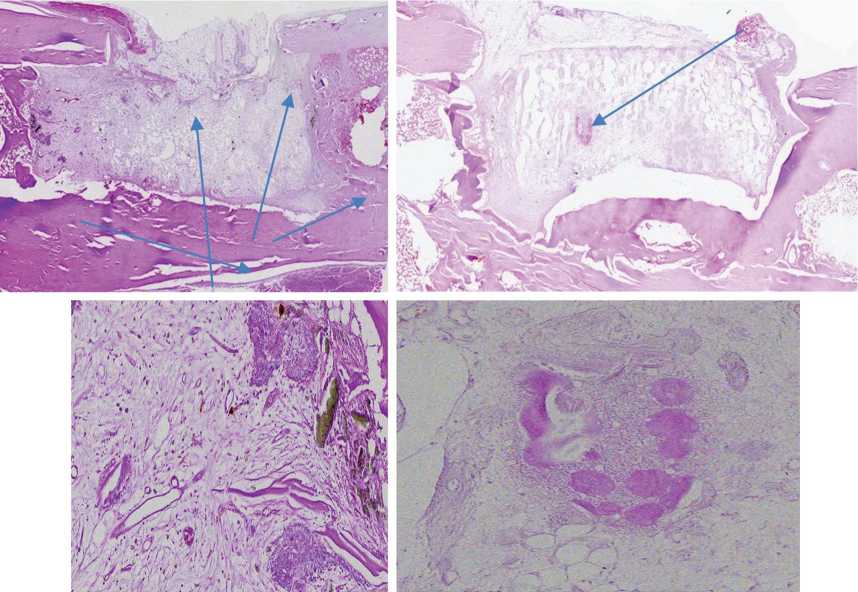
Рис. 6. Верхний ряд: гистологический препарат продольного разреза зоны монокортикального дефекта бедренной кости через 3 мес. (слева) и через 6 мес. (справа) после имплантации материала Гироид-50 мкм, окраска гематоксилином и эозином, ×10. Нижний ряд: те же препараты соответственно, участки новообразованной костной ткани, ×40. Тонкими стрелками указаны островки костной ткани, вросшей в поры материала
Через 6 мес. в группе Гироид-50 мкм в динамике отмечено увеличение числа и площади островков кости в толще имплантата, а также появление зон резорбции материала по всей толще в виде округлых пустот. Со стороны костномозгового канала отмечено обрастание имплантата костной тканью, соответствующей по структуре кортикальной кости (рис. 6).
Суммарные данные по площади новообразованной костной ткани представлены в таблице 2.
Таблица 2
Распределение величины площади новообразованной костной ткани в зоне дефекта по группам исследования — проценты к его общей площади, среднее ± выборочное стандартное отклонение
|
Группа |
Площадь новообразованной костной ткани на момент вывода из эксперимента, % |
|
|
через 3 месяца |
через 6 месяцев |
|
|
Цилиндры |
11 ± 4 |
31 ± 6 |
|
Гироид |
14 ± 5 |
29 ± 4 |
|
Гироид-50 мкм |
17 ± 7 |
27 ± 8 |
|
Гироид-150 мкм |
39 ± 5* |
41 ± 7* |
Примечание : значения, обозначенные знаком *, статистически значимо отличаются от значений в других группах для данного срока наблюдения, критерий Kruskal – Wallis, р < 0,05
В группе Гироид-150 мкм статистически значимо больше площадь новообразованной костной ткани по сравнению с остальными группами исследования. При этом следует отметить, что во всех остальных группах наблюдается прорастание кости внутрь материала с течением времени, что свидетельствует о наличии остеокондуктивных свойств у всех исследуемых материалов.
ОБСУЖДЕНИЕ
Критические дефекты кости, не подвергающиеся самостоятельно репарации, составляют в настоящее время одну из серьезных проблем современной медицины. Возможности применения собственной кости, трупной кости и кости животных ограничены по разным причинам (ограничение количества, риск передачи инфекций, иммунные реакции), что делает создание синтетических костнозамещающих материалов перспективным направлением современной регенеративной медицины. Активно развивающиеся в последние 10 лет технологии 3D-печати значительно расши- рили возможности создания материалов с заданной структурой, однако возникла проблема поиска наиболее эффективных образцов для замещения костной ткани, чему и посвящены многочисленные исследования последних лет.
Целью нашего исследования было установление влияния трехмерной организации пор на остео-кондуктивные свойства костнозамещающего материала. Влияние структуры пористого материала на остеокондуктивные свойства созданных из них костнозамещающих блоков в последние годы широко обсуждается в литературе [27–31]. При этом признается, что небольшие поры облегчают адгезию клеток и их первичную дифференцировку, но затрудняют дальнейшее прорастание сосудов и ухудшают питание новообразованных тканей. Очень большие поры снижают механические свойства блоков материала, из-за чего возможно их преждевременное разрушение и нарушение врастания, что особенно важно при заполнении сегментарных дефектов диафиза костей [32]. Одним из направлений решения этой проблемы является создание в одном образце пор различного диаметра, позволяющих добиться высокой пористости при сохранении механических свойств материала, чему и посвящена наша работа.
Выбор архитектуры Гироид обусловлен как предшествующими нашими работами, так и результатами исследований, показывающими теоретические преимущества этой архитектуры для процесса миграции клеток. Например, в статье S. Seehanam et al. [33] проведено сравнение структур Гироид и Diamond по различным биомеханическим параметрам и способности стимулировать рост клеток, в результате чего сделан вывод о преимуществе архитектуры Гироид с размером основных пор 500 мкм.
Результаты применения материалов in vivo в нашем исследовании сопоставимы с работами других исследователей. Так, в статье R. Wu at al. [34] проведено сравнение остеокондуктивных свойств керамического материала на основе Mg-замещенного валлостонита с диаметром пор 200, 320, 450 и 600 мкм и кубической структурой ячеек на модели критического дефекта мыщелка бедренной кости кролика на сроках от 2 до 16 нед. При этом группа Цилиндры нашего исследования соответствовала материалу с размерами пор 320 мкм, а группа Гироид — размеру пор более 600 мкм. Также как и в исследовании указанных выше авторов, лучшие остеокондуктивные и остеоиндуктивные свойства показали структуры с большим диаметром пор. Количество образованной костной ткани для материала с порами 400 и 600 мкм в сроки около 3–4 мес. (30–35 %) соответствуют группе Гироид с дополнительной модой пор 150 мкм [34]. При этом авторы данной работы использовали дефект в губчатой кости метаэпифиза бедренной кости вблизи от зоны красного костного мозга, в отличие от нашей работы, где дефект располагали в диафизарной зоне. Спецификой нашего исследования стало использование структуры типа Гироид с добавлением еще одного уровня пор, который при диаметре 150 мкм показал достоверно значимое увеличение прорастания костной ткани внутрь материала.
X. Wang at al. [35] показали положительные результаты увеличения пористости материала на основе трикальцийфосфата в виде увеличения образования костной ткани на срезах на уровне середины материала. Однако моделью в работе был дефект костей свода черепа с мембранозным костеобразованием, а сам материал получен путем вспенивания смеси порошка трикальцийфосфата, то есть без четкой 3D-организации пор. Большие продольные поры 1 мм в диаметре образованы путем высверливания в исходном блоке, исходные поры были диаметром 550 мкм, общая пористость составляла 80 %. Толщина блока была всего 1,5 мм, а диаметр — 8 мм. Авторы сообщают об уровне образования костной ткани в материале до 40–50 % через 3 мес., однако участки костной ткани повторяли размеры пор, а различия между блоками с порами и непористым материалом были только в средней части.
H.K. Lim at al. [36] изучали керамические материалы на основание гидроксиапатита и трикальциевого фосфата на модели костного дефекта черепа кролика на сроках 4 и 8 нед. В материале были только крупные основные поры размерами от 0,8 до 1,4 мм с шагом 0,2 мм без дополнительного сообщения между ними. Авторы сообщают о разрастании костной ткани к двум месяцам только до 10 %, при этом отмечают, что на данном сроке размер пор уже не влияет на количество образованной костной ткани. По сравнению с нашей работой, авторы применили меньшие сроки наблюдения, простую форму решетки и отсутствие пор в материалах, а также модель дефекта черепа, что, вероятно, и обусловило худшие гистологические результаты.
K. Shibahara at al. [37] также изучали влияние микропор на остеокондуктивные свойства керамического костнозамещающего материала (в работе карбонатзамещенный апатит). Однако размер основных пор был значительно меньше (около 300 мкм), их структура линейная («сотовое» расположение), а микропоры размером около 1 мкм расположены хаотично. Данный материал соответствует архитектуре Цилиндры в нашем исследовании. Свойства in vivo проверяли на модели дефекта локтевой кости кролика с дополнительной фиксацией пластиной и винтами на сроках 1 и 4 мес. Площадь новообразованной костной ткани даже через 4 мес. в группе с большими порами и большими микропорами составила всего 12 %, в группах с меньшими размерами пор этот показатель был менее 10 %, что сопоставимо с нашими результатами в группе Цилиндры. Это говорит о необходимости создания в материале основной группы пор диаметром больше 1 мм для более быстрого врастания тканей, а модификация должна проводиться уже в соединениях пор и микропорах, которые создают необходимые условиях для дифференцировки клеток и ускоряют процесс резорбции костнозамещающего материала.
J. Jiao et al. [32] изучали влияние пористости (60, 70 и 80 %) костнозамещающего материала из тантала на его остеокондуктивные свойства. Размер основных пор был соответственно 450, 600 и 800 мкм, а соединения между ними — 100 мкм. 3D-структуру авторы описали как бионическую трабекулярную, соответствующую структуре нативной губчатой кости. Для изучения свойств in vivo использовали модель некритического метафизарного дефекта наружного мыщелка бедренной кости крысы размерами 3 мм в диаметре и 5 мм в глубину на сроках 6 и 12 нед. после имплантации. Авторы сообщают о площади новообразованной костной ткани через 12 нед. в группах с пористостью 60, 70 и 80 % соответственно 14,3 %, 28,6 %, и 23,3 %, что уступает результатам в группе Гироид — 150 мкм через 3 мес., однако больше, чем площадь новообразованной костной ткани в других группах. Объяснение этому факту лежит в большей общей пористости нашего материала (около 85 %) и более сложной структуре пор, что оказывает принципиальное влияние на остеокондуктивные свойства материала. Особенностью материалов из металлов (титан, тантал и их сплавы) является невозможность его резорбции и сохранение постоянного размера пор в течение всего времени остеоинтеграции.
Мы согласны с авторами, считающими, что в настоящее время нет единых подходов к изучению кост-нозамещающих материалов на животных моделях, это очень сильно затрудняет сравнение результатов и выработку рекомендаций для клинической практики [32].
В результате нашего исследования можно сделать вывод о положительном влиянии выбора структуры Гироид с большим диаметром основных пор (более 1 мм) и добавления при печати в структуру материала дополнительных соединительных каналов средним диаметром 150 мкм. Это позволяет достоверно увеличить количество новообразованной костной ткани и, соответственно, улучшить остеокондук-тивные свойства костнозамещающего материала на основе керамики. Причиной данного явления может быть влияние поверхности пор с определенной кривизной на дифференциацию прогенитор-ных клеток по остеобластическому пути, что отражается в большем количестве врастающей костной ткани. Однако отсутствие нарастания количества новообразованной костной ткани при сравнении сроков наблюдения в 3 и 6 мес. говорит о недостаточной способности к резорбции выбранного вещества (трикальциевый фосфат), поскольку максимум прорастания достигается уже на ранних сроках и в дальнейшем ограничивается именно сохранением материала в объеме дефекта. Таким образом, пути дальнейшего повышения остеокондуктивных свойств лежат не только в оптимизации архитектуры материала, но и в выборе для его построения вещества с большей способностью к резорбции.
ЗАКЛЮЧЕНИЕ
Добавление в структуру керамических материалов на основании трикальциевого фосфата Гироида дополнительной моды пор до 150 мкм в диаметре позволяет статистически значимо увеличить количество новообразованной костной ткани и улучшить остеокондуктивные свойства материала.


