Экспериментальное цитотоксическое поражение предстательной железы в моделировании хронического простатита
Автор: Хорош В.Я., Мысак А.И.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Целью этой работы было выявить участие токсичных продуктов разложения тканей и индуцированного цитотоксического механизма поражения предстательной железы в эксперименте. Патологический процесс в предстательной железе был сформирован на модели HP у самцов крыс-альбиносов. Экспериментальная часть была проведена у 78 взрослых самцов крыс, 16 из которых были контрольной группой (нетронутой). HP инициировали кастрацией самцов крыс с одновременным введением тестостерона в дозе 0,1 мг / кг подкожно один раз в день в течение 21 дня. Кроме того, дважды с интервалом в 3 дня животным вводили подкожно токсичным стандартизованным ксеноскином свиной свиной головы с экстрактом в дозе 1 мл / кг. Экспериментальные животные наблюдались ежедневно. В этом случае было оценено их общее состояние, мобильность. На 2, 7 и 14 день эксперимента были взяты образцы для исследования, и животные были выведены из эксперимента под анестезией. Чтобы восстановить экспериментальную модель, пришел к выводу, что был сделан из критериев глубины морфологических изменений в ткани предстательной железы в соответствии с их уровнем лейкоцитолиза и поляризованной флуоресценции железистого сока кристаллов в печати на стеклянная полка. Было доказано, что использование токсичного термодененатурированного субстрата ксеногенетической кожи в качестве индуктора HP обеспечивает высокую воспроизводимость и стандартизацию моделируемой модели патологического процесса. Особенности поляризованной флуоресценции компонентов предстательной железы представляют собой высокоинформативный тест на структурное и функциональное состояние предстательной железы и могут использоваться в качестве клинико-диагностических и прогностических критериев.
Хронический простатит, лейкоцитолиз, поляризованная флуоресценция кристаллов сока предстательной железы
Короткий адрес: https://sciup.org/142188364
IDR: 142188364
Текст научной статьи Экспериментальное цитотоксическое поражение предстательной железы в моделировании хронического простатита
The goal of this work was to reveal the participation of toxic decomposition products of tissues and induced cytotoxic mechanism of prostate lesion in the experiment. Pathological process in the prostate was formed on the model of HP in male albino rats. An experimental part was held on 78 adult male rats, 16 of which where control group (intact). HP were initiated by castration of male rats with simultaneous introduction of testosterone in a dose of 0,1 mg/kg subcutaneously once a day for 21 days. Besides that twice with an interval of 3 days animals were injected subcutaneously with toxic standardized extract head-treated swine xenoskin at a dose of 1 ml/kg. Experimental animals were observed daily. In this case, was estimated their general condition, mobility. On 2nd, 7th and 14th day of the experiment samples were taken for the study and animals were deduced from the experiment under anesthesia. In order re-establishing the experimental model came up with the conclusion that was made from the criteria of depth of morphological changes in the tissue of the prostate gland, accordance to their level of leucocytolysis and polarized fluorescence of gland juice of crystals in print on a glass slide. It was proved that the use of the toxic termodenaturated substrate of xenogenetic skin as inductor of HP provides high reproducibility and standardization of the pathological process’s simulated model. Features of polarized fluorescence of components prostate juice are highly informative test for structural and functional state of prostate gland and can be used as its clinical diagnostic and prognostic criteria.
В.Я. Хорош, А.И. Мысак
Тернопольская университетская больница, Тернопольский государственный медицинский университет, Украина
оделирование хронического простатита (ХП) занимает важное место как в решении задач разработки информативных методов диагностики, так и высокоэф фективного лечения. Исходя из понимания особенностей формирования патологии предстательной железы (ПЖ) как следствия сложных фазовых процессов в организме на всех уровнях его структурной организации, становится совершенно очевидной необходимость изучения указанной патологии с системных позиций и использование достижений фундаментальных наук, в частности, физики поверхностей и жидких кристаллов. Тем более что именно соединениям со свойствами жидких кристаллов, входящих в состав лецитиновых зерен сока ПЖ, присуща высокая оптическая активность, в частности, в виде способности к двойному лучепреломлению в виде высвечивания как основе метода поляризованной флуоресценции.
Цитотоксическое повреждение отдельных органов и тканей обычно связывают с протеолизом, как одним из проявлений патохимической фазы иммунопатологического процесса. При этом в поврежденных клетках происходит процесс биохимической деградации органических веществ (белков, жиров, углеводородов, нуклеиновых кислот и тому подобное) с образованием многочисленных, токсичных для живого организма, продуктов, так на- зываемых DAMPs (damage-associated molecular patterns) [1-3]. К ним относятся молекулы мышечного белка миозина, цитокины, органические кислоты, в частности, молочная, пировиноградная, мочевая, аминокислоты, фенольные соединения, например, индол, скатол, крезол, фенол, токсичные амины (кадаверин, путресцин), свободные радикалы и продукты липопероксида-ции. Протеолитическая активность нейтрофильных гранулоцитов при этом существенно усиливает сложный многокомпонентный механизм воспаления: лейкоцитоз, появление в крови С-реактивного белка, увеличение содержимого серкогликоидов, программируемая смерть клеток и тому подобное — все это проявления реакции на избыточное образование DAMPs [4-6]. Неслучайно отмечается повышенный интерес исследователей к изучению патогенного действия токсичных продуктов распада тканей, которое относят к генетически детерминированным механизмам адаптации высокоорганизованного многоклеточного организма к повреждению как таковому. Учитывая вышеизложенное, большой интерес вызывает роль цитотоксических факторов в формировании ХП, учитывая связь между возникновением данного заболевания и токсичным влиянием на организм.
ЦЕЛЬ РАБОТЫ
Изучить влияние токсичных продуктов распада тканей и □ индуцируемых ими цитотоксических механизмов в развитии поражения ПЖ в эксперименте.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальная часть работы была выполнена на 78 половозрелых крысах-самцах, 16 из которых были контрольной группой (интактные). Масса тела животных составляла от 190 до 245 г. ХП вызывался кастрацией и последующим подкожным введением тестостерона в течение 21 дня в дозе 0,1 мг/кг. Дважды с интервалом в 3 дня им подкожно вводили стандартизированный токсичный экстракт (ТЭ) термически обработанной ксено-кожи свиньи в дозе 1мл/кг [8, 9].

Рис. 1. Измельченный субстрат криолио-филизованной кожи свиньи
Вышеуказанную токсичную субстанцию получали следующим образом. Измельченный субстрат ксеноко-жи свиньи (рис. 1) выдерживали в сухожаровом шкафу при 350OС в течение 90 мин, в результате чего субстрат приобретал своеобразный светлокоричневый цвет (рис.2). Токсичность его возникала в результате декарбоксилирования α-аминокислот и разрушения всех пептидных связей белковых макромолекул при высокотермической обработке с образованием первичных алифатических аминов. К 10 г термически обработанного субстрата добавляли 60 мл дистиллированной воды и

Рис. 2. Ксенокожа свиньи после термической обработки выдерживали при 20OС на протяжении 4 ч, после чего центрифугировали при 1500 об.мин–1 в течение 30 мин. Полученную в сверхосадке токсичную субстанцию стандартизировали по содержанию аминов до уровня 10 г/л.
Экспериментальные животные наблюдались ежедневно: оценивалось их общее состояние, двигательная активность. Все исследуемые животные содержались на общепринятом рационе вивария Тернопольского государственного медицинского университета. После завершения эксперименг-тальной части подопытных животных под эфирным наркозом выводили с эксперимента (согласно регламентированным Правилам использования лабораторных животных), отбирая в качестве материала для исследования периферическую кровь и ткань ПЖ.
Спектральный анализ поляризуемой флуоресценции нативного биоматериала от животных (изолированные лейкоциты крови и кристаллы сока ПЖ) осуществляли с помощью люминесцентного микроскопа ЛЮМАМ 8-3М, оснащенного фотоэлектронной насадкой ФМЭЛ-1, которая содержит набор интерференционных светофильтров для выявления узких спектральных диапазонов, а также поляризационного микроскопа МС-200 с програмным обеспечением (“Sumy Electron Optics”, Украина).
О развитии экспериментальной модели ХП судили по критериям глубины морфологических изменений в ткани ПЖ: уровню лейкоцитолиза и характеру поляризуемой флуоресценции кристаллов сока железы в отпечатке на предметном стекле [10].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате инкубации изолированных лейкоцитов периферической крови интактных крыс с ТЭ in vitro отмечена выраженная реакция лейкоци-
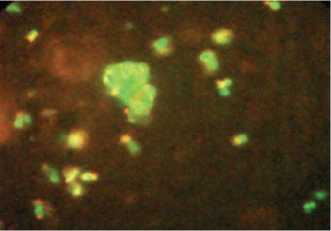
Рис. 3. Реакция лейкоцитолиза in vitro под воздействием токсичного экстракта у интактных крыс толиза с деструкцией клеток, кариоли-зис в лимфоцитах (рис. 3).
При исследовании нативной крови подопытных животных на фоне воспроизведенного в эксперименте ХП (рис. 4) были выявлены аналогичные процессы лейкоцитолиза с той лишь разницей, что спектр вторичной люминесценции лейкоцитов в данном случае характеризовался большей длиной волны с одновременным снижением интенсивности свечения.
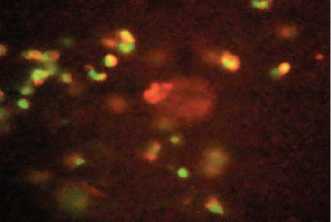
Рис. 4. Реакция лейкоцитолиза in vitro после повторного введения токсичного экстракта у кастрированных крыс
Последнее, на наш взгляд, является достаточно убедительным свидетельством интоксикации организма, связанной с влиянием ТЭ, в условиях экспериментального воспроизведения патологического процесса в предстательной железе.
Доказательством этого является и картина патогистологических изменений в предстательной железе. Проведенные гистологические исследования установили перидуктальную и периацинозную лейкоцитарную инфильтрацию стромальной междолевой ткани простаты. Наблюдается значительное уменьшение просветов части выводных протоков, деструктивные изменения выстилающего их эпителия (рис. 5). Нарушение оттока простатического секрета приводит к увеличению размеров и деформации ПЖ,
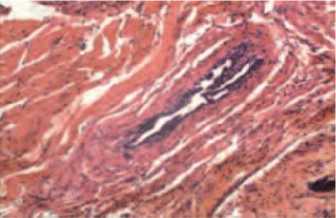
Рис. 5. Гистологические изменения предстательной железы при моделировании ХП в эксперименте. Склеротические изменения выводных протоков. Значительная лейкоцитарная инфильтрация стромы. Окраска гематоксилином и эозином х 200
изменениям формы ацинусов секреторных отделов со значительным накоплением секрета в их просвете. Отмечается плоскоклеточная метаплазия секреторного эпителия ацинусов (рис. 6).
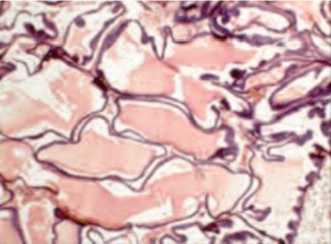
Рис. 6. Гистологические изменения предстательной железы при моделировании ХП в эксперименте. Гипертрофированные конечные секреторные отделы заполнены секретом, уплощенный железистый эпителий. Окраска гематоксилином и эозином х 200
Также выявлен фиброз некоторых отделов предстательной железы и дистрофичные изменения ацинусов. Разрастание соединительной ткани сопровождалось значительными изменениями сосудистой системы органа. Отмечено утолщение стенки артерий и артериол, кровенаполнение просветов всех сосудов и, особенно, венул и вен (рис. 7).
Кроме того, убедительным доказательством токсического действия ТЭ на ПЖ и развитие ХП являются результаты исследования поляризуемой флуоресценции кристаллов сока предстательной железы. Относительно мелкие неправильной формы кристаллы сока ПЖ при развитии ХП в условиях избыточной концентрации тестостерона (рис. 8) заметно увеличиваются в размере в условиях потенцирования экспериментального патологического процесса в железе токсичным факто-
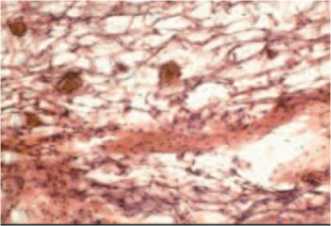
Рис. 7. Гистологические изменения предстательной железы при моделировании ХП в эксперименте. Разрастание соединительной ткани, измененные сосуды микроциркуля-торного русла. Окраска гематоксилином и эозином х 200
ром (рис. 9). Для сока предстательной железы интактного животного характерными являются лецитиновые зерна примерно одинакового размера (в пределах 2-3 мкм), в то время как в условиях хронического воспаления размеры зерен увеличиваются до 5-6 мкм с характерными изменениями формы кристаллов преимущественно в виде мальтийского креста. Учитывая анизотропные свойства липидных компонентов сока предстательной железы, являющиеся физической основой их жидкокристаллических характеристик, изменение размеров кристаллов и характера их поляризуемой флуоресценции доказывает
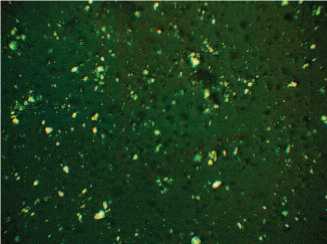
Рис.8. Поляризованная флуоресценсия кристаллов сока предстательной железы при ХП без дополнительного введения ТЭ
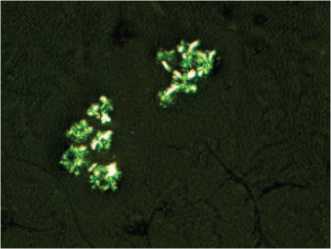
Рис. 9. Увеличенные кристаллы сока предстательной железы при ХП и ДГПЖ у животных с введенным ТЭ системный характер формирования указанного патологического процесса, реализация которого осуществляется как на уровне целостного организма, так и на клеточно-молекулярном и субмолекулярном уровнях. Вышеописанный феномен приобретает роль высокочувствительного информативного теста для решения задач диагностиче-ски-прогностического направления, а также для оценки эффективности новых средств и способов лечения хронического воспалительного процесса в предстательной железе.
ЗАКЛЮЧЕНИЕ
Список литературы Экспериментальное цитотоксическое поражение предстательной железы в моделировании хронического простатита
- Majno G, La Gattuta M, Thompson TE. Cellular death and necrosis: chemical, physical and morphologic changes in rat liver.//Virchows Arch Pathol Anat Physiol Klin Med. 1960. Vol. 333. Р. 421-465.
- Romson J L, Hook BG, Kunkel SL. Reduction of the extent of ischemic myocardial injury by neutrophil depletion in the dog.//Circulation. 1983. Vol. 67. P. 1016-1023.
- Jaeschke H, Hasegawa T. Role of neutrophils in acute inflammatory liver injury.//Liver Int. 2006. Vol. 26. P. 912-919.
- Копо H, Rock KL. How dying cells alert the immune system to danger.//Nat Rev Immunol. 2008. Vol. 8. P. 279-289.
- Rock KL, Kono H. The inflammatory response to cell death.//Annu Rev Pathol. 2008. Vol. 3. P. 99-126.
- Lotze MT. The grateful dead: damage-associated molecular pattern molecules and reduction/oxidation regulate immunity.//Immunol Rev. 2007. Vol. 220. P. 60-81.
- Kos FJ, Engleman EG. Requirement for natural killer cells in the induction of cytotoxic Tails.//J Immunol. 1995. Vol. 155. P. 578-584.
- Пат. 63156 U. Способ моделирования хронического простатита с доброкачественной гиперплазией предстательной железы/Хорош В.Я. -№ U200103758; 30.08.2010; опубл. 25.02.2011, Бюл. № 4/2011.
- Пат. 62894 U. Способ моделирования цитотоксического действия термически поврежденной биологической ткани/Хорош В.Я., Подручная С.Р. -№ U200100052; 04.01.2011; опубл. 26.09.2011, Бюл. № 18/2011.
- Пат. 57466 U. Способ люминесцентного анализа/Хорош В.Я., Демяненко В.В. -№ U201010471; 04.01.2011; опубл. 26.09.2011, Бюл. № 18/2011.


