Экспериментальное изучение особенностей формирования парагемолитическими вибрионами биопленки на поверхностях биотических объектов
Автор: Полеева Марина Владимировна, Чемисова Ольга Сергеевна, Водопьянов Сергей Олегович, Меньшикова Елена Аркадьевна, Курбатова Екатерина Михайловна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Наиболее распространенными патогенами, встречающимися на морепродуктах, способными вызвать серьезные заболевания у людей, являются парагемолитические вибрионы. Занимая различные экологические ниши, V. parahaemolyticus может существовать в воде в планктонной форме или же быть прикрепленным к инертным частицам, таким как зоопланктон, рыбы, моллюски и ракообразные, и формировать биопленку. Цель работы - изучение особенностей формирования биопленки парагемолитическими вибрионами на поверхностях биотических объектов для дальнейшего совершенствования алгоритма исследования на галофильные вибрионы в зонах рекреации на этапе отбора проб. Изучение проводили бактериологическим методом и методом Real-Time ПЦР. Показано, что парагемолитические вибрионы активно используют в качестве питательных веществ компоненты чешуи и хитина, что способствует образованию биопленки и интенсивному размножению на биотических поверхностях. Высокую концентрацию жизнеспособных клеток в биопленке на поверхности биотических субстратов следует учитывать при выборе объектов исследования на наличие V. parahaemolyticus, особенно в зонах рекреации.
Биопленка, планктон, биотические субстраты, днк, хитин, чешуя
Короткий адрес: https://sciup.org/147227107
IDR: 147227107 | УДК: 579.843:579.26:547.995.12 | DOI: 10.17072/1994-9952-2019-4-417-425
Текст научной статьи Экспериментальное изучение особенностей формирования парагемолитическими вибрионами биопленки на поверхностях биотических объектов
Ежегодно в мире вылавливается и потребляется свыше 100 млн т морепродуктов [Cisneros-Montemayor et al., 2016], которые являются скоропортящимися и представляют опасность для здоровья из-за загрязнения патогенами [Reyhanath,
Kutty, 2014]. Поэтому безопасность морепродуктов важна для поддержания здоровья населения.
Наиболее распространенными патогенами, встречающимися на морепродуктах (креветки, рыба, моллюски) и способными вызвать серьезные заболевания у людей, являются парагемолитиче-ские вибрионы [Lee, Liu, Huang, 2003; Беленева,
Масленникова, Магарламов, 2004; Lin, Yu, Chou, 2004; Park et al., 2004; Тарасенко др., 2016]. Занимая различные экологические ниши, V. parahaemolyticus, благодаря наличию одного полярного жгутика, может существовать в воде в планктонной форме или же быть прикрепленным к инертным частицам, таким как взвешенные частицы, зоопланктон, рыбы, моллюски и ракообразные [Скитович, Шадрова, Прунтова, 2015].
Употребление морепродуктов, зараженных V. parahaemolyticus, приводит к вспышкам болезней пищевого происхождения (Китай, Австралия, Индонезия, Россия), протекающим по типу пищевой токсикоинфекции. Кроме того, парагемолитиче-ские вибрионы могут быть причиной заболеваний не только пищевого характера людей. Известны случаи инфицирования ран, ушей, связанные с пребыванием в морской воде; имеются сообщения о пневмонии, септицимии, хроническом посттравматическом отите, вызванном V. parahaemolyticus [Бойко, 1994; Deepanjali et al., 2005; Zhang, Orth, 2013; Shaw et al., 2014; Elmahdi, DaSilva, Parveen, 2016].
Непосредственное заражение человека от воды – явление редкое, так как парагемолитические вибрионы, в первую очередь, встречаются в морской воде, которая для питьевых целей не употребляется. В тех же количествах морской воды, которые попадают в организм человека при купании, видимо, не содержится того количества возбудителя, которое могло бы вызвать заболевание. Этим и следует объяснить единичность сообщений о заболеваниях, связанных с водными заражениями человека бактериями V. parahaemolyticus . Однако такую возможность нельзя исключать, учитывая вспышку диареи в г. Абиджан (Кот-д'Ивуар) в 1987 г., обусловленную V. parahaemolyticus и связанную с употреблением воды из лагуны, которая продолжались 8 недель и охватила 84 человека [Хотько, Дмитриев, 2002]. Были зарегистрированы случаи выделения парагемолитических вибрионов и в пресноводных водоемах [Бойко, 1994; Chakraborty, Nair, Shinoda, 1997]. Возможны случаи вторичного инфицирования овощных продуктов при обработке их водой, содержащей V. parahaemolyticus .
На протяжении большей части истории микробиологии микроорганизмы в основном характеризовались как планктонные, свободно взвешенные клетки и описывались на основе их характеристик роста в питательно богатых культуральных средах. Впервые микробиологический феномен того, что микроорганизмы прикрепляются и растут на поверхностях, описал Э. ван Левенгук, увидев микроорганизмы на поверхности зубов, еще в конце XVII в. Достижения технологии электронной микроскопии привели к обнаружению структурных поверхностно-ассоциированных организованных микроорганизмов, заключенных во внеклеточную матрицу полимерного вещества – биопленок [Donlan, 2002].
Биопленка представляет собой совокупность микробных клеток, которые необратимо связаны (не удаляются путем мягкого ополаскивания) с поверхностью и заключены в матрицу преимущественно полисахаридного материала и могут образовываться на самых разных поверхностях, таких как живые ткани, медицинские изделия, трубопроводы [Шварц, 2015]. Граница раздела фаз «твердое вещество-жидкость» обеспечивает идеальную среду для прикрепления и роста микроорганизмов. Отмечено, что степень микробной колонизации увеличивается по мере увеличения шероховатости поверхности, что связано с большей площадью прикрепления [Characklis, McFeters, Marshall, 1990]
Способность бактерий к формированию биопленок приводит к тому, что биопленочные штаммы демонстрируют множественную лекарственную устойчивость [Ahmed et al., 2018], устойчивость к дезинфектантам [Song et al., 2017], что представляет собой потенциальную угрозу для здоровья человека. Формируя биопленки, микроорганизмы могут быть в 1000 раз более устойчивыми к стрессу, чем планктонные формы [Brooun, Liu, Lewis, 2000; Ashrafudoulla et al., 2019], сохраняя при этом способность к заражению, что демонстрирует важность изучения биопленкообразования у болезнетворных микроорганизмов. Опасность заключается также в том, что наблюдается широкое распространение морепродуктов по всей стране из городов, занимающихся рыбным промыслом, что может привести к возникновению заболевания в случае инфицированности их вибрионами в городах, не являющихся прибрежными и не имеющими прямого контакта с морем [Mizan et al., 2016].
Согласно МУК 4.2.2046-06, по эпидпоказаниям на V. parahaemolyticus исследуют пищевые продукты, воду открытых водоемов, гидробионтов. Способность к формированию биопленок требует дополнительного изучения в плане определения объектов, способствующих накоплению возбудителя и требующих внимания при проведении микробиологических исследований.
Так как парагемолитические вибрионы выделяются как из воды поверхностных водоемов, так и из гидробионтов, целью нашей работы явилось изучение особенностей формирования биопленки бактериями вида V. parahaemolyticus на поверхностях биотических объектов для дальнейшего совершенствования алгоритма исследования на га-лофильные вибрионы в зонах рекреации на этапе отбора проб.
Материалы и методы исследования
Материал для исследования
В работе были исследованы штаммы V. рa-rahaemolyticus , характеристика которых приведена в табл. 1. Штаммы имели как природное, так и клиническое происхождение и различались по наличию основного фактора патогенности параге-молитических вибрионов – гена tdh – прямого термостабильного гемолизина V. parahaemolyticus . Все штаммы были получены из коллекции Музея живых культур с Центром патогенных для человека вибрионов ФКУЗ Ростовский противочумный институт Роспотребнадзора.
Таблица 1
Характеристика штаммов, использованных в работе
|
№ штамма |
Генетическая характеристика |
Объект выделения |
Место и год выделения |
|
13331 |
tdh+ trh- |
человек |
Япония, 1971 |
|
14704 |
tdh- trh- |
рыба |
Азовское море, 1984 |
|
14810 |
tdh+ trh- |
человек |
г. Новороссийск, 1976 |
|
16696 |
tdh- trh- |
морская вода |
г. Новороссийск, 1973 |
|
19013 |
tdh+ trh- |
человек |
г. Бердянск, 1988 |
|
19149 |
tdh- trh- |
морская вода |
г. Находка, 2009 |
Методы исследования
Питательные среды . Для культивирования штаммов использовали 1%-ную пептонную воду с 2%-ным NaCl (рН 7.8); 2%-ный агар Мартена с 2%-ным NaCl (рН 7.7); 0.3%-ный агар Мартена с 2%-ным NaCl (рН 7.7).
Биотические субстраты . В качестве субстратов использовали чешую рыбы и хитиновый экзоскелет креветки, которые нарезали пластинами 5×5 мм, помещали в количестве 30 штук во флаконы с 50 мл морской воды и автоклавировали при 130ºС, 1.5 атм в течение 60 мин.
Выращивание биопленки. Из суточной агаровой культуры штаммов V. parahaemolyticus готовили взвесь 109 микробных клеток/мл (мк.кл./мл). Во флаконы с 50 мл морской воды и субстратами добавляли взвесь вибрионов до конечной концентрации во флаконе 104 мк.кл./мл. Параллельно проводили высев на твердую питательную среду для определения КОЕ/мл. В качестве контроля все исследуемые штаммы засевали во флаконы с 50 мл морской воды без субстратов. Флаконы инкубировали в течение 1 месяца при комнатной температуре (t = 25±2ºС), что соответ- ствует температурным условиям окружающей среды в летнее время года.
Бактериологические методы . Для контроля жизнеспособности штаммов V. parahaemolyticus использовали метод бактериологического посева супернатантов и отпечатков субстрата на твердую питательную среду – агар Мартена с 2%-ным NaCl [Титова, Веркина, 2016]. Результат оценивали по наличию роста.
Микроскопия . Образцы пластинок субстратов (чешуи и хитина) с сформировавшейся биопленкой окрашивали 0.1%-ным водным раствором Конго красным по методике, предложенной С.В. Титовой и Л.М. Веркиной [2016]. Микроскопию проводили на микроскопе Nicon Eclipse E200 (Japan).
Real-Time ПЦР . Для проведения ПЦР в «реальном времени» отбирали по 0.3 мл из контрольных проб. Фрагменты хитина и чешуи стерильно трижды отмывали физиологическим раствором (рН 7.2) от несвязавшихся клеток, избавлялись от излишков влаги с помощью фильтровальной бумаги и помещали в 0.3 мл дистиллированной воды. Также отбирали по 0.3 мл проб планктонных микроорганизмов. Все пробы обеззараживали прогреванием при 100ºС в течение 30 мин., согласно руководству [Организация …, 2010].
Для проведения Real-Time ПЦР с количественным учетом результатов использовали сконструированные нами праймеры и зонд к гену металло-протеазы/коллагеназы V. parahaemolyticus [Рыков-ская и др., 2018]. Постановку реакции амплификации проводили в автоматическом детектирующем амплификаторе ДТ-Lite (ДНК-технология, Россия). Учет детекции флуоресцентного свечения проводили по каналу ROX с длиной волны 605 нм.
Результаты и их обсуждение
Для проведения Real-Time ПЦР в протокол исследования проб были включены образцы с известным количеством искомой ДНК – калибровочные стандарты, в качестве которых использовали взвеси суточных культур парагемолитических вибрионов с концентрацией клеток 109–102 м.кл./мл. Количество клеток взвесей определяли путем высева на чашки Петри и подсчета КОЕ. Программа проводит построение кривой линии по точкам калибровочных стандартов, в соответствии с которой проводится расчет концентрации исследуемых проб.
Отбор проб для постановки Real-Time ПЦР и бактериологического высева на питательные среды проводили ежедневно в течение 7 дней, затем один раз в неделю в течение 1 месяца.
В течение первых 3 сут. культивирования отме- чался активный рост парагемолитических вибрионов во всех испытуемых пробах, но степень роста была разной. Так, наименьшей скоростью роста характеризовались штаммы в контрольных флаконах с морской водой. Штаммы, культивируемые в морской воде с биотическими субстратами, имели более высокую скорость роста, что подтверждалось и бактериологическим методом путем подсчета КОЕ/мл, и методом Real-Time ПЦР при определении количества копий ДНК в течение всего периода наблюдения. Слабый рост в контрольных пробах с морской водой, по сравнению с планктоном над хитиновыми пластинками и чешуей, говорит о недостатке питательных веществ и использовании вибрионами биотических субстратов в качестве источника питания.
Через 72 ч. культивирования было отмечено, что штаммы парагемолитических вибрионов, не имеющие гена tdh , образуют на поверхности морской воды с хитином и чешуей довольно плотную пленку, в отличие от токсигенных штаммов, у одного из которых пленка визуально отсутствовала ( V. parahaemolyticus 19013), а у двух других была значительно менее выражена, чем у штаммов, выделенных из объектов окружающей среды.
К 14-м сут. наблюдения пленка на поверхности жидкости во флаконе с пластинками хитина и чешуей увеличилась и стала более плотной. В контрольных пробах при визуальном учете на поверхности раздела фаз «вода-воздух» все штаммы независимо от токсигенности и происхождения биопленки не образовывали на протяжении всего периода наблюдения.
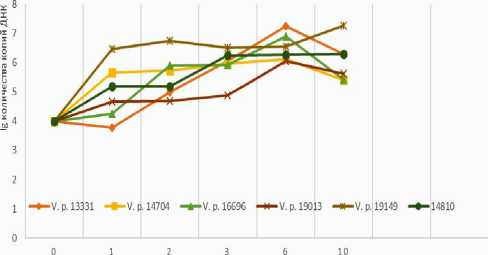
Изучение особенностей роста и формирования биопленок на поверхности субстратов показало, что парагемолитические вибрионы по-разному проявляют себя на хитине и на чешуе рыб. Так, на 6-е сутки культивирования, при отборе пластинок субстратов было отмечено, что клинические токси-генные штаммы в процессе жизнедеятельности утилизируют пластинки чешуи, в результате чего они становятся рыхлыми и при прикосновении к ним распадаются. Согласно литературным данным, чешуя рыб содержит 39–68% азотистых веществ (щелочерастворимых, водорастворимых и солерастворимых белков), 27–49% минеральных веществ (кальций, фосфор, магний и др.), 0.1–0.2% жира. Основная доля белков чешуи приходится на коллаген – 48–59%. Вибрионы способны активно вырабатывать фермент коллагеназу, что объясняет использование чешуи в качестве источника питательных веществ для роста и размножения микробных клеток [Якубова, Котенко, 2004; Антипова, Ву Тхи Лоан, 2009; Као, Нгуен, Карапун, 2016]. Динамика формирования биопленок штаммами поверхностных водоемов представлена на рис. 1.
Время культивирования, сутки
Рис. 1 . Динамика изменения количества копий ДНК при выращивании на пластинках чешуи
Столь активное использование рыбьей чешуи в качестве источника питания для роста и размножения парагемолитических вибрионов приводит к выводу о ее возможном применении в качестве основы для приготовления питательных сред. Учитывая, что чешуя является отходом рыбного производства, который образуется в большом количестве, возможное использование ее для приготовления питательных сред привело бы к снижению затрат на их производство.
Данные количественного ПЦР-анализа свидетельствуют о том, что образование биопленки на хитиновом панцире креветок шло активнее, чем на чешуе рыб (рис. 2). Панцирь креветки, по разным данным, состоит из белка – 7–37%, липидов – 3– 5%, углеводов – до 13%, минеральных веществ – до 22% [Осовская и др., 2010; Муравьев, 2017; Аллам, 2018]. Количество хитина составляет от 5– 25%. Хитин панциря креветок Penaeus semisulcatus может быть использован в качестве источника хитина и хитозана [Аллам, 2018].
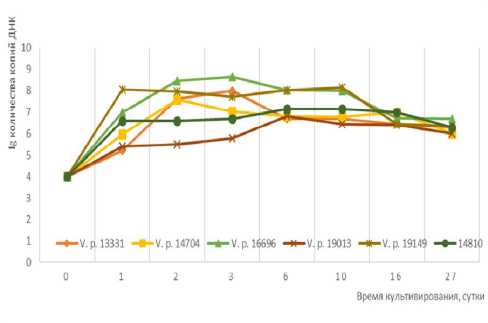
Рис. 2. Динамика изменения количества копий ДНК при выращивании на пластинках хитина
Поскольку хитин имеет компактную структуру, он нерастворим в большинстве растворителей, его биодоступность для микроорганизмов предположительно является невысокой, что объясняет меньшие темпы роста бактерий V. parahaemo-lyticus в планктоне с хитином. Однако наличие большого количества других питательных веществ позволяет микроорганизмам активнее размножаться в сравнении с контрольными флаконами с морской водой, где отсутствуют какие-либо питательные субстраты. Это согласуется с количественными результатами Real-Time ПЦР, согласно которым нарастание количества копий ДНК наиболее активно идет именно в планктоне над чешуей и хитином.
При культивировании контрольных проб с морской водой в течение 72 ч. методом Real-Time ПЦР было показано, что во всех пробах количество копий ДНК увеличивалось (рис. 3). На 6-e сутки инкубирования количество копий ДНК парагемоли-тических вибрионов значительно снизилось, что, учитывая отсутствие каких-либо питательных веществ в морской воде, может свидетельствовать о том, что ДНКаза вибрионов расщепляет ДНК клеток, и продукты расщепления используются для выживания других клеток [Беленева, Масленникова, Магарламов, 2004]. Такая же закономерность прослеживается и при изучении планктонных форм микроорганизмов из проб, содержащих пластинки чешуи и хитина.
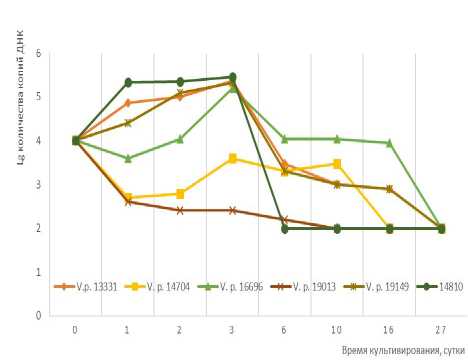
Рис. 3. Динамика изменения количества копий ДНК при выращивании в морской воде
Через 27 сут. культивирования ПЦР анализ показал, что количество копий ДНК в контрольной и планктонных пробах стало менее 103 в мл. При этом в биопленочных пробах количество копий ДНК V. parahaemolyticus было 104–106.
Таблица 2
Отношение количества копий ДНК планктонной формы к биопленочной
|
№ штамма |
Субстрат |
24 ч. |
48 ч. |
72 ч. |
16 сут. |
|
13331 |
чешуя |
2583 |
- |
- |
- |
|
хитин |
1108 |
13.6 |
0.2 |
1.1 |
|
|
14704 |
чешуя |
143.6 |
58.5 |
36.5 |
- |
|
хитин |
150.2 |
0.03 |
0.7 |
0.3 |
|
|
14810 |
чешуя |
59.6 |
156.1 |
10 |
- |
|
хитин |
40.8 |
40.8 |
0.02 |
- |
|
|
16696 |
чешуя |
15056 |
5841 |
457.4 |
3,7 |
|
хитин |
15.7 |
- |
- |
- |
|
|
19013 |
чешуя |
1891 |
4615 |
802.6 |
- |
|
хитин |
1360 |
8943 |
476.3 |
0.2 |
|
|
19149 |
чешуя |
169.7 |
450.6 |
51.9 |
- |
|
хитин |
3.2 |
5.6 |
4.8 |
0.2 |
Было установлено, что через 24 ч. инкубирования соотношение планктонной формы к биопле-ночной максимально независимо от наличия генов токсигенности и происхождения штаммов, т. е. в этот период времени количество копий ДНК в планктоне выше, чем в биопленке (табл. 2), и формирование биопленки находится на начальном этапе. Через 48 ч. у трех штаммов (14810, 19013 и 10149) соотношение биопленочной и планктонной форм продолжало расти, а у трех штаммов снизилось. К 16 дню инкубирования у всех штаммов данное соотношение значительно снизилось (у штамма V. parahaemolyticus 16696 в 4000 раз), что свидетельствует о том, что большая часть планктонных штаммов перешла в биопленочную форму для переживания неблагоприятных условий (снижение питательных веществ и отравление продуктами собственной жизнедеятельности).
Выводы
-
1. Утилизация парагемолитическими вибрионами в качестве питательных веществ компонентов чешуи и хитина способствует образованию биопленки и интенсивному размножению на биотических поверхностях.
-
2. Высокую концентрацию жизнеспособных клеток парагемолитических вибрионов в биопленке на поверхности биотических субстратов следует учитывать при выборе объектов исследования на наличие V. parahaemolyticus , особенно в зонах рекреации.
Список литературы Экспериментальное изучение особенностей формирования парагемолитическими вибрионами биопленки на поверхностях биотических объектов
- Аллам А.Ю. Разработка технологии получения хитозана из панциря креветки Penaeus semisulcalcatus и изучение возможности его использования в качестве пищевых покрытий и добавок: автореф. дис. … канд. техн. наук. Астрахань, 2018. 20 с.
- Антипова Л.В., Ву Тхи Лоан. Чешуя прудовых рыб - источник пищевого продукта [Электронный ресурс]. URL: http://www.tstu.ru/education/elib/pdf/st/2009/antipova
- Беленева И.А., Масленникова Э.Ф., Магарламов Т.Ю. Физиолого-биохимические свойства галофильных вибрионов Vibrio parahaemolyticus и V. alginolyticus, изолированных из гидробионтов залива Петра Великого Японского моря // Биология моря. 2004. Т. 30, № 2. C. 114-119.
- Бойко А.В. Факторы персистенции микроорганизмов // Эпидемиология, клиника, диагностика, лечение и профилактика важнейших инфекционных болезней: материалы конф. Тамбов; Астрахань, 1994. С. 33.
- Бойко А.В., Погорелова Н.П., Жигарева Т.М. Эколого-эпидемиологические аспекты распространенности Vibrio parahaemolyticus в пресноводном регионе // Журнал микробиологии, эпидемиологии и иммунологии. 1994. № 3. С. 49-51.
- Као Т.Х., Нгуен Т.М., Карапун М.Ю. Чешуя рыб как источник получения пищевого желатина // Молодой ученый. 2016. № 23. С. 113-115.
- Методы выявления и определения парагемолитических вибрионов в рыбе, нерыбных объектах промысла, продуктах, вырабатываемых из них, воде поверхностных водоемов и других объектах: МУК 4.2.2046-06. М.: Федеральный центр госсанэпиднадзора Минздрава России, 2006. 26 с.
- Муравьев А.А. Растворы смесей целлюлозы и хитина в ионных жидкостях и композиционные материалы на их основе: автореф. дис. … канд. хим. наук. СПб., 2017. 24 с.
- Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности: МУ 1.3.2569-09. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. 51 c.
- Осовская И.И. и др. Хитин-глюкановые комплексы. Физико-химические свойства и молекулярные характеристики: учеб. пособие / под. ред. Г.М. Полторацкого. СПб., 2010. 52 с.
- Рыковская О.А. и др. Разработка способа идентификации V. parahaemolyticus с помощью ПЦР в режиме реального времени // Здоровье населения и среда обитания. 2018. № 3 (300). С. 48-50.
- Скитович Г.С., Шадрова Н.Б., Прунтова О.В. Vibrio parahaemolyticus: распространение, выявление и методы идентификации // Ветеринария сегодня. 2015. № 3 (14). С. 66-70.
- Тарасенко Т.Т. и др. Заболеваемость прочими кишечными инфекциями в Приморском крае // Здоровье. Медицинская экология. Наука. 2016. Т. 3, № 66. С. 127-134.
- Титова С.В., Веркина Л.М. Моделирование биопленок холерного вибриона на твердых поверхностях (стекло и пластик) и визуализация их в световом и люминисцентном микроскопах // Клиническая и лабораторная диагностика. 2016. Т. 61, № 4. С. 238-241.
- Хотько Н.И., Дмитриев А.П. Водный фактор в передаче инфекций. Пенза, 2002. 232 с.
- Шварц Т.А. Биопленки как микробное сообщество // Вестник Курганского государственного университета. 2015. № 1, вып.7. С. 41-44.
- Якубова О.С., Котенко А.Л. Чешуя как источник получения ихтиожелатина // Вестник Астраханского государственного технического университета. 2004. № 2 (21). С. 130-134.
- Ahmed H.A. et al. Molecular characterization, antibiotic resistance pattern and biofilm formation of Vibrio parahaemolyticus and V. cholerae isolated from crustaceans and humans // International Journal of Food Microbiology. 2018. Vol. 274. P. 31-37.
- Ashrafudoulla Md. et al. Genetic Relationship, Virulence Factors, Drug Resistance Profile and Biofilm Formation Ability of Vibrio parahaemolyticus Isolated From Mussel // Front. Microbiol. 2019. Vol. 10. 513.
- DOI: 10.3389/fmicb.2019.00513
- Brooun A., Liu S., Lewis K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms // Antimicrobial Agents and Chemotherapy. Mar. 2000. P. 640-646.
- Chakraborty S., Nair G.B., Shinoda S. Pathogenic vibrios in the natural aquatic environment // Rev. Environ. Health. 1997. Vol. 12 (2). P. 63-80.
- Characklis W.G., McFeters G.A., Marshall K.C. Physiological ecology in biofilm systems // Biofilms / Characklis W.G., Marshall K.C., eds. New York: John Wiley & Sons, 1990. P. 341-394.
- Cisneros-Montemayor A.M. et al. A global extimate of seafood consumption by coastal indigenous peoples // PLoS One. 2016. 11. e0166681. 10.1371/journal.pone. 0166681.
- DOI: 10.1371/journal.pone.0166681
- Deepanjali A. et al. Seasonal variation in abundance of total and pathogenic Vibrio parahaemolyticus bacteria in oysters along the southwest coast of India /// Appl. Environ. Microbiol. 2005. Vol. 71, № 7. P. 3575-3580.
- Donlan M.R. Biofilms: Microbial Life on Surface // Emerg. Infect. Dis. 2002. Vol. 8, № 9. P. 881-890.
- Elmahdi S., DaSilva L.V., Parveen S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: A review // Food Microbiol. 2016. Vol. 57. P. 128-134.
- Lee K.K., Liu P.C., Huang C.Y. Vibrio parahaemolyticus infectious for both humans and edible mollusk abalone // Microbes Infect. 2003. Vol. 5. P. 481-485.
- Lin C., Yu R.C., Chou C.C. Susceptibility of Vibrio parahaemolyticus to various environmental stresses after cold shock treatment // Int. J. Food Microbiol. 2004. Vol. 92. P. 207-215.
- Mizan M.F.R. et al. Effects of NaCl, glucose, and their combinations on biofilm formation on black tiger shrimp (Penaeus monodon) surfaces by Vibrio parahaemolyticus // Food Control. 2016. Vol. 89. P. 203-209.
- Park K.S. et al. Functional characterization of two type III secretion systems of Vibrio parahaemolyticus // Infect. Immun. 2004. Vol. 72. P. 6659-6665.
- Reyhanath P.V., Kutty R. Incidence of multidrug resistant Vibrio parahaemolyticus isolated from Ponnani, South India // Iran. J. Microbiol. 2014. Vol. 6, № 2. P. 60-67.
- Shaw K.S. et al. Antimicrobial susceptibility of V. vulnificus and V. parahaemolyticus recovered from recreational and commercial areas of Chesapeake Bay and Mareland coastal bays // PLoS One. 2014. Vol. 9 (2).
- DOI: 10.1371/journal.pone.0089616
- Song X. et al. Effect of temperature on pathogenic and non-pathogenic Vibrio parahaemolyticus biofilm-formation // Food Control. 2017. Vol. 7. P. 485-491.
- Zhang L., Orth K. Virulence determinants for Vibrio parahaemolyticus infection // Curr. Opin. Microbiol. 2013. Vol. 16, № 1. P. 70-77.


