Экспериментальное моделирование костного дефекта со склерозированной стенкой
Автор: Нетылько Георгий Иванович, Румакин Василий Петрович, Конев Владимир Александрович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2014 года.
Бесплатный доступ
Цель. Разработать модель костного дефекта со склерозированной костной стенкой, пригодную для изучения различных патогенезов заболеваний, связанных со склерозированием кости, и их последствий. Материалы и методы. В эксперимент вошли 12 кроликов, которые были распределены на 2 группы. Опытную группу составили животные, которым выполняли создание модели костного дефекта со склерозированной стенкой (n=6). В контрольной группе животных создавали костный дефект без зоны склероза (n=6). Лучевые и морфологические исследования выполняли в обеих группах на 45-е сутки и 90-е сутки после проведенных операций. Эвтаназию для забора органов на морфологическое исследование выполняли на 45-е, 90-е сутки после операции, соответственно по трое животных на каждый срок. Результаты. В контрольной группе с неизмененным костным дефектом процент фиброзной ткани был равен 3,33±0,8 %, а в модели со склерозированной стенкой дефекта соотношение фиброзной ткани было существенно выше - 26,7±5,2 %, что повлекло за собой резкое отставание в скорости регенерации в сравнении с контрольной группой. Заключение. Нами разработана экспериментальная модель костного дефекта со склерозированной костной стенкой с рентгенологическим и морфологическим подтверждением, позволяющая изучать процессы реорганизации биодеградируемых остеозамещающих материалов. Комбинированное воздействие в виде термического ожога и укладки цемента способствует формированию зоны склероза и фиброза вокруг сформированной костной полости.
Эксперимент, дефект костной ткани со склерозированной стенкой, склероз, экспериментальная модель, животные
Короткий адрес: https://sciup.org/142121780
IDR: 142121780
Текст научной статьи Экспериментальное моделирование костного дефекта со склерозированной стенкой
Среди проблем здравоохранения одной из актуальных является проблема восстановления и замены поврежденных костных тканей. В хирургической практике необходимость замещения костных дефектов и полостей возникает при лечении целого ряда заболеваний, связанных с патологией костной ткани. Сюда можно отнести переломы, замедленную консолидацию, кистозную перестройку, опухоли, ложные суставы, инфекционные и постинфекционные изменения, дефекты после оперативных вмешательств. Восстановление подобных дефектов представляет собой существенную медицинскую, социальную и немалую экономическую проблему.
Актуальной задачей является разработка и апробация материалов, способных заполнять костные дефекты сложной геометрической формы и одновременно восстанавливать механические свойства пораженной костной ткани. Оптимальные для имплантации материалы должны выполнять не только заместительную опорную функцию, но и вместе с тем, постепенно интегрируясь в окружающую костную ткань, поддерживать физиологический уровень остеокластической и остеобластической активности, способствуя формированию и ремоделированию новообразованной костной ткани [2]. Кроме того, материалы должны быть биосов-местимыми, не обладать токсичностью и не вызывать реакции отторжения [6]. Этим характеристикам в той или иной степени соответствуют костные цементы на основе фосфатов кальция [1, 8, 10]. На сегодняшний день недостаточно изучены процессы реорганизации биодеградируемых костнопластических материалов в костных дефектах в неблагоприятных условиях с измененной трофикой периферии дефекта [4, 11]. Остается нерешенным вопрос о выборе биодеградируемого материала для заполнения такого рода костных дефектов [7, 12]. В связи с чем, актуальной задачей является разработка экспериментальной модели костного дефекта, имеющего склерозированную костную стенку, для изучения различных патогенезов заболеваний, связанных со склерозированием кости, а также и их последствий.
В проанализированной нами литературе описаны модели экспериментальных костных дефектов, которые были выполнены на кроликах в проксимальном метаэпифезе большеберцовой кости [3, 14]. Надо отметить, что представленные модели костных дефектов не позволили создать модель склерозирования стенки костного дефекта, а именно, отсутствие склерозирования костной стенки дефекта, годную для изучения различных патоге- незов заболеваний, связанных со склерозированием кости, а также и их последствий. Перечисленные важные и нерешенные вопросы современной ортопедии, травматологии и экспериментальной медицины обусловили выбор темы нашего исследования.
Цель исследования : разработать модель костного дефекта со склерозированной костной стенкой, пригодную для изучения различных патогенезов заболеваний, связанных со склерозированием кости, и их последствий.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на 12 половозрелых кроликах весом 2500-2800 гр. из вивария «ФГБУ РНИИТО им. P.P. Вредена» в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей [9], и требованиями «Правил проведения работ с использованием экспериментальных животных» [5]. Все процедуры с животными были рассмотрены и утверждены институтским этическим комитетом по использованию животных на предмет соответствия этическим принципам.
Условия содержания животных соответствовали стандартам, указанным в руководстве "The Guide for Care and Use of Laboratory Animals" [13].
Распределение животных по группам и их исследование . В экспериментальные группы были отобраны животные без признаков отклонений внешнего вида, таким образом, чтобы индивидуальное значение массы не отклонялось от среднего значения в группе более чем на ± 10 %. На каждое животное заводили отдельную историю болезни.
В эксперимент вошло 12 кроликов, которые были распределены на 2 группы. Опытную группу составили животные, которым выполняли создание модели костного дефекта со склерозированной стенкой (n=6). В контрольной группе животных создавали костный дефект без зоны склероза (n=6). Лучевые и морфологические исследования выполняли в обеих группах на 45-е сутки и 90-е сутки после проведенных операций. Для выполнения рентгенографии использовали аппарат Phillips Diagnost. Условия съемки: 42 kV, 5.00 mAs, 22,9 ms. Фокусное расстояние составляло 1 м. Рентгенологические исследования выполняли в двух стандартных проекциях. Для проведения морфологического исследования материал фиксировали в 10 % растворе нейтрального формалина. После фиксации декальцинировали в 25 % растворе органической кислоты «трилон Б». Окраску микропрепаратов производили гематоксилином. Микроскопическое исследование выполняли с помощью светового микроскопа МИКМЕД-2 с увеличением в 40, 100, 200 и 400 раз. Оценивали состояние костной ткани губчатого строения, а также костнопластический материал. С целью количественной оценки изменений костной ткани большеберцовой кости производили гистомор-фометрическое исследование. Визуализацию, оптическое изображение и гистоморфометрический анализ микрообъектов производили в ручном режиме. Относительную площадь костных балок вычисляли при помощи специальной морфометрической сетки. В каждом срезе измерения производили в трех полях зрения при увеличении х100. Для статистической обработки применяли методы прикладной статистики. Полученные данные обрабатывали с использованием статистического пакета Statistica 6.0.
Эвтаназию для забора органов на морфологическое исследование выполняли на 45-е, 90-е сутки после операции, соответственно по трое животных на каждый срок. Все манипуляции над животными проводили в соответствии с Хельсинкской декларацией о гуманном обращении с животными.
Создание модели асептического костного дефекта
В условиях стерильной операционной экспериментальной лаборатории под внутривенным наркозом (Sol. Ketamini 3 % 4 ml + Sol. relanium 2 ml) животное укладывали на спину, привязывали к операционному столу за передние и задние конечности и ограничивали операционное поле стерильной простыней (рис. 1). Создание костной полости выполняли на обеих задних конечностях. После троекратной обработки операционного поля раствором йода из кожного разреза длиной 2 см по передневнутренней поверхности проксимального отдела обеих голеней кроликов производили доступ к большеберцовой кости. При помощи стоматологического бора под углом 45˚ относительно поверхности кости круговыми движениями формировали трепанационное отверстие диаметром 8 мм и глубиной 10 мм. Далее мы использовали дополнительный бор диаметром 8 мм. Бор нагревали на пламени горелки не менее 3-х минут до температуры не менее 100 °С, после чего производили коагуляцию стенок ранее сформированного костного дефекта. После остывания бора в костном дефекте его извлекали. Следующим этапом выполняли замешивание костного цемента (DePuy CMW3) согласно общепринятым рекомендациям. До момента начала полимеризации костного цемента путем скатывания из него формировали шарик диаметром не менее 10 мм. Далее, не дожидаясь затвердевания цемента, костный дефект заполняли готовым пластичным цементным шариком до момента его полимеризации. В результате последующей полимеризации костного цемента происходило дополнительное температурное воздействие на стенку сформированного костного дефекта (рис. 2).
Рис. 1. Укладка животного и область операционного поля после обработки антисептиками
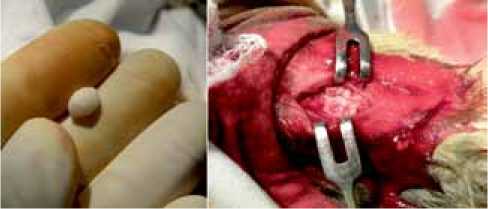
Рис. 2. Заготовленный цементный «шарик» (слева). Дефект, заполненный костным цементом (справа)
пластинки (рис. 4, а). После высверливания краев кортикальной пластинки костный цемент без технических трудностей и без повреждения подлежащей капсулы удаляли из сформированной ранее полости (рис. 4, б).
В зоне прилегания костного цемента к подлежащим тканям в результате ранее выполненных манипуляций к 90-м суткам образовывалась зона склероза.
В контрольной группе костный дефект без создания склерозированной стенки выполняли аналогичным способом, за исключением того, что коагуляцию костного дефекта и укладку в нее цемента не производили.
После окончательной полимеризации цемента рану промывали раствором хлоргекседина, после чего ушивали, затем повторно обрабатывали растворами антисептиков (йод, спирт). Всем животным в первые сутки после оперативного вмешательства выполняли контрольные рентгенограммы обеих конечностей в двух проекциях (рис. 3).
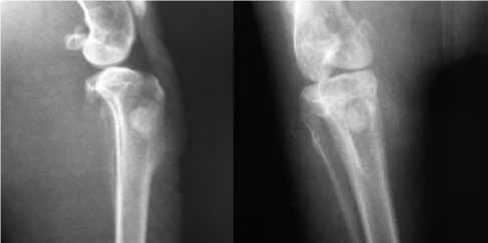
Рис. 3. Контрольные рентгенограммы области проксимального отдела голени в 1-е сутки после операции
В послеоперационном периоде кроликов помещали по трое в клетки габаритами 100×100×50 см. На 45-е сутки животным выполняли очередной рентгенологический контроль в стандартных укладках. В срок 90 суток от момента укладки цемента в область дефекта костной ткани, на наш взгляд, происходило достаточное созревание рубцовой ткани по периферии костного дефекта. В связи с чем, на 90-е сутки мы выполняли повторное оперативное вмешательство с целью удаления костного цемента.
Второй этап оперативного вмешательства был выполнен в условиях стерильной операционной экспериментальной лаборатории под внутривенным наркозом (Sol. Ketamini 3 % 4 ml + Sol. relanium 2 ml) описанным выше способом укладки животного на операционный стол (рис. 1). После троекратной обработки операционного поля раствором йода из кожного разреза длиной 2 см по старому послеоперационному рубцу производили доступ к проксимальному метаэпифизу большеберцовой кости. При помощи стоматологического бора выполняли краевое экономное высверливание периферии костного цемента на уровне кортикальной
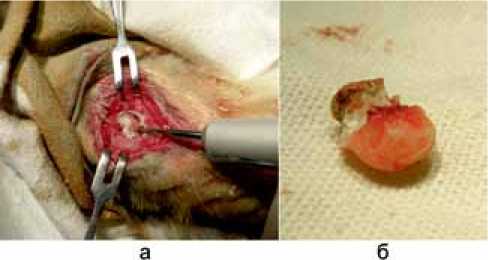
Рис. 4. Выполнение второго этапа операции: а – процесс высверливания костного цемента; б – костный цемент после извлечения из полости
Согласно задачам исследования, произведено выведение из эксперимента (эвтаназия) данной группы в намеченные сроки. Макропрепараты отправлены на гистологическое исследование.
Формирование групп и их исследование
В эксперимент вошло 12 кроликов, которые были поровну распределены по группам согласно таблице 1.
Таблица 1
Распределение животных по группам и срокам выполнения исследований
|
Группы животных |
Сроки выполнения рентгенологических и морфологических исследований |
|
|
45-е сутки |
90-е сутки |
|
|
Контрольная группа – неизмененный дефект на обеих конечностях |
3 |
3 |
|
Модель костного дефекта со склерозированной стенкой |
3 |
3 |
Цифрами указано количество животных, вошедших в исследование на каждый срок.
Контрольные исследования проведены на 1-е (лучевые), 45-е сутки и 90-е сутки (лучевые, морфологические). Эвтаназию для забора органов на морфологическое исследование выполняли на 45-е, 90-е сутки после операции.
РЕЗУЛЬТАТЫ РЕНТГЕНОЛОГИЧЕСКОГО И МОРФОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
По результатам анализа группы с созданием модели дефекта костной ткани со склерозированной стенкой макроскопически по периферии костной полости видна равномерная зона уплотнения костной ткани, дно и стенки костной полости представлены плотной рубцовой тканью (рис. 5).
В контрольной группе животных, где не создавали модель костного дефекта со склерозированной стенкой, к 45-м суткам после оперативного вмешательства соединительной капсулы не наблюдалось, площадь фиброза составила 1,66±0,3 % от общего объема дефекта. Пространство дефекта на 63±24,3 % было представлено незрелым костным мозгом с очагами дифференцировки в кроветворный костный мозг по периферии дефекта (16,6±8,1%) (рис. 6, б).
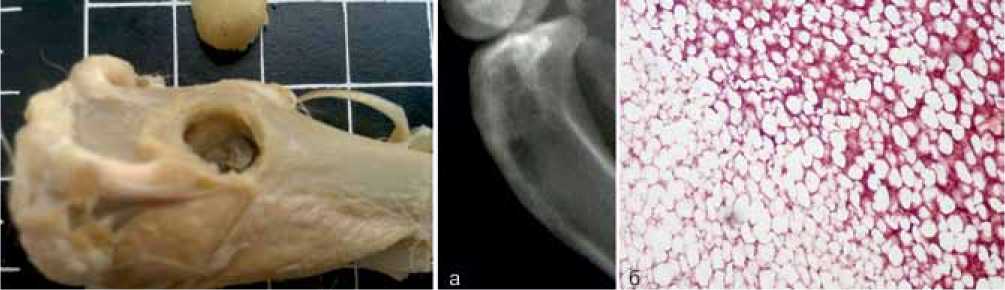
Рис. 6. Рентгенограмма и микропрепарат в контрольной группе на 45-е сутки без создания склероза стенки: а – рентгенограмма дефекта костной ткани; б – микропрепарат дефекта костной ткани (окраска гематоксилином, увеличение × 100)
Рис. 5. Макропрепарат эксперементальной модели костного дефекта со склерозированной стенкой
Соответственно в этот срок (45 сутки) после удаления костного цемента в группе с созданием модели наблюдали формирование зоны склероза костных стенок, объем и очертания костной полости сохранялись. Размер костной полости составил 7,17±0,14 мм, однако содержимое костного дефекта заполнено, по-видимому, слабоконтрастной соединительной тканью, зона этого просветления составила 7,25±0,17 мм (рис. 7, а). При морфологическом исследовании гистологическая картина этой группы отличалась от контрольной группы. Процент фиброзной ткани составлял 35,5±2,5 % от общей площади зоны дефекта, при этом площадь жирового костного мозга была незначительна и составила 3±1 %. В свою очередь, площадь кроветворного костного мозга равнялась 6,5±1,5 %. Центральная зона дефекта была представлена остаточными полостями, что говорит о выраженном торможении процессов репарации в зоне костного дефекта (рис. 7, б) и свидетельствует о соответствии созданной модели костному дефекту со склерозированной стенкой в ранние сроки ее формирования.
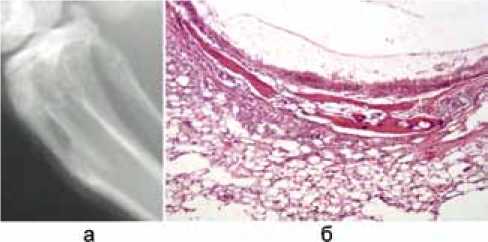
Рис. 7. Рентгенограмма и микропрепарат на 45-е сутки в группе с моделированием склероза стенки: а – рентгенограмма дефекта костной ткани; б – микропрепарат дефекта костной ткани (окраска гематоксилином, увеличение × 100)
На 90-е сутки в контрольной группе границы дефекта костной ткани были меньше (3,67±0,3 мм), кортикальная пластинка над зоной дефекта восстановилась на 22,5±4,56 %. Зона просветления в области дефекта составила 3,67±0,3 мм. Остальное пространство костного дефекта занимала умеренно контрастная ткань (40±4,26 %). Происходил набор костной массы по периферии (рис. 8, а). Гистологическая картина подтверждала рентгенологическую: костная полость на 34,0±26,0 % заполнена кроветворным костным мозгом. Костный мозг характеризуется неравномерной ячеистостью с повышенной васкуляризацией и небольшими серозными полостями. Площадь жирового костного мозга равнялась 60,3±25,1 %. Площадь фиброзной ткани при этом составила 0,6±0,1 %. Отмечалась слабая макрофагальная реакция в виде единичных скоплений макрофагов (1,0±0,5 %). Площадь костных балок составила 1,3±0,8 %, что говорит об активной репарации в зоне дефекта костной ткани (рис. 8, б). Спустя 90 суток в группе с созданием модели склерозированной стенки дефекта костной ткани размер границ костного дефекта составил 5,67±0,33 мм. Сохранялась зона просветления в области зоны дефекта, размер ее был равен 6,22±0,23 мм. Костный дефект восстановился на 16,67±3,33 %. Края дефекта все еще визуализировались, восстановление кортикальной пластинки происходило в виде начальных признаков регенерации (10,0±2,87 %) (рис. 8, в), что подтверждалось морфологически. Полость уменьшена, в стенках полости сохраняется разрастание фиброзной ткани (34,6±2,0 %) с единичными очагами оссификации, встречающимися не во всех макропрепаратах (1,0±1,0 %), и активная макрофагальная реакция (27,33±0,3 %). Остальное пространство было занято кроветворным костным мозгом (13,3±8,5 %), при этом площадь жирового костного мозга составляла 4,0±0,5 % (рис. 8, г).
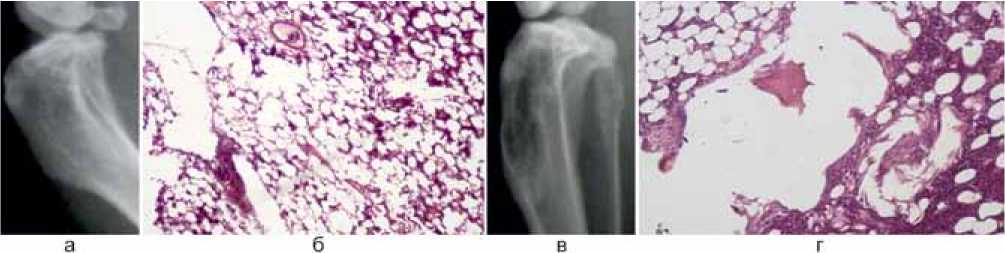
Рис. 8. Контрольные рентгенограммы и микропрепараты контрольной группы на 90-е сутки: а – рентгенограмма дефекта без склероза стенки; б – общий вид микропрепарата дефекта без склероза стенки (окраска гематоксилином, увеличение × 100); в – рентгенограмма дефекта со склерозом стенки; г – общий вид микропрепарата дефекта со склерозом стенки (окраска гематоксилином, увеличение × 200)
ЗАКЛЮЧЕНИЕ
Соответственно рентгенологическим и морфологическим данным, комбинированное воздействие в виде термического ожога и укладки полиметилметакрилат-ного цемента способствует формированию зоны склероза и фиброза вокруг сформированной костной полости. В контрольной группе с неизмененным костным дефектом процент фиброзной ткани в центральной зоне равнялся 1,6±0,3 %, а в модели со склерозированной стенкой дефекта доля фиброзной ткани была существенно выше – 35,5±2,5 %, что, в свою очередь, повлекло за собой резкое отставание в скорости регенерации в сравнении с контрольной группой. Это выражалось в замедлении образования жирового костного мозга с последующей дифференцировкой в кроветворный костный мозг. Как известно, восстановление кроветворного костного мозга происходит посредством дифференцировки жирового костного мозга в кроветворный костный мозг. В результате морфологических исследований установлено, что при создании модели склероза восстановление костного мозга существенно запаздывало в сравнении с контрольной группой. В ранние сроки в модели дефекта костной ткани со склерозированной костной стенкой в центральной зоне дефекта отсутствовал как кроветворный, так и жировой костный мозг, напротив, в контрольной группе зона дефекта в этот срок начала свою регенерацию. Лишь на 90-е сутки в модели костного дефекта со склерозированной стенкой были отмечены первые признаки начальной регенерации, а в контрольной группе дефект костной ткани на 39,67±0,32 % был заполнен кроветворным костным мозгом. Это позволило нам считать данную модель пригодной для изучения репарации костной ткани в условиях хронического костного дефекта в неблагоприятных условиях для регенерации.
Таким образом, в условиях нарушения трофики, вследствие склерозирования либо фиброзного перерождения костной стенки дефекта наблюдается резкое замедление процессов регенерации кости в сравнении с контрольной группой. Данная модель может быть рекомендована для изучения эффективности различных остеозамещающих материалов при восполнении дефектов костной ткани в различных условия регенерации.


