Экспериментальное обоснование использования поликомпонентного сорбента для детоксикации печени от микотоксинов
Автор: Мишина Н.Н., Семенов Э.И., Алеев Д.В., Галяутдинова Г.Г., Халикова К.Ф., Маланьев А.В.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 1 (49), 2023 года.
Бесплатный доступ
Показаны результаты исследования биохимического статуса сыворотки крови белых крыс при воздействии рациона с включенным поликомпонентным сорбентом на фоне смоделированного смешанного микотоксикоза. Поликомпонентный сорбент содержит шунгит, цеолит, глюкан и лигнин. Смоделированный состав корма для воспроизводства смешанного микотоксикоза включает Т-2 токсин, зеараленон, дезоксиниваленол, фумонизин В1 и афлатоксин В1. Для исследования было сформировано семь групп животных по шесть голов (n = 6), разделенных по принципу аналогов. Первая группа животных (биологический контроль) получала основной рацион (чистый автоклавированный комбикорм), второй группе (положительный контроль) задавали контаминированный микотоксинами токсичный рацион. Третья, четвертая, пятая и шестая группы получали токсичный рацион с поликомпонентным сорбентом в количестве 0,05; 0,1; 0,25 и 0,5% от рациона и седьмая группа - основной рацион и комплексный сорбент в количестве 0,5% от рациона. Эксперимент длился 30 суток. Результаты исследований показывают, что поликомпонентный сорбент в рационах белых крыс при смешанном микотоксикозе позволяет в значительной степени снизить воздействие токсинов на печень путем адсорбции микотоксинов на пути их поступления. Состав данного сорбента нормализует биохимические показатели (аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), триглицеридов, холестерина, общего билирубина, альбуминов и глобулинов) крови. При этом наилучшие биохимические показатели, близкие к биологическому контролю, отмечены в группах с включением в рацион 0,5% поликомпонентного сорбента на фоне смешанного микотоксикоза.
Микотоксикозы, поликомпонентный сорбент, шунгит, цеолит, глюкан, лигнин, белые крысы, биохимические показатели
Короткий адрес: https://sciup.org/142237261
IDR: 142237261 | УДК: 619:615.9:636.5 | DOI: 10.48136/2222-0364_2023_1_114
Текст научной статьи Экспериментальное обоснование использования поликомпонентного сорбента для детоксикации печени от микотоксинов
Микотоксины – это токсические вещества, образующиеся в процессе жизнедеятельности микроскопических грибов. Они обладают мутагенными, тератогенными, канцерогенными и иммуносупрессивными свойствами. В настоящее время известно и идентифицировано более 300 видов микотоксинов, каждый из которых имеет свой механизм влияния, но в основном они воздействуют путем нарушения синтеза белка и нуклеиновых кислот в клетках, усиливают процесс перекисного окисления липидов, тем самым, вызывают глубокие необратимые изменения в органах и тканях [1].
Поедание животными кормов, содержащих микотоксины, приводит к нарушению их роста и развития, снижению продуктивных показателей, подавлению иммунитета и другим последствиям [2]. Большие дозы микотоксинов вызывают сильно выраженные признаки отравления, которые часто приводят к гибели, малые дозы нарушают обмен веществ, снижают иммунитет, повышают восприимчивость организма к различным заболеваниям, вызывают дисбактериоз, репродуктивные нарушения, отек легких и многое другое [3]. Главным органом-мишенью, детоксицирующим на начальном этапе микотоксины и получающим на себя наибольший удар, является печень [4]. Влиянию микотоксинов также подтвержены: почки, желудочно-кишечный тракт, селезенка, нервная система и головной мозг.
Признаки поражения печени микотоксинами: ее увеличение, жировая дистрофия, нарушение синтеза белка и выброс в кровь печеночных ферментов аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и щелочной фосфатазы (ЩФ) [5; 6]. Данные ферменты являются маркерами при патологии печени, так как в основном они локализуются в ее клетках, незначительно – в клетках сердца и почек. ЩФ образуется в мембране клеток печени, ее активность чаще всего увеличивается при повреждении клеток гепатоцитов. Триглицериды вместе с холестерином являются основным источником энергии для клеток.
Современный способ снижения воздействия микотоксинов на детоксикационную функцию печени – применение в качестве терапии адсорбирующих веществ (сорбентов) [7–9]. Данный метод является наиболее удобным в профилактике микотоксикозов и не вызывает физиологических изменений в организме животных [10]. Благоприятное воздействие сорбентов связано с их высокими сорбционными свойствами и регуляцией минерального обмена [11; 12]. Из-за особенностей химической структуры микотоксинов и их биологического действия поиск новых комбинаций сорбентов остается актуальным и не прекращается [13–15].
Vestnik of Omsk SAU, 2023, no. 1(49)
VETERINARY AND ZOOTECHNY
Чтобы снизить негативное воздействие комплекса микотоксинов на печень, сохранить здоровье белых крыс и улучшить биохимические показатели сыворотки крови, нами представлена смесь веществ в виде поликомпонентного сорбента, состоящего из шунгита, цеолита, глюкана и лигнина [16; 17].
Целью настоящей работы являлось экспериментальное обоснование использования поликомпонентного сорбента для детоксикации микотоксинов в печени.
Объект и методы
Для сравнительной оценки биохимических показателей крови лабораторных животных был проведен эксперимент по терапевтическому воздействию in vivo различных доз поликомпонентного сорбента на белых крысах при смоделированном смешанном микотоксикозе. Поликомпонентный сорбент содержит шунгит, цеолит, глюкан и лигнин. Смешанный микотоксикоз моделировали путем включения в рацион белых крыс микотоксинов: Т-2 токсина, зеараленона, дезоксиниваленола, фумонизина В1 и афлатоксина В1. Работа проведена в условиях вивария лаборатории микотоксинов ФГБНУ «ФЦТРБ-ВНИВИ». Сформировали семь групп животных по шесть голов (n = 6), разделенных по принципу аналогов. Схема эксперимента представлена в табл. 1.
Таблица 1
Схема эксперимента
|
Группа животных |
Рацион группы |
Кол-во животных |
|
1 контрольная |
Основной рацион (ОР) – чистый корм |
6 |
|
2 опытная |
Токсичный рацион (ТР) – рацион с микотоксинами |
6 |
|
3 опытная |
ТР + поликомпонентный сорбент (ПС) (0,05% от рациона) |
6 |
|
4 опытная |
ТР + ПС (0,1% от рациона) |
6 |
|
5 опытная |
ТР + ПС (0,25% от рациона) |
6 |
|
6 опытная |
ТР + ПС (0,5% от рациона) |
6 |
|
7 опытная |
ОР + ПС (0,5% от рациона) |
6 |
Первая контрольная группа животных (биологический контроль) в течение 30 сут опыта получала основной рацион; крысам второй опытной группы давали токсичный рацион, контаминированный микотоксинами; третья, четвертая, пятая и шестая опытные группы получали токсичный рацион и поликомпонентный сорбент в количестве 0,05; 0,1; 0,25 и 0,5% от рациона, седьмая опытная группа получала основной рацион и комплексный сорбент в количестве 0,5% от рациона.
В середине эксперимента (15-е сут) и на 30-е сут проводили эвтаназию животных и забор крови для изучения биохимических показателей (аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), триглицеридов, холестерина и общего билирубина). Биохимические показатели определяли с помощью анализатора «Microlab 300» (Нидерланды).
Полученные данные обрабатывали общепринятым методом вариационной статистики с применением критерия достоверности по Стьюденту с использованием специальных программ. Вычисляли среднеарифметическую величину (М), среднеквадратическую ошибку (±m) и показатель существенной разницы (р).
Результаты исследований
Результаты исследования биохимических показателей активности печеночных ферментов крови белых крыс в опытах in vivo представлены в табл. 2.
Vestnik of Omsk SAU, 2023, no. 1(49) VETERINARY AND ZOOTECHNY
Таблица 2
Содержание печеночных ферментов крови белых крыс (М ± m; n = 6)
|
Группа животных |
Показатель крови |
||
|
АСТ, Ед/л |
АЛТ, Ед/л |
ЩФ, Ед/л |
|
|
на 15-е сут эксперимента |
|||
|
1 контрольная |
128,40 ± 4,82 |
56,20 ± 1,35 |
147,80 ± 2,01 |
|
2 опытная |
149,45 ± 2,01*** |
67,50 ± 2,12*** |
189,70 ± 2,63*** |
|
3 опытная |
140,98 ± 3,25* |
63,20 ± 1,97** |
176,10 ± 8,71** |
|
4 опытная |
139,00 ± 3,25 |
62,60 ± 1,90* |
170,00 ± 9,46* |
|
5 опытная |
136,74 ± 3,66 |
59,40 ± 1,83 |
163,40 ± 7,15 |
|
6 опытная |
132,50 ± 3,85 |
57,60 ± 1,60 |
157,80 ± 10,01 |
|
7 опытная |
128,42 ± 2,91 |
56,20 ± 1,39 |
147,60 ± 1,88 |
|
на 30-е сут эксперимента |
|||
|
1 контрольная |
131,12 ± 4,21 |
57,10 ± 1,36 |
143,10 ± 1,92 |
|
2 опытная |
178,58 ± 2,10*** |
94,80 ± 2,01*** |
207,90 ± 2,81*** |
|
3 опытная |
158,65 ± 6,22** |
78,90 ± 6,05** |
185,40 ± 10,15** |
|
4 опытная |
154,60 ± 8,09* |
72,90 ± 6,83** |
175,30 ± 11,16** |
|
5 опытная |
148,95 ± 7,12* |
67,00 ± 8,28* |
167,70 ± 10,55* |
|
6 опытная |
139,38 ± 3,29 |
60,00 ± 1,43 |
158,20 ± 2,03 |
|
7 опытная |
129,80 ± 3,84 |
58,60 ± 1,31 |
143,20 ± 2,25 |
Примечание. *р < 0,05; **р < 0,01; ***р < 0,1
О функциональном состоянии печени крыс судили по динамике изменения уровня трансаминаз. Данные биохимических исследований сыворотки крови показывают, что уровень АСТ в крови опытных животных второй, третьей, четвертой, пятой и шестой групп увеличивался в сравнении с биологическим контролем. Причем наибольшая разница 36,1% (р < 0,1) к 30-м сут отмечается во 2-й опытной группе (получавшей токсичный рацион), в 3-й опытной группе – 20,9% (р < 0,01), в 4-й и 5-й опытных группах разница с контролем составила 17,9% (р < 0,05) и 13,5%, соответственно. Наименьшему воздействию подверглись животные 6-й опытной группы, получавшие 0,5% сорбента от рациона, при этом уровень АСТ в группе возрос в сравнении с контролем на 6,2%. Активность фермента АЛТ во 2-й опытной группе выше на 66,0% (р < 0,1), в 3-й и 4-й опытных группах – 38,1% (р < 0,01) и 27,6% (р < 0,01), в 5-й опытной группе возрастает на 17,3% (р < 0,05). В 6-й опытной группе увеличение АЛТ составило 5,0% в сравнении с контрольной группой. Аналогичные изменения зарегистрированы при определении уровня ЩФ. Наибольшее повышение данного показателя зарегистрировано во 2-й группе (токсичный рацион), где токсичный корм давали без поликомпонент-ного сорбента. И чем выше была доза введения сорбента в токсичный рацион, тем меньше было отличие от показателей контроля. Повышение уровня активности данных ферментов указывает на повреждение клеток (гепатоцитов). Это приводит к изменению проницаемости клеточной мембраны, вызванной микотоксинами, и выходу внутриклеточных субстанций в кровь.
Результаты исследования биохимических показателей активности липидного и пигментного обмена в сыворотке крови белых крыс в опытах in vivo на 15-е сут эксперимента на фоне смешанного микотоксикоза представлены на рис. 1.
Результаты, представленные на рис. 1 и 2, показали значительные изменения концентрации триглицеридов, холестерина и общего билирубина в сыворотке крови. Установлено, что уровень триглицеридов в крови опытных животных на 15-е сут увеличивался в сравнении с биологическим контролем. Максимальная разница от контроля выявлялась во 2-й опытной группе – 16,3%, также в 3-й, 4-й и 5 группах – 11,4%, 9,8% и 4,9%, а в 6-й и 7-й группах количество триглицеридов не изменялось и соответство-
Vestnik of Omsk SAU, 2023, no. 1(49)
VETERINARY AND ZOOTECHNY
вало контролю. Холестерин также незначительно возрастал: во 2-й группе на 13,8% относительно контроля, в остальных группах, кроме 7-й, превышал контроль в пределах 3,0–10,7%. В 7-й группе уровень холестерина снизился на 0,7% в сравнении с биологическим контролем. По общему билирубину в опытных группах также происходила тенденция к повышению в сравнении с контрольной группой.
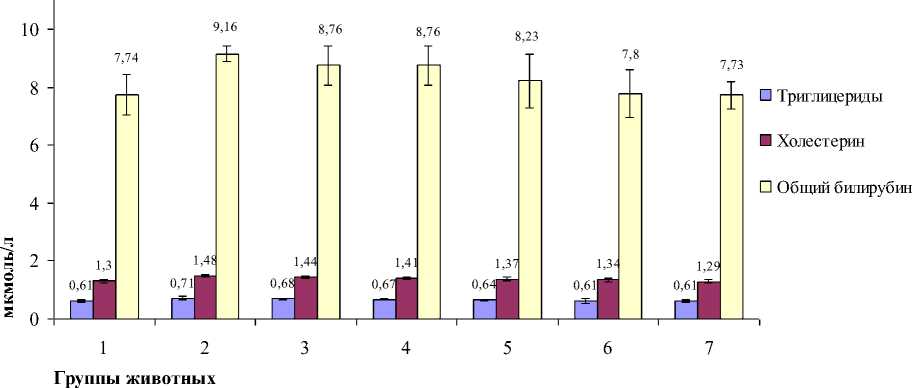
Рис. 1 . Биохимические показатели липидного и пигментного обмена в крови белых крыс на 15 сут эксперимента (М ± m) (n = 6)
Результаты исследования биохимических показателей крови на 30-е сут эксперимента представлены на рис. 2
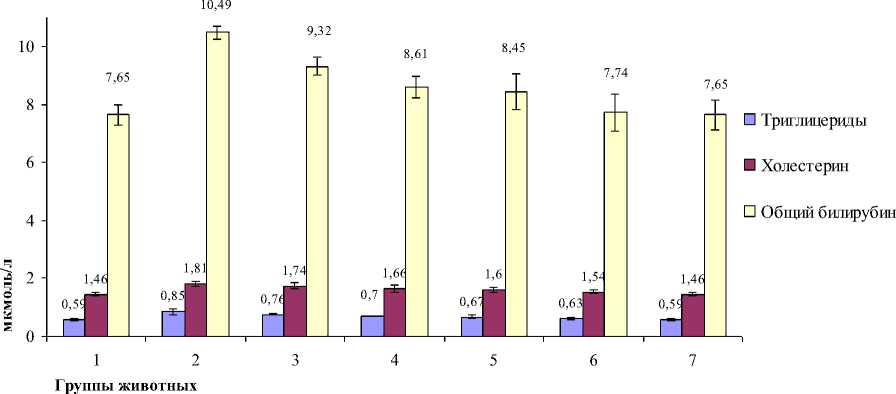
Рис. 2. Биохимические показатели липидного и пигментного обмена в крови белых крыс на 30 сут эксперимента (М ± m) (n = 6)
Наиболее существенные различия в концентрации триглицерида от данных группы контроля наблюдали у животных 2-й группы. К 30-м сут количество триглицеридов во 2-й группе превышало первую контрольную группу на 44,0% при достоверности (р < 0,05). Показатели триглицеридов у животных с 3-й группы по 6-ю группу также
Vestnik of Omsk SAU, 2023, no. 1(49)
VETERINARY AND ZOOTECHNY
имели тенденцию к возрастанию по отношению к контролю и варьировали от 28,8% (р < 0,05) до 6,7%. Показатель триглицеридов в 7-й группе соответствовал уровню контрольной группы. Воздействие микотоксинов вызывает значительные изменения липидного профиля. На фоне токсического рациона у белых крыс происходило увеличение всасывания холестерина в кишечнике и увеличение его синтеза в печени, что привело к увеличению количества холестерина во 2-й группе на 23,9% (р < 0,01). На развитие патологии печени и застой желчи у животных, затравленных микотоксинами, указывали результаты анализа на общий билирубин, который на 30-е сут превысили контрольные значения: у 3-й, 4-й, 5-й и 6-й групп на 19,1 (р < 0,05); 13,6; 9,4 и 5,4%. В 7-й группе количество общего билирубина на 30-е сут соответствовало показателям биологического контроля. Количество общего билирубина во 2-й группе превышало содержание в контрольной группе на 37,1% (р < 0,1). В остальных группах общий билирубин возрастал. Увеличение активности ЩФ вместе с появлением в сыворотке крови билирубина указывает на поражение паренхимы печени, так как билирубин образуется при распаде эритроцитов. Негативное действие сочетанного микотоксикоза приводит к биохимическим изменениям показателей крови, сопровождаемым повышением уровня АСТ, АЛТ, ЩФ, триглицеридов, холестерина, общего билирубина и повреждению внутренних органов и тканей.
Заключение
На основании полученных результатов можно сделать вывод, что применение по-ликомпонентного сорбента, состоящего из шунгита, цеолита, глюкана и лигнина, в рационах белых крыс при смешанном (Т-2, зеараленон, дезоксиниваленол, фумонизин В1 и афлатоксин В1) микотоксикозе позволяет в значительной степени снизить воздействие токсинов на печень и другие внутренние органы-мишени путем адсорбции их на пути поступления. Состав данного сорбента способствует нормализации биохимических показателей сыворотки крови. Биохимические показатели, наиболее близкие к биологическому контролю, отмечены в группах с включением в рацион 0,5% поли-компонентного сорбента на фоне смешанного микотоксикоза.
Список литературы Экспериментальное обоснование использования поликомпонентного сорбента для детоксикации печени от микотоксинов
- Сагдеев Д.Р. Токсичность свинца и Т-2 токсина при их совместном поступлении в организм животных // Ветеринарный врач. 2021. № 6. С. 61–65.
- Иванов А.В., Фисинин В.И., Тремасов М.Я., Папуниди К.Х. Микотоксикозы (биологические и ветеринарные аспекты): монография. М.: Колос, 2010. 392 с.
- Перфилова К.В., Мишина Н.Н., Семенов Э.И. Обоснование компонентного состава комплексного средства «Цеапитокс» в отношении Т-2 токсина в опытах in vitro // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2021. Т. 247. № 3. С. 208–212.
- Галяутдинова Г.Г., Маланьев А.В., Егоров В.И. Диагностика, поиск средств лечения и профилактика сочетанного отравления крупного рогатого скота пестицидами и микотоксином // Вопросы нормативно-правового регулирования в ветеринарии. 2020. № 1. С. 218–219.
- Крюков В.С., Крупинин В.В., Котик В.В. Применение клиноптилолита для профилактики микотоксикозов // Ветеринария. 1992. № 9 (12). С. 28.
- Matrosova L., Tanaseva S., Tarasova E. et al. Zeolite, hepatoprotector and probiotic for aflatoxicosis in pigs international. International Journal of Mechanical and Production Engeneering Research and Development (IJNPERD). 2020;10:7053-7060.
- Герунов Т.В., Герунова Л.К., Тарасенко А.А., Лапухова В.А. Секвестранты микотоксинов: избирательность действия и побочные эффекты // Вестник Омского государственного аграрного университета. 2022. № 2(46). С. 79–84.
- Семенов Э.И. Фармако-токсикологические аспекты применения энтеросорбентов при сочетанных микотоксикозах: дис. … канд. биол. наук. Казань, 2019. 342 с.
- Герунова Л.К. Углеродные сорбенты как секвестранты микотоксинов и инфекционных агентов // Каталог научных и инновационных разработок ФГБОУ ВО Омский ГАУ: сборник статей. Омск: Омский государственный аграрный университет имени П.А. Столыпина, 2022. С. 340–341.
- Алеев Д.В., Халикова К.Ф., Ямалова Г.Р. Оценка качества куриного мяса при использовании сорбентов на фоне воздействия имидаклоприда // Вопросы нормативно-правового регулирования в ветеринарии. 2020. № 1. С. 212–213.
- Huwig А., Freimund S., Kappeli O. et al. Mycotoxin detoxification of animal feed by different absorbents. Toxicol. Lett. 2001;122:179-188.
- Jones F.T., Genter M.B., Hagler W.M. et al. Understanding and Coping with Effects of Mycotoxins in Livestock Feed And Forage. North Carolina Cooperative Extension Service: Raleigh, NC, USA. 2007. 13. Алеев Д.В. Изыскание методов обезвреживания кормов, контаминированных сочетанно микотоксинами – афлатоксином В1, охратоксином А и Т-2 токсином: дис. … канд. биол. наук: 16.00.04 / Алеев Дамир Вазыхович. Казань, 2003. 136 с.
- Кадиков И.Р., Бикташев Р.У., Вафин И.Ф. и др. Применение шунгита и цеолита при контаминации рационов свиней кадмием и свинцом // Ветеринарный врач. 2020. № 2. С. 9–13.
- Папуниди К.Х., Семенов Э.И., Кадиков И.Р., Гатаулин Д.Х. Применение сорбентов для профилактики нарушения обмена веществ и токсикозов животных: монография. Казань: ФГБНУ «ФЦТРБ-ВНИВИ», 2018. 224 с.
- Гематдинова В.М., Канарская З.А., Канарская А.В. Получение концентрата бета-глюкана из овсяных отрубей для функциональных продуктов питания // Пищевая промышленность. 2018. № 3. С. 19–22.
- Мишина Н.Н. Профилактическая эффективность лигнин- и полисахаридсодержащих энтеросорбентов при сочетанном Т-2 токсикозе: авто-реф. дис. … канд. биол. наук. Казань, 2009. 24 с.


