Экспериментальное обоснование методики оценки фитотоксичности микромицетов на проростках пшеницы
Автор: Жемчужина Н.С., Елизарова С.А., Киселева М.И., Захаров Д.А., Сардарова И.И.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 4 (72), 2023 года.
Бесплатный доступ
Актуальность. В настоящее время возрастает актуальность изучения по выявлению способности многих микромицетов синтезировать фитотоксичные вещества, которые снижают всхожесть семян и ведут к огромным потерям урожая стратегических сельскохозяйственных культур. Для решения задачи требуется разработка новых методических подходов, что представляет значимость для иммунологов и фитопатологов. Цель работы - определение фитотоксической активности штаммов микромицетов из родов Fusarium, Alternaria, Bipolaris, паразитирующих на всех сельскохозяйственных культурах, возделываемых в России. Материалы и методы. Использованы штаммы, способы их культивирования, метод биопробы и проведена статистическая обработка полученных результатов. Проведена модификация некоторых методических подходов для оценки фитотоксичности микромицетов. Проведен подбор репрезентативных концентраций фильтратов культуральной жидкости (ФКЖ) штаммов для оценки фитотоксичности. Результаты. Установлена корреляционная связь для всех вариантов опыта между двумя независимыми параметрами: параметры развития проростков пшеницы и концентрация фильтратов культуральной жидкости. Получены новые результаты по исследованию фитотоксической активности 70 штаммов гемибиотрофных микромицетов и установлены оптимальные концентрации ФКЖ грибов для классификации штаммов грибов по группам токсичности. Наиболее вариабельные значения по токсичности были найдены при применении 40% раствора ФКЖ. Показано, что при соблюдении этих условий штаммы грибов можно делить по степени токсичности на достоверно различающиеся группы. Это обстоятельство является важным основанием для включения штаммов микромицетов с определенными свойствами токсичности в Государственную коллекцию фитопатогенных микроорганизмов. Штаммы грибов необходимы и целесообразны для использования в селекции по созданию устойчивых и толерантных сортов к фитопатогенам из родов Fusarium, Alternaria, Bipolaris. Заключение. Новые методические подходы подтвердили, что наиболее вариабельные значения по токсичности были найдены при применении ФКЖ в пропорции 2:3. При этой концентрации ФКЖ штаммы делятся на 4 группы с характерными отличиями по степени токсичности, что является важным основанием для включения подобных штаммов микромицетов в Государственную коллекцию фитопатогенных микроорганизмов и в дальнейшем они будут использованы в селекции по созданию устойчивых и толерантных сортов сельскохозяйственных культур.
Пшеница, фитотоксичность, микромицеты, методические подходы, селекция
Короткий адрес: https://sciup.org/140301904
IDR: 140301904 | УДК: 633.11:631.547:632.95.024.4 | DOI: 10.18619/2072-9146-2023-4-97-106
Текст научной статьи Экспериментальное обоснование методики оценки фитотоксичности микромицетов на проростках пшеницы
Оригинальные статьи / Originalarticles
Forcitations: Zhemchuzhina N.S., Elizarova S.A., Kiseleva M.I., Zakharov D.A., Sardarova I.I. Experimental substantiation of the method for assessing the phytotoxicity of micromycetes on wheat seedlings. Vegetable crops of Russia. 2023;(4):97-106. (In Russ.)
Способность к образованию фитотоксичных веществ установлена для многих микромицетов, большинство из которых принадлежат к сапрофитным видам грибов. Важнейшими продуцентами токсинов являются представители родов Alternaria, Asperegillus, Claviceps, Fusarium, Penicillium, Trichoderma и др. [1-5]. Способность микромицетов синтезировать метаболиты в процессе их жизнедеятельности является одной из составляющих, играющих существенную роль в снижении всхожести и энергии прорастания семян и, как следствие, приводящих к снижению урожайности культурных растений [6, 7]. С биологической точки зрения микотоксины выполняют в обмене веществ у грибов функции, направленные на выживание и конкурентоспособность в среде обитания. Свидетельством фитотоксичности метаболитов является сдерживание развития проростков культурных растений при обработке их фильтратами культуральной жидкости грибов (ФКЖ). При этом концентрация токсичных веществ в фильтратах многих видов грибов настолько высока, что обработанные ими всходы гибнут [5]. Уровень ингибирующего действия метаболитов грибов зависит не только от количества (концентрации) действующего вещества в культуральной жидкости, но и от устойчивости культуры. Последнее заключается в способности растений противостоять негативным последствиям воздействия грибов-продуцентов на уровне биохимических и физиологических процессов [8, 9, 10].
Широкое распространение микромицетов – продуцентов токсинов в биоценозах сельскохозяйственных культур обуславливает необходимость изучения факторов, приводящих к негативному воздействию на растения, в том числе и методов проведения экспериментальных наблюдений [11, 12]. Для получения сравнимых результатов экспериментов по определению степени фитотоксичности штаммов грибов требуется не только точное следование методическим рекомендациям, но и модификация некоторых приемов. Основным критериям сравнимости результатов является унификация критериев методического характера. Основными из них являются:
-
- получение моноконидиальных колоний грибов, обладающих типичными для вида морфологическими характеристиками, независимо от места сбора и культуры, из которых они изолированы;
-
- выбор универсального тест-объекта из культурных растений для оценки результатов воздействия ФКЖ штаммов разных видов микромицетов на развитие проростков;
-
- подбор параметров разведения ФКЖ, позволяющих классифицировать штаммы по группам фитотоксичности.
В коллекции ФГБНУ ВНИИ Фитопатологии содержится большое количество изолятов и штаммов микроми-цетов – продуцентов фитотоксинов, наносящих ощутимый вред сельскому хозяйству. Одной из главных задач коллекции является обеспечение научных центров инфекционным материалом при селекции сортов, линий, гибридов культурных растений, устойчивых к болезням. Исходя из этого факта, предназначение коллекции заключается в хранении и поддержании востребованных видов микромицетов в жизнеспособном и активном состоянии [13-15].
Предметом наших исследований являлось определение фитотоксичной активности штаммов мик-ромицетов из родов Fusarium, Alternaria, Bipolaris, паразитирующих на сельскохозяйственных культурах, возделываемых в России.
Материалы и методы
Объектами исследований стали 70 коллекционных штаммов 11 видов грибов из родов Fusarium, Alternaria, Bipolaris, выделенных из пораженных образцов свеклы, гороха, пшеницы, ячменя, ржи, кукурузы и некоторых других культур. В общей сложности, штаммы грибов были представлены 9 видами рода Fusarium : Fusarium culm orum , Fusarium fujikuroi, Fusarium gram inearum, Fusarium heterosporum, Fusarium oxysporum, Fusarium poae, Fusarium roseum , Fusarium sporotrichioides, Neocosm ospora solani, рода Alternaria – Alternaria alternatа, рода Bipolaris - Bipolaris sorokiniana (табл. 1).
Фитотоксичность штаммов грибов определяли по методу биопробы на проростках пшеницы (сорт Мироновская 808), обработанных культуральной жидкостью, полученной путем культивирования мицелия гриба в жидкой среде Чапека-Докса, способствующей интенсивному биосинтезу токсинов. Состав жидкой питательной среды Чапека – Докса включал следующие ингредиенты (в %): NaNO 3 – 0.3; К 2 HPO 4 – 0.1; MgSO 4 ·7H 2 O – 0.05; KCl – 0.025; FeSO 4 ·7H 2 O – 0.001; сахароза – 3.0. Исходное значение рН питательной среды – 5.8. Агаровыми блоками диаметром 10 мм, вырезанными из зоны роста колоний соответствующих штаммов, осуществляли засев жидких сред в конических колбах объемом 250 мл, объем среды – 100 мл. Культивирование проводили при температуре 26°С в термостатируемом шейкере (200 об/мин) в течение 10 суток. Далее содержимое колб фильтровали через мембранные фильтры с размером пор 0,22 мкм, и полученный фильтрат использовали для проведения серии биопроб на семенах растения-тестера [3, 12, 22].
Биопробы включали варианты с использованием ФКЖ в разных концентрациях. Для получения 100 мл раствора смешивали объемы ФКЖ и воды в следующих пропорциях 4:1, 3:2, 2:3, 1:4 (шаг 20 мл). Вариант состоял из 30 семян пшеницы, разложенных на фильтровальной бумаге в чашке Петри с внесением в каждую по 6 мл ФКЖ необходимой концентрации. Интенсивность прорастания семян и развития проростков тест-культуры оценивали на 5
Таблица 1. Виды микромицетов, выделенные из образцов сельскохозяйственных культур, возделываемых в России в 1998-2020 годах Table 1. Types of micromycetes isolated from samples of agricultural crops cultivated in Russia in 1998-2020
|
Вид гриба |
Происхождение образца (регион: культура) |
Количество штаммов |
|
Alternaria alternata |
Волго-Вятский: горох Центрально-Черноземный: пшеница, ячмень, свекла |
1 4 |
|
Bipolaris sorokiniana |
Волго-Вятский: ячмень Центральный: озимая рожь Центрально-Черноземный: ячмень, кукуруза Северо-Кавказский: пшеница |
2 2 2 2 |
|
Fusarium culmorum |
Центральный: озимая рожь, Волжский: ячмень, Центрально-Черноземный: кукуруза, свекла Восточно-Сибирский: ячмень |
1 1 2 1 |
|
Fusarium graminearum |
Центральный: пшеница Центрально-Черноземный: кукуруза |
2 1 |
|
Fusarium fujikuroi |
Центрально-Черноземный: кукуруза |
6 |
|
Fusarium heterosporum |
Центральный: рожь, Волжский: пшеница, хлопчатник Центрально-Черноземный: кукуруза Северо-Кавказский: пшеница, рис |
1 4 2 3 |
|
Fusarium oxysporum |
Волго-Вятский: ячмень Центрально-Черноземный: кукуруза, свекла Северо-Кавказский: пшеница, рис |
2 7 4 |
|
Fusarium poae |
Северо-Кавказский: пшеница Центральный: ячмень, озимая рожь |
3 2 |
|
Fusarium roseum |
Центрально-Черноземный: кукуруза Северо-Кавказский: пшеница |
1 3 |
|
Fusarium sporotrichioides |
Волго-Вятский: ячмень Центрально-Черноземный: пшеница, кукуруза, свекла Северо-Кавказский: Рис |
2 3 2 |
|
Neocosmospora solani |
Центральный: ячмень Центрально-Черноземный: свекла |
3 1 |
|
Всего штаммов грибов: |
70 |
|
Таблица 2. Влияние разведения ФКЖ на токсичность штаммов грибов, выраженной показателем средней длины первичных корней пшеницы (% к контролю)
Table 2. Influence of the diluting the filtration of a cultural liquid on the toxicity of fungal strains, expressed as an indicator of the average length of primary wheat roots (% of control
|
ФКЖ штамма гриба |
Разведение 4:1 |
Разведение 3:2 |
Разведение 2:3 |
Разведение 1:4 |
||||
|
1* |
** |
1 |
2 |
1 |
2 |
1 |
2 |
|
|
Alternaria alternata |
||||||||
|
КОП-18-1-8 |
28,5±1,6 |
Т |
48,5±1,8 |
УТ |
58,9±1,7 |
СТ |
78,7±1,9 |
НТ |
|
КОЯ-18-6 |
13,0±1,5 |
Т |
33,0±1,4 |
УТ |
65,0±1,6 |
СТ |
101,0±2,1 |
НТ |
|
AI-3n-18 |
11,8±1,2 |
Т |
13,4±1,2 |
Т |
28,4±1,1 |
Т |
55,4±1,4 |
СТ |
|
AII-1M-18 |
10,1±1,3 |
Т |
19,1±1,4 |
Т |
30,1±1,6 |
УТ |
85,4±1,7 |
НТ |
|
МСГ(Д)-7 |
17,7±0,8 |
Т |
57,7±0,9 |
УТ |
77,4±1,5 |
НТ |
97,8±2,3 |
НТ |
|
Bipolaris sorokiniana |
||||||||
|
ТРК 2-4 |
4,0±0,9 |
Т |
15,3±1,5 |
Т |
26,7±1,4 |
Т |
56,8±1,3 |
СТ |
|
ТРК 2-1 |
4,0±0,9 |
Т |
46,7±1,4 |
УТ |
34,6±1,1 |
УТ |
75,6±1,3 |
НТ |
|
МКЯ(В)-1 |
8,6±2,7 |
Т |
24,1±1,6 |
Т |
29,9±3,6 |
Т |
62,7±2,6 |
СТ |
|
МСЯ (В)-3 |
7,8±1,1 |
Т |
38,6±2,4 |
УТ |
44,4±1,8 |
УТ |
78,5±2,0 |
НТ |
|
КОП-18-1-9 |
11,6±3,1 |
Т |
26,6±2,2 |
Т |
41,1±2,5 |
УТ |
71,2±2,2 |
НТ |
|
КОЯ-18-8 |
12,7±2,4 |
Т |
20,9±1,7 |
Т |
61,2±4,2 |
СТ |
89,1±3,8 |
НТ |
|
ZM-B-1к |
10,5±6,2 |
Т |
25,8±2,4 |
Т |
75,5±2,7 |
НТ |
95,9±2,2 |
НТ |
|
Кр-19-6к-2 |
27,2±1,9 |
Т |
45,7±3,1 |
УТ |
67,2±1,9 |
СТ |
90,2±1,7 |
НТ |
|
Fusarium culmorum |
||||||||
|
ЦМЗ-1-00 |
13,9±1,2 |
Т |
21,4±1,0 |
Т |
50,7±2,4 |
СТ |
80,6±2,2 |
НТ |
|
КМ-11-5ст |
10,7±0,9 |
Т |
15,8±1,3 |
Т |
32,7±0,8 |
УТ |
72,4±1,3 |
НТ |
|
СЭ-36 |
6,9±1,0 |
Т |
11,9±1,1 |
Т |
26,7±1,3 |
Т |
51,6±1,4 |
СТ |
|
ZM-FC-1з |
13,9±1,6 |
Т |
27,6±3,0 |
Т |
43,6±2,5 |
УТ |
79,6±1,9 |
НТ |
|
FcB-1-16 |
19,4±1,3 |
Т |
30,5±1,6 |
УТ |
61,6±1,8 |
НТ |
95,5±2,1 |
НТ |
|
Fusarium fujikuroi |
||||||||
|
ZM-FF-4з |
30,1±1,6 |
Т |
39,9±2,2 |
УТ |
47,7±2,6 |
УТ |
78,6±3,0 |
НТ |
|
ZM-FF-2з |
45,0±2,2 |
УТ |
61,0±2,5 |
СТ |
76,4±2,4 |
НТ |
98,4±2,5 |
НТ |
|
ZM-FF-2кш |
35,6±1,6 |
УТ |
41,0±2,8 |
УТ |
70,8±3,3 |
НТ |
98,6±3,1 |
НТ |
|
ZM-FF-2л-1 |
34,5±1,6 |
УТ |
48,0±2,4 |
УТ |
59,1±2,6 |
СТ |
89,8±2,5 |
НТ |
|
ZM-FF-4з-1 |
44,4±2,0 |
УТ |
51,0±2,6 |
СТ |
89,2±3,0 |
НТ |
105,5±3,3 |
НТ |
|
ZM-FF-5з |
46,4±1,4 |
УТ |
60,0±1,6 |
СТ |
86,1±1,7 |
НТ |
106,3±1,9 |
НТ |
|
Fusarium graminearum |
||||||||
|
FG-30 |
1,1±0,3 |
Т |
5,7±0,4 |
Т |
25,8±0,8 |
Т |
55,9±1,3 |
СТ |
|
FG-33 |
0,3±0,1 |
Т |
1,9±0,7 |
Т |
12,3±1,1 |
Т |
44,8±1,3 |
УТ |
|
ZM-FG-3п |
22,8±2,0 |
Т |
31,7±2,7 |
УТ |
44,8±3,3 |
УТ |
65,7±2,4 |
СТ |
|
Fusarium heterosporum |
||||||||
|
ЦМО-1-01 |
7,9±0,6 |
Т |
26,3±1,3 |
Т |
49,2±1,6 |
УТ |
62,3±1,7 |
СТ |
|
КС-17-1-3 |
7,7±0,4 |
Т |
26,3±1,3 |
Т |
78,8±2,0 |
НТ |
109,7±2,2 |
НТ |
|
КС-17-3-1 |
12,0±0,7 |
Т |
29,7±1,3 |
Т |
86,1±2,2 |
НТ |
112,3±2,0 |
НТ |
|
ЦМО-1-01 |
9,7±0,8 |
Т |
24,5±1,3 |
Т |
49,2±1,6 |
УТ |
69,4±1,9 |
СТ |
|
100180 (к) |
16,7±3,6 |
Т |
36,6±2,2 |
Т |
60,7±2,7 |
СТ |
90,9±1,9 |
НТ |
|
Кр-19-6к-1 |
18,3±2,9 |
Т |
26,3±1,3 |
Т |
44,4±1,7 |
УТ |
69,5±1,8 |
СТ |
|
Кр-19-6л |
5,7±0,9 |
Т |
33,7±1,7 |
УТ |
52,8±2,9 |
СТ |
75,6±2,1 |
НТ |
|
ХЛ-2к-1 |
6,7±1,7 |
Т |
16,7±1,3 |
Т |
19,6±2,0 |
Т |
60,7±2,1 |
СТ |
|
ZM-FL-1к |
7,9±0,6 |
Т |
40,7±1,9 |
УТ |
66,7±1,9 |
СТ |
107,7±2,3 |
НТ |
|
ZM-FL-2л |
21,1±1,6 |
Т |
42,3±1,2 |
УТ |
72,3±3,2 |
НТ |
100,3±3,0 |
НТ |
Продолжение таблицы 2
Continuation of table 2
|
ФКЖ штамма гриба |
1* |
1 |
1 |
1 |
||||
|
1* |
2** |
1 |
2 |
1 |
2 |
1 |
2 |
|
|
Fusarium oxysporum |
||||||||
|
КЗ-17-3-2 |
6,6±1,1 |
Т |
10,5±1,2 |
Т |
26,4±2,1 |
Т |
65,5±2,4 |
СТ |
|
МКЯ(NT)-4 |
0,7±0,2 |
Т |
3,7±0,5 |
Т |
20,4±1,5 |
Т |
56,7±2,1 |
СТ |
|
МКЯ(Д)-4 |
20,2±1,8 |
Т |
33,7±1,9 |
УТ |
63,4±1,7 |
СТ |
102,3±1,6 |
НТ |
|
Fo-10-18 |
0,9±0,4 |
Т |
9,4±1,7 |
Т |
29,1±1,0 |
Т |
58,4±1,4 |
СТ |
|
Fo-117 |
0,7±0,2 |
Т |
1,7±0,7 |
Т |
8,7±0,3 |
Т |
53,6±2,3 |
СТ |
|
ZM-FO-2л |
1,6±0,6 |
Т |
6,6±1,1 |
Т |
36,4±1,3 |
УТ |
66,7±1,5 |
СТ |
|
FS-1-17 |
18,3±2,4 |
Т |
36,6±3,2 |
УТ |
45,5±3,4 |
УТ |
71,4±2,5 |
НТ |
|
ZM-FO-1л |
27,3±2,1 |
Т |
57,5±2,0 |
УТ |
77,6±2,4 |
НТ |
105,2±2,5 |
НТ |
|
ZM-FO-1ст |
17,7±2,3 |
Т |
29,3±1,8 |
Т |
39,5±2,8 |
УТ |
69,8±2,4 |
СТ |
|
ZM-FO-2к |
24,0±3,8 |
Т |
66,1±3,3 |
УТ |
73,1±4,5 |
НТ |
93,7±3,4 |
НТ |
|
ZM-FO-4з-2 |
24,5±1,4 |
Т |
45,3±1,9 |
УТ |
80,3±2,2 |
НТ |
100,6±1,9 |
НТ |
|
ZM-FO-8л |
8,6±1,3 |
Т |
16,7±1,5 |
Т |
26,6±1,6 |
Т |
65,4±1,5 |
СТ |
|
Кр-19-5к |
0,8±0,2 |
Т |
7,0±1,0 |
Т |
13,0±1,7 |
Т |
76,7±1,7 |
НТ |
|
Fusarium poae |
||||||||
|
100170 |
17,1±1,7 |
Т |
28,1±2,3 |
Т |
48,1±2,6 |
УТ |
79,4±2,5 |
НТ |
|
М-2-2 |
18,3±1,7 |
Т |
37,4±2,7 |
УТ |
57,4±2,4 |
СТ |
77,8±2,5 |
НТ |
|
ЦМВ 3-99 |
20,3±1,0 |
Т |
36,2±1,9 |
УТ |
58,4±1,8 |
СТ |
87,3±2,0 |
НТ |
|
Кр-19-15к |
46,2±1,9 |
УТ |
54,8±2,4 |
СТ |
74,2±2,9 |
НТ |
101,7±2,4 |
НТ |
|
Кр-19-7к |
38,6±1,9 |
УТ |
49,2±2,2 |
УТ |
65,4±1,8 |
СТ |
98,5±1,6 |
НТ |
|
Fusarium roseum |
||||||||
|
КРТ-10-1-кч |
16,2±1,1 |
Т |
22,2±1,5 |
Т |
28,7±2,1 |
Т |
58,8±2,0 |
СТ |
|
КРТ-11-1-кч |
19,1±1,9 |
Т |
26,2±1,1 |
Т |
46,2±1,7 |
УТ |
87,3±1,9 |
НТ |
|
КРТ-15-1-кч |
18,0±1,0 |
Т |
39,2±2,1 |
УТ |
72,6±1,9 |
НТ |
95,5±1,6 |
НТ |
|
ZM-FR-5к |
28,2±1,8 |
Т |
41,8±2,7 |
УТ |
51,2±2,8 |
СТ |
98,4±2,4 |
НТ |
|
Fusarium sporotrichioides |
||||||||
|
КС-17-1-1 |
7,3±0,7 |
Т |
15,0±1,3 |
Т |
50,2±1,6 |
СТ |
91,2±1,8 |
НТ |
|
КЗ-5-06 |
9,2±1,2 |
Т |
19,5±1,6 |
Т |
31,2±1,2 |
УТ |
66,2±1,4 |
СТ |
|
КП-97-4-2 |
8,2±1,1 |
Т |
19,2±1,3 |
Т |
33,2±1,8 |
УТ |
64,4±2,2 |
СТ |
|
КС-17-3-2 |
15,7±0,6 |
Т |
35,4±0,8 |
УТ |
70,8±1,6 |
НТ |
93,4±2,4 |
НТ |
|
ZM-FS-4к |
1,2±0,3 |
Т |
4,2±0,8 |
Т |
14,8±1,1 |
Т |
83,3±2,8 |
НТ |
|
КОП-18-2-5 |
15,1±1,6 |
Т |
26,1±1,7 |
Т |
45,1±1,3 |
УТ |
72,4±1,5 |
НТ |
|
Fsp-1 |
26,1±1,6 |
Т |
37,5±1,8 |
УТ |
47,1±2,4 |
УТ |
80,4±2,0 |
НТ |
|
Neocosmospora solani |
||||||||
|
МО-Кр-3-09 |
15,9±1,1 |
Т |
19,9±1,2 |
Т |
29,7±1,2 |
Т |
55,5±1,4 |
СТ |
|
МСП-3-6 |
23,8±2,3 |
Т |
40,6±1,8 |
УТ |
63,7±2,1 |
СТ |
87,6±2,2 |
НТ |
|
Р-1-05 |
26,6±1,8 |
Т |
45,8±1,6 |
УТ |
71,5±2,0 |
НТ |
97,4±2,2 |
НТ |
|
Fs-10-16 |
22,2±1,4 |
Т |
37,2±1,8 |
УТ |
46,2±2,4 |
УТ |
76,3±1,8 |
НТ |
Примечание: 1* – средняя длина корней (% к контролю); 2** - уровень токсичности.
сутки инкубации при комнатной температуре и естественном освещении.
О фитотоксичности штамма гриба судили по влиянию ФКЖ на всхожесть семян, развитие проростков и корней пшеницы.Наиболее заметное влияние метаболиты оказывали на рост первичных корней растений.В этой связи расчет измерений средних значений длины первичных корней (мм), выраженных в процентах к контролю,позволил выявить степень фитотоксичности штаммов микромицетов во всех вариантах.Так,если длина корней в опытном варианте составляла 0-30% от длины контроля, то это свидетельствовало о сильной токсичной (Т) активности гриба; 31-50% – умеренной токсичности (УТ); 51-70% – слабой токсичности (СТ); 71-100% – о нетоксичных (НТ) свойствах изолятов. Длину корней семян, пророщенных в воде, считали контролем и принимали за 100%.
Статистическую обработку результатов проводили общепринятыми методами, рассчитывая средние арифметические и доверительные интервалы с уровнем вероятности 0.95 по трем независимым экспериментам с помощью модифицированной программы, разработанной в среде Windows 98 на базе Excel [23, 24].
Результаты исследований и обсуждение
Для получения статистически сравнимых результатов при определении токсичности штаммов существенное значение имел выбор вида растения в качестве тест-объекта, общего для всех изучаемых микромицетов. Как следует из таблицы 1, исследуемые виды грибов широко специализированы ко многим неродственным культурным растениям. Так, штаммы Fusarium oxysporum были изолированы из корнеплодов свеклы,корней пшеницы и ячменя, приземных листьев риса и кукурузы, при этом все они формировали стандартные для вида характеристики по морфологии мицелия и структуре конидий. Попытка использования в качестве тест-культур проростков свеклы оказалась непродуктивной из-за особенностей развития семян этой культуры и слабой энергии ростовых процессов в начале вегетации.Хорошие результаты показали семена кукурузы, ячменя и риса, ответные реакции на споровые суспензии и фильтраты культуральной жидкости грибов на проростках этих культур были типичными для всех зерновых с четкими характеристиками для получения достоверных результатов. А поскольку известно, что виды мицелиальных микро-мицетов из родов Alternaria, Bipolaris, Fusarium
хорошо адаптированы к паразитированию на широком круге культурных растений, в том числе и зер-новых,нами в качестве тест-объекта была выбрана пшеница,как наиболее частый источник выделения микромицетов из родов Alterna ria , B ipola ris, F usa rium. Кроме всего прочего, использование семян пшеницы в качестве тест-объекта для метода биопробы доступно и удобно в практическом применении. Предварительные исследования, проведенные на семенах зерновых культур, в том числе и сортах пшеницы, позволили получить математически достоверные и сравнимые результаты.В наших исследованиях по определению степени влияния ФКЖ штаммов грибов на интенсивность развития проростков растений широкое применение получил сорт Мироновская 808. Для экспериментов отбирали здоровые,выполненные,одинаковые по размеру семена.
Следует отметить,что при проведении исследований по влиянию концентрации споровых суспензий и фильтратов культуральных жидкостей грибов на проростки пшеницы, для более лаконичного изложения материала ограничились использованием в описательной части только одним биометрическим показателем, а именно показателем длины первичных корней.
Результаты обработки семян пшеницы (сорт Мироновская 808) фильтратами штаммов грибов без разведения водой оказались неинформативными. Высокая концентрация токсичных веществ в культуральной жидкости мицелиальных грибов негативно сказывалась на всхожести семян.В течение 5суток,следующих после обработки ФКЖ,на поверхности зерен появлялся мицелий плесневых микромицетов,в результате чего они,как правило, не прорастали и загнивали.
Принимая во внимание это обстоятельство,нами была опробована серия разведений ФКЖ стерильной водопроводной водой в пропорциях 4:1, 3:2, 2:3 и 1:4,проверка которых позволила выбрать наиболее репрезентативную концентрацию для оценки фитотоксичности у штаммов грибов.
По результатам проведенных исследований на 5-суточных всходах пшеницы установлено,что мета- болиты грибов в указанных разведениях ФКЖ избирательно влияли на рост и развитие проростков, оказывая как ингибирующее, так и стимулирующее действие (табл. 2).
Результаты обработки семян пшеницы ФКЖ сорта Мироновская 808 при разведении 4:1 выявили достоверное ингибирующее влияние метаболитов штаммов Bipolaris sorokiniana (рис. 1а), Fusarium oxysporum (рис. 1б), Fusarium gram inearum, Fusarium heterosporum Alternaria alternata на рост первичных корней. Так, например, действие ФКЖ штаммов Fusarium sporotrichioides подавляло развитие корней тест-объекта на 73,9-98,8%.
Некоторое разнообразие по изучаемому признаку отмечали у видов Fusarium poae и Fusarium fujikuroi , здесь наряду с токсичными штаммами встречались и умеренно-токсичные (рис. 1в).
Таким образом, использование культуральной жидкости в разведении 4:1 выявило наличие двух групп, из которых 90% были представлены высокотоксичными и 10% - умеренно-токсичными штаммами грибов.
Результаты обработки метаболитами культуральной жидкости при разведениях ФКЖ 3:2 и 1:4 оказались неоднозначными. В первом случае развитие проростков пшеницы достоверно замедлялось.Тем не менее,результаты,полученные при разведении 3:2, показали наличие штаммов грибов (66 из 70), относящихся по токсичности к двум группам: умеренно (41,4%) и высокотоксичные (52,9%).
Нейтральное и слабое проявление токсичности отмечали на всходах пшеницы при обработке семян ФКЖ в разведении 1:4.Из общего числа проверенных штаммов группу слаботоксичные составили 31,4%, а группу нетоксичные - 68,6%. Следует заме-тить,что в последней группе встречались штаммы, заметно стимулирующие рост корней.Например,у Fusarium heterosporum такими свойствами обладали штаммы КС-17-1-3, КС-17-3-1, ZM -F L-1к, у Fusarium fujikuroi – ZM-FF-4з-1, ZM-FF-5з.
Результаты обработки семян пшеницы ФКЖ грибов в пропорции 2:3 выявили весь спектр известных градаций токсичности, что, в конечном итоге, позволило условно разделить штаммы микромице-
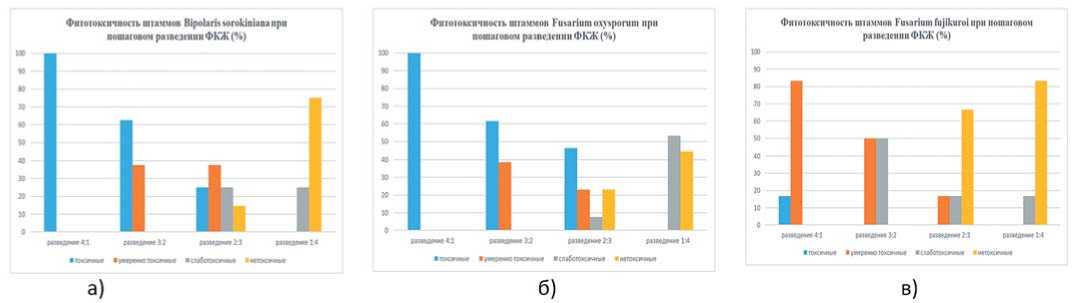
Рис.1.Фитотоксичность штаммов при пошаговом разведении ФКЖ (%): а)Bipolaris sorokiniana;б)Fusarium oxysporum;в)Fusarium fujikuroi
Fig.1.Phytotoxicityofstrains during step-by-step dilution offiltration ofculturalliquid (%): а)Bipolaris sorokiniana;b)Fusarium oxysporum;c)Fusarium fujikuroi
Таблица 3. Распределение видов мицелиальных микромицетов по степени фитотоксичности при разведении ФКЖ в соотношении 2:3 Table 3. Distribution of species of mycelial micromycetes according to the degree of phytotoxicity when diluting the filtration of a cultural liquid in a ratio of 2:3
• Altei Ilaria alternate
• Fusarium graminearum
• Fusarium sporotrichioides
• Fusarium fujikuroi
1:4
-
• Bipolaris sorokiniana
-
• Fusarium oxysporum
-
• Neocosmospora solani
-
• Fusarium culmorum
-
• Fusarium roseuni
-
• Fusarium poae
-
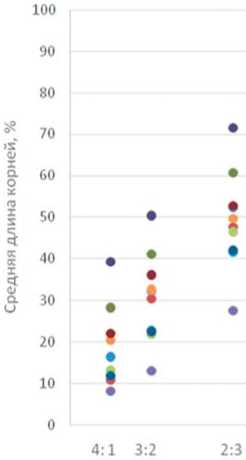
Рис.2.График линейной корреляционной зависимости двух факторов: средняя длина первичных корней пшеницы (%)и разведение ФКЖ микромицетов
Таблица 4. Статистические показатели зависимости средней длины корней (в % к контролю) и разведения ФКЖ микромицетов Table 4. Statistical indicators of the dependence of the average length of the roots (in % of the control) and the diluting the filtration of a cultural liquid of micromycetes
|
Вид |
о „ m ш о ° ■ с ° о S |
Средние значения по виду гриба в разведении ФКЖ |
и О.® ” н О ° |
н т S И" е® о. |
z го % =Г^ s S Q. |
к о X S= CQ Q. |
ГО a -8-q. |
н го | S н к Q.O q ОО |
|||
|
4:1 |
3:2 |
2:3 |
1:4 |
||||||||
|
Alternaria alternata |
5 |
16,2 |
32,3 |
52,2 |
83,7 |
12,4 |
0,99149 |
0,64545 |
0,99983 |
0,09208 |
10,8 |
|
Bipolaris sorokiniana |
8 |
10,8 |
30,5 |
47,6 |
77,5 |
4,6 |
0,98375 |
0,41565 |
0,99968 |
0,12695 |
7,7 |
|
Fusarium culmorum |
5 |
13,0 |
21,8 |
46,3 |
75,9 |
12,8 |
0,99359 |
0,72125 |
0,99987 |
0,07991 |
12,4 |
|
Fusarium graminearum |
3 |
8,1 |
13,1 |
27,6 |
55,5 |
7,6 |
0,99933 |
0,96670 |
0,99999 |
0,02591 |
38,6 |
|
Fusarium oxysporum |
13 |
11,7 |
22,6 |
41,5 |
75,8 |
10,8 |
0,99915 |
0,95793 |
0,99998 |
0,02919 |
34,2 |
|
Fusarium roseum |
4 |
20,4 |
32,4 |
49,7 |
85,0 |
10,4 |
0,99899 |
0,95032 |
0,99998 |
0,03178 |
31,4 |
|
Fusarium sporotrichioides |
7 |
11,8 |
22,4 |
41,8 |
78,8 |
11 |
0,99975 |
0,98723 |
0,99999 |
0,01596 |
62,6 |
|
Neocosmospora solani |
4 |
22,1 |
35,9 |
52,8 |
79,2 |
10,6 |
0,99086 |
0,62408 |
0,99982 |
0,09540 |
10,4 |
|
Fusarium poae |
5 |
28,1 |
41,1 |
60,7 |
88,9 |
11,6 |
0,99269 |
0,68806 |
0,99985 |
0,08532 |
11,6 |
|
Fusarium fujikuroi |
6 |
39,3 |
50,2 |
71,6 |
96,2 |
11,9 |
0,98899 |
0,56382 |
0,99978 |
0,10463 |
9,5 |
Исходя из данных по частоте встречаемости групп штаммов грибов,судили и о степени токсичности видов, в целом. Виды Fusarium graminearum (66,7%) и Fusarium oxysporum (46,2%) отнесены к наиболее токсичным видам,что согласуется с данными многих исследователей [4, 25, 26]. Для вида Fusarium graminearum доля высоко и умеренно токсичных показателей в суммарном выражении составила 100%, Fusarium oxysporum – 69,3%. Наряду с этими видами, Bipolaris sorokiniana и Fusarium sporotrichioides по сумме показателей токсичности (высокой и умеренной) имели 62,5% и 71,4%, соот-ветственно.В свою очередь,это свидетельствовало о достаточно высокой токсичности этих видов, что, с практической точки зрения, проявлялось значительным угнетением развития всходов пшеницы.
Более низкая токсичность ФКЖ у видов Fusarium fujikuroi и Fusarium poae может быть объяснена биологическими особенностями или недостаточностью выборки.
По результатам испытаний установлено,что все используемые штаммы микромицетов обладали той или иной степенью токсической активности, которая проявлялась интенсивностью развития проростков растений пшеницы. Практически во всех вариантах исследований показатель длины корней зависел от концентрации ФКЖ (рис. 2).
Как следует из рисунка 2,независимые факторы (разведение ФКЖ грибов и развитие растений тест-объекта) выражаются на графике в виде линейной положительной корреляции. Для всех вариантов опыта, r - коэффициент корреляции Пирсона был больше 0.9 (при r< 0,3- корреляционная зависимость слабая; r=0,3-0,7 – средняя; r>0,7 – сильная.), что указывает на сильную зависимость двух факторов (табл. 4).
Наряду с этим, вычисление верхних и нижних границ стандартного доверительного интервала подтвердили зависимость двух факторов, так как все значения коэффициента не выходят за рамки 95%.
Взаимосвязь двух факторов доказана и при вычислении критерия существенности, через ошибку корреляции. Значения критерия t-Стьюдента (табличное значение)для критерия свободы 2 (для всех вариантов) равняется t= 4,3. При сравнивании t факт и t теор (t-Стьюдента), получается, что t факт >t теор . Значит, корреляционная связь существенная для всех вариантов опыта.
Среднеквадратическое отклонение дает возможность оценить разброс значений, полученных в результате измерения определенного показателя, в нашем случае – длины корней (в % к контролю). При вычислении среднего отклонения,основывались на том, что, чем оно больше, тем сильнее разброс значений в представленном множестве; чем меньше, тем более сгруппированы показатели вокруг среднего значения. Полученные результаты свидетельствуют о достаточном разбросе показателей развития корней в пределах среднего значения фактора. Из этого следует, что разница между 4 показателями разведения ФКЖ, выраженная значениями среднего отклонения, существенна.
Таким образом, результатами исследований подтверждено,что наиболее вариабельные значения по токсичности были найдены при применении фильтрата культуральной жидкости (ФКЖ) в пропорции 2:3.В условиях применения этой концентрации ФКЖ штаммы делятся на 4 группы с характерными отличиями по степени токсичности. Это обстоятельство является важным основанием для включения подобных штаммов микромицетов в Государственную коллекцию фитопатогенных мик-роорганизмов.Штаммы грибов с установленными свойствами токсичности необходимы для использования в селекции по созданию устойчивых и толерантных сортов сельскохозяйственных культур.
Об авторах:
Aboutthe Authors:
Natalya S. Zhemchuzhina – Cand. Sci. (Biology),
Svetlana A. Elizarova – microbiologist of the State Collection of Phytopathogenic Microorganisms and Plant Varieties-Identifiers of
Pathogenic Microorganism Strains
Marina I. Kiseleva – Cand. Sci. (Biology),
Senior Researcher, Department of Mycology and Immunity
Dmitri A. Zakharov – Postgraduate Student of the State Collection of
Phytopathogenic Microorganisms and Plant Varieties-Identifiers of
Pathogenic Microorganism Strains
Irina I. Sardarova – Postgraduate student of the laboratory for selection for resistance to abiotic and biotic stress factors
Список литературы Экспериментальное обоснование методики оценки фитотоксичности микромицетов на проростках пшеницы
- Арасланова Н.М., Ивебор М.В., Саукова С.Л., Антонова Т.С., Рамазанова С.А. Влияние культуральных фильтратов изолятов грибов родов Alternaria, Bipolaris, Ulocladium на прорастание семян и развитие проростков подсолнечника. Масличные культуры. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур. 2014;1(157-158):124-129. EDN SFBQVN.
- Берестецкий О.А. Изучение фитотоксических свойств микроскопических грибов / Методы экспериментальной микологии. Киев: Наукова думка, 1982. C. 321-333
- Билай В.И., Курбатская З.А. Определитель токсинообразующих микромицетов. Киев. - 1990.
- Гагкаева Т.Ю., Гаврилова О.П., Орина А.С. Выявление токсинопродуцирующих грибов рода Fusarium в зерне озимой пшеницы в Центральном регионе Европейской части России. Успехи медицинской микологии. 2018;(19):299-303. EDN UROYXQ.
- Третьякова И.Н., Садыкова В.С., Носкова Н.П., Бондарь П.Н., Гайдашева И.И., Громовых Т.И., Иваницкая А.С., Ижболдина М.В., Барсукова А.В. Рост стимулирующая активность штаммов рода Streptomyces и Trichoderma и перспективы их использования для микроклонального размножения хвойных. Биотехнология. 2009;(1):39-44.
- Temirbekova, S.K., Kulikov, I.M., Afanasyeva, Y.V., Ashirbekov, M.Z., Beloshapkina, O.O., Kalashnikova, E.A., Sardarova, I., Begeulov, M.S., Kucher, D.E., Ionova, N.E., Rebouh N.Y. The Biological Traumatization of Crops Due to the Enzyme Stage of Enzyme-Mycotic Seed Depletion. Pathogens. 2022;(11):376. https://doi.org/10.3390/pathogens11030376
- Темирбекова С.К., Черемисова Т.Д., Куликов И.М., Афанасьева Ю.В., Зуев Е.В., Потапова Е.С. Мировая коллекция ВИР - ключ для «идеала» сорта Н.И. Вавилова на устойчивость к абиотическим и биотическим стрессам Центрального региона РФ. Москва: ВСТИСП, 2020. 108 с.: илл.
- Берестецкий А.О. Фитотоксины грибов: от фундаментальных исследований - к практическому использованию (обзор). Прикладная биохимия и микробиология. 2008;44(5):501-514. EDN JJWHSJ.
- Литовка Ю.А., Савицкая А.Г., Рязанова Т.В. Видовой состав и фитотоксичные свойства микромицетов рода Fusarium, распространенных в лесных питомниках средней и южной Сибири. Теоретический и научнопрактический журнал: Хвойные бореальной зоны. 2011;XXIX(3-4):232- 236.
- Wagacha J.M., Muthomi J.W. Fusarium culmorum: Infection process, mechanisms of mycotoxin production and their role in pathogenesis in wheat. Crop Protection. 2007;(26):877-885.
- Ганнибал Ф.Б. Токсигенность и патогенность грибов рода Alternaria для злаков. Лаборатория микологии и фитопатологии им. А.А. Ячевского ВИЗР. История и современность / Под ред. А.П. Дмитриева. СПб. 2007. С. 82-93
- Парфенова Т.А., Алексеева Т.П. Токсическое влияние фильтрата культуральной жидкости грибов рода Fusarium на семена пшеницы. Микология и фитопатология. 1995;29(1)Я:78-82.
- Жемчужина Н.С., Киселева М.И., Коломиец Т.М. Выявление разнообразия микромицетов рода Fusarium в агроэкосистемах равнинной части Северного Кавказа для пополнения Государственной коллекции фитопатогенных микроорганизмов ФГБНУ ВНИИФ. Вавиловский журнал генетики и селекции. 2021;25(8):874-881. https://doi.org/10.18699/VJ21.101. EDN YBJMZN.
- Коломиец Т.М., Жемчужина Н.С., Киселева М.И., Пахолкова Е.В., Глинушкин А.П. Роль генофонда Государственной Коллекции фитопатогенных микроорганизмов ВНИИ фитопатологии в обеспечении научных исследований. Материалы Пятого Съезда Микологов России (12-14 октября 2022 г., г. Москва), в сборнике: Современная микология в России. 2022;(9):10-12. https://doi.org/10.14427/cmr.2022.ix.01
- Государственная коллекция фитопатогенных микроорганизмов и сортов растений-идентификаторов патогенных штаммов микроорганизмов. ВНИИФ URL: http://vniif.ru/vniif/structure/collection/page/1367.
- Дудка И.А. Методы экспериментальной микологии. Киев: Наук. Думка. 1982. 550 с.
- Билай В.И. Основы общей микологии. Киев: Выща школа, 1989. 392 с.
- Хасанов Б.А. Определитель грибов возбудителей «гельминтоспориозов» растений из родов Bipolaris, Drechslera и Exserohilum. Ташкент: ФАН, 1992. 243 с.
- Dugan F.M. The identification of fungi. An illustrated introduction with keys, glossary, and guide to literature. The American Phytopathological Society Press, St. Paul, Minnesota, USA, 2006. 176 p.
- Gerlach W., Nirenberg H. The genus Fusarium - a pictorial atlas. Mitteilungen der Biologischen Bundesanstalt fоr Land- und Forstwirtschaft. 1982;(209):1-406.
- Simmons E.G. Alternaria. An Identification Manual. Utrecht: CBS. 2007. 775 p.
- Федорович М.Н., Шашко Ю.К., Шашко М.Н., Поликсенова В.Д. Токсичность культуральных фильтратов мелкоспоровых видов рода Alternaria Nees. Вестник БГУ. 2006;2(2):36-39.
- Доспехов Б.А. Планирование полевого опыта и статистическая обработка его данных. М.: Колос, 1972. 206 с.
- Ершова Н.М. Дисперсионный анализ данных наблюдений с помощью пакета анализа приложения Excel. Вісник Придніпровської державної академії будівництва та архітектури. 2009;3(134):10-20. EDN WXFFUJ.
- Домрачева Л.И., Трефилова Л.В., Фокина А.И. Фузарии: биологический контроль, сорбционные возможности. Saarbrücken: LAP LAMBERT, 2013. 182 с. EDN YKYHWR.
- Иванов А.В., Семенов Э.И., Ермолаева О.К., Галиева Г.М., Тремасов М.Я. Токсигенный потенциал штаммов Fusarium sporotrichioides. Проблемы микологии и фитопатологии в ХХI веке / Материалы международной научной конференции, посвященной 150-летию со дня рождения члена-корреспондента АН СССР, профессора Артура Артуровича Ячевского. Санкт-Петербург 2-4 октября 2013 года. C. 142-145.


