Экспериментальное обоснование применения адъювантной терапии церебролизином для оптимизации посттравматической регенерации периферического нерва
Автор: Щудло Н.А., Сизова Т.В., Борисова И.В., Щудло М.М., Шамара А.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2008 года.
Бесплатный доступ
С целью выявления эффектов церебролизина на регенерацию периферического нерва у 36 взрослых беспородных собак пересекали седалищный нерв и сшивали с применением микрохирургической техники. У 13 собак с 3-го дня после операции провели курс параневральных инъекций церебролизина, остальные составили группу сравнения. Тяжесть и длительность неврологических расстройств в опытной группе уменьшены. По данным ЭМГ, отмечается тенденция более интенсивного прироста амплитуды М-ответа икроножной мышцы и более раннего появления М-ответов в передней большеберцовой мышце, меньшая их вариативность в ходе восстановления. Установлено положительное влияние церебролизина на восстановление и поддержание структурных параметров регенерирующих нервных волокон, врастающих в дистальный отрезок нерва
Регенерация нерва, фармакологическая стимуляция
Короткий адрес: https://sciup.org/142121121
IDR: 142121121
Текст научной статьи Экспериментальное обоснование применения адъювантной терапии церебролизином для оптимизации посттравматической регенерации периферического нерва
Волокна периферической нервной системы высших млекопитающих и человека обладают высокими потенциями к регенерации. Объясняется это чаще всего тем, что в отличие от глии центральной нервной системы, шванновские клетки не ингибируют, а стимулируют и ориентируют аксональный спраутинг.
Однако в клинике функциональные результаты лечения анатомических перерывов нервов признаются хорошими не более чем у половины пациентов даже при оптимальном варианте восстановительной операции - первичном микрохирургическом шве [3, 9, 11]. Известно, что кроме своевременности и качества операции на нерве её результат определяется множеством биологических факторов. К ним относятся выраженность посттравматического и отсроченного апоптоза нейронов и дезориентации их регенерирующих аксонов, низкая скорость аксонно- го транспорта, проблемы восстановления кровоснабжения нерва и ремиелинизации регенерирующих мякотных волокон, снижающиеся с возрастом регенераторные потенции и сопутствующие заболевания пациента.
В течение нескольких десятилетий в опытах на животных проверялось предположение о целесообразности применения для оптимизации регенерации нервов экзогенных пептидов – факторов роста и нейротрофинов [10], однако клиническое внедрение данной терапевтической стратегии затруднено по ряду причин. Отсутствуют соответствующие официнальные препараты. Факторы роста нервов и нейротрофины не проникают через гемато-энцефалический и гемато-нейральный барьеры и потому невозможно их длительное систематическое применение. Кроме того, они обладают побочными эффектами (например, вызывают гипералгезию).
В фармакопее известен пептидергический препарат церебролизин, который проникает через барьерные структуры и по действию аналогичен естественным факторам нейронального роста. Он более 40 лет используется в лечении цереброва- скулярной патологии и травматических повреждений головного мозга, однако данных о его влиянии на ПНС в доступной литературе нет.
Цель - выявление эффектов церебролизина на регенерацию периефрического нерва.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты выполнены на 36 взрослых беспородных собаках, которым на уровне середины бедра ножницами Millesi пересекали седалищный нерв и сшивали с применением оптического увеличения операционного микроскопа Opton 6-12х, инструментария фирмы Aesculap, шовного материала Ethicon калибра 8/0. У 13 собак начиная с 3-го дня после операции провели курс из 20 инъекций церебролизина (по 0,5 мл 3-5 раз в неделю), который вводили параневрально в область седалищной вырезки. Остальные 23 собаки составили контрольную группу.
В ходе эксперимента регистрировали клинические проявления выпадения опорнодвигательной и трофической функций седалищного нерва в индивидуальных семиотическых картах животных.
Через 1, 2, 4, 6, 9 и 12 месяцев после операции проводили электрофизиологические исследования. Оценивали качественный состав интенсивность и динамику во времени спонтанной биоэлектрической активности икроножной и передней большеберцовой мышц в покое при биполярном отведении. Методом стимуляционной электромиографии (ЭМГ) по общепринятой методике [1] в модификации, предложенной д.б.н. А.П. Шеиным (Удлинение нервного ствола после образования его дефекта в эксперименте: Отчет о НИР (заключит.) / МЗ РСФСР. КНИИЭКОТ; Науч. рук. Г.А. Илизаров. – № ГР. 01830066812 инв. № 02870018716. - Курган, 1986.–74 с.), под внутривенным барбитуровым наркозом получали вызванную биоэлектрическую активность (M-ответы) икроножной и передней большеберцовой мышц в результате раздражения седалищного нерва через игольчатый электрод прямоугольными импульсами длительностью 1 мс с заведомо супрамаксимальной амплитудой и регистрировали с помощью ЭМГ-системы “DISA-1500” фир- мы DANTEC (Дания) монополярно. Активный электрод вводили в брюшко тестируемой мышцы, а индифферентный - под кожу в области сухожилия.
Содержание, кормление животных, операции и сеансы ЭМГ, а также выведение из опыта осуществляли согласно приказу МЗ СССР № 775, 1977 г. (Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник и вивариев. Утверждено приказом № 1045-73 главным санитарным врачом СССР от 06.04.73).
Седалищные нервы иссекали, подвергали аль-дегидно-осмиевой фиксации, заливали в эпоксидные смолы. Поперечные полутонкие (толщиной 1 мкм) срезы оперированных нервов дистальнее уровня швов и соответствующих участков интактных нервов получали на ультратомах фирмы LKB (Швеция) и окрашивали по Уикли.
Используя большие исследовательские микроскопы фирмы “Opton” (Германия) и аппаратно-программный комплекс “ДиаМорф” (Москва), оцифровывали от 30 до 80 полей зрения (увеличение 1250) и таким образом от каждой собаки получали изображения от 300 до 500 мякотных нервных волокон. Методом точечного счёта в изображениях определяли объёмную плотность нейральных элементов. Рассчитывали численную плотность мякотных волокон. Измеряли их диаметры, толщину аксонов и миелиновой оболочки, определяли соответствующие средние показатели. Для двойного контроля результатов опыта морфометрировали нервы 3 интактных собак. Строили гистограммы распределения мякотных волокон по диаметру (шаг 1 мкм) по данным от каждого животного и усреднённые гистограммы по каждой группе. Для статистической обработки данных использовали средства Microsoft Excel-2000.
РЕЗУЛЬТАТЫ
Как в опыте, так и контроле в послеоперационном периоде отмечалось отсутствие либо ослабление опорной функции денервированной конечности, её волочение, опора на тыльную поверхность стопы, находящейся в состоянии подошвенной гиперфлексии. Средний срок восстановления нормального позиционирования стопы в стойке, при ходьбе и беге в контрольной группе составил 4,9±0,7 месяца после операции, а в опыте - 3,2±0,4 (p<0,05).
В контрольной группе среди нейротрофических расстройств наряду с поверхностными эрозиями кожи в пяточной области, на тыле стопы и пальцах развивались длительно заживающие (до 3,5 месяцев после операции) трофические язвы площадью от 1 до 5 см2, которые наблюдались у 10 собак из 23 (43,5 %). В опыте преобладали поверхностные кожные эрозии площадью до 0,5 см2, язвы – только у 3 собак из 13 (23,1 %), их площадь ни в одном опыте не пре- высила 1 см2, срок заживления 24-35 дней. На фоне лечения церебролизином ни у одного из 13 животных не наблюдалось аутомутиляционного поведения, а в контроле аутомутиляция отмечена у 2 собак из 23 (8,7 %).
Описание динамики фоновой биоэлектрической активности мышц в покое контрольных животных подробно описаны в ранее опубликованных работах [6; 7]. В основной группе она укладывалась в значительно меньший временной интервал, чем в контроле.
По данным электромиографии в первый месяц после операции у всех животных в обеих мышцах голени регистрировался повышенный уровень ЭМГ покоя. В икроножной мышце животных основной группы в трети (33 %) всех наблюдений он состоял из множественных потенциалов фибрилляции (ПФ), чуть больше половины (56 %) анализируемых случаев были представлены их комбинацией с потенциалами фасцикуляции (ПФК) и только в одном наблюдении (11 %) были только ПФК без ПФ. Для передней большеберцовой мышцы фон, состоящий из ПФ, имеет место в 20 % наблюдений, комбинация ПФ и ПФК отмечена в 60 % случаев и в 20 % наблюдений зарегистрированы только ПФК. По сравнению с контролем в основной группе ПФ встречаются реже в обеих мышцах, а ПФК чаще в передней большеберцовой. Степень интенсивности и насыщенности ЭМГ-покоя в основной группе была меньше, чем в контрольной. ПФ быстрее затухают. Для икроножной мышцы интерференционная активность встречается в единичных случаях, а для передней большеберцовой несколько больше.
Ко второму месяцу после операции у животных основной группы в икроножной мышце в большинстве наблюдений (55 %) фоновая биоэлектрическая активность отсутствовала, ПФ наблюдались только в комбинации с ПФК (18 % - в икроножной, 58 % - в передней большеберцовой мышцах). ПФК без фибриллятор-ной активности отмечались в 27 % и 25 % случаев, соответственно. Случаев полного отсутствия повышенной ЭМГ покоя в передней большеберцовой было значительно меньше (17 %), чем в икроножной. У контрольных животных во всех отведениях имела место выраженная спонтанная активность покоя, состоящая из ПФ, ПФК и их разнообразного сочетания.
К четвёртому месяцу наблюдений в основной группе животных в икроножной мышце имеется только один случай возникновения быстро затухающих ПФ, возникающих в ответ на введение игольчатого электрода. У остальных животных биоэлектрический фон в норме. В передней большеберцовой мышце имеется по одному случаю наблюдения ПФ и ПФК.
В дальнейшем, практически у всех животных основной группы ЭМГ покоя обеих тести- рованных мышц остаётся в норме, за исключением двух наблюдений единичных ПФК на 6 и 12 месяцев эксперимента, что может быть связано с эффектами наркоза [2] или другими причинами, не имеющими прямого отношения к реиннервации (см. ниже).
Если сравнивать фоновую активность тестированных мышц, то следует отметить, что в ранние сроки эксперимента у животных основной группы и в контроле ПФ (самостоятельно или в комбинации) встречаются чаще и проявляются интенсивнее в передней большеберцовой мышце, чем в икроножной, что соответствует ранее полученным данным [6; 7]. ПФК у животных основной группы в обеих мышцах выражены одинаково, в то время как в контрольной группе они преобладают в икроножной.
В основной группе животных при биполярном отведении в первый месяц после операции из-за высокого уровня биоэлектрического фона и выраженного артефакта раздражения нельзя было с полной уверенностью констатировать отсутствие или наличие М-ответа икроножной и передней большеберцовой мышц в 66 % и 93 % наблюдений, соответственно. Причём в первой мышце M-ответ скорее отсутствовал в 33 % наблюдений, а во второй - в 62 % случаев. Для обеих мышц голени около трети наблюдений неоднозначной идентификации M-ответа соответствовали ситуации, когда он скорее присутствовал. Наличие хорошо выраженных M-ответов с амплитудой до нескольких сот микровольт наблюдалось, соответственно, в 33 % и 8 % (1 наблюдение) случаев для тестированных мышц голени на данный срок эксперимента.
Через два месяца после операции в икроножной мышце оставалось только одно наблюдение, в котором M-ответ был под вопросом, причём скорее «да», чем «нет». Для передней большеберцовой мышцы наблюдений с неопределённостью наличия М-ответа 4, в двух из них его «скорее нет» и только в одном, он «скорее есть». В большинстве же случаев в обеих мышцах регистрируются хорошо выраженные M-ответы с амплитудой несколько сот микровольт и выше.
Часто в период 1-2 месяца после операции М-ответ обеих тестированных мышц при биполярном отведении в основной и контрольной группах животных приобретал характерный полифазный или даже мультифазный вид, при этом его форма, амплитуда и длительность постоянно флуктуировали.
Если сравнивать М-ответы тестированных мышц при локальном отведении в ранние сроки эксперимента, то следует отметить, что случаи полного отсутствия вызванной активности или затруднений при её идентификации встречаются чаще в передней большеберцовой мышце, чем в икроножной мышце, что соответствует ранее полученным данным [6, 7].
В дальнейшем при биполярном отведении амплитуда М-ответа быстро увеличивается, достигая нескольких тысяч мкВ и более. Высокая её вариативность не позволяет в дальнейшем (на поздних сроках эксперимента) использовать данный параметр в качестве критерия сравнения результатов основной и контрольной групп.
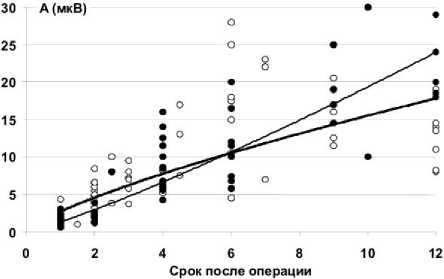
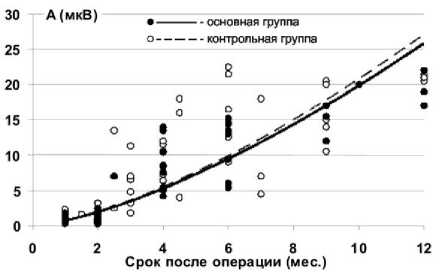
При монополярном отведении М-ответы появляются через месяц после операции во всех мышцах и у всех животных. Их амплитуда колеблется от 200-300 мкВ до 1-3 мВ. В икроножной мышце этот параметр, как правило, выше, чем в передней большеберцовой, а в основной группе ниже, чем в контрольной (рис. 1). Таким образом, мы наблюдаем ЭМГ-признаки более интенсивного начала процесса восстановления функции двигательных единиц икроножной мышцы, по сравнению с передней большеберцовой мышцей в обеих группах животных.
Относительно сравнения интенсивности ре-иннервационных процессов в основной и контрольной группах животных на ранних сроках после шва нерва по имеющимся данным сделать нельзя. C одной стороны, наблюдается более быстрая нормализация ЭМГ покоя у животных, получавших церебролизин. С другой стороны, М-ответы при би- и монополярном отведении у них несколько меньше, чем в контроле. Компромиссное объяснение этого феномена может быть связано с тем, что амплитуда М-ответа определяется не только количеством синхронно активированных ДЕ, но и характером суммации их ПД [1]. Это обстоятельство в сочетании с фактом более быстрой нормализации ЭМГ покоя в мышцах животных основной группы позволяет предположить, что более низкая амплитуда ранних M-ответов связана не с отставанием реиннервации от контроля, а с особенностями её характера.
Для сравнения динамики дальнейшего восстановления активационной способности мышц голени животных основной и контрольной групп использовали метод аппроксимации соответствующих рядов значений амплитуд М-ответов, ранжированных по увеличению времени эксперимента, поскольку в ранее проведённых нами исследованиях [5] было показано, что эффективная реиннервация сопровождается увеличением амплитуды М -ответа хорошо описываемым уравнением степенной функции A=at b ; где A -амплитуда М-ответа, t - срок эксперимента, а и b - параметрические коэффициенты.
Аппроксимация показывает (рис. 1), что для М-ответов икроножной мышцы (рис. 1, а) основной группы отмечается тенденция более интенсивного прироста амплитуды по сравнению с контролем. Для передней большеберцовой мышцы (рис. 1, б) тренды восстановления М-ответов в основной и контрольной группах практически совпадают, однако при этом в основной группе можно отметить повышение вероятности более раннего появления М-ответов и меньшую их вариативность в ходе восстановления.
б
Рис. 1. Динамика амплитуды М-ответа икроножной (а) и передней большеберцовой (б) мышц у животных основной и контрольной групп. Аппроксимация функцией A j = a tb; (где A - амплитуда М-ответа, t - срок эксперимента, а и b - параметрические коэффициенты
По данным гистоморфометрического исследования дистального отрезка регенерирующего нерва, через 4 месяца после операции объёмная плотность нейральных элементов в опыте на 13 % выше, чем контроле (p<0,05), различия численной плотности миелинизирующихся и безмиелиновых волокон недостоверны.
При имеющемся количестве наблюдений статистически незначима тенденция к уменьшению частоты фигур вторичной дегенерации крупных миелинизирующихся волокон на фоне терапии церебролизином: в контроле - от 1 до 5,4 %, в опыте - от 0 до 2,3 % от общей численности выборки. Ширина гистограммы распределения миелинизированных волокон по диаметру в опыте на 4 класса больше, чем в контроле.
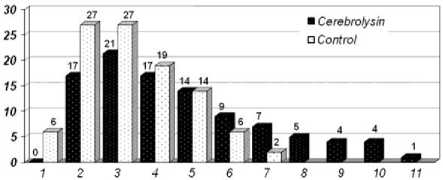
Рис. 2. Частотные гистограммы распределения по диаметру регенерирующих миелинизированных нервных волокон в опыте и контроле. Абсциссы -размерный класс, ординаты - процентная доля
Средний диаметр регенерирующих миелинизирующихся волокон в опыте на 33 % превышает показатель контроля, средний диаметр их аксонов - на 45 %, толщина мякотной оболочки - на 20 % (p<0,001).
Через 12 месяцев после операции гистограммы распределения миелинизированных регенерирующих волокон по диаметру, а также их средние численные и размерные параметры в опыте и контроле не различаются.
ОБСУЖДЕНИЕ
Проведённые исследования показали, что официнальный препарат церебролизин при его параневральном введении на проксимальном по отношению к зоне повреждения нерва уровне позволяет уменьшить тяжесть и длительность неврологической симптоматики при травматических повреждениях периферических нервов, в том числе профилактировать и превентивно лечить нейротрофические язы. Электрофизиологическое исследование позволяет подтвердить предположение о повышении эффективности реиннервации в опытной группе: по данным
ЭМГ отмечается тенденция более интенсивного прироста апмплитуды М-ответа икроножной мышцы и повышение вероятности более раннего появления М-ответов в передней большеберцовой мышце и меньшая их вариативность в ходе восстановления. Установлено положительное влияние церебролизина на восстановление и поддержание структурных параметров регенерирующих нервных волокон, врастающих в дистальный отрезок нерва. Это влияние продолжается по крайней мере в течение 2,5 месяцев после отмены препарата.
ВЫВОД
При данном способе и режиме введения це-ребролизин является промотором регенерации периферического нерва.


