Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки
Автор: Семнов Э.И., Матросова Л.Е., Танасева С.А., Валиев А.Р., Потехина Р.М., Тарасова Е.Ю., Спиридонов Г.Н., Губеева Е.Г., Мишина Н.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология, патология, терапия
Статья в выпуске: 2 т.57, 2022 года.
Бесплатный доступ
Микотоксикозы - это отравления животных и человека, вызванные поступлением в организм метаболитов токсигенных микроскопических грибов. Токсическое действие возрастает при одновременном воздействии нескольких микотоксинов, а также при их совместном поступлении с другими экотоксикантами и биологическими агентами. В настоящей работе впервые показано влияние инфекционной нагрузки Clostridium perfringes и комбинированного воздействия микотоксинов Т-2 токсина, зеараленона и дезоксиниваленола в малых дозах на свиней. Нашей целью было изучение хронической формы сочетанного микотоксикоза у поросят-отъемышей на фоне персистирующей в стаде инфекции с учетом продуктивности животных, морфо-биохимических, иммунологических показателей крови, патологоанатомической картины органов и тканей. Экспериментальный сочетанный микотоксикоз на фоне инфекционной нагрузки моделировали в условиях виварного комплекса Федерального центра токсикологической, радиационной и биологической безопасности (ФГБНУ ФЦТРБ-ВНИВИ) в 2018 году на поросятах ( Sus scrofa domesticus ) отъемного возраста крупной белой породы, разделенных на три группы по 3 свинки в каждой. Животные из I группы получали рацион, не содержащий микотоксины, свинки II группы получали корм, контаминированный Т-2 токсином (70 мкг/кг рациона), поросята III группы - корм, загрязненный тремя микотоксинами (ДОН - 1000 мкг/кг, ЗЕН - 50 мкг/кг и Т-2 - 70 мкг/кг рациона). Всем животным перорально вводили суспензию Clostridium perfringes № 392 тип С в объеме 2 мл (1×106 КОЕ/мл). На 15-е сут животных вакцинировали ассоциированной вакциной (1 мл) против рота-, коронавирусной и эшерихиозной диареи новорожденных поросят (ФЦТРБ-ВНИВИ) внутримышечно в заднюю поверхность бедра. Животных I группы считали клинически здоровыми, и с их показателями сравнивали результаты, полученные для остальных поросят. Оценивали признаки интоксикации свинок, биохимические параметры (общий белок, общий билирубин, уровень глюкозы, малонового диальдегида, активность щелочной фосфатазы, аспартатаминотрансферазы, аланинаминтрансферазы) в сыворотке крови, гематологические характеристики (число эритроцитов, лейкоцитов, содержание гемоглобина) и иммунологические показатели (Т-, В-лимфоциты, титр антител к вакцинным антигенам) на 10-е, 20-е и 30-е сут опыта. Титры антител к вакцинному штамму Escherichia coli определяли в реакции агглютинации, к короновирусному антигену вакцины - при помощи иммуноферментного анализа на фотометре Multiscan FC («Thermo Scientific», США), к ротавирусному антигену - в реакции непрямой гемагглютинации. В конце опыта брали образцы органов для гистологических исследований, фиксировали их в 10 % нейтральном формалине, далее осуществляли проводку общепринятыми в патоморфологии методами. Гистопрепараты окрашивали гематоксилином и эозином. Потребление поросятами корма, содержащего микотоксины, на фоне клостридиоза оказывало неблагоприятное влияние на клинический и иммунный статус, морфо-биохимические показатели крови, патологоанатомическую картину. Изменения были более выражены при совместном поступлении экотоксикантов. Среднесуточный прирост массы тела у поросят из II группы был ниже контроля на 20,5 % (р ≥ 0,05), из III группы - на 39,2 % (р ≤ 0,05). У животных из III группы к концу эксперимента регистрировали уменьшение количества эритроцитов на 40 % (р ≤ 0,001), гемоглобина - на 20 % (р ≤ 0,01), глюкозы - на 57 % (р ≤ 0,001), общего белка - на 13 % (р ≤ 0,05). Выявлено увеличение содержания билирубина в 5,1 раза (р ≤ 0,001), активности аланинаминотрансферазы и аспартатаминотрансферазы в 2,2 и 1,8 раза (р ≤ 0,001), концентрации малонового диальдегида в 2,8 раза (р ≤ 0,001), снижение активности щелочной фосфатазы на 41,5 % (р ≤ 0,001). При сочетанном микотоксикозе на фоне инфекционной нагрузки мы регистрировали изменение иммунологических показателей. Титры специфических антител к ротавирусу были ниже в 8 раз, к коронавирусу - в 6,4 раза (р ≤ 0,05), к эшерихиям - в 5 раз (р ≤ 0,05) относительно контроля. Отмечали и выраженные патологоанатомические изменения во внутренних органах. Таким образом, потребление поросятами корма, содержащего Т-2 токсин, дезоксиниваленол и зеараленон, в сочетании с персистенцией в организме возбудителя кишечной инфекции C. perfringens сопровождается угнетением иммунного статуса (снижение титра специфических защитных антител, количества Т- и В- лимфоцитов), активацией перекисного окисления липидов, развитием в тканях и органах патологических процессов.
Микотоксины, микотоксикозы, свиньи, морфобиохимические показатели крови, иммуносупрессия, гистологические исследования
Короткий адрес: https://sciup.org/142235678
IDR: 142235678 | УДК: 636.4:619:615.9:591.1 | DOI: 10.15389/agrobiology.2022.2.371rus
Текст научной статьи Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки
Серьезную проблему для животноводства представляют микотоксины — вторичные метаболиты микроскопических грибов (1, 2). Опасность для здоровья как человека, так и животных имеют трихотеценовые микотоксины (3), которые обладают цитотоксическими и цитостатическими свойствами (4), препятствуют синтезу белка (5) и повреждают паренхиматозные органы, нервную и иммунную системы (6).
Т-2 токсин — наиболее токсичный из вторичных метаболитов, продуцируемых микромицетами Fusarium (7). Всемирная организация здравоохранения (ВОЗ) еще в 1973 году включила Т-2 токсин в число неизбежных контаминантов, которые загрязняют корма и сельскохозяйственную продукцию (8). Зеараленон (ЗЕН) представляет собой микотоксин, способствующей развитию эстрогенного синдрома (9). Дезоксиниваленол (ДОН) может вызывать разнообразные симптомы, включая некроз кишечного тракта, печени и костного мозга с лейкопенией, рвотой и диареей (10, 11). Вопрос о безопасном и токсическом содержании ДОН по-прежнему остается нерешенным (12).
Чтобы лучше оценивать риски для здоровья животных и людей, важно изучать токсикологическое воздействие комбинаций микотоксинов. Подавляющее большинство исследований на эту тему проведены на клеточных культурах in vitro и сосредоточены на изучении токсического действия двух микотоксинов (13-15), ряд авторов отмечают возрастание токсического эффекта нескольких микотоксинов (16-19), а также в комплексе с другими экотоксикантами (20, 21).
В условиях производства нередки случаи присутствия в кормах таких микотоксинов, как Т-2 токсин, ДОН и ЗЕН (21-22). Считается, что свиньи чувствительны к микотоксинам (23). Исследования по комбинированному действию сразу трех микотоксинов на этих животных немногочисленны (24-26). Мало данных по изучению сочетанных микотоксикозов на фоне инфекционных заболеваний (27, 28). Микотоксины негативно влияют на иммунные показатели, повышают восприимчивость животных к патогенным агентам бактериальной и вирусной природы (29). Работ, посвященных комбинированному воздействию микотоксинов на фоне инфекционной нагрузки Clostridium perfringes в моделях на свиньях мы не встречали.
В настоящей работе впервые показано влияние инфекционной нагрузки Clostridium perfringes и комбинированного воздействия микотоксинов Т-2 токсина, зеараленона и дезоксиниваленола в малых дозах на свиней. Потребление поросятами корма, содержащего Т-2 токсин, дезоксиниваленол и зеараленон, на фоне персистенции в организме возбудителя кишечной инфекции C. perfringens сопровождается угнетением функции иммунной системы (снижение титра специфических защитных антител, количества Т- и В- лимфоцитов), активацией перекисного окисления липидов (ПОЛ), развитием в тканях и органах патологических процессов.
Нашей целью было изучение влияния хронической формы сочетанного микотоксикоза на фоне персистирующей в стаде инфекции у поросят-отъемышей на продуктивность животных, морфо-биохимические, иммунологические показатели крови, патологоанатомическую картину органов и тканей.
Методика. Экспериментальный сочетанный микотоксикоз на фоне инфекционной нагрузки моделировали в условиях виварного комплекса Федерального центра токсикологической, радиационной и биологической безопасности (ФГБНУ ФЦТРБ-ВНИВИ) в 2018 году на поросятах (Sus scrofa domesticus) отъемного возраста (35 сут) крупной белой породы, разделенных на три группы по 3 свинки в каждой. Кормление и содержание осуществлялось групповым способом. Использовали полнорационные комбикорма для кормления поросят (ГОСТ 34109-2017. М., 2017).
Животные из I группы получала рацион, не содержащий микотоксины, из II группы — корм, контаминированный Т-2 токсином (70 мкг/кг рациона), из III группы — корм, загрязненный тремя микотоксинами (ДОН — 1000 мкг/кг, ЗЕН — 50 мкг/кг и Т-2 — 70 мкг/кг рациона). Доступ к воде не ограничивали. Микотоксины (чистота 96,7-99,8 %, получены в ФЦТРБ-ВНИВИ) вводили в комбикорм с помощью последовательного и ступенчатого перемешивания. Опыт длился 30 сут. В качестве инфекционного агента использовали патогенный изолят Clostridium perfringes № 392 тип С (коллекция штаммов ФЦТРБ-ВНИВИ). Всем животным перорально вводили суспензию Clostridium perfringes (1*106 КОЕ/мл) в объеме 2 мл. Взятое нами количество микробных клеток C. perfringens № 392 тип С ранее отработано как доза, не вызывающая клинического проявления клостридиоза, но обеспечивающая его носительство. На 15-е сут опыта животных вакцинировали ассоциированной вакциной против рота-, коронавирусной и эшерихиозной диареи новорожденных поросят (ФЦТРБ-ВНИВИ) внутримышечно в заднюю поверхность бедра в объеме 1 мл.
При формировании групп животных учитывали принципы гуманности и достаточности, при этом старались приблизить эксперимент к производственным условиям. Животные I группы были приняты как клинически здоровые, и параметры остальных поросят сравнивали с их показателями.
Оценивали признаки интоксикации свинок, биохимические параметры (общий белок, общий билирубин, концентрация глюкозы, малонового диальдегида — МДА, активность щелочной фосфатазы — ЩФ, аспартатаминотрансферазы — АсАТ, аланинаминтрансферазы — АлАТ) в сыворотке крови, гематологические показатели (число эритроцитов, лейкоцитов, содержание гемоглобина) и иммунологические показатели (число Т-, В-лимфоцитов в крови, титр антител в сыворотке крови к вакцинным антигенам). Кровь для исследований брали из хвостовой вены на 10-е, 20-е и 30-е сут опыта.
Гематологические исследования осуществляли на анализаторе Mythic 18 Vet («Orphee Geneva», Швейцария). Биохимические показатели определяли на анализаторе АРД-200 (ООО «ВИТАКО», Россия) с использованием специальных наборов реагентов («Chronolab Systems S.L.», Испания). Содержание Т- и В-лимфоцитов определяли методом спонтанного розеткооб-разования с эритроцитами козла (30). По накоплению МДА в реакции с 2-тиобарбитуровой кислотой судили о степени интенсивности перекисного окисления липидов (31).
Титры антител к вакцинному штамму Escherichia coli определяли в реакции агглютинации (РА). Последнее разведение, в котором наблюдалась четкая агглютинация, принимали за титр. Результат реакции оценивали по наличию и количеству осадка и степени прозрачности надосадочной жидкости через 18-20 ч. Титры антител к короновирусному антигену вакцины определяли при помощи иммуноферментного анализа (ИФА) на фотометре Multiscan FC («Thermo Scientific», США) по показаниям оптической плотности (ОП) (X = 490 нм). За положительный результат (титр) принимали отношение ОП в лунке с изучаемой сывороткой к ОП в лунке с негативной сывороткой > 2,0. Титры антител к ротавирусному антигену вакцины определяли в реакции непрямой гемагглютинации (РИГА). Положительным считался результат РИГА, когда эритроциты равномерно покрывали дно лунки пластины в виде зонтика на 2-4 креста. При отрицательной реакции скопление эритроцитов имело вид маленького диска («пуговки»).
В конце опыта животных всех групп убивали с учетом этических норм. Отобранные для гистологических исследований образцы органов фиксировали в 10 % нейтральном формалине, далее осуществляли проводку общепринятыми в патоморфологии методами. Гистопрепараты окрашивали гематоксилином и эозином. Микрофотосъемку гистологических препаратов осуществляли в проходящем свете (микроскоп Leica DM 1000, камера Leica DFC 320, «Leica Microsystems», Германия) при увеличении *200 (*10 объектив, *20 окуляр) и *600 (*15 объектив, *40 окуляр).
При статистической обработке результатов рассчитывали значения средних ( М) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по t -критерию Стьюдента. Статистически значимыми считали различия при р < 0,05; р < 0,01 и р < 0,001.
Результаты. Первые признаки интоксикации начали появляться на 6-8-е сут эксперимента у животных, получавших Т-2 токсин, ДОН и ЗЕН. На протяжении нескольких суток наблюдался частичный отказ от корма. В дальнейшем животные потребляли корм в меньших количествах. Развитие синдрома отказа от корма, вероятно, связано с тем, что трихотецены нарушают синтез протеинов печени и вызывают гипераминоацидемию, увеличивают количество триптофана и серотонина в головном мозге, и это влияет на восприятие насыщения. Также у поросят из III группы периодически отмечали диарею и рвоту (характерный синдром отравления ДОН у свиней). Полученные данные согласуются с работами других авторов (2, 32).
Клинические проявления усилились во второй части опыта: мы регистрировали повышение температуры тела, поросята держались группой, были угнетены, поджимали живот, отмечались признаки желудочно-кишечного расстройства. На 23-и сут в III группе пал один поросенок. Из его внутренних органов был выделен изолят C. perfringes № 392 тип С.
К концу эксперимента у свинок из III группы наблюдались незначительные кровотечения из влагалища. Причина кровотечений была связана с содержанием в корме эстрогенного микотоксина зеараленона, что весьма неожиданно, учитывая низкие концентрации ЗЕН. Зеараленон представляет собой микотоксин, способствующей развитию эстрогенного синдрома, который проявляется бесплодием, абортами, рассасыванием плодов (9). Воздействие ЗЕН на супоросных свиноматок снижает количество фолликулов у поросят, что приводит к преждевременному истощению ооцитов во взрослом возрасте (33). Вероятно, наличие трихотеценовых микотоксинов в корме создает предпосылки для большей чувствительности свинок к действию зеараленона. Зарубежные исследователи также выяснили, что эффекты одновременного воздействия микотоксинов плохо распознаются и трудно предсказуемы (34). Животные, получавшие только Т-2 токсин, были более активными, хорошо поедали корм.
Среднесуточный прирост живой массы у поросят из II группы был ниже контроля на 20,5 % (р < 0,05), из III группы — на 39,2 % (р < 0,05). Ухудшение конверсии корма зарегистрировали в III группе (в 1,4 раза выше, чем в группе биологического контроля, р < 0,05) (табл. 1).
Длительное потребление токсичного корма оказывало неблагоприятное влияние на морфологические, биохимические и иммунологические показатели крови (табл. 2). Гематологические параметры и биохимические показатели сыворотки крови у поросят из I группы, получивших перорально взвесь микробных клеток C. perfringes № 392 тип С и не получавших микотоксины, в основном были в пределах физиологических границ у здоровых животных. Так, число эритроцитов составило 5,45±0,15х1012/л (физиологические границы 5,1-6,8х1012/л), лейкоцитов — 16,47±0,51х109/л (норма 11-22х109/л), содержание общего белка — 63,2±0,87 г/л (норма 58-83 г/л). Аналогичные закономерности мы наблюдали и по другим параметрам, в том числе более лабильным, таким как активность сывороточных ферментов АлАТ (норма 22-47 ед/л), АСТ (норма 15-55 ед/л) (см. табл. 2). Полученные данные свидетельствуют, что животные I группы были клинически здоровыми.
-
1. Живая масса, конверсия корма и выживаемость поросят-отъемышей ( Sus scrofa domesticus ) крупной белой породы при экспериментальном сочетанном микотоксикозе на фоне инфекционной нагрузки ( М ±SEM, Федеральный центр токсикологической, радиационной и биологической безопасности, 2018 год)
Показатель
Группа
I ( n = 3)
1 II ( n = 3)
| III ( n = 3)
Масса в начале эксперимента, кг
14,9±0,2
15,2±0,2
14,6±0,2
Масса в конце эксперимента, кг
22,2±0,3
21,0±0,4
19,1±0,6*
Среднесуточный прирост живой массы тела, г
244,0
194,0
148,3
Конверсия корма
3,55
4,06
5,07
Выживаемость поросят, %
100
100
66,6
Примечание. Описание групп см. в разделе «Методика». * Различия с контролем статистически значимы при р < 0,05.
-
2. Морфологические, биохимические и иммунологические показатели крови у поросят-отъемышей ( Sus scrofa domesticus ) крупной белой породы при экспериментальном сочетанном микотоксикозе на фоне инфекционной нагрузки в зависимости от времени с начала эксперимента ( М ±SEM, Федеральный центр токсикологической, радиационной и биологической безопасности, 2018 год)
Показатель
Группа
I ( n = 3)
II ( n = 3)
III ( n = 3)
10-е сут
Эритроциты, х1012/л
5,4±0,1
5,3±0,1
6,1±0,1
Лейкоциты, х 109/л
16,4±0,5
17,5±0,4
19,3±0,5*
Гемоглобин, г/л
93,0±1,5
92,0±1,9
95,0±1,3
Общий белок, г/л
63,2±0,8
62,2±0,9
62,6±0,8
Билирубин общий, мкмоль/л
1,5±0,2
4,4±0,5***
4,2±0,1***
Глюкоза, ммоль/л
3,5±0,1
3,5±0,1
2,9±0,1*
АлАТ, ед/л
33,2±1,6
28,8±1,7
46,3±1,9***
АсАТ, ед/л
36,9±2,4
35,2±2,6
60,2±2,2***
ЩФ, ед/л
137,9±14,9
76,8±15,9
312,2±18,7***
МДА, мкмоль/л
1,9±0,2
3,3±0,1***
5,2±0,1***
Т-лимфоциты, %
53,2±2,4
51,6±2,2
53,7±2,8
В-лимфоциты, %
26,5±1,4
26,0±1,8
28,6±1,5
20-е сут
Эритроциты, х1012/л
5,6±0,1
5,2±0,1
5,8±0,1
Лейкоциты, х 109/л
15,9±0,5
19,4±0,5**
26,9±0,2***
Гемоглобин, г/л
95,0±1,7
90,0±1,3
91,0±1,3
Общий белок, г/л
63,3±0,7
60,6±0,7
58,1±0,8
Билирубин общий, мкмоль/л
3,2±0,2
6,3±0,3***
4,9±0,2***
Глюкоза, ммоль/л
4,2±0,1
3,4±0,1*
2,5±0,1***
АлАТ, ед/л
29,2±1,9
39,4±1,3***
80,6±1,5***
АсАТ, ед/л
35,2±2,3
43,4±1,9**
75,2±2,2***
Щелочная фосфатаза, ед/л
143,4±13,9
144,4±13,7
267,7±17,2***
МДА, мкмоль/л
2,8±0,1
5,6±0,1***
6,9±0,1***
Т-лимфоциты, %
51,4±2,8
55,0±2,8
48,3±2,1
В-лимфоциты, %
25,3±0,9
28,6±0,4
26,1±0,4
30-е сут
Эритроциты, х1012/л
6,4±0,1
5,0±0,1**
4,0±0,2***
Лейкоциты, х 109/л
17,9±0,4
17,4±0,5
19,1±0,5
Гемоглобин, г/л
99,0±1,8
85,0±1,6*
79,0±2,1**
Общий белок, г/л
63,9±0,9
57,3±0,9
55,5±0,9*
Билирубин общий, мкмоль/л
2,5±0,1
7,3±0,1***
12,7±0,5***
Глюкоза, ммоль/л
4,4±0,1
4,3±0,1
1,9±0,1***
|
Продолжение таблицы 2 |
|||
|
АлАТ, ед/л |
51,9±1,8 |
38,4±1,9*** |
114,8±1,9*** |
|
АсАТ, ед/л |
55,3±2,5 |
48,8±2,6 |
99,5±2,5*** |
|
ЩФ, ед/л |
175,3±15,1 |
143,0±14,8* |
102,6±14,0*** |
|
МДА, мкмоль/л |
3,0±0,1 |
7,3±0,2*** |
8,7±0,2*** |
|
Т-лимфоциты, % |
46,7±3,0 |
52,0±1,8 |
32,1±3,0*** |
|
В-лимфоциты, % |
28,5±1,3 |
27,2±0,4 |
23,2±1,8* |
Примечание. АлАТ — аланинаминтрансфераза, АсАТ — аспартатаминотрансфераза, ЩФ — щелочная фосфатаза, МДА — малоновый диальдегид. Описание групп см. в разделе «Методика».
*, **, *** Различия с контролем статистически значимы при р < 0,05; р < 0,01 и р < 0,001.
В сравнении контролем отмечали более выраженные отклонения у животных из III группы. Так, у них регистрировали повышение содержания лейкоцитов к 10-м сут опыта на 17,7 % (р < 0,05) и к 20-м сут — на 69,2 % (р < 0,001). Число лейкоцитов у поросят из II группы к 20-м сут было выше на 21,8 % (р < 0,01), чем в контрольной группе. Статистически значимые изменения в содержании эритроцитов и гемоглобина у животных из опытных групп отмечали на 30-е сут. У поросят из III группы на 30-е сут эксперимента содержание эритроцитов и гемоглобина по сравнению с биологическим контролем было ниже соответственно на 36,9 и 20,2 % (р < 0,01).
Прогрессирующие эритроцито- и лейкопения и анемия указывали на изменения деструктивного характера в иммунокомпетентных и кроветворных органах, которые, как известно, служат для Т-2 токсина органами-мишенями (35), что также имело место при хроническом токсикозе, вызванном зеараленоном и дезоксиниваленолом (36).
Выраженное снижение содержания белка и глюкозы в группах животных, получавших микотоксины, регистрировали на 30-е сут опыта. Общий белок был снижен на 13,1 % (р < 0,05), уровень глюкозы — на 55,8 % (р < 0,001) у поросят в III группе. У животных из II и III групп к концу опыта содержание билирубина было выше, чем в контроле, соответственно в 2,9 и 5,1 раза (р < 0,001). На 20-е сут эксперимента активность ЩФ, АлАТ и АсАТ в сыворотке крови у животных из III группы оказалась выше, чем в контроле, в 1,9, 2,8 и 1,7 раза (р < 0,001). На 30-е сут активность ЩФ была меньше, чем в I группе, на 41,5 % (р < 0,001), активность АлАТ и АсАТ — выше в 2,2 и 1,8 раза (р < 0,001). Полученные данные свидетельствуют о разрушительном действии комбинации микотоксинов на гепатоциты.
В патогенезе микотоксикозов важная роль отводится активации перекисного окисления липидов (37). В нашем эксперименте на 30-е сут отмечали повышение содержания МДА (количественный маркер для оценки степени перекисного окисления липидов) во II и III группах животных соответственно в 2,4 и 2,8 раза (р < 0,001) по сравнению с контролем. Интересны данные об изменении иммунологических показателей на фоне инфекционной нагрузки. На 30-е сут опыта количество Т-лимфоцитов у животных в III группе было ниже, чем в контроле, на 31,3 % (р < 0,001).
Об иммуносупрессивном действии микотоксинов известно давно (3840). Снижение устойчивости организма к инфекционным заболеваниям при микотоксикозах обусловлено иммуносупрессией и непосредственным повреждающим действием микотоксинов на желудочно-кишечный тракт (41).
В кишечнике микотоксины метаболизируются, и их токсичность снижается до тех пор, пока не накопится концентрация, способная влиять на слизистую оболочку кишечника (42). Микотоксины повреждают ткани слизистой оболочки, повышают проницаемость эпителиального барьера кишечника, вызывают синдром плохого всасывания (или мальабсорбции).
Дон и Т-2 токсин могут непосредственно повреждать ткани слизистой оболочки. Эпителиальные клетки кишечника считаются одними из основных мишеней их действия (43). Ранее также сообщалось о способности дезок-синиваленола снижать поглощение питательных веществ (44). В одних исследованиях указывается, что механизмы действия ЗЕН на функции кишечника неизвестны (12), в других отмечается усиление апоптоза и ослабление пролиферации лимфоцитов пейровых бляшек (45).
При нарушении эпителиального барьера кишечника происходит транслокация патогенов под действием микотоксинов, как, например, при сальмонеллезе (46), патологиях, вызванных C. perfringens (47) и Helicobacter sp. (48). При токсикозе, вызванном ДОН, происходит утечка аминокислот плазмы в просвет кишечника, обеспечивающая необходимый субстрат для роста C. perfringens (49), который служит фактором риска развития кишечных заболеваний, что увеличивает затраты на вакцинацию (50).
Определение титров специфических антител у подопытных животных подтвердило иммуносупрессивное действие комбинации микотоксинов в изученных дозах при наличии в стаде патогенного бактериального возбудителя (табл. 3).
3. Титры специфических антител в сыворотке крови у вакцинированных поросят-отъемышей ( Sus scrofa domesticus ) крупной белой породы при экспериментальном сочетанном микотоксикозе на фоне инфекционной нагрузки ( М ±SEM, Федеральный центр токсикологической, радиационной и биологической безопасности, 2018 год)
|
Группа |
Титр (разведение) антител |
||
|
к ротавирусу |
к коронавирусу |
к кишечной палочке |
|
|
I ( n = 3) |
8533,0±2090,0 |
170,6±52,0 |
213,3±65,0 |
|
II ( n = 3) |
7680,0±3135,0 |
128,0±0,0 |
160,0±0,0 |
|
III ( n = 3) |
1066,6±261,0* |
26,7±6,5* |
46,6±21,6* |
|
Примечание. Описание групп см. в разделе «Методика». * Различия с контролем статистически значимы при р < 0,05. |
|||
Тяжелые кишечные инфекции (клостридиозы, рота-, коронавирусные инфекции, эшерихиоз) могут быть спровоцированы воздействием микотоксинов. Микотоксины, поступающие в организм с кормом, препятствуют образованию специфических антител в необходимом количестве, что снижает напряженность поствакцинального иммунитета. В наших опытах это было особенно характерно для животных из III группы, которые потребляли рацион, искусственно загрязненный Т-2 токсином, ЗЕН и ДОН. Также у этих поросят титры специфических антител по сравнению с I группой (биологический контроль) были ниже: к ротавирусу — в 8 раз (р < 0,05), к коронавирусу — в 6,4 раза (р < 0,05), к эшерихиям — в 5 раз (р < 0,05). Титры антител в I группе были характерны для здоровых животных. Во II группе отмечалась тенденция к снижению титров, но показатели оставались в пределах, свойственных здоровым животным.
Наши результаты свидетельствуют о том, что микотоксины, в частности Т-2 токсин, ЗЕН и ДОН, при сочетанном поступлении могут блокировать функции иммунной системы животных, препятствуя синтезу специфических антител после вакцинации. Это повышает риск снижения защитного эффекта вакцинации, что необходимо учитывать при организации противоэпизоотических мероприятий.
А
Б
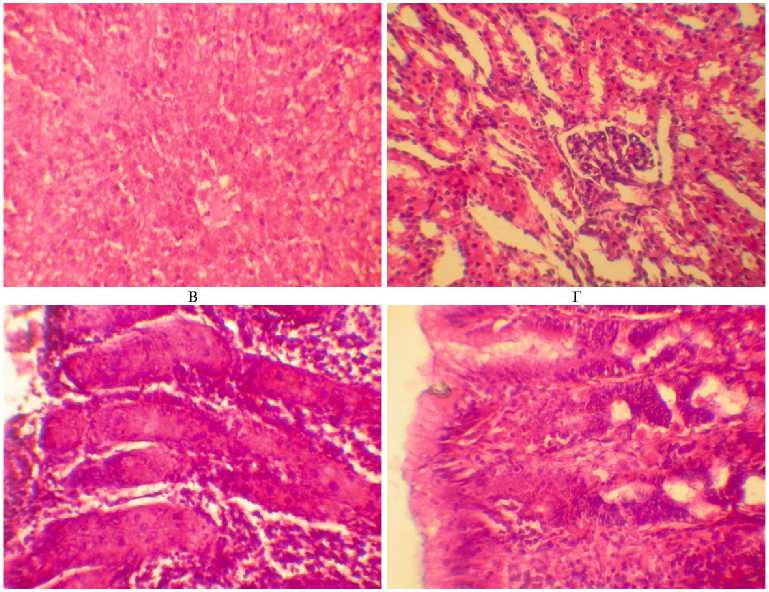
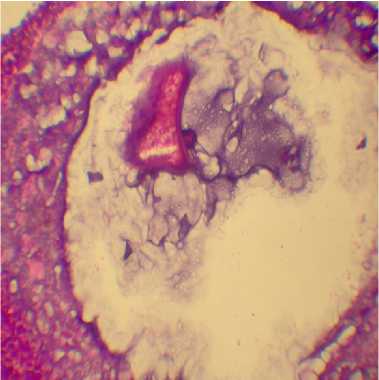
У животных, подвергнутых воздействию тремя микотоксинами, отмечали белковую дистрофию в почках, эпителий канальцев был с участками некроза. В печени наблюдали белковую дистрофию и очаги некроза, а также реакцию Купферовских клеток в виде расширения пространства Диссе, их увеличения и деформации. Происходило обеднение белой пульпы селезенки. В легких развивался серозный отек межальвеолярных перегородок. Интересным представляется выявление колликвационного некроза фолликула яичника с клеточной реакцией (см. рис.).
Поступление с кормами низких количеств микотоксинов — серьезная проблема для животноводства. В наших исследованиях мы испытывали предельно допустимые концентрации микотоксинов. В стандартной схеме оценки кормов их наличие на уровне ПДК не говорит о том, что корм потенциально опасен для свиней. Для нас представляло интерес методически правильно воспроизвести эту комбинацию с использованием доброкачественного основного рациона и внесением токсинов на фоне персистирующей в стаде инфекции при максимальном исключении влияния других значимых токсинов и ксенобиотиков.
На основании информации об индивидуальной токсичности ксенобиотиков не всегда можно предсказать влияние их комбинаций, а также других воздействующих факторов (52). Связь между воздействием микотоксинов и инфекционными заболеваниями требуют дальнейшего изучения, что отмечалось и ранее (53).
Таким образом, сочетанный микотоксикоз свиней на фоне кишечной инфекции сопровождался угнетением иммунологических параметров. Титры специфических антител к ротавирусу снижались в 8 раз (р < 0,05), к коронавирусу — в 6,4 раза (р < 0,05), к эшерихиям — в 5 раз (р < 0,05) относительно контроля. Отмечалось уменьшение числа Т-лимфоцитов на 31,3 % (р < 0,001), В-лимфоцитов — на 18,6 % (р < 0,05). За счет активации перекисного окисления липидов у животных, которые потребляли корм, контаминированный Т-2 токсином и тремя микотоксинами (Т-2 токсином, дезоксиниваленолом и зеараленоном), концентрация малонового диальдегида увеличивалась в 2,4-2,8 раза (р < 0,001) по сравнению с контролем. В печени и почках поросят выявили белковую дистрофию и очаги некроза. Результаты наших исследований свидетельствуют об отрицательном воздействии Т-2 токсина, ДОН и ЗЕН при их сочетанном поступлении в регламентированных законодательством концентрациях на клиническое состояние, морфо-биохимические, иммунологические показатели поросят. Полученные данные могут использоваться для диагностики заболеваний животных и учитываться при проведении противоэпизоотических мероприятий.
Список литературы Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки
- Иванов А.В., Фисинин В.И., Тремасов М.Я., Папуниди К.Х. Микотоксикозы (биологические и ветеринарные аспекты). М., 2010.
- Bryden W.L. Mycotoxin contamination of the feed supply chain: implications for animal productivity and feed security. Animal Feed Science and Technology, 2012, 173(1-2): 134-158 (doi: 10.1016/j.anifeedsci.2011.12.014).
- Ferrigo D., Raiola A., Causin R. Fusarium toxins in cereals: occurrence, legislation, factors promoting the appearance and their management. Molecules, 2016, 21(5): 627 (doi: 10.3390/molecules21050627).
- Schiefer H.B., Beasley V.R. Effects on the digestive system and energy metabolism. In: Trichothecene mycotoxicosis: pathophysiologic effects /V.R. Beasley (eds.). CRC Press, 2017 (doi: 10.1201/9781315121260).
- Rosenstein Y., Lafarge-Fraysinnet C. Inhibitory effect of Fusarium T-2 toxin on lymphoid DNA and protein synthesis. Toxicology and Applied Pharmacology, 1983, 70(2): 283-290 (doi: 10.1016/0041-008X(83)90104-7).
- Taylor M.J., Pang V.F., Beasley V.R. The Immunotoxicity of trichothecene mycotoxins. In: Trichothecene mycotoxicosis: pathophysiologic effects /Val Richard Beasley (eds.). CRC Press, 2017 (doi: 10.1201/9781315121260).
- Sun Y., Li S., Chen R, Wu P., Liang J. Ultrasensitive and rapid detection of T-2 toxin using a target-responsive DNA hydrogel. Sensors and Actuators, B: Chemical,2020, 311: 127912 (doi: 10.1016/j.snb.2020.127912).
- Lin R., Sun Y., Ye W., Zheng T., Wen J., Deng Y. T-2 toxin inhibits the production of mucin via activating the IRE1/XBP1 pathway. Toxicology, 2019, 424: 152230 (doi: 10.1016/j.tox.2019.06.001).
- Minervini F., Dell’Aquila M.E. Zearalenone and reproductive function in farm animals. International Journal of Molecular Sciences, 2008, 9(12): 2570-2584 (doi: 10.3390/ijms9122570).
- Akbari P., Braber S., Gremmels H., Koelink P.J., Verheijden K.A.T., Garssen J., Fink-Gremmels J. Deoxynivalenol: a trigger for intestinal integrity breakdown. FASEB Journal, 2014, 28(6): 2414-2429 (doi: 10.1096/fj.13-238717).
- Escrivá L., Font G., Manyes L. In vivo toxicity studies of fusarium mycotoxins in the last decade: a review. Food and Chemical Toxicology, 2015, 78: 185-206 (doi: 10.1016/j.fct.2015.02.005).
- Przybylska-Gornowicz B., Tarasiuk M., Lewczuk B., Prusik M., Ziółkowska N., Zielonka Ł., Gajęcki M., Gajęcka M. The effects of low doses of two Fusarium toxins, zearalenone and deoxynivalenol, on the pig jejunum. A light and electron microscopic study. Toxins, 2015, 7(11): 4684-4705 (doi: 10.3390/toxins7114684).
- Smith M.-C., Madec S., Coton E., Hymery N. Natural co-occurrence of mycotoxins in foods and feeds and their in vitro combined toxicological effects. Toxins, 2016, 8(4): 94 (doi: 10.3390/toxins8040094).
- Труфанов О.В., Котик А.Н., Труфанова В.А. Влияние зеараленона, Т-2 токсина и их комбинации на организм несушек. ЖивотноводствоРоссии, 2017, 7: 5-7.
- Yang Y., Yu S., Tan Y., Liu N., Wu A. Individual and combined cytotoxic effects of co-occurring deoxynivalenol family mycotoxins on human gastric epithelial cells. Toxins, 2017, 9(3): 96 (doi: 10.3390/toxins9030096).
- Тремасов М.Я., Сметов П.К. Спонтанные смешанные микотоксикозы животных. Ветеринария, 1995, 3: 20-22.
- Крюков В.C. Полимикотоксикоз: оценка действия. Комбикорма, 2013, 10: 59-63.
- Семененко М.П., Тяпкина Е.В., Кузьминова Е.В., Кощаев А.Г. Особенности проявления хронического кормового микотоксикоза у лабораторных крыс в условиях эксперимента. Сельскохозяйственная биология, 2019, 4: 777-786 (doi: 10.15389/agrobiology.2019.4.777rus).
- Мишина Н.Н., Семенов Э.И., Папуниди К.Х., Потехина Р.М., Танасева С.А., Ермолаева О.К., Сагдеева З.Х., Гатауллин Д.Х. Влияние комплекса цеолита и шунгита на резистентность и продуктивность цыплят-бройлеров при смешанном микотоксикозе. Ветеринарный врач, 2018, 6: 3-9.
- Папуниди К.Х., Конюхов Г.В., Низамов Р.Н., Семенов Э.И., Кадиков И.Р. Комбинированные поражения животных и разработка средств профилактики и лечения. Казань, 2019.
- Бурдов Л.Г., Матросова Л.Е. О результатах анализа кормов на содержание микотоксинов. Ветеринарный врач, 2011, 2: 7-9.
- Гагкаева Т.Ю., Гаврилова О.П., Левитин М.М., Новожилова К.В. Фузариоз зерновых культур. Защита и карантин растений, 2011, 5: 2-3.
- Meurens F., Summerfield A., Nauwynck H., Saif L., Gerdts V. The pig: A model for human infectious diseases. Trends in Microbiology, 2012, 20(1): 50-57 (doi: 10.1016/j.tim.2011.11.002).
- Obremski K., Zielonka Ł., Gajęcka M., Jakimiuk E., Bakuła T., Baranowski M., Gajęcki M. Histological estimation of the small intestine wall after administration of feed containing deoxynivalenol, T-2 toxin and zearalenone in the pig. Polish Journal of Veterinary Sciences, 2008, 11(4): 339-345.
- Zielonka Ł., Jakimiuk E., Obremski K., Gajęcka M., Dąbrowski M., Gajęcki M. Evaluation of the proliferative activity of immunocompetent cells in the jejunal and iliac lymph nodes of prepubertal female wild boars diagnosed with mixed mycotoxicosis. Bulletin of the Veterinary Institute in Pulawy, 2015, 59(2): 197-203 (doi: 10.1515/bvip-2015-0030).
- Мирошниченко П.В. Экспериментальное воспроизведение сочетанного микотоксикоза свиней. Ветеринарныйврач, 2007, 2: 16-17.
- Antonissen G., Martel A., Pasmans F., Ducatelle R., Verbrugghe E., Vandenbroucke V., Li S., Haesebrouck F., Van Immerseel F., Croubels S. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins, 2014, 6(2): 430-452 (doi: 10.3390/toxins6020430).
- Park S.-H., Kim D., Kim J., Moon Y. Effects of mycotoxins on mucosal microbial infection and related pathogenesis. Toxins, 2015, 7(11): 4484-4502 (doi: 10.3390/toxins7114484).
- Папуниди К.Х., Тремасов М.Я., Фисинин В.И., Никитин А.И., Семенов Э.И. Микотоксины (в пищевой цепи). Казань, 2017.
- Фримель Г. Иммунологические методы. М., 1987.
- Методы ветеринарной клинической лабораторной диагностики. Справочник /Под ред. И.П. Кондрахина. М., 2004.
- Bonnet M.S., Roux J., Mounien L., Dallaporta M., Troadec J.D. Advances in deoxynivalenol toxicity mechanisms: the brain as a target. Toxins, 2012, 4(11): 1120-1138 (doi: 10.3390/toxins4111120).
- Schoevers E.J., Santos R.R., Colenbrander B., Fink-Gremmels J., Roelen B.A.J. Transgenerational toxicity of Zearalenone in pigs. Reproductive Toxicology, 2012, 34(1): 110-119 (doi: 10.1016/j.reprotox.2012.03.004).
- Döll S., Dänicke S. The Fusarium toxins deoxynivalenol (DON) and zearalenone (ZON) in animal feeding. Preventive Veterinary Medicine, 2011, 102(2): 132-145 (doi: 10.1016/j.prevetmed.2011.04.008).
- McDonald E., Cavan K.R., Smith T.K. Effect of acute oral doses of T-2 toxin on tissue concentrations of biogenic amines in the rat. Journal of Animal Science, 1998, 66(2): 434-441 (doi: 10.2527/jas1988.662434x).
- Dąbrowski M., Obremski K., Gajęcka M., Gajęcki M.T., Zielonka Ł. Changes in the subpopulations of porcine peripheral blood lymphocytes induced by exposure to low doses of zearalenone (ZEN) and deoxynivalenol (DON). Molecules, 2016, 21(5): 557 (doi: 10.3390/molecules21050557).
- Dinu D., Bodea G.O., Ceapa C.D., Munteanu M.C., Roming F.I., Serban A.I., Hermenean A., Costache M., Zarnescu O., Dinischiotu A. Adapted response of the antioxidant defense system to oxidative stress induced by deoxynivalenol in Hek-293 cells. Toxicon, 2011, 57(7-8): 1023-1032 (doi: 10.1016/j.toxicon.2011.04.006).
- Тарасова Е.Ю., Тремасов М.Я. Клинические, гематологические и биохимические показатели овец при воздействии Т-2 токсина на фоне применения лекарственных средств. Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана, 2013, 213: 278-282.
- Валиев А.Р., Семенов Э.И., Ахметов Ф.Г. Иммуносупрессия в патогенезе Т-2 микотоксикоза и ее фармакокоррекция. Ветеринарный врач, 2011, 2: 4-6.
- Kuchenbuch H.S., Cramer B., Humpf H.U. Matrix binding of T-2 toxin: structure elucidation of reaction products and indications on the fate of a relevant food-borne toxin during heating. Mycotoxin Research, 2019, 35(3): 261-270 (doi: 10.1007/s12550-019-00350-2).
- Pinton P., Guzylack-Piriou L., Kolf-Clauw M., Oswald I.P. The effect on the intestine of some fungal toxins: the trichothecenes. Current Immunology Reviews, 2012, 8(3): 193-208 (doi: 10.2174/157339512800671967).
- Waśkiewicz A., Beszterda M., Kostecki M., Zielonka Ł., Goliński P., Gajęcki M. Deoxynivalenol in gastrointestinal tract of immature gilts under per os toxin application. Toxins, 2014, 6(3): 973-987 (doi: 10.3390/toxins6030973).
- Diesing A.K., Nossol C., Panther P., Walk N., Post A., Kluess J., Kreutzmann P., Dänicke S., Rothkὅtter H.J., Kahlert S. Mycotoxin deoxynivalenol (DON) mediates biphasic cellular response in intestinal porcine epithelial cell lines IPEC-1 and IPEC-J2. Toxicology Letters, 2011, 200(1-2): 8-18 (doi: 10.1016/j.toxlet.2010.10.006).
- Awad W.A., Ghareeb K., Zentek J. Mechanisms underlying the inhibitory effect of the feed contaminant deoxynivalenol on glucose absorption in broiler chickens. Veterinary Journal, 2014, 202(1): 188-190 (doi: 10.1016/j.tvjl.2014.06.012).
- Obremski K., Gajęcka M., Zielonka Ł., Jakimiuk E., Gajęcki M. Morphology and ultrastructure of small intestine mucosa in gilts with zearalenone mycotoxicosis. Polish Journal of Veterinary Sciences, 2005, 8(4): 301-307.
- Verbrugghe E., Vandenbroucke V., Dhaenens M., Shearer N., Goossens J., De Saeger S., Eeckhout M., D’Herde K., Thompson A., Deforce D., Boyen F., Leuman B. T-2 toxin induced Salmonella Typhimurium intoxication results in decreased Salmonella numbers in the cecum contents of pigs, despite marked effects on Salmonella-host cell interactions. Veterinary Research, 2012, 43: 22 (doi: 10.1186/1297-9716-43-22).
- Antonissen G., Van Immerseel F., Pasmans F., Ducatelle R., Haesebrouck F., Timbermont L., Verlinden M., Janssens G.P.J., Eeckhaut V., Eeckhout M., De Saeger S., Hessenberger S., Martel A., Croubels S. The mycotoxin deoxynivalenol predisposes for the development of Clostridium perfringens-induced necrotic enteritis in broiler chickens. PLoS ONE, 2014, 9(9): e108775 (doi: 10.1371/journal.pone.0108775).
- Нургалиев Ф.М., Семенов Э.И., Поздеев О.К., Софронов П.В. Частота развития язвенных процессов в слизистой оболочке желудка свиней, обусловленных воздействием микотоксинов и колонизацией бактериями рода Helicobacter. Ветеринарный врач, 2020, 2: 31-38.
- Grenier B., Applegate T.J. Modulation of intestinal functions following mycotoxin ingestion: Meta-analysis of published experiments in animals. Toxins, 2013, 5(2): 396-430 (doi: 10.3390/toxins5020396).
- Timbermont L., Haesebrouck F., Ducatelle R., Van Immerseel F. Necrotic enteritis in broilers: an updated review on the pathogenesis. Avian Pathology, 2011, 40(4): 341–347 (doi: 10.1080/03079457.2011.590967).
- Gereza J.R., Pintonb P., Callud P., Grosjeand F., Oswaldb I.P., Bracarensea A.P.F.L. Deoxynivalenol alone or in combination with nivalenol and zearalenone induce systemic histological changes in pigs. Experimental and Toxicologic Pathology, 2015, 67(2): 89-98 (doi: 10.1016/j.etp.2014.10.001).
- Grenier B., Oswald I.P. Mycotoxin co-contamination of food and feed. Meta-analysis of publications describing toxicological interactions. World Mycotoxin Journal, 2011, 4(3): 285-313 (doi: 10.3920/WMJ2011.1281).
- Шахов А.Г., Востроилова Г.А., Шабунин С.В., Сашнина Л.Ю., Канторович Ю.А., Чусова Г.Г. Оптимизация биохимического статуса белых крыс аминоселетоном при вакцинации против сальмонеллеза на фоне хронической интоксикации Т-2 токсином. Проблемы ветеринарной санитарии, гигиены и экологии, 2017, 3(23): 91-97.


