Экспрессия биомаркеров почечного повреждения и иммуногистохимическая детекция онкогенеза при хирургическом лечении почечно-клеточного рака
Автор: Тарасенко А.И., Россоловский А.Н., Березинец О.Л., Понукалин А.Н., Медведева А.В., Захарова Н.Б., Попков В.М., Маслякова Г.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 3 т.14, 2018 года.
Бесплатный доступ
Цель: оценка возможности использования маркеров почечного повреждения и канцерогенеза в качестве дополнительных критериев выбора метода оперативного лечения пациентов с почечно-клеточным раком и минимизации риска развития и прогрессирования почечного повреждения. Материал и методы. Обследованы 60 пациентов с морфологически подтвержденным почечно-клеточным раком T1-3M0N0, оперированных в объеме открытой или лапароскопической нефрэктомии или лапароскопической резекции почки. Пациенты разделены на три группы: больные с ПКР после нефрэктомии, выполненной традиционной хирургической техникой (1-я группа); пациенты после лапароскопической нефрэктомии (2-я группа); после лапароскопической резекции опухоли (3-я группа). Перед операцией всем больным методом твердофазного ИФА произведено исследование концентраций экскретирующегося с мочой липокалина-2 (NGAL) и сывороточных концентраций IL-18, ММР-9 и IGF-1 на 5-7-е сутки и через 1 месяц послеоперационного наблюдения. Оценена почечная функция с помощью расчетного уравнения СКФ (CKD-EPI 2009) на основе уровня креатинина сыворотки крови. Всем больным проведено иммуногистохимическое исследование гистологических препаратов удаленных опухолей на антитела пролиферации (Ki-67, PCNA), апоптоза (ВАХ, Bcl-2). Различия в клинических данных и клинические переменные сравнивали с помощью ранговых корреляций Спирмена и t-критерия. Результаты. Исследуемые показатели почечного повреждения IL-18, NGAL, ММР-9 и IGF-1, как в раннем (5-7 дней), так и в более позднем (1 месяц) послеоперационном периоде показали корреляцию метода оперативного вмешательства и степени дифференцировки опухолевых клеток. Заключение. Уровни биомолекулярных маркеров почечного повреждения (IL-18, NGAL, ММР-9 и IGF-1) коррелируют со степенью дифференцировки опухолевых клеток и функциональной активностью оставшейся почечной паренхимы в послеоперационный период, однако зависят и от индивидуальных особенностей организма (исходного функционального состояния почечной паренхимы) пациента. Определенный уровень экспрессии ММР-9 и IL-18 при небольшом размере опухоли может быть ориентиром для определения показаний к выбору органосохраняющей операции у пациентов с ПКР
Биомолекулярные маркеры, иммуногистохимическое исследование, почечно-клеточный рак, почечное повреждение
Короткий адрес: https://sciup.org/149135117
IDR: 149135117
Текст научной статьи Экспрессия биомаркеров почечного повреждения и иммуногистохимическая детекция онкогенеза при хирургическом лечении почечно-клеточного рака
1 Введение. Почечно-клеточный рак (ПКР) является одной из актуальных проблем онкоурологии. На его долю приходится, по различным литературным данным, от 82 до 95% всех опухолей почек, он занимает десятое место среди наиболее распространенных злокачественных опухолей в мире [1]. Среди новообразований в урологической практике рак почки находится на третьем месте после злокачественных опухолей простаты и мочевого пузыря, а по смертности на первом месте. При сравнении онкологической заболеваемости и смертности с использованием базы данных ВОЗ и GLOBOCAN эти показатели выше в развитых странах (например, в Центральной и Восточной Европе) [2].
Несмотря на различные подходы к диагностике и ведению пациентов с ПКР, основным методом лечения данной патологии по-прежнему является хирургическое вмешательство. В течение многих десятилетий диагноз ПКР являлся показанием для выполнения открытой радикальной нефрэктомии, описанной Robson C. J. в 1963 г. Позже в работе Clаyman R. V., et al. (1991) был представлен первый случай лапароскопического доступа для нефрэктомии. Лапароскопическая нефрэктомия позволила значительно сократить сроки реабилитации и улучшить качество жизни пациентов в послеоперационном периоде. По данным многочисленных исследований, оба способа обеспечивают высокие и сопоставимые онкологические результаты лечения [3]. Немаловажной задачей лечения неметастатического ПКР является также предотвращение нарушения функции почек в послеоперационном периоде. Данное направление способствует активному внедрению органосберегающей тактики оперативного вмешательства у пациентов со злокачественными опухолями почек небольших размеров (до 4 см) [4].
Исследования последних лет показывают, что при наличии показаний и технической возможности резекция, а в отдельных случаях энуклеация
опухоли почки обеспечивает аналогичные нефрэктомии онкологические результаты, но при этом максимально сохраняется почечная функция. Однако и резекция и нефрэктомия при ПКР приводят к потере части функционирующих нефронов и активации механизмов прогрессирования нефросклероза, что выступает морфологическим проявлением почечного повреждения. Почечное повреждение может протекать в виде острого нарушения функции почек/почки в раннем послеоперационном периоде (острое повреждение почек — ОПП), а впоследствии привести к формированию хронической болезни почек (ХБП), сопровождающейся развитием атрофических и склеротических процессов в паренхиме и строме.
Связь между ПКР и почечным повреждением признана значительным числом исследователей, но привлекла особое внимание после формирования в последние годы новой субспециальности «онконефрология». При этом известно, что сама по себе операционная травма может способствовать развитию ХБП, а также прогрессированию ранее существовавшего заболевания с поражением почек [5]. Кроме того, недостаточно учитываются факторы, которые непосредственно влияют на послеоперационную функцию почки (возраст, объем кровопотери, площадь раневой поверхности, время операции, а также продолжительность тепловой/холодовой ишемии почечной паренхимы при пережатии почечной артерии, наличие сопутствующей патологии и некоторые другие). Такие пациенты подвергаются риску значительно большего снижения функции почек/поч-ки в раннем послеоперационном периоде, что оправдывает расширение в подобных случаях показаний к «нефронсберегающей» хирургии.
Ключевыми моментами в принятии решения о проведении малоинвазивного вмешательства при почечно-клеточном раке являются локализация и распространенность процесса, стадия опухолевого роста, размер и структура опухоли [6]. При этом следует учитывать, что к проведению «нефронсберегающих» вмешательств имеется ряд ограничений, связанных со стадией заболевания и особенностями гистологической картины опухоли, в частности градацией по Фурману (Fuhrman nuclear grade). Недостаточное внимание к указанным характеристикам может представлять повышенный онкологический риск или увеличивать вероятность хирургических осложнений [7].
Одним из основных направлений развития современной биомедицины, позволяющих объективировать показания к различным видам оперативного лечения, минимизировать риски последующего развития ОПП и ХБП и определить оптимальный баланс между онкологической безопасностью и максимальным сохранением функции почки, является поиск универсальных биомаркеров. В проведенных ранее исследованиях определены маркеры ранней фазы послеоперационного ишемического повреждения почек. К наиболее быстро реагирующим среди данных маркеров отнесены NGAL и IL-18 [4]. При этом повышение уровней NGAL и IL-18 в раннем послеоперационном периоде прямо пропорционально коррелирует с острым повреждением почек и является важным диагностическим маркером ОПП [8]. Мы продолжили наши исследования и среди маркеров опухолевой прогрессии проанализировали уровни MMP-9 и инсулиноподобного фактора роста IGF-1, что также вызывает интерес других исследователей [9–19]. Ма-триксные металлопротеиназы (ММП/ММР) играют решающую роль в развитии опухолевой прогрессии, в том числе и ангиогенезе новообразования. Кроме того, ММР-9 — один из важнейших ферментов, который участвует в процессах инвазии и метастазирования. Доказано, что у ММР-9 имеется сильная корреляция между увеличенной экспрессией гена, стадией опухоли и ее агрессивностью [12, 13]. Kal-lakuru B., et al. в своих исследованиях зафиксировали, что увеличенные показатели ММР-9 в ПКР соотносились с худшим прогнозом заболевания, включая сокращение времени выживаемости пациента [14]. Другим исследованным фактором онкогенеза явился инсулиноподобный фактор роста-1 (insulin-like growth factor-1 (IGF-1)). Повышение его концентрации в сыворотке крови связывают с риском развития таких видов опухолей, как рак молочной железы, простаты, толстого кишечника и легких. IGF-1 играет важную роль в защите от апоптоза и регуляции клеточного роста, и его повышенная экспрессия в клетках ПКР связана с плохим прогнозом [19].
Известно, что прогноз заболевания обусловлен биологическим потенциалом опухоли. Степень гистологической дифференцировки, а соответственно и агрессивности (G — грейд) опухоли в настоящее время определяется с помощью иммуногистохимических методов исследования с антителами пролиферации и апоптоза. Так, Р53, Ki-67, PCNA — маркеры пролиферации. Чем более выражена реакция этих маркеров, тем более агрессивно ведет себя опухоль и соответственно имеет более низкую дифференцировку. Напротив, чем слабее реакция маркеров апоптоза ВАХ и Bcl-2, тем менее благоприятно для прогноза. Маркер VEGF показывает васкуляризацию опухоли: чем более выражена реакция VEGF, тем лучше васкуляризирована опухоль и тем быстрее и агрессивнее она развивается [8, 20].
Цель: оценка возможности использования биохимических маркеров почечного повреждения и канцерогенеза в качестве дополнительных критериев выбора метода оперативного лечения ПКР и минимизации риска развития и прогрессирования хронического повреждения почек.
Материал и методы. Исследование проведено на базе НИИ фундаментальной и клинической уро- нефрологии Саратовского ГМУ им. В. И. Разумовского и НИИ уронефрологии и репродуктивного здоровья Первого Московского медицинского университета. Проспективно обследованы 60 пациентов с последующим подтверждением ПКР Т1-3М0N0 гистологическим методом. Проведено иммуногистохимическое исследование гистологических препаратов удаленных опухолей на антитела пролиферации (Ki-67, PCNA), апоптоза (BAX, Bcl-2). Пациенты прооперированы в объеме резекции почки, открытой или лапароскопической нефрэктомии. Все случаи распределялись на три группы: больные с ПКР после нефрэктомии, выполненной традиционной хирургической техникой (1-я группа); пациенты после лапароскопической нефрэктомии (2-я группа); после лапароскопической резекции опухоли (3-я группа).
Помимо стандартного обследования перед операцией, на 5–7-е сутки и через 1 месяц после оперативного вмешательства всем больным методом твердофазного ИФА произведено исследование концентраций экскретирующегося с мочой липокалина-2 (NGAL), сывороточных концентраций IL-18, MMP-9 и IGF-1. На основе уровня креатинина сыворотки крови оценена почечная функция с помощью расчетного уравнения СКФ (CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) 2009).
Для статистического анализа данных применяли программу Statistica 7.0 и IBM SPSS Statistics 20. Для обработки количественных данных изучаемых показателей использована описательная статистика, оценивался характер распределения. При нормальном распределении выборки достоверность различий средних показателей между независимыми группами определяли с помощью t-критерия Стьюдента. В выборках, где распределение отличалось от нормального, в процессе статистической обработки использовались методы непараметрического анализа, которые включали в себя вычисление медианы, квартилей вариационного ряда, максимальных и минимальных значений. В качестве критерия достоверности отличия между двумя независимыми группами использовался непараметрический критерий (U) Манна — Уитни. С целью изучения взаимосвязи количественных и качественных признаков выполнялся корреляционный анализ с использованием непараметрического метода Спирмена. Мера (коэффициент) корреляции «r» показывает, в какой степени изменение значения одного признака сопровождается изменением значения другого признака: r≤0,25 — слабая корреляция; 0,25
Результаты. Исходно у 82% оперированных пациентов установлен диагноз ХБП на разных стадиях. При этом у большинства пациентов в группах исходно имелось незначительное снижение СКФ (ХБП 2-3), из них 32,6% больных имели признаки хронической почечной недостаточности (рис. 1.).
Проведенное исследование продемонстрировало, что послеоперационная (через 1 мес.) СКФ была достоверно ниже у пациентов, подвергшихся нефрэктомии, выполненной как традиционной, так и лапароскопической техникой. СКФ-EPI составила 47, 47,8 и 58,7 ммоль/л в 1, 2 и 3-й группах соответственно.
Таким образом, у пациентов 1-й и 2-й групп через 1 месяц после вмешательства сохранялось снижение функциональной способности почек, тогда как при выполнении резекции восстановление после-
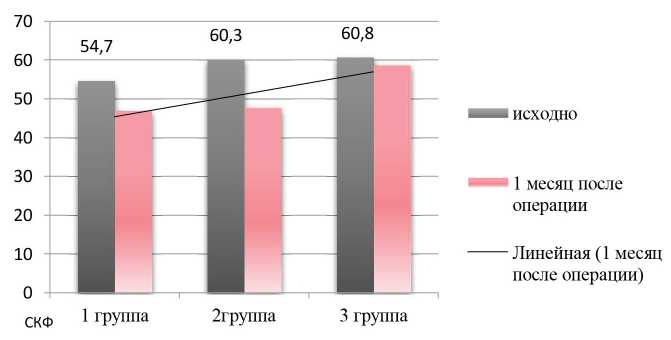
Рис. 1. Сравнительная оценка функционального состояния почек (СКФ-СKD EPI, мл/мин/1,73 м2) при различных видах оперативного лечения ПКР
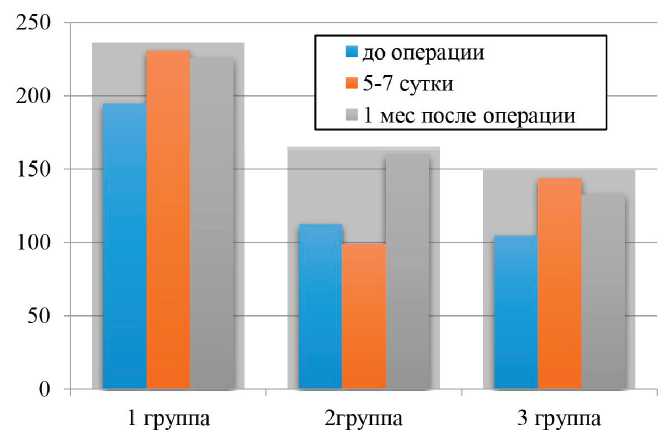
Рис. 2. Сравнительная оценка уровней ИЛ-18 в сыворотке крови при различных видах оперативного лечения ПКР
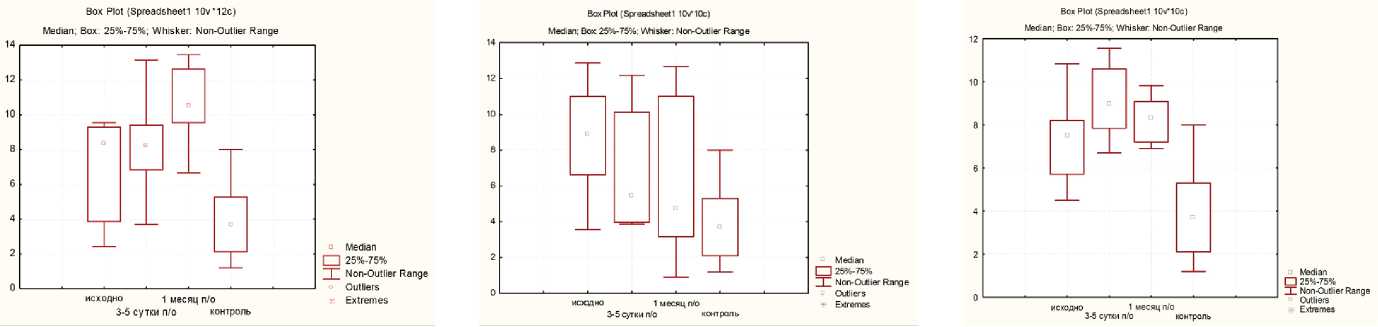
А Б В
Рис. 3. Уровни ММР-9 в динамике: А — после открытой операции; Б — после лапароскопической нефрэктомии; В — после лапароскопической резекции
операционной функции почек наступало быстрее по сравнению с другими группами, однако функциональная способность почек достоверно не изменилась по сравнению с исходной (р≤0,05).
Определяемые значения маркера ОПП IL-18 в раннем послеоперационном периоде были повышены у пациентов после открытой нефрэктомии, что указывает на более высокую степень интраоперационного повреждения паренхимы (рис. 2). При корреляционном анализе по методу Спирмена выявлена сильная достоверная корреляция между дооперационным уровнем IL-18 и СКФ после операции (r=0,75; р≤0,05).
У больных 1-й группы по сравнению с малоинвазивными вмешательствами отмечалось также повышение концентрации ММР-9 в сыворотке крови через 1 месяц. Вместе с тем значения данного показателя находились в пределах референсного интервала (рис. 3). Кроме того, повышение уровня ММР-9 ассоциировалось с высокой градацией опухоли G3–4 по Фурману и лимфоваскулярной инвазией.
При проведении корреляционного анализа Спирмена выявлена сильная достоверная корреляция между уровнем ММР-9 и NGAL в сыворотке крови (r=0,6, p≤0,001) (таблица).
Результаты корреляционного анализа Спирмена
|
Биомаркеры |
MMP-9 |
IGF-1 |
IL-18 |
NGAL |
|
|
Коэффициент корреляции |
1,000 |
–0,093 |
0,154 |
0,632** |
|
|
MMP-9 |
Знач. (2-сторонняя) |
. |
0,667 |
0,473 |
0,001 |
|
N |
60 |
60 |
60 |
60 |
|
|
Коэффициент корреляции |
–0,093 |
1,000 |
–0,087 |
0,001 |
|
|
IGF-1 |
Знач. (2-сторонняя) |
0,667 |
. |
0,686 |
0,995 |
|
N |
60 |
60 |
60 |
60 |
|
|
Коэффициент корреляции |
0,154 |
–0,087 |
1,000 |
0,310 |
|
|
IL-18 |
Знач. (2-сторонняя) |
0,473 |
0,686 |
. |
0,141 |
|
N |
60 |
60 |
60 |
60 |
|
|
Коэффициент корреляции |
0,632** |
0,001 |
0,310 |
1,000 |
|
|
NGAL |
Знач. (2-сторонняя) |
0,001 |
0,995 |
0,141 |
. |
|
N |
60 |
60 |
60 |
60 |
|
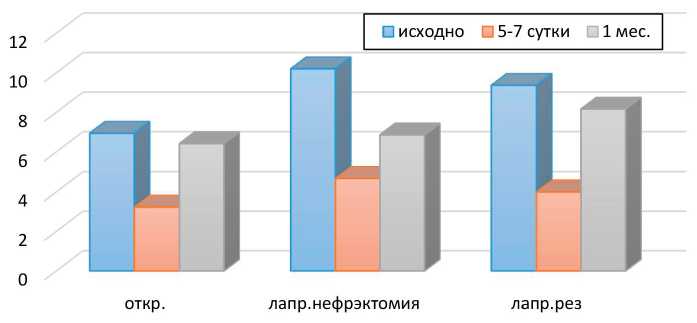
Рис. 4. IGF-1 в сыворотке крови в периоперационном периоде
При определении экспрессии IGF-1 в сыворотке крови в периоперационном периоде отмечалось отсутствие достоверного повышения данного показателя по сравнению с нормой. В то же время исходное повышение концентрации IGF-1 коррелировало с более низкой клеточной градацией по Фурману (G), склонностью опухоли к инвазии. При этом в раннем послеоперационном периоде отмечалось существенное снижение данного маркера в сыворотке крови, более выраженное у пациентов 1-й группы (p≥0,05). Последующий анализ концентрации IGF-1 в сыворотке крови в послеоперационном периоде указывает на повышение уровня IGF-1 у больных с почечной дисфункцией через 1 месяц после оперативного вмешательства.
При морфологическом исследовании отмечено, что в большинстве случаев клиническая стадия опухоли по TNM совпадала с гистологическим вариантом степени градации опухолевых клеток (или G), т.е. при T1–2 стадии в опухолевых узлах чаще всего наблюдали высокую степень дифференцировки раковых клеток G1–2, что имеет благоприятный прогноз. Однако в двух случаях из шестидесяти после проведенного гистологического исследования, при первоначально небольшом размере опухоли (менее 4 см, что соответствует Т1а стадии), имелись признаки выраженного атипизма опухолевых клеток: неравномерность контуров ядер и их крупный размер, визуализация крупных ядрышек и глыбок хроматина, что соответствовало G3–4 степени ядерной градации по Фурману (рис. 5, 6).
Иммуногистохимическое исследование фрагментов опухолевых узлов также подтвердило, что при высокой дифференцировке (G1-2) раковых клеток отмечается более низкий уровень экспрессии маркеров пролиферации и васкуляризации (Ki-67, PCNA, VEGF) и более высокий уровень экспрессии маркеров апоптоза (BAX и Bcl-2) (рис. 7, 8).
Обратная ситуация наблюдалась при низкой дифференцировке опухолевых клеток (G3-4): отмечались высокий уровень экспрессии Ki-67, PCNA и
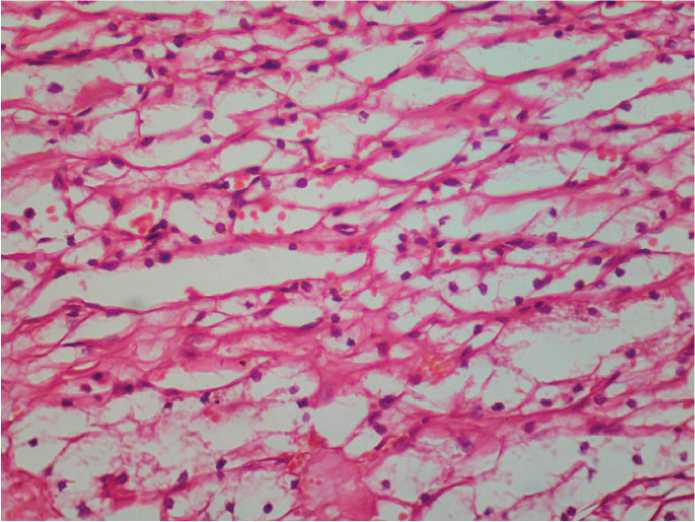
Рис. 5. ПКР светлоклеточный вариант, G1, г/э, ув. 450
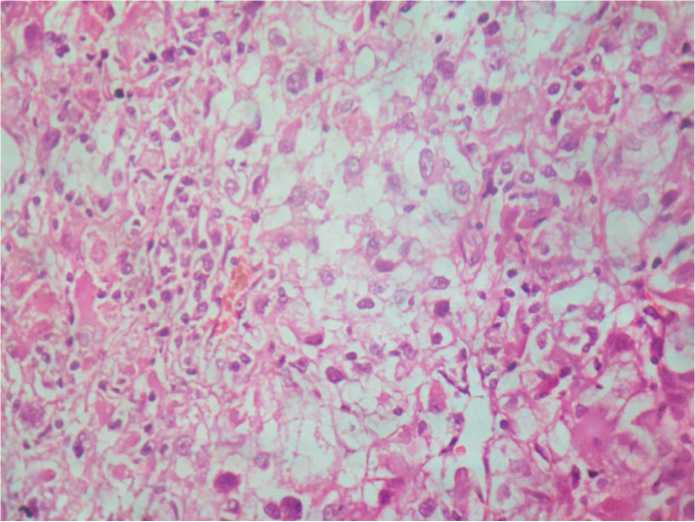
Рис. 6. ПКР светлоклеточный вариант, G3–4, г/э, ув. 450
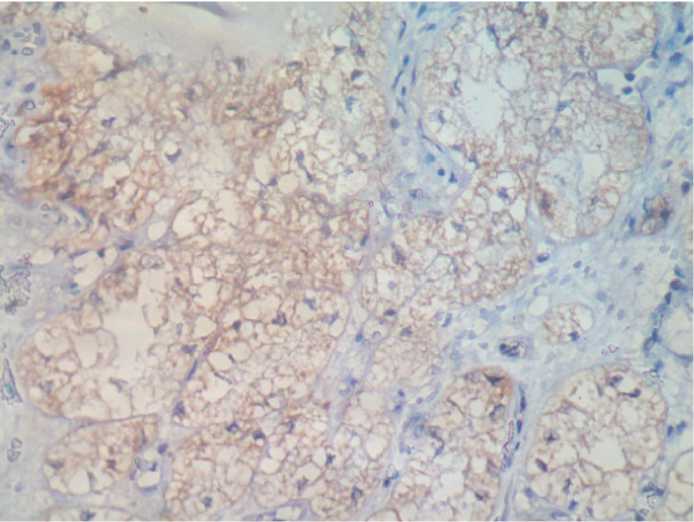
Рис. 7. ПКР, светлоклеточный вариант, G1, ИГХ, 90-95%-ная экспрессия на ВАХ, ув. 450
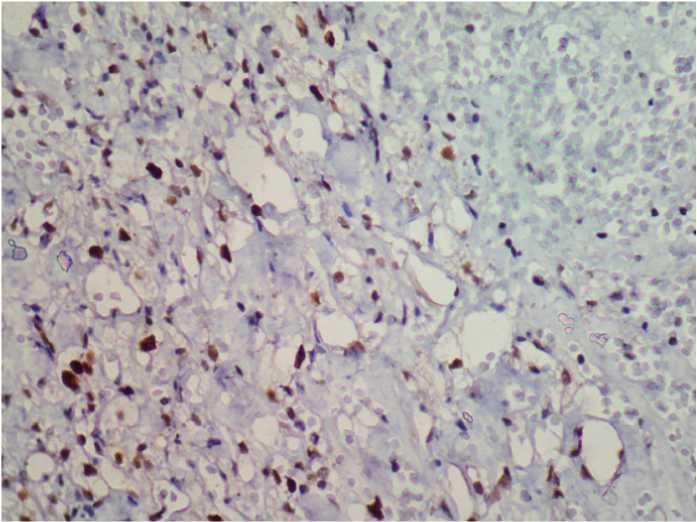
Рис. 8. ПКР, светлоклеточный вариант, G1, ИГХ, 25-30%-ная реакция на антитело PCNA, ув. 450
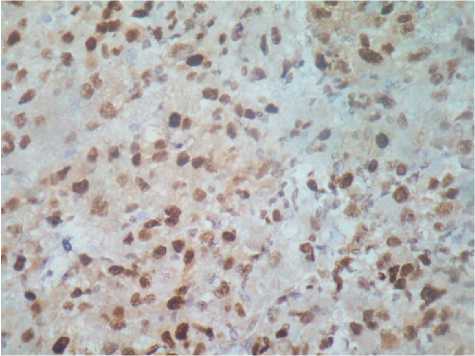
Рис. 9. ПКР светлоклеточный вариант, G3-4, ИГХ, 90%-ная экспрессия маркера PCNA, ув. 450
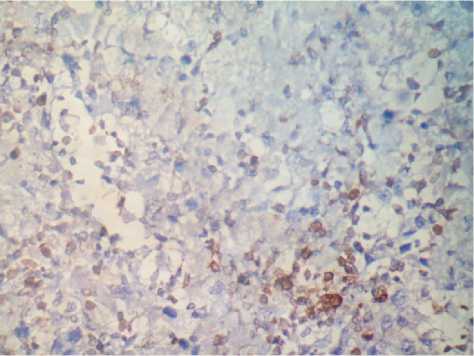
Рис. 10. ПКР светлоклеточный вариант, G3-4, ИГХ, 40-45% клеток реакция на маркер Bcl-2, ув. 450
VEGF и более слабая реакция маркеров апоптоза (BAX и Bcl-2) (рис. 9, 10) даже при небольших размерах опухоли при обследовании на дооперационном этапе.
При этом нами установлено, что уровни биомаркеров почечного повреждения и онкогенеза (IL-18 и NGAL, MMP-9 и IGF-1) были выше при более низкой дифференцировке раковых клеток (G3-4) и не зависели от размеров опухолевого узла.
Гистологический вариант и иммуногистохимические особенности опухоли не коррелировали с методом оперативного вмешательства. Однако следует отметить, что при небольших размерах опухоли в комбинации с ее низкой гистологической дифференцировкой (G3-4) наиболее оправданным методом оперативного вмешательства является малоинвазивный — резекция. Подобный подход позволяет снизить выраженность повреждения оставшейся функционирующей почечной ткани, как в плане развития острого почечного повреждения в ранний послеоперационный период, так и в более длительной перспективе для уменьшения риска развития хронического прогрессирующего повреждения почек. Особенно актуально это положение при наличии предоперационной нефробиопсии.
Обсуждение. Почечно-клеточный рак является одним из наиболее распространенных опухолевых процессов в онкоурологии. Ежегодно регистрируется все большее количество случаев ПКР у взрослого населения 50–70 лет, но также отмечается появление этого типично «взрослого» новообразования у подростков и даже у детей [1, 2]. Возможно, такая тенденция связана с улучшением диагностических возможностей медицинских учреждений. В этих условиях малоинвазивная и в то же время эффективная диагностика почечно-клеточного рака, своевременное адекватное оперативное вмешательство с минимальным повреждением функционирующей почечной ткани играют определяющую роль в отношении продолжительности и качества жизни пациентов [3–6].
В последние годы у врачей урологов-онкологов имеется широкий выбор хирургического лечения ПКР: открытая или эндоскопическая нефрэктомия, резекция, энуклеация опухоли почки, аблационные процедуры.
Поиск универсальных биомаркеров, позволяющих определить оптимальный баланс между онкологической безопасностью и максимальным сохранением функции почки после хирургического вмешательства по поводу рака почки, — одна из приоритетных задач современной онкоурологии. Известны маркеры ранней фазы послеоперационного острого повреждения почек: NGAL и IL-18. Раннее повышение уровней липокалина NGAL и IL-18 прямо пропорционально коррелирует с острым повреждением почек в ранней послеоперационный период и является важным диагностическим маркером ОПП [5]. Согласно существующим представлениям, NGAL защищает ММП-9 от протеолитической деградации, повышая ферментативную активность ММП-9, и впоследствии способствует расширению зоны опухолевой инвазии. В то же время NGAL является высокочувствительным маркером острого почечного повреждения, и его повышение, вследствие увеличения объема операционной травмы, опосредованно приводит к повышенной продукции ММР-9, фактически обеспечивая условия к метастазированию и продолженному росту опухоли [15].
В проведенной работе получена сильная достоверная корреляция между уровнем ММР-9 и NGAL в сыворотке крови (r=0,6, p≤0,001), что косвенно доказывает возможность активации инвазивного роста, в частности, за счет повышения ферментативной активности ММР-9, что рядом авторов расценивается как плохой прогноз для пациента в плане сокращения выживаемости [12–14]. Подобный вывод подтверждается и полученным в ходе исследования повышением уровня ММР-9 у больных 1-й группы через 1 месяц после операции, которое ассоциировалось с высокой градацией опухоли G3–4 по Фурману и лимфоваскулярной инвазией.
Инсулиноподобный фактор роста-1 (insulin-like growth factor-1 (IGF-1)) играет важную роль в защите от апоптоза и в регуляции клеточного роста, и его повышенная экспрессия в клетках ПКР связана также с плохим прогнозом для больного [19]. В литературе имеются доказательства, что IGF-1 стимулирует синтез ДНК в нормальных почечных клетках, а также в клетках ПКР. Считается, что как инсулин, так и IGF влияют на развитие и прогрессирование рака, но точный молекулярный механизм этого явления еще не выяснен. Более того, данные о влиянии инсулина на развитие и прогрессирование опухоли ограничены.
Морфологическое и иммуногистохимическое исследования (с помощью маркеров пролиферации, васкуляризации Ki-67, PCNA, VEGF и маркеров апоп- тоза BAX и Bcl-2) чаще всего подтверждают минимальный атипизм опухолевых клеток (G1-2). Но и при первоначально небольших размерах ПКР (3,6–3,8 см) возможно обнаружение агрессивных опухолей с ярко выраженным атипизмом клеток (G3-4). Уровни биомаркеров почечного повреждения (IL-18 и NGAL, MMP-9 и IGF-1) выше при более низкой дифференцировке раковых клеток (G3-4), даже несмотря на небольшие размеры опухолевого узла. При небольших размерах опухоли в комбинации с ее низкой гистологической дифференцировкой (G3-4) приоритетным методом оперативного вмешательства является лапароскопическая резекция почки. Этот метод операции позволяет снизить степень повреждения оставшейся почечной ткани, минимизировать или предотвратить острое и хроническое почечное повреждение.
Заключение. Лапароскопическая резекция почки при ПКР демонстрирует лучшие функциональные показатели почечной паренхимы в ближайшем (1 мес.) послеоперационном периоде. В качестве маркера неблагоприятного прогноза в отношении прогрессирования ХБП у пациентов с ПКР может быть использован уровень IL-18 в сыворотке крови. Повышенные уровни ММР-9 в сыворотке крови больных ПКР до и после различных видов оперативного лечения отражает индивидуальные особенности организма пациента и опухолевого процесса, что требует персонализированного подхода к выбору метода хирургического лечения. Другим не менее важным ориентиром является степень дифференцировки опухоли на основании градации Фурмана (G опухолевых клеток), а также наличие лимфоваскулярной инвазии. Уровень ММР-9 при этом может являться дополнительным весомым критерием для определения показаний к выбору органосберегающей хирургии у пациентов ПКР.
Список литературы Экспрессия биомаркеров почечного повреждения и иммуногистохимическая детекция онкогенеза при хирургическом лечении почечно-клеточного рака
- Chinello Cl, L'imperio VI, Stella M. The proteomic landscape of renal tumors. Expert Rev Proteomics 2016 Dec; 13 (12): 1103-20
- 2.FerlayJ,Soerjomataraml,ErvikM,etal.GLOBOCAN2012, cancer incidence and mortality worldwide: IARC CancerBase No. 11. International Agency for Research on Cancer, Lyon, France; 2014
- Мосоян M.C. Открытая, лапароскопическая и робот-ассистированная нефрэкто-мия при локализованном раке почки: что предпочесть? Нефрология 2014; 18 (6): 76-81
- Попков B.M., Тарасенко A.M., Маслякова Г. H. и др. Биомолекулярная оценка почечной функции при различных видах оперативного лечения почечно-клеточного рака. Саратовский научно-медицинский журнал 2017; 13 (1): 73-7
- Pocсоловский A. H., Глыбочко П. В., Попков В.М. и др. Дифференцированный подход к оценке почечного повреждения у больных мочекаменной болезнью с помощью неинвазивных маркеров. Саратовский научно-медицинский журнал 2010; 6 (3):708-15
- Коган М.И., Ахохов 3.M., Гусев А.А., Пасечник Д. Г. Молекулярно-биологические факторы прогнозирования течения почечно-клеточного рака (обзор литературы). Онкоурология 2016; 12 (3): 45-51
- Баныра О. Б., Строй А. А, Шуляк А. В. Маркеры опухолевого роста в диагностике рака почки. Экспериментальная и клиническая урология 2011; 4: 72-8
- Глыбочко П. В., Захарова Н. Б., Понукалин А. Н. и др. Диагностическое значение показателей ангиогенеза при раке почки. Онкоурология 2011; 7 (3): 25-30
- Rosner МН. Urinary biomarkers for the detection of renal injury. Adv Clin Chem 2009; 49: 73-97
- Lisowska-Myjak B. Serum and urinary biomarkers of acute kidney injury. Blood Purif 2010; 4 (29): 357-65
- Larsson SC & WolkA. Diabetes mellitus and incidence of kidney cancer: a meta-analysis of cohort studies. Diabetologia 2011; 54: 1013-8
- Zhang L, Xul B, Chen S, et al. The complex roles of microRNAs in the metastasis of renal cell carcinoma. J Nanosci Nanotechnol 2013; 13: 3195-203
- Wu D, Pan H, Zhou Y, Zhou J. microRNA-133b down regulation and inhibition of cell proliferation, migration and invasion by targeting matrix metallopeptidase-9 in renal cell carcinoma. Mol Med Rep 2014 Jun; 9 (6): 2491-8
- Kallakury BV, Karikehalli S, Haholu A, et al. Increased expression of matrix metalloproteinases 2 and 9 and tissue inhibitors of metalloproteinases 1 and 2 correlate with poor prognostic variables in renal cell carcinoma. Clin Cancer Res 2001;7:311-9
- Angelina Di Carlo. Evaluation of neutrophil gelatinase-associated lipocalin (NGAL), matrix metalloproteinase-9 (MMP-9) and their complex MMP-9/NGAL in sera and urine of patients with kidney tumors. Oncol Lett 2013 May; 5 (5): 1677-81
- Sarfstein R, Werner H. Minireview: nuclear insulin and insulin-like growth factor-1 receptors: a novel paradigm in signal transduction. Endocrinology 2013;154 (5): 1672-9
- Kjeldsen L. Isolation and primary structure of NGAL, a novel protein associated with human neutrophil gelatinase. J Biol Chem 1993; 268: 10425-32
- Flower DR, North AC, Sansom CE. The lipocalin protein family: structural and sequence overview. Biochim Biophys Acta 2000, 1482:9-24
- Rabkin R, Schaefer F. New concepts: growth hormone, insulin-like growth factor-l and the kidney. Growth Horm IGF Res 2004 Aug; 14 (4): 270-6
- Маслякова Г. H., Медведева А. В. Изучение факторов агрессивности для диагностики и прогнозирования течения опухолей почек (анализ литературных данных). Бюллетень медицинских интернет конференций 2013; 3 (4): 845-8
- Реброва О.Ю. Статистический анализ медицинских данных: применение пакета прикладных программ STATISTICA. М.: Медиа Сфера, 2002; 312 с.


