Экспрессия CD68+, BCL-2+, KI-67+ в сторожевых, нативных и постнатально индуцированных лимфатических узлах
Автор: Рустамханов Расул Айдарович, Зайратьянц Олег Вадимович, Ганцев Шамиль Ханяфиевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.25, 2017 года.
Бесплатный доступ
В работе исследованы иммуногистохимические особенности постнатально индуцированных лимфатических узлов в сравнении со сторожевыми и нативными лимфатическими узлами в эксперименте. Для постнатального формирования лимфатических узлов проведен эксперимент на 25 белых крысах-самцах линии Wistar. Первой группе животных (15 крыс) произведена перевивка саркомы М1, вторая группа состояла из интактных животных (10 крыс). В эксперименте на модели перевиваемой саркомы М1 показана возможность воспроизведения постнатальной индукции неолимфогенеза при опухолевом росте. Исследование продемонстрировало высокий уровень антигенной стимуляции Т- и В-лимфоцитов в постнатально индуцированных лимфоузлах и показало возможную роль клеток макрофагального ряда в стимуляции неолимфогенеза и образованных лимфоузлов.
Постнатально индуцированный лимфоузел, саркома м-1, неолимфогенез, всl-2
Короткий адрес: https://sciup.org/143177173
IDR: 143177173 | DOI: 10.20340/mv-mn.17(25).02.06
Текст научной статьи Экспрессия CD68+, BCL-2+, KI-67+ в сторожевых, нативных и постнатально индуцированных лимфатических узлах
Рустамханов Р.А., Зайратьянц О.В., Ганцев Ш.Х. Экспрессия CD68+, BcL-2+, Ki-67+ в сторожевых, нативных и постнатально индуцированных лимфатических узлах// Морфологические ведомости.- 2017.- Том 25.- № 2.- С. 37-42. (25).02.06
Rustamkhanov RA, Zayrat’yants OV, Gantsev ShKh. Expression of CD68+, BСL-2+, KI-67+ in sentinel, native and postnatal induced lymph nodes. Morfologicheskie Vedomosti – Morphological Newsletter. 2017 Jun 30;25(2):37-42. (25).02.06
Введение. Исследования последних лет в области клинической онколимфологии позволили обнаружить ранее не описанный феномен постнатального неолимфогенеза при онкологических заболеваниях [1-2]. Этот феномен характеризуется появлением новых лимфатических узлов, имеющих некоторые анатомические особенности, которые позволяют отличить их от нативных по числу приносящих и отводящих лимфатических сосудов, структуре капсулы и «привязанности» к сторожевому лимфатическому узлу. Ранее проведенные исследования при раке молочной железы с метастазами в подмышечный лимфатический регион установили, что центром перераспределения потоков лимфы является сторожевой лимфатический узел. Функционирование этой анатомической структуры определяет движение лимфы и масштабы лимфогенного метастазирования [2-3]. Предполагается, что появление новых лимфатических узлов при злокачественных опухолях можно рассматривать с позиций сложных механизмов взаимодействия иммунной системы с опухолью. В постнатально индуцированных лимфатических узлах (далее - ПНИЛУ) у онкологических больных содержатся различные вещества, которые обладают высокой биологической активностью [1, 3]. Макрофаги играют важную роль в реакциях иммунной системы на процессы онкогенеза, представляют собой центральное звено врождённого иммунного ответа, и именно их реакция на патоген детерминирует развитие адаптивного иммунитета. Макрофаг является основным клеточным трансдуктором биологического сигнала как для патогенных микроорганизмов, так и для опухолевых клеток на иммунную систему организма [4-5]. Можно предположить важную роль макрофагов в процессах неолимфогенеза. Для объективной визуализации макрофагов и ряда других клеток системы мононуклеарных фагоцитов в тканях используется иммуногистохимическое выявление экспрессии их мембранного маркера - белка СD68 [6]. Выявляемый иммуногистохимически белок-ингибитор апоптоза Bcl-2 в лимфатических узлах обнаруживается в цитоплазме лимфоцитов лимфоидных узелков кортикальной зоны (в малых В-лимфоцитах мантии, лимфоцитах и лимфобластах зародышевых центров), а также в единичных Т-лимфоцитах паракортикальной Т-зависимой зоны. Этот белок осуществляет защиту клеток от эндогенных и экзогенных воздействий, индуцирующих апоптоз [7-8]. Для оценки пролиферативной активности различных клеток используется иммуногистохимический метод с выявлением экспрессии белка Ki-67. Экспрессия Кi-67 – негистонового ядерного белка, позволяет выделить пролиферирующие клетки, находящиеся в поздней G1, S, M и G2 фазах клеточного цикла, кроме G0 и ранней G1 фаз, поскольку в течение 60–90 минут после митоза этот белок разрушается [9].
Цель работы - изучить иммуногистохимические особенности ПНИЛУ в сравнении со сторожевыми и нативными лимфатическими узлами в эксперименте.
Материалы и методы исследования . Исследование проводили на белых крысах-самцах альбиносах линии Wistar, вес животных варьировал в пределах 120-180 грамм. Животные были разделены на две группы. Первая группа (экспериментальная) включала 15 крыс, которым перевивался опухолевый штамм саркомы М1 в мягкие ткани правой боковой области живота; вторая группа (контрольная) состояла из 10 интактных крыс. Все манипуляции на лабораторных животных проводили согласно международным и отечественным этическим и научным стандартам планирования и выполнения исследований на животных (приказ МЗ и СР РФ от 23.08.2010 г. № 708н «Правила лабораторной практики», приложения к приказу Минздрава СССР от 12.08.1977 г. № 755 и приказу Минсельхоза РФ от 05.11.2008 г. № 490 «Об утверждении правил проведения лабораторных исследований в области ветеринарии»; Европейская конвенция по защите позвоночных животных, используемых для экспериментальных и других научных целей, ЕЭС, Страсбург, 1985; требования Хельсинкской декларации и Всемирной медицинской ассоциации, 2000; рекомендации, содержащиеся в Директивах Европейского сообщества, 86/609 ЕС). Объектом исследования явились новообразованные лимфатические узлы аксиллярной области, индуцированные опухолевым ростом перевивной саркомы М1 с лимфогенными метастазами в регионарные лимфатические узлы. Для сравнительного анализа изучали сторожевые с метастазами опухоли (далее - СЛУ) животных основной группы и нативные лимфоузлы (далее - НЛУ) аксиллярной области у интактных крыс контрольной группы. Лимфатические узлы фиксировали в 10% растворе нейтрального формалина, обрабатывали по стандартной гистологической методике и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином. Для иммуногистохимического исследования парафиновые гистологические срезы изготовленные на микротоме LEICA RM 2145 (Германия) толщиной 4 мкм, окрашивали с помощью иммуногистостейнера Leica Microsystems Bond™ (Германия) согласно протоколам фирм-изготовителей антител. В качестве первичных моноклональных антител применяли следующую панель: Вcl2 в разведении 1:200 (клон N-19, Santa Cruz Biotechnology, США); CD68 в разведении 1:300 (клон ED 1, Santa Cruz Biotechnology, США); Ki-67 в разведении 1:75 (клон Mib 5, Daco, Дания). Для окрашивания использовали непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия). Оценку специфичности реакции проводили при окрашивании срезов без первичных антител. Полученные препараты исследовали с использованием микроскопа Leica DM 2500 (Германия) со специализированным программным обеспечением управления настройками и захвата изображения. Для оценки результатов иммуногистохимической реакции проводили подсчет индексов экспрессии CD68, Bcl-2 и Ki-67 в процентах на 1000 клеток (или их ядер для Ki-67) в 10 случайным образом отобранных полях зрения (увеличение микроскопа х400). Учитывали умеренное и выраженное иммуногистохимическое окрашивание.
Полученные данные подвергали статистическому анализу. В зависимости от характера распределения выборок (групп) использовали как параметрические, так и непараметрические методы статистической обработки. Для выборок, которые не отличались по распределению от нормального, и имели положительные тесты на равенство дисперсий применяли параметрические методы. В отдельных случаях после параметрических расчетов анализ проверялся ранговыми методами для исключения возможных ошибок. Применяли однофакторный дисперсионный анализ с расчетом критерия Фишера (F) и уровня его статистической значимости. Множественное сравнение средних проводили при помощи одного из самых жестких тестов – теста Тьюки для равных и неравных выборок. В случае отсутствия условий для использования параметрических тестов применяли непараметрические (ранговые) тесты. При наличии большего числа групп оценку проводили с помощью рангового дисперсионного анализа Краскела-Уоллиса. При множественном сравнении средних рангов учитывали поправку Бонферрони (0,05/n, n - число групп). Критический уровень статистической значимости при сравнении 2-х групп принимали за 0,05.
Результаты исследования и обсуждение. Лимфоидная ткань СЛУ была в разной степени вытеснена метастазами опухоли. Исследовали сохранные участки лимфоидной ткани с неизмененной структурой их строения. СD68+клетки (макрофаги и гистиоциты) определялись преимущественно в краевом и промежуточных синусах, а также в кортикальной межузелковой и паракортикальной зонах (рис. 1-а). Исследование экспрессии ингибитора апоптоза Всl-2 показало, что она была выражена в клетках (В-лимфоцитах) герминативных центров лимфоидных узелков и отдельных клетках (Т-лимфоцитах, макрофагах) паракортикальной зоны и локализованных в краевом и промежуточном синусах. Такая картина характерна для узелковой гиперплазии лимфатического узла (рис. 1-б). Экспрессия маркера пролиферации Кi-67 была выражена в ядрах клеток (В-лимфоцитов) герминативных центров лимфоидных узелков (до 90% клеток). Она была высокой в лимфоцитах и макрофагах синусов (до 20-30%) и отмечалась также в единичных клетках (лимфоцитах, макрофагах) других структур лимфатического узла. Однако в паракортикальной зоне встречались очаги высокой пролиферативной активности Т-лимфоцитов, в которых интенсивность составляла 50-60% (рис. 1-в).
Исследование НЛУ контрольной группы показало, что CD68+клетки (макрофаги и гистиоциты) локализовались преимущественно в краевом и промежуточных синусах (рис. 2-а). Исследование экспрессии ингибитора апоптоза Всl-2 показало, что она была более выражена в клетках (В-лимфоцитах) герминативных центров лимфоидных узелков и отдельных клетках (Т-лимфоцитах, макрофагах) паракортикальной зоны, а также краевого и промежуточного синусов (рис. 2-б). Экспрессия маркера пролиферации Кi-67 преобладала в ядрах клеток (В-лимфоцитов) герминативных центров лимфоидных узелков (до 90% клеток), лимфоцитах и макрофагах синусов (до 20-30%) и определялась лишь в единичных клетках (лимфоцитах, макрофагах) других структур лимфатического узла. Распределение клеток, экспрессирующих этот маркер, указывает на нормальную функциональную активность лимфатического узла (рис. 2-в) [4].
Исследование экспрессии маркера CD68 в ПНИЛУ позволило выявить большое количество макрофагов и гистиоцитов в просвете синусов. Местами они определялись в лимфоидных узелках и в паракортикальной зоне (рис 3-а). Экспрессия ингибитора апоптоза белка Всl-2 выявлялась в цитоплазме лимфоцитов герминативных центров лимфоидных узелков, единичных макрофагах и лимфоцитах, расположенных в синусах и вокруг лимфатических узелков (рис. 3-б).
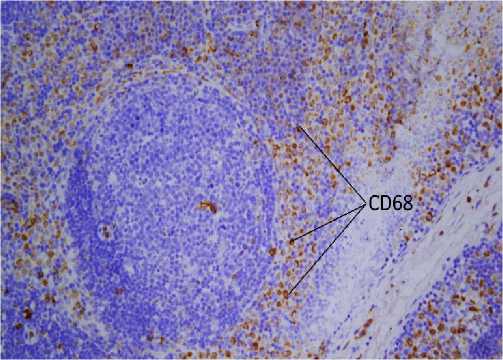
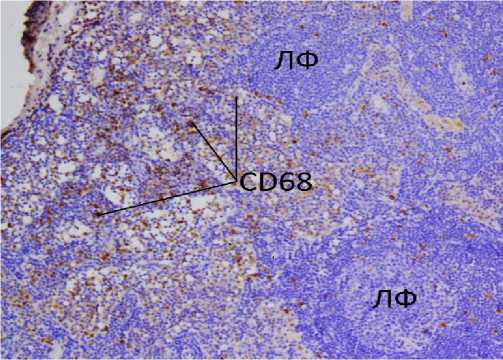
Рис. 1-а. Сторожевой лимфатический узел. CD68+ макрофаги и гистиоциты в краевом и промежуточных синусах, кортикальной межузелковой и паракортикальной зонах. Непрямой иммунопероксидазный метод. Ув.: х200.
Рис. 2-а. Нативный лимфатический узел. CD68+ макрофаги и гистиоциты в краевом и промежуточных синусах; ЛФ – лимфоидные узелки. Непрямой иммунопероксидазный метод Ув.200.
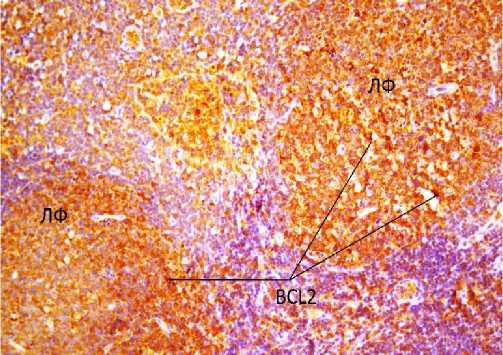
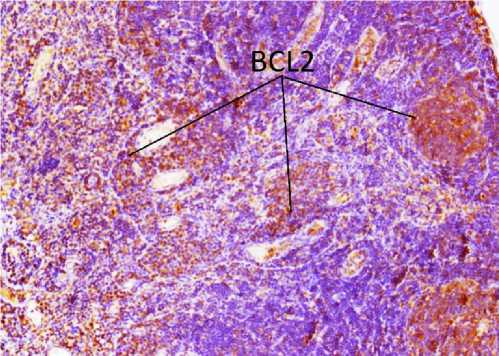
Рис. 1-б. Сторожевой лимфатический узел. Экспрессия Вс1- 2 в В-лимфоцитах герминативных центров лимфоидных узелков, Т-лимфоцитах и макрофагах паракортикальной зоны, краевого и промежуточного синусов. Непрямой иммунопероксидазный метод. Ув.: х200.
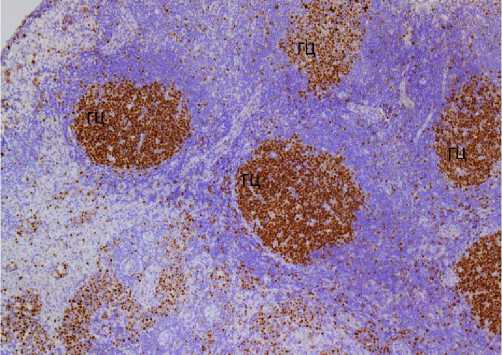
Рис. 2-б . Нативный лимфатический узел. Экспрессия Вс1-2 в В-лимфоцитах герминативных центров лимфоидных узелков и отдельных Т-лимфоцитах и макрофагах паракортикальной зоны, краевого и промежуточного синусов. Непрямой иммунопероксидазный метод. Ув.: х200.
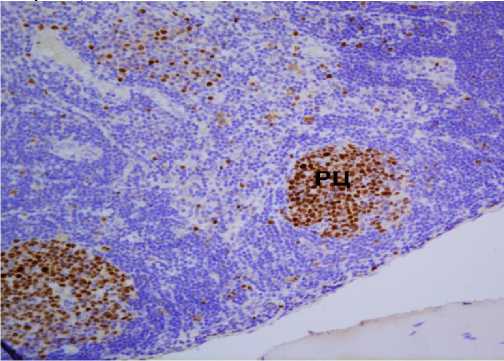
Рис. 1-в. Сторожевой лимфатический узел. Экспрессия Кi-67 в ядрах В-лимфоцитов герминативных центров лимфоидных узелков и в лимфоцитах, макрофагах и других структурах. Непрямой иммунопероксидазный метод. Ув.: х200.
Рис. 2-в . Экспрессия Кi-67 в ядрах (В-лимфоцитов герминативных центров лимфоидных узелков (РЦ), лимфоцитах, макрофагах и других структурах. Непрямой иммунопероксидазный метод. Ув.: х250.
Таблица 1
Показатели индекса экспрессии CD68 в сторожевых, нативных и постнатально индуцированных лимфоузлах
|
№№ |
Структурно- функциональные зоны лимфоузлов |
n |
СЛУ |
НЛУ |
ПНИЛУ |
|
1 |
Краевые синусы |
10 |
17,7±4,0* 0,000128 ᴾ 0,000127 ᶰ |
6,1±2,6* 0,387462 ᴾ 0,000127 ˢ |
8,1±3,3* 0,387462 ᶰ 0,000128 ˢ |
|
2 |
Промежуточные синусы |
10 |
23,0(20,0-28,0)** 1,000000 ᴾ 0,001076 ᶰ |
10,0(8,010,0)** 0,000180 ᴾ 0,001076 ˢ |
25,0(20,0-30,0)** 0,000180 ᶰ 1,000000 ˢ |
|
3 |
Лимфатические узелки |
10 |
28,5(12,0-35,0)** 0,000021 ᶰ 0,006084 ᴾ |
0,0 (0,0-0,0)** 0,475884 ᴾ 0,000021 ˢ |
1,0 (1,0-2,0)** 0,475884 ᶰ 0,006084 ˢ |
|
4 |
Паракортикальная зона |
10 |
19,2±7,0* 0,175656 ᴾ 0,000130 ᶰ |
3,8±1,3* 0,000855 ᴾ 0,000130 ˢ |
14,5±6,9* 0,000855 ᶰ 0,175656 ˢ |
Список литературы Экспрессия CD68+, BCL-2+, KI-67+ в сторожевых, нативных и постнатально индуцированных лимфатических узлах
- Ганцев Ш.Х. Новые технологии диагностики и лечения рака молочной железы// Креативная хирургия и онкология. -2009.-№ 1.- С. 6-9.
- Ганцев Ш.Х. Аксиллярный лимфатический аппарат при раке молочной железы: Атлас.- М.: МИА, 2011.- 194 с.
- Gantsev ShKh, Umezawa K, Islamgulov DV et al. The role of inflammatory chemokines in lymphoid neoorganogenesis in breast cancer. Biomed. Pharmacother. 2013;67(5):363-366.
- Бородин Ю.И. Лимфатическая система и старение// Фундаментальные исследования.- 2011.- № 5.- С. 11-15.
- Martin TR, Frevert CW. Innate Immunity in the Lungs. Proc. Am. Thor. Soc. 2005;2:403-411.
- Holness CL, Simmons DL. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 1993;81(6):1607-1613.
- Белкин А.Д. Содержание белков регуляторов апоптоза bcl-2 и bad в регионарных лимфатических узлах печени при воздействии магнитного поля 50 гц//Гигиена и санитария.- 2015.- № 1.- С. 112-114.
- Белушкина Н.Н., Северин С.Е. Молекулярные основы патологии апоптоза// Архив патологии.- 2001.- Том 63.- № 1.- С. 51-60.
- Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J. Cell. Physiol. 2000;182:311-322.


