Экспрессия иммуногистохимических маркеров в аденокарциноме простаты после максимальной андрогенной блокады
Автор: Воронина Елена Сергеевна, Медведева Анна Валентиновна, Маслякова Галина Никифоровна, Аристова Ирина Сергеевна
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 3 (27), 2017 года.
Бесплатный доступ
Рак простаты (РП) приобретает особую актуальность вследствие неуклонного роста заболеваемости и смертности, а также в связи с трудностями своевременной диагностики. Критерием эффективности лечения РП является морфологическое определение патоморфоза аденокарциномы, однако применение стандартного метода не всегда отражает истинную картину изменений. Целью данного исследования было изучение степени выраженности патоморфоза аденокарциномы простаты при помощи иммуногистохимических маркеров после максимальной андрогенной блокады (МАБ). Методы исследования. Материал для данного исследования был получен при трансректальной биопсии простаты (до лечения), и трансуретральной резекции простаты (после лечения). Заключение. Через 4 месяца после МАБ (билатеральная орхэктомия) при иммуногистохимическом исследовании отмечается существенное снижение индекса пролиферации, экспрессии онкомаркера AMACR, ядерной экспрессии андрогенов и маркера регулятора апоптоза Bcl-2 в клетках аденокарциномы простаты. Экспрессия регулятора апоптоза Р53 в ядрах опухолевых клеток после лечения также снижалась, но достоверного различия между группами пациентов до и после МАБ не было.
Лечебный патоморфоз, максимальная андрогенная блокада, иммуногистохимия, аденокарцинома простаты
Короткий адрес: https://sciup.org/14344288
IDR: 14344288 | УДК: 616.65-002-006
Текст научной статьи Экспрессия иммуногистохимических маркеров в аденокарциноме простаты после максимальной андрогенной блокады
Введение. Проблема рака простаты (РП) приобретает особую актуальность вследствие неуклонного роста заболеваемости и смертности, а также в связи с трудностями своевременной диагностики. РП занимает второе место среди злокачественных новообразований у мужчин. Несмотря на улучшение методов диагностики и внедрение ПСА-мониторинга, заболеваемость запущенными формами РП в России остается на высоком уровне. В последние десятилетия эффективность лечения онкологических больных по показателям длительной выживаемости и продолжительности жизни изменяется незначительно [2]. Лечебный патомор-фоз – это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование. Положительный патоморфоз РП, выявляемый при рутинных гистологических методах окраски, не дает достоверной информации об эффективности данного метода лечения. В качестве дополнительного критерия эффективности лечения РП необходимо применение иммуногистохимических методов исследования [5, 6].
Цель: изучение степени выраженности патоморфоза аденокарциномы простаты при помощи иммуногистохимических маркеров после максимальной андрогенной блокады (МАБ).
Материалы и методы. В данной работе мы изучали материал, полученный от 40 пациентов с диагнозом ацинарная аденокарцинома простаты до и через 4 месяца после лечения МАБ. До лечения мы изучали материал трансректальной биопсии простаты, после – трансуретральной резекции простаты. МАБ проводилась билатеральной орхэктомией. Иммуногистохимические реакции проводили на парафиновых срезах, используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675) фирмы Daco, в качестве хромогена – диаминобензидин (Daсo). В работе использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441-фирма Daco (разведение 1:50); P53 Mouse Monoclonal Antibody – фирма CELL MARQUE (разведение 1:100); Monoclonal Mouse Anti-Human Ki67 Antigen Clone MIB-1– фирма Daco (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R – фирма Diagnoatic BioSystems (разведение 1:50); Monoclonal Mouse anti Bcl-2 oncoprotein – фирма Daco (разведение 1:50). Результаты реакций цитоплазматических маркеров (AMACR, Вcl2) оценивали полуко-личественным способом по балльной шкале от 0 до 3 с помощью светового бинокулярного микроскопа «MicrosMC100», учитывая выраженность реакции и ее локализацию: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – сильная реакция маркера. Результаты экспрессии с ядерными антигенами (Р53, Andr) оценивали по системе подсчета histochemical score (Hs). Формула подсчета следующая:
histochemicalscore (Hs) = ∑ P (i) × i, где i – интенсивнось окрашивания, выраженная в баллах от 0 до 3. P (i) – процент клеток, окрашенных с разной интенсивностью. Интенсивность окраски: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Для определения индекса пролиферации экспрессии ядерного маркера Ki67 выполняли подсчет количества окрашенных ядер клеток опухоли, учитывая процентное соотношение окрашенных\неокрашенных ядер клеток на 100 учтенных клеток в 10-ти репрезентативных полях зрения при увеличении х40. Статистический анализ проводили с использованием программы статистической обработки SSPS 13.0 forWindows, критерия Манна – Уитни.
Результаты исследования и их обсуждение. Опухолевый маркер Ki-67 является одним из наиболее востребованных в онкологии для определения пролиферативной активности опухолевых клеток, степени злокачественности новообразования и решения вопроса о виде дополнительного консервативного лечения [3]. Мы изучали экспрессию данного маркера как до, так и после МАБ. До лечения индекс пролиферации опухолевых клеток был во всех случаях на достаточно высоком уровне и колебался от 42 % до 96 % (медиана 61 %). После МАБ показатели индекса пролиферации заметно снижались и находились в пределах от 0 % до 27 % (медиана14 %). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия.
Альфа-метилацил-КоА-рацемаза (AMACR) специфичный высокоэффективный иммуногистохимический онкомаркер, позволяющий дифференцировать рак простаты от других патологических процессов, а также более точно определить стадию заболевания [1]. В нашем исследовании до лечения у 97 % пациентов в аденокарциноме отмечали сильную (3 балла) реакцию данного маркера в виде зерен коричневого цвета в цитоплазме, у 3 % пациентов – умеренную реакцию. После лечения у 53 % пациентов реакция данного маркера была слабая (1 балл), у 34 % – умеренная (2 балла), и лишь у 13 % пациентов экспрессия оставалась на высоком уровне (3 балла). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия в уровнях выборок. Экспрессия AMACR находилась в прямой корреляции с маркером пролиферации Ki-67.
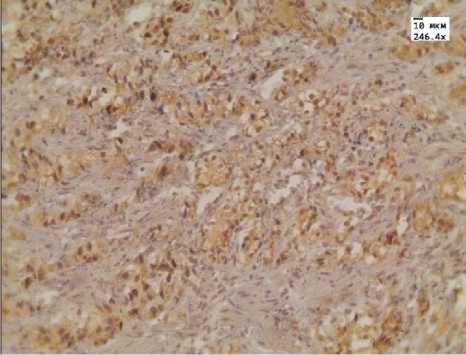
Рис. 1. Умеренная иммуногистохимическая реакция с антителом к AMACR в аденокарциноме простаты после лечения МАБ.Ув. 246,4
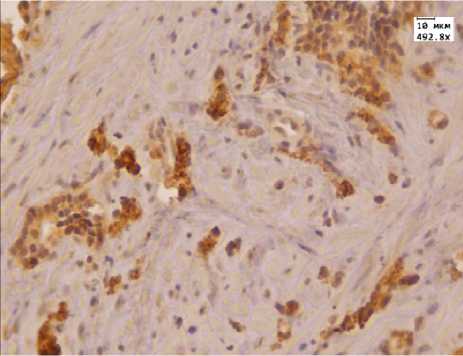
Рис. 2. Выраженная иммуногистохимиче с кая реакция с а н тителом к AMACR в аденокарциноме простаты до лечения МАБ.Ув. 492,8
Р53 иммуногистохимический маркер является супрессором опухолевого р оста. Предотвращает вступление клетки с поврежденной ДНК в фазу цикла и индуцирует апоптоз.
Мутация гена р53 ведет к потере контроля пролиферации клеток, угнетению апоптоза. Величина экспрессии мутированного р53 при РП зависит от того, состоит ли она из гормонозависимых клеток или образована гормононезавис и мыми клетками [1]. У пациентов до лечения МАБ в аденокарциноме реакция данного маркера колебалась в пределах Hs = от 200 до 72 (медиана 120). После лечения показатели экспрессии снижались: медиана Hs = 61, но интервал колебания экспрессии данного показателя составлял от Hs = 13 до 255. Сравнивая показатели групп по критерию Манна – Уитни мы получили, что различия в уровн я х выборок были не существенными. Антиген Всl-2 экспрессируется в цитоплазме и на база л ьной мембране эпителия и является регулятором апоптоза. Ген Вс1-2 способствует опухолевой прогрессии, ингибируя апоптоз и тем самым повыша я выживаемость опухолевых клеток [4]. В нашем исследовании реакция данного маркера в аденокарциноме у пац и ентов до М АБ была умеренной (2 балла) и сильной (3 балла) во всех случаях. После лечения у 11 % пациентов экспрессия оставалась сильной, у 42 % пациентов отмечали умеренную экспрессию, у 35 % – слабую, и у 12 % экспрессия в аденокарциноме была отрицательной. Использу я критерий Манна – Уитни, мы выявили, что различия в уровнях выборок являются существенными. У 94 % пациентов после МАБ положительная реакция Вс1-2 отмечалась в лимфоцитах в очагах лимфоцитарной инфильтрации в строме.
Андрогены участвуют в стимуляции пролиферации эпителиальных клеток простаты, а также стимулируют синтез кератинного и фибробластического факторов роста стромальными клетками, что оказывает митогенный эффект на эпителиальные клетки и окружающую строму. До билатеральной орхэктомии реакция данного маркера в аденокарциноме простаты у 72 % пациентов была выраженной (медиана Hs = 226). Через 4 месяца после МАБ медиана Hs составила 88, показатель гистосчета колебался в пределах от 3 до 290. При анализе критерия Манна – Уитни различия в уровнях выборок можно считать существенными. Экспрессия андрогенов находилась в прямой корреляции с экспрессией Ki67 и AMACR.
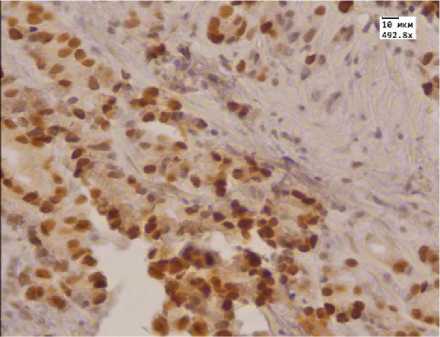
Рис. 3. Выраженная иммуногистохимическая реакция с антителом к андрогенам в аденокарциноме простаты до лечения МАБ.Ув. 492,8
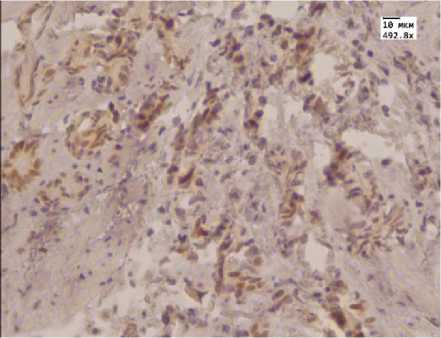
Рис. 4. Слабая иммуногистохимическая реакция с антителом к андрогенам в аденокарциноме простаты после лечения МАБ.Ув. 492,8
Заключение. Через 4 месяца после МАБ (билатеральная орхэктомия) при иммуногистохимическом исследовании отмечается существенное снижение индекса пролиферации, экспрессии онкомаркера AMACR, ядерной экспрессии андрогенов и маркера регулятора апоптоза Bcl-2 в клетках аденокарциномы простаты. Экспрессия регулятора апоптоза Р53 в ядрах опухолевых клеток после лечения также снижалась, но достоверного различия между группами пациентов до и после МАБ не было. Таким образом, используя иммуногистохимические маркеры мы смогли оценить показатели лечебного патоморфоза, недоступные при стандартной окраске.
Список литературы Экспрессия иммуногистохимических маркеров в аденокарциноме простаты после максимальной андрогенной блокады
- Ефремов Г.Д. Роль иммуногистохимических маркеров в диагностике рака предстательной железы//Экспериментальная и клиническая урология. -2011. -№ 1. -C. 50-55.
- Жаринов Г.М. Скорость роста и клинические потери рака предстательной железы/Г.М. Жаринов, И.В. Чепурная, К.М. Пожарисский, А.Г. Кудайбергенова, Н.Ю. Некласова, О.А. Богомолов//Экспериментальная и клиническая урология. -2016. -№ 3. -С. 36-39.
- Лазукин А.В. Роль маркера Ki-67 в определении прогноза при раке молочной железы//РМЖ. -2013. -№ 1. -С. 28.
- Носов А.К. Новые лекарственные препараты в терапии рака предстательной железы, резистентного к кастрации/А.К. Носов, С.Б. Петров, Н.А.Воробьев//Урология сегодня. -2017. -№ 1.
- Фомкин Р.Н. Патоморфоз рака предстательной железы при лечении высокоинтенсивным сфокусированным ультразвуком (HIFU)/Р.Н. Фомкин, Е.С. Воронина, В.М. Попков, Г.Н. Маслякова, Б.И. Блюмберг//Онкоурология. -2013. -№ 1. -С. 55-62.
- Фомкин Р.Н. Прогностическое значение моллекулярно-биологических, морфологических и клинических маркеров в оценке эффективности лечения локализованного рака предстательной железы высокоинтенсивным сфокусированным ультразвуком/Р.Н. Фомкин, Е.С. Воронина, В.М. Попков, Г.Н. Маслякова, Б.И. Блюмберг//Экспериментальная и клиническая урология. -2013. -№ 4. -С. 29-33.


