Экспрессия каналов с транзиторным рецепторным потенциалом (TRP) на лейкоцитах периферической крови больных хронической обструктивной болезнью легких
Автор: Наумов Д. Е., Сугайло И. Ю., Котова О. О., Гассан Д. А., Горчакова Я. Г., Шелудько Е. Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Известно, что каналы с транзиторным рецепторным потенциалом (TRP) являются рецепторами активных форм кислорода и компонентов сигаретного дыма и потому могут быть вовлечены в патогенез хронической обструктивной болезни легких (ХОБЛ).Цель исследования: изучить экспрессию каналов TRPV1, TRPV4, TRPM8 и TRPA1 на лейкоцитах периферической крови больных ХОБЛ и здоровых лиц, а также установить ее возможные взаимосвязи с воспалительными маркерами и показателями функции внешнего дыхания.Материал и методы. Обследованы 23 больных ХОБЛ различной тяжести и 17 лиц без бронхиальной обструкции. Экспрессию каналов TRP на моноцитах, лимфоцитах и гранулоцитах определяли методом непрямой проточной цитометрии. Концентрации цитокинов в плазме крови измеряли с помощью мультиплексного анализа. Показатели вентиляционной функции легких оценивали методом спирометрии.Результаты. Моноциты больных ХОБЛ отличались повышенной экспрессией каналов TRPV1 (98,8 (97,6; 99,6)% против 97,8 (96,3; 98,6)%, p = 0,03) и TRPA1 (99,2 (98,7; 99,8)% против 95,1 (94,2; 98,4)%, p = 0,003). Кроме того, ХОБЛ была ассоциирована с увеличением соотношения экспрессии TRPV4 / TRPM8 на моноцитах (0,66 (0,51; 0,90) против 0,27 (0,12; 0,70), p = 0,02) и гранулоцитах (0,97 (0,86; 0,92) против 0,29 (0,06; 0,89), p = 0,003). Экспрессия TRPV4 на моноцитах демонстрировала корреляции с уровнем CXCL10 (ρ = 0,55, p = 0,01), а для TRPM8 были обнаружены обратные взаимосвязи с концентрациями IL-6 (ρ = -0,56; p = 0,02) и IL-10 (ρ = -0,55; p = 0,02). Мы не нашли ассоциаций экспрессии TRP каналов с показателями вентиляционной функции легких.Заключение. Повышенная экспрессия TRPV1 и TRPA1, а также увеличенное соотношение TRPV4 / TRPM8 на моноцитах периферической крови больных ХОБЛ могут свидетельствовать о вкладе данных рецепторов в провоспалительную активацию клеток и указывают на возможные перспективы фармакологической модуляции TRP каналов с целью терапии заболевания.
Лейкоциты, trp каналы, хроническая обструктивная болезнь легких, бронхиальная обструкция, воспаление, проточная цитометрия
Короткий адрес: https://sciup.org/149144420
IDR: 149144420 | УДК: 616.155.3-008.1: | DOI: 10.29001/2073-8552-2023-659
Текст научной статьи Экспрессия каналов с транзиторным рецепторным потенциалом (TRP) на лейкоцитах периферической крови больных хронической обструктивной болезнью легких
Хроническая обструктивная болезнь легких (ХОБЛ) – частое заболевание, которое входит в число лидирующих причин смертности и вносит существенный вклад в социально-экономическое бремя хронической респираторной патологии. Имея глобальную распространенность 10,3 (8,2– 12,8)%, в том числе среди некурящих, в настоящее время ХОБЛ ассоциирована с 3 млн смертей ежегодно. При этом, согласно прогнозам, к 2060 г. смертность от ХОБЛ возрастет до 5,4 млн случаев в год [1]. По данным анализа 2016 г., экономические потери от ХОБЛ в России составили более 170 млрд рублей или 0,2% внутреннего валового продукта [2].
Считается, что важнейшим патогенетическим компонентом ХОБЛ является оксидативный стресс, приводящий к повреждению ДНК, белков и в итоге к ускоренному клеточному старению. Причинами этого могут служить как непосредственное поступление компонентов сигаретного дыма (в том числе, АФК и азота) из легких в системный кровоток, так и опосредованная индукция АФК провоспалительными медиаторами (TNF-α, IL-1β, IL-6) или продуктами перекисного окисления липидов, которые образуются в эпителиальных клетках и лейкоцитах респираторного тракта в результате первичного контакта с дымом и пылевыми частицами. Несмотря на центральную роль оксидативного стресса при ХОБЛ, применяемые в настоящее время способы его фармакологической коррекции недостаточно эффективны. По данным метаанализа, такой широко используемый антиоксидант, как N-ацетилцистеин, не снижает частоту обострений, не приводит к замедлению прогрессирования ХОБЛ и улучшению качества жизни пациентов, а также не увеличивает уровень эндогенного антиоксиданта – глутатиона [3] . По данной причине актуальным остается дальнейшее изучение механизмов патогенеза заболевания и поиск дополнительных способов контроля уровня оксидативного стресса.
Сенсорами оксидативного стресса в организме могут служить различные белки, в том числе киназы, факторы транскрипции и ионные каналы. К числу последних относятся каналы с транзиторным рецепторным потенциалом (TRP), некоторые из которых способны активироваться АФК, оксидом азота и электрофильными соединениями, том числе образующимися эндогенно в результате перекисного окисления полиненасыщенных жирных кислот. Семейство TRP у млекопитающих представлено 28 белками и насчитывает 6 подсемейств: канонические (TRPC), ваниллоидные (TRPV), меластатиновые (TRPM), полицистиновые (TRPP), муколипиновые (TRPML) и анкириновые (TRPA). Как было показано, активация большинства редокс-чувствительных
TRP каналов АФК или азота осуществляется за счет окисления либо нитрозилирования цистеиновых остатков в составе соответствующего белка. Среди наиболее часто упоминаемых рецепторов TRP, для которых была установлена возможность активации под действием АФК и азота, являются TRPV1, TRPA1, TRPM2, TRPM8, TRPC5, TRPV4 [4] . Примечательно, что эти же каналы чувствительны к пылевым частицам и компонентам сигаретного дыма – основным этиологическим факторам ХОБЛ, что подтверждает вероятное участие данных белков в развитии заболевания. В совокупности каналы TRP способны регулировать широкий спектр биологических процессов в различных клетках: влиять на продукцию медиаторов воспаления и АФК, оказывать эффект на пролиферацию и апоптоз, стимулировать секрецию бокаловидных клеток и сокращение гладкой мускулатуры, изменять проницаемость эпителиального барьера в дыхательных путях [5] .
Известно, что TRP экспрессированы в лейкоцитах периферической крови, однако детального анализа экспрессии на уровне белка в зависимости от субпопуляции клеток не проводилось. Кроме того, несмотря на потенциальную патогенетическую значимость, остаются неизученными особенности экспрессии TRP на лейкоцитах больных ХОБЛ.
Цель настоящего исследования: изучить экспрессию каналов TRPV1, TRPV4, TRPM8 и TRPA1 на лейкоцитах периферической крови больных ХОБЛ и здоровых лиц, а также установить ее возможные взаимосвязи с воспалительными маркерами и показателями функции внешнего дыхания.
Материал и методы
Исследование было проведено в соответствии принципами Хельсинкской декларации «Этические принципы проведения медицинских исследований с участием людей в качестве субъектов исследования» с поправками 2013 г. и нормативными документами «Правила надлежащей клинической практики в Российской Федерации», утвержденными Приказом № 200н от 01.04.2016 МЗ РФ, и одобрено локальным комитетом по биомедицинской этике (протокол
№140 от 16.12.2021 г.). Все лица подписывали информированное согласие на участие в исследовании.
На базе клинико-диагностического отделения ДНЦ ФПД были обследованы 23 больных ХОБЛ вне обострения (возраст - 60,8 ± 1,64 лет) и 17 лиц группы контроля, в том числе 8 курильщиков без бронхиальной обструкции (возраст - 56,0 ± 3,55 лет) и 9 здоровых, никогда не куривших добровольцев (возраст - 50,7 ± 3,18 лет). Критериями включения в основную группу были верифицированный диагноз ХОБЛ, индекс курения не менее 10 пачка-лет, мужской пол, возраст от 40 до 80 лет. В группу контроля были включены лица мужского пола от 40 до 80 лет, в том числе с индексом курения не менее 10 пачка-лет, не имевшие признаков бронхиальной обструкции по данным спирометрии. Из исследования исключались лица, имевшие эндокринные, онкологические, инфекционные заболевания, а также прочую респираторную патологию, кроме ХОБЛ и хронического необструктивного бронхита (у курильщиков).
Среди больных ХОБЛ индекс курения составлял 40,0 (30,0; 60,0) пачка-лет, а среди курильщиков, не имевших бронхиальной обструкции, – 31,5 (23,5; 35,0) пачка-лет (p = 0,07). В структуре ХОБЛ преобладали пациенты с тяжелой (GOLD III) бронхиальной обструкцией (65%), реже встречались больные с легкой и средней обструкцией (GOLD I–II, 26%) либо крайне тяжелым течением заболевания (GOLD IV, 9%).
Образцы венозной крови собирали в пробирки с ЭДТА. Экспрессию каналов TRPV1, TRPV4, TRPM8 и TRPA1 определяли в лейкоцитах после лизиса эритроцитов реагентом BD Pharm Lyse (BD Biosciences, США) методом непрямой проточной цитометрии. Клетки выдерживали в течение 30 мин в фосфатно-солевом буфере, содержащем 3% параформальдегида и 0,5% сапонина при 4 °C, отмывали 0,5% сапонином и добавляли первичные поликлональные антитела к TRPV1, TRPV4, TRPM8, TRPA1 (Alomone Labs, Израиль) либо изотипические антитела. Клетки инкубировали с первичными антителами 30 мин при 4 °C, после чего однократно отмывали 0,5% сапонином, вносили вторичные антитела, конъюгированные с Alexa Fluor 647 (Abcam, Великобритания) и выдерживали еще 30 мин при 4 °C. Анализ проводили на проточном цитофлуориметре FACSCantoII (BD Biosciences, США), гейтируя популяции моноцитов, лимфоцитов и гранулоцитов на графиках прямого (FSC) и бокового (SSC) светорассеяния. Величину экспрессии каналов TRP определяли по сравнению с изотипическим контролем и выражали в виде процента положительно окрашенных клеток.
Концентрации цитокинов IL-4, IL-2, CXCL10, IL-1β, TNF-α, MCP-1, IL-17A, IL-6, IL-10, IFN-γ, IL-12p70, IL-8, TGF-β1 определяли в плазме крови коммерческими наборами LEGENDplex (BioLegend, США) на проточном цитофлуориметре FACSCantoII (BD Biosciences, США).
Оценку показателей вентиляционной функции легких проводили с помощью спирометрии форсированного выдоха на аппарате Easy on-PC (nddMedizintechnik AG, Швейцария). На фоне действия бронхолитика (сальбутамол 400 мкг) определяли значения объема форсированного выдоха за 1 с (ОФВ 1 ), соотношение ОФВ 1 к форсированной жизненной емкости легких (ФЖЕЛ), пиковую объемную скорость (ПОС), Максимальную объемную скорость на уровнях 25% ФЖЕЛ (МОС 25 ), 50% ФЖЕЛ (МОС 50 ), 75% ФЖЕЛ (МОС 75 ), а также среднюю объемную скорость (СОС 25–75 ) в процентах от должных величин.
Статистический анализ выполняли в программном пакете STATISTICA 12.0 (StatSoft, Inc., США). Количественные данные представлены в виде Me ( Q1; Q3 ) – медиана и межквартильный интервал. Значимость межгрупповых различий для количественных переменных определяли с помощью U -критерия Манна – Уитни. Корреляционный анализ выполняли с помощью коэффициента ранговой корреляции ρ Спирмена. В качестве критического уровня значимости принимали значение 0,05.
Результаты
Уровни экспрессии всех четырех TRP каналов были тесно взаимосвязаны между собой, о чем свидетельствовали высокозначимые прямые корреляционные связи, которые наблюдались как при изолированном анализе в моноцитах, лимфоцитах и гранулоцитах, так и между клетками различных типов (табл. 1).
Таблица 1. Корреляции между уровнями экспрессии каналов TRP на моноцитах обследованных лиц
Table 1. Correlations between the expression levels of the TRP channels on monocytes of the studied subjects
|
Канал TRP TRP channel |
TRPV4 |
TRPM8 |
TRPA1 |
|
TRPV1 |
ρ = 0,73; p < 0,001 |
ρ = 0,63; p < 0,001 |
ρ = 0,68; p < 0,001 |
|
TRPV4 |
– |
ρ = 0,71; p < 0,001 |
ρ = 0,81 p < 0,001 |
|
TRPM8 |
– |
– |
ρ = 0,69 p < 0,001 |
Note: TRP - transient receptor potential.
При сравнении экспрессии каналов TRP между больными ХОБЛ и группой контроля было обнаружено, что клетки больных лиц, преимущественно моноциты, отличаются повышенной экспрессией всех TRP белков. Значимые различия показателей экспрессии были обнаружены для TRPV1 и TRPA1 на моноцитах (табл. 2). Экспрессия каналов TRP на лейкоцитах периферической крови курильщиков без бронхиальной обструкции и здоровых некуривших лиц значимо не отличалась. Кроме того, экспрессия не зависела от индекса курения как в группе больных ХОБЛ, так и среди курильщиков группы контроля.
Таблица 2. Экспрессия каналов TRP на лейкоцитах периферической крови больных хронической обструктивной болезнью легких и лиц без бронхиальной обструкции
Table 2. Expression of TRP channels on peripheral blood leukocytes of chronic obstructive pulmonary disease patients and individuals without bronchial obstruction
|
Канал TRP TRP channel |
Больные ХОБЛ COPD patients |
Лица без бронхиальной обструкции Individuals without bronchial obstruction |
p |
|
TRPV1 мон , % |
98,8 (97,6; 99,6) |
97,8 (96,3; 98,6) |
0,03 |
|
TRPV4 мон , % |
46,4 (20,8; 70,5) |
11,3 (5,3; 68,1) |
0,14 |
|
TRPM8 мон , % |
94,1 (88,0; 96,8) |
88,9 (28,8; 97,3) |
0,37 |
|
TRPA1 мон , % |
99,2 (98,7; 99,8) |
95,1 (94,2; 98,4) |
0,003 |
|
TRPV1 лимф , % |
98,1 (90,6; 99,1) |
97,5 (93,2; 98,7) |
0,68 |
|
TRPV4 лимф , % |
10,4 (5,0; 24,9) |
2,6 (0,9; 24,9) |
0,14 |
|
TRPM8 лимф , % |
81,6 (70,4; 90,8) |
89,4 (23,7; 90,2) |
0,65 |
|
TRPA1 лимф , % |
98,6 (93,7; 99,5) |
93,7 (83,0; 97,5) |
0,10 |
|
TRPV1 гран , % |
97,1 (92,9; 98,3) |
98,4 (95,1; 98,7) |
0,21 |
|
TRPV4 гран , % |
85,3 (49,9; 87,4) |
24,0 (5,6; 86,7) |
0,16 |
|
TRPM8 гран , % |
89,2 (83,2; 95,0) |
93,9 (91,4; 95,7) |
0,45 |
|
TRPA1 гран , % |
97,1 (95,1; 98,9) |
96,2 (72,6; 98,9) |
0,29 |
Примечание: ХОБЛ - хроническая обструктивная болезнь легких.
Note: TRP - transient receptor potential, COPD - chronic obstructive pulmonary disease.
Больные ХОБЛ отличались от лиц контрольной группы достоверным увеличением уровней IL-1β, IL-17A, IL-10, IL-12p70 и IL-8 в плазме крови (рис. 1). Отличий в концентрациях цитокинов между курящими лицами без бронхиальной обструкции и никогда не курившими обнаружено не было.
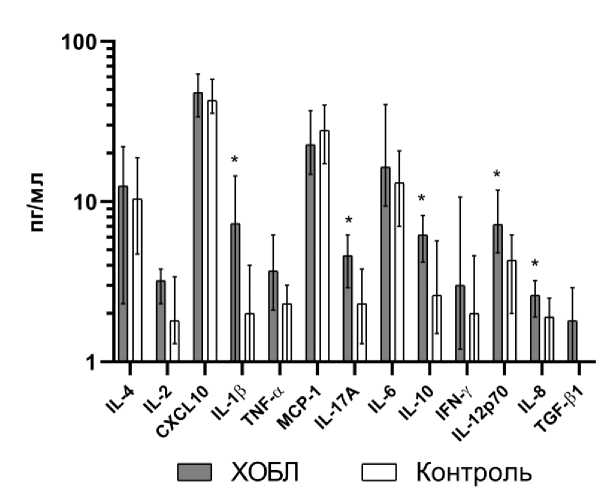
Рис. 1. Концентрации цитокинов в плазме крови больных хронической обструктивной болезнью легких и лиц контрольной группы
Примечание: * – p < 0,05, ХОБЛ - хроническая обструктивная болезнь легких.
Fig. 1. Cytokines concentrations in the blood plasma of chronic obstructive pulmonary disease patients and individuals in the control group
Note: * – p < 0.05.
Корреляционный анализ экспрессии каналов TRP и концентраций цитокинов в плазме больных ХОБЛ выявил ряд значимых взаимосвязей (табл. 3).
Таблица 3. Корреляции экспрессии каналов TRP на лейкоцитах периферической крови больных хронической обструктивной болезнью легких с уровнями цитокинов
Table 3. Correlations of TRP channel expression on peripheral blood leukocytes of chronic obstructive pulmonary disease patients with cytokine levels
|
Моноциты |
Лимфоциты |
Гранулоциты |
|
|
TRPV1 |
-- |
-- |
CXCL10 ( ρ = 0,43; p = 0,07) |
|
TRPV4 |
CXCL10 ( ρ = 0,55; p = 0,01) |
CXCL10 ( ρ = 0,44; p = 0,06) |
CXCL10 ( ρ = 0,55; p = 0,01) IFN-γ ( ρ = 0,46; p = 0,05) |
|
TRPM8 |
IL-2 ( ρ = –0,47; p = 0,06) IL-6 ( ρ = –0,57; p = 0,02) IL-10 ( ρ = –0,62; p = 0,009) IL-12p70 ( ρ = –0,50; p = 0,04) |
IL-4 ( ρ = –0,48; p = 0,05) IL-6 ( ρ = –0,56; p = 0,02) IL-10 ( ρ = –0,55; p = 0,02) IL-12p70 ( ρ = –0,50; p = 0,04) |
IL-6 ( ρ = –0,67; p = 0,004) IL-10 ( ρ = –0,49; p = 0,05) |
|
TRPA1 |
IL-12p70 ( ρ = –0,52; p = 0,04) |
-- |
-- |
Note: TRP - transient receptor potential.
В целом можно заметить, что корреляции экспрессии TRPV1 и TRPV4 с уровнями цитокинов в плазме больных ХОБЛ были преимущественно положительные, а для TRPA1 и в особенности для TRPM8 – преимущественно отрицательные (рис. 2).
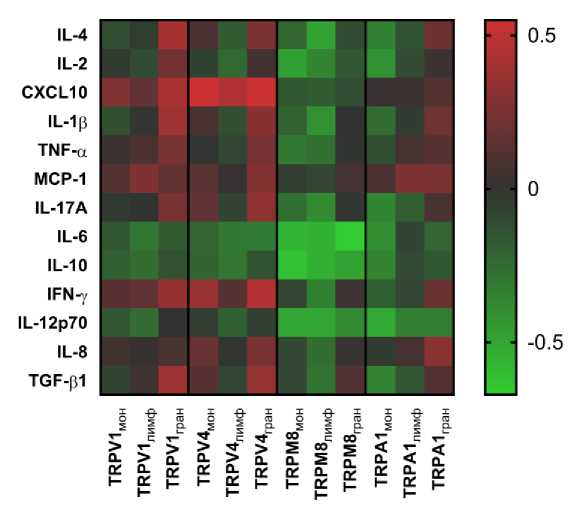
Рис. 2. Матрица корреляций экспрессии каналов TRP в субпопуляциях лейкоцитов периферической крови и уровнями цитокинов в плазме крови больных хронической обструктивной болезнью легких
Примечание: яркость каждой ячейки отражает величину коэффициента корреляции ρ Спирмена, при этом прямые корреляции обозначены красным цветом, а обратные – зеленым; соответствующая шкала приведена справа от изображения матрицы корреляций.
Fig. 2. Correlation matrix of TRP channels expression in peripheral blood leukocytes subpopulations and cytokines levels in the blood plasma of chronic obstructive pulmonary disease patients
Note: the brightness of each cell reflects the value of ρ Spearman's correlation coefficient, with direct correlations indicated in red and reverse correlations in green; the corresponding scale is shown to the right of the image of the correlation matrix.
Мы не нашли значимых корреляций между экспрессией каналов TRP и концентрациями цитокинов в плазме крови лиц контрольной группы.
Учитывая выявленный «антагонизм» каналов TRPV1 и TRPV4 по отношению к TRPM8 и TRPA1, был проведен сравнительный анализ соотношений их экспрессии в различных сочетаниях и установлено, что отношение TRPV4/TRPM8 наилучшим образом отличает больных ХОБЛ от лиц группы контроля, несмотря на то, что значимых индивидуальных особенностей экспрессии данных каналов при ХОБЛ в ходе первичного анализа обнаружено не было. Наличие заболевания было ассоциировано с более высоким отношением TRPV4 / TRPM8 на моноцитах (0,66 (0,51; 0,90) против 0,27 (0,12; 0,70), p = 0,02) и гранулоцитах (0,97 (0,86; 0,92) против 0,29 (0,06; 0,89), p = 0,003), но не на лимфоцитах.
Больные ХОБЛ отличались от лиц контрольной группы ожидаемо сниженными значениями бронхиальной проходимости (ОФВ1 42,5 (34,5; 58,5) против 95,0 (74,0; 103,5)%, p < 0,001; ОФВ 1 / ФЖЕЛ 46,9 (43,1; 57,2) против 79,0 (70,9; 83,9)%, p < 0,001). При этом ни у больных ХОБЛ, ни среди лиц группы контроля экспрессия каналов TRP на лейкоцитах периферической крови не была достоверно взаимосвязана с показателями вентиляционной функции легких.
Обсуждение
В проведенном исследовании мы впервые представили комплексную характеристику экспрессии каналов TRP, наиболее релевантных для патогенеза ХОБЛ, на лейкоцитах периферической крови, в том числе на моноцитах, лимфоцитах и гранулоцитах. Выполненный нами сравнительный анализ позволил определить, что лейкоциты периферической крови лиц контрольной группы и больных ХОБЛ экспрессируют вариабельные количества катионных каналов TRPV1, TRPV4, TRPM8 и TRPA1. Мы установили, что каналы TRPV1 и TRPA1 экспрессировались более чем 90% клеток, что существенно выше значений, прежде определенных для альвеолярных макрофагов, в которых уровни экспрессии TRP каналов были существенно ниже (до 20–30% клеток) [6] .
Моноциты больных ХОБЛ отличались небольшим, но значимым увеличением экспрессии TRPV1 и TRPA1, при этом уровень TRPV4 и TRPM8 также был несколько увеличен, хотя различия с группой контроля не достигали статистической значимости. Мы не зафиксировали достоверных различий в экспрессии каналов TRP на лимфоцитах и гранулоцитах. Несмотря на это, было обнаружено, что моноциты и гранулоциты больных ХОБЛ характеризуются увеличенным соотношением экспрессии TRPV4 к TRPM8, что можно предварительно трактовать как признак провоспалительной активации клеток, учитывая прямую и обратную взаимосвязь экспрессии TRPV4 и TRPM8 соответственно с концентрациями цитокинов плазмы крови.
Основываясь на имеющихся сведениях, можно однозначно утверждать важную роль TRPV1 в патогенезе ХОБЛ. Ранее повышенная экспрессия данного канала была найдена на альвеолярных макрофагах [6], а также в тотальном гомогенате легких больных ХОБЛ и в эпителии дыхательных путей у больных бронхиальной астмой [7]. Экспериментальные данные указывают на стимулирующий эффект канала TRPV1 на различные лейкоциты. Установлено, что агонист TRPV1 капсаицин в дозах менее 125 мкМ увеличивал выброс IL-6 и TNF-α в клеточной линии моноцитов THP-1 под действием липополисахаридов. В то же время стимулированная фитогемагглютинином секреция IL-1β, TNF-α, MCP-1 и IL-6 снижалась в присутствии капсаицина. Однако данный эффект, по мнению авторов, может быть опосредован не TRPV1, а другими механизмами [8]. Ингибирование лимфоцитарных TRPV1 приводит к сниженной экспрессии маркеров CD25 и CD69 на T-клетках, стимулированных антителами к CD3 и СD28, что говорит о его участии в TCR-опосредованной активации. Кроме того, блокада TRPV1 снижает стимулированную продукцию цитокинов IL-2 и IFN-γ и TNF [9]. В нейтрофилах активация TRPV1 также обладает стимулирующим эффектом, поскольку увеличивает секрецию CXCL8 и продукцию АФК [10].
Аналогичное влияние на функциональную активность клеток было установлено и для канала TRPA1. В моноцитах активация TRPA1 увеличивала продукцию TNF-α, но снижала синтез IL-10, а фармакологическая блокада канала имела противоположный эффект [11] . Стимулирующий эффект TRPA1 был отмечен и на лимфоцитах. При этом нокаут TRPA1 сопровождался снижением продукции цитокинов IL-1β, IL-6, TNF-α, IL-17A, IL-22, RANTES [12] . Экспериментальные данные указывают на то, что TRPA1 может участвовать в активации нейтрофилов. Нокаут гена сопровождался снижением уровня нейтрофильной миелопероксидазы [13] .
Данные о функции TRPV4 на моноцитах немногочисленны и противоречивы. С одной стороны, показано, что активация канала сопровождается фосфорилированием и активацией eNOS [14] , с другой, – подавляет сигналинг NFkB, снижает продукцию IL-1β и блокирует дифференцировку в M1 макрофаги in vitro [15] . В нашем исследовании обращает на себя внимание прямая связь TRPV4 с измеренными концентрациями CXCL10 и IFN-γ, которая была характерна для всех субпопуляций лейкоцитов, что, вероятно, характеризует ассоциацию с Th1 воспалением. При этом ранее мы также установили, что среди прочих каналов TRP именно экспрессия TRPV4 на альвеолярных макрофагах демонстрировала прямую корреляцию с концентрацией ряда цитокинов мокроты, в том числе
CXCL10 и IFN-γ. Кроме того, апрегуляция TRPV4 на макрофагах служила отличительной чертой фенотипа ХОБЛ с быстрым прогрессированием бронхиальной обструкции [16] . Эффект TRPV4 на лимфоцитах, по-видимому, полностью аналогичен наблюдаемому для TRPV1 и заключается в активации клеток и продукции провоспалительных цитокинов [9] . Известно, что TRPV4 имеет активирующее влияние на нейтрофильные гранулоциты, опосредуя увеличение продукции АФК, а также способствуя адгезии и хемотаксису клеток [17] .
Наблюдаемые нами обратные корреляции уровня цитокинов с экспрессией TRPM8 in vivo находят экспериментальное подтверждение в работе E. Hornsby и соавт. [18] . Авторы отмечали, что блокирование TRPM8 на моноцитах in vitro увеличивает выживаемость клеток, повышает экспрессию CD14 и продукцию TNF-α в ответ на стимуляцию липополисахаридами, но нарушает дифференцировку моноцитов в макрофаги. Данные о роли TRPM8 на лимфоцитах противоречивы. В то время как некоторые исследователи сообщают об ингибирующем эффекте ментола на пролиферацию клеток, продукцию IFN-γ и экспрессию факторов транскрипции T-bet и FOXP3 [19] , другими, напротив, было установлено стимулирующее влияние TRPM8 на пролиферацию, экспрессию маркеров активации CD25 и CD69, а также продукцию TNF-α [20] . Возможно, различные результаты обусловлены выбором метода вспомогательной стимуляции T-клеток: ингибирующий эффект TRPM8 был обнаружен на фоне стимуляции фитогемагглютинином или форбол-12-миристат-13-ацетатом и кальциевым ионофором, тогда как активирующее влияние было выявлено при стимуляции T-клеточных рецепторов антителами к CD3 / CD28 или конкавалином А. В отличие от моноцитов и лимфоцитов экспрессия и функциональная роль TRPM8 на нейтрофильных гранулоцитах остаются неизученными.
Выводы
Полученные результаты свидетельствуют о повышенной экспрессии TRPV1 и TRPA1 на моноцитах периферической крови больных ХОБЛ, что согласуется с литературными данными, указывающими на их провоспалительную активность. В то же время, несмотря на выявленные различия, следует обратить внимание на близкие величины экспрессии данных каналов среди больных и здоровых лиц, что может говорить об их ограниченной патофизиологической роли.
При том, что экспрессия TRPV4 и TRPM8 не имела существенных особенностей при ХОБЛ, данные каналы демонстрировали наибольшие взаимосвязи с уровнями маркеров воспаления в плазме крови, при этом активность TRPV4, по-видимому, является провоспалительной, тогда как TRPM8 отличается ингибирующими эффектами на системный воспалительный процесс. Мы также установили, что для больных ХОБЛ характерно более высокое отношение величин экспрессии TRPV4 к TRPM8 на моноцитах и гранулоцитах по сравнению с лицами группы контроля.
В настоящем исследовании не удалось обнаружить взаимосвязей между экспрессией каналов TRP и степенью вентиляционных нарушений при ХОБЛ. С одной стороны, это может объясняться ограниченной ролью лейкоцитов периферической крови по сравнению с лейкоцитами, персистирующими в респираторном тракте, в формировании бронхиальной обструкции. С другой стороны, более перспективным может оказаться поиск взаимосвязей экспрессии TRP с показателями бодиплетизмографии как более информативного метода, учитывающего степень гиперинфляции легких, либо оценка влияния уровней экспрессии на долгосрочную динамику нарушений вентиляционной функции легких.
Учитывая важную роль оксидативного стресса в патогенезе ХОБЛ, а также потенциальную способность некоторых TRP каналов зацикливать процесс генерации АФК, полученные результаты вносят вклад в формирование новых представлений о возможных молекулярных механизмах, поддерживающих перекисное окисление, воспалительную реакцию и способствующих прогрессированию заболевания.
Таким образом, таргетная модуляция активности каналов TRP на моноцитах может оказаться новым перспективным подходом к патогенетической терапии ХОБЛ, эффективно дополняя существующие методы лечения с использованием ингаляционных бронхолитиков и глюкокортикоидов. Дальнейший прогресс в данном направлении может быть обеспечен изучением особенностей функционирования TRP каналов в условиях патологии, учитывая разрозненность и противоречивость имеющихся данных. Предстоит получить всеобъемлющую характеристику функциональной активности данных рецепторов in vitro и in vivo , в том числе с помощью транскриптомного и протеомного анализов.
Список литературы Экспрессия каналов с транзиторным рецепторным потенциалом (TRP) на лейкоцитах периферической крови больных хронической обструктивной болезнью легких
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease report; 2023. URL: https://goldcopd.org/2023-gold-report-2 (20.09.2023).
- Концевая А.В., Муканеева Д.К., Баланова Ю.А., Худяков М.Б., Драпкина О.М. Экономический ущерб от болезней органов дыхания и хронической обструктивной болезни легких в Российской Федерации в 2016 году. Пульмонология. 2019;29(2):159-166. https://doi.org/10.18093/0869-0189-2019-29-2-159-166.
- Huang C., Kuo S., Lin L., Yang Y. The efficacy of N-acetylcysteine in chronic obstructive pulmonary disease patients: a meta-analysis. Ther. Adv. Respir. Dis. 2023;17:17534666231158563. https://doi.org/10.1177/17534666231158563.
- Sakaguchi R., Mori Y. Transient receptor potential (TRP) channels: Biosensors for redox environmental stimuli and cellular status. Free Radic. Biol. Med. 2020;146:36-44. https://doi.org/10.1016/j.freeradbiomed.2019.10.415.
- Milici A., Talavera K. TRP Channels as Cellular Targets of Particulate Matter. Int. J. Mol. Sci. 2021;22(5):2783. https://doi.org/10.3390/ijms22052783.
- Наумов Д.Е., Сугайло И.Ю., Котова О.О., Гассан Д.А., Горчакова Я.Г., Мальцева Т.А. Сравнительная характеристика уровней экспрессии TRP каналов на макрофагах больных хронической обструктивной болезнью легких. Бюллетень физиологии и патологии дыхания. 2022;(85):37-46. https://doi.org/10.36604/1998-5029-2022-85-37-46.
- Kim J.H. The emerging role of TRPV1 in airway inflammation. Allergy Asthma Immunol. Res. 2018;10(3):187-188. https://doi.org/10.4168/aair.2018.10.3.187.
- Kunde D.A., Yingchoncharoen J., Jurković S., Geraghty D.P. TRPV1 mediates capsaicin-stimulated metabolic activity but not cell death or inhibition of interleukin-1β release in human THP-1 monocytes. Toxicol. Appl. Pharmacol. 2018;360:9-17. https://doi.org/10.1016/j.taap.2018.09.025.
- Majhi R.K., Sahoo S.S., Yadav M., Pratheek B.M., Chattopadhyay S., Goswami C. Functional expression of TRPV channels in T-cells and their implications in immune regulation. FEBS J. 2015;282(14):2661-2681. https://doi.org/10.1111/febs.13306.
- Andersen G., Kahlenberg K., Krautwurst D., Somoza V. [6]-Gingerol facilitates CXCL8 secretion and ROS production in primary human neutrophils by targeting the TRPV1 channel. Mol. Nutr. Food Res. 2023;67(4):e2200434. https://doi.org/10.1002/mnfr.202200434.
- Billeter A.T., Galbraith N., Walker S., Lawson C., Gardner S.A., Sarojini H. et al. TRPA1 mediates the effects of hypothermia on the monocyte inflammatory response. Surgery. 2015;158(3):646-654. https://doi.org/10.1016/j.surg.2015.03.065.
- Sahoo S.S., Majhi R.K., Tiwari A., Acharya T., Kumar P.S., Saha S. et al. Transient receptor potential ankyrin1 channel is endogenously expressed in T cells and is involved in immune functions. Biosci. Rep. 2019;39(9):BSR20191437. https://doi.org/10.1042/BSR20191437.
- Horváth Á., Tékus V., Boros M., Pozsgai G., Botz B., Borbély É. et al. Transient receptor potential ankyrin 1 (TRPA1) receptor is involved in chronic arthritis: in vivo study using TRPA1-deficient mice. Arthritis Res. Ther. 2016;18:6. https://doi.org/10.1186/s13075-015-0904-y.
- Xu S., Liu B., Yin M., Koroleva M., Mastrangelo M., Ture S. et al. A novel TRPV4-specific agonist inhibits monocyte adhesion and atherosclerosis. Oncotarget. 2016;7(25):37622-37635. https://doi.org/10.18632/oncotarget.9376.
- Atsumi Y., Toriyama M., Kato H., Nakamura M., Morita A., Takaishi M. et al. Anti-inflammatory role of TRPV4 in human macrophages. Immunohorizons. 2023;7(1):81-96. https://doi.org/10.4049/immunohorizons.2200100.
- Наумов Д.Е., Сугайло И.Ю., Гассан Д.А., Котова О.О., Горчакова Я.Г., Шелудько Е.Г. Особенности экспрессии TRP каналов и цитокиновый профиль мокроты у больных хронической обструктивной болезнью легких с прогрессирующей бронхиальной обструкцией. Бюллетень физиологии и патологии дыхания. 2022;1(86):24-32. https://doi.org/10.36604/1998-5029-2022-86-24-32.
- Najder K., Musset B., Lindemann O., Bulk E., Schwab A., Fels B. The function of TRP channels in neutrophil granulocytes. Pflugers Arch. 2018;470(7):1017-1033. https://doi.org/10.1007/s00424-018-2146-8.
- Hornsby E., King H.W., Peiris M., Buccafusca R., Lee W.J., Wing E.S. et al. The cation channel TRPM8 influences the differentiation and function of human monocytes. J. Leukoc. Biol. 2022;112(3):365-381. https://doi.org/10.1002/JLB.1HI0421-181R.
- Bayat M., Kalantar K., Amirghofran Z. Inhibition of interferon-γ production and T-bet expression by menthol treatment of human peripheral blood mononuclear cells. Immunopharmacol. Immunotoxicol. 2019;41(2):267-276. https://doi.org/10.1080/08923973.2019.1588294.
- Acharya T.K., Tiwari A., Majhi R.K., Goswami C. TRPM8 channel augments T-cell activation and proliferation. Cell. Biol. Int. 2021;45(1):198-210. https://doi.org/10.1002/cbin.11483.


