Экспрессия Oct-4, p53, p16 и Ki67 при ВПЧ-ассоциированном предраке и раке шейки матки
Автор: Коган Евгения Александровна, Ли Дьзя Дзинь, Файзулина Нафиса Мануваровна, Козаченко Андрей Владимирович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (25), 2016 года.
Бесплатный доступ
При патологии шейки матки на фоне ВПЧ инфекции обнаруживается три вида сфероидных эпителиально-мезенхимальных структур: репаративные, неопластические и раковые, участвующие в репаративных процессах и в опухолевом росте. Раковые сфероиды, отличаются от неопластических не только более крупными размерами, но и тенденцией к слиянию, а также высокой экспрессией p53. Экспрессия онкомаркеров p53, p16 и Ki-67 может быть использована в ранней дифференциальной диагностике предрака и плоскоклеточного рака шейки матки.
Рак шейки матки, впч
Короткий адрес: https://sciup.org/14338545
IDR: 14338545
Текст научной статьи Экспрессия Oct-4, p53, p16 и Ki67 при ВПЧ-ассоциированном предраке и раке шейки матки
Рак шейки матки (РШМ) является наиболее распространенной формой онкологической патологии репродуктивной системы женщин, занимающей 7-е место среди всех злокачественных опухолей и 3-е место среди карцином [1].
Вирус папилломы человека (ВПЧ) в настоящее время признается в качестве этиологического фактора этого новообразования и обнаруживается в 98% случаев РШМ [2].
Согласно современной концепции канцерогенеза полагают, что опухоль обычно возникает в зонах активных регенераторных процессов, в области ниш стволовых клеток (НСК) из трансформированных тканевых стволовых клеток или путем перепрограммирования трансформированных клеток очагов предраковых изменений [3, 4, 5]. В шейке матки НСК соответствует зоне трансформации [6]. Остается открытым вопрос о роли стволовой тканевой и стволовой раковой клетки в канцерогенезе рака шейки матки.
Полагают, что мутантный ген-супрессор рака p53 играет важную роль в развитии плоскоклеточного рака шейки матки и может использоваться для его диагностики [7, 8].Кроме того, онкобелок E6 ВПЧ связывается с диким типом p53 и инактивирует его [9]. В результате чего, клетки с поврежденным геномом не отправляются в апоптоз, сохраняются, дают потомство, что ведет к накоплению мутаций в клетках и их злокачественной трансформации [10, 11].
Ранее нами были описаны сфероидные эпителиально-мезенхимальные структуры (СЭМС), обнаруживаемые в пласте плоского эпителия по экспрессии маркера эмбриональных стволовых клеток Oct-4 при ВПЧ-ассоциированной патологии шейки матки, включая предрак и плоскоклеточный рак [12]. Как было установлено, СЭМС формируются в зоне НСК, при этом их клетки обладают пролиферативной активностью. Часть сфероидов не имеют признаков клеточного ати-пизма, экспрессируют только Ki-67, не содержат р16 и были названы нами репаративными сфероидами [12], в то время как другие построены из атипичных клеток и экспрессируют и Ki-67 и p16, за что получили название опухолевых сфероидов [12]. Данные об экспрессии р53 в СЭМС в доступной литературе отсутствуют.
Целью исследования явилось
изучение экспрессии p53, Oct-4, p16 и Ki-67, в репаративных и опухолевых сфероидах при ВПЧ-ассоциированной патологии шейки матки: хронический цервицит, цервикальная интраэпителиальная неоплазия < II степень (ЦИН
Материалы и методы исследования
Проведено клинико-морфологическое и иммуногистохимическое исследование биопсийного материала, полученного от 61 пациентки репродуктивного возраста, проходивших обследование и лечение в ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава РФ за 20132015 год. Обследованные женщины были в возрасте от 17 до 56 лет (средний возраст 36,5 лет). Всем женщинам проводили ВПЧ-тестирование цервикального содержимого, полученного при заборе цитологического материала, на приборе Cobas 4800 методом ПЦР-НВ, представляющем собой полностью автоматизированную систему, выдающую результат по трем отдельным каналам: индивидуально ДНК ВПЧ16, ДНК ВПЧ18 и общий пул ДНК других 12 высокоонкогенных генотипов ВПЧ (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68) [13, 14]. Во всех образцах получили положительные результаты, причем ДНК ВПЧ 16 типа обнаружена в 19 случаях (31,15%), ДНК ВПЧ 18 типа – в 4 случаях (6,55%), ДНК ВПЧ других 12 высокоонкогенных типов – в 38 случаях (62,30%). Все женщины были разделены на 4 группы в зависимости от патологического процесса в шейке матки: хронический цервицит (15), ЦИН Результаты и их обсуждение При гистологическом исследовании биоп-татов шейки матки морфологический диагноз хронического ВПЧ-ассоциированного церви-цита ставился при обнаружении лимфогисти-оцитарной инфильтрации подслизистого слоя, лейкопедеза в эпителиальном пласте, явлении акантоза, очаговой плоскоклеточной метаплазии и койлоцитоза. При ЦИН < II и ЦИН ≥ II, также выявлялись признаки хронического воспаления с кой-лоцитозом в сочетании с появлением атипичных клеток, распространяющихся не более чем на 1/3 толщины плоского эпителия при ЦИН < II и более 2/3 толщины эпителия при ЦИН ≥ II. Микроинвазивный плоскоклеточный рак отличался наличием разрушения базальной мембраны с микроинвазией раковых клеток в подслизистый слой на глубину менее 3 мм. СЭМС идентифицированы при использовании имуногистохимической реакции на Oct-4, который экспрессируется во всех клетках сфероидов. В среднем данный маркер определяется в эпителии шейки матки при хроническом цервиците в 13.5% клеток, при ЦИН < II в 33.5% клетках, при ЦИН ≥ II в 43.75% клеток и при микроинвазивном раке в 48.5% клеток. При гистологическом исследовании выявляли 3 типа СЭМС: 1тип – небольших размеров, построенные из крупных эпителиальных клеток типа базальных, в центре, как правило, можно быть увидеть кровеносный сосуд; 2 тип – более крупных размеров, построенные из клеток с признаком атипизма, часто не имеющие сосудов; 3 тип – крупные и сливающиеся между собой, образованные резко атипичными раковыми клетками. При хроническом цервиците обнаруживались СЭМС 1 типа, при ЦИН < II – преобладали СЭМС 1 типа в сочетании с СЭМС 2 типа, при ЦИН ≥ II – СЭМС 2 типа, а при микроинвазивной карциноме – СЭМС 3 типа (в окружающей ткани с морфологией ЦИН При двойной окраске p16/Ki67 СЭМС 1 типа содержали клетки, экспрессирующие только Ki67, что наблюдалось при хроническом церви-ците. В СЭМС 2 типа клетки экспрессировали одновременно оба маркера. При этом одновременная экспрессия p16/Ki67 определялась в 7.5% клеток СЭМС при ЦИН p53 не обнаруживался в СЭМС 1 типа (Рис. 2 А, Б), выявлялся в 10% клеток СЭМС 2 типа (Рис. 2С) и в 70% клеток СЭМС 3 типа (Рис. 2Д.). В целом в эпителиальном пласте маркер не определялся при хроническом цервиците и при ЦИН Таким образом, на основании всех полученных данных и данных литературы [8, 12], было установлено, что процесс канцерогенеза в шейке матки связан с формированием СЭМС, которые могут быть разделены на 3 типа в соответствии с иммунофенотипом, участием в репаративных СЭМС процессах и опухолевом росте: репаративные, не экспрессирующие р16 и р53, неопластические, экспрессирующие р16 и р53 в единичных клетках, и раковые СЭМС с высокой экспрессией клетками р16 и р53. В результате проведенного исследования установлено, что высокая экспрессия р53 (70,0%) позволяет проводить дифференциальный диагноз между ЦИН≥II и микроинвазив-ным раком шейки матки, что совпадает с данными других авторов. Согласно работам Wang N. [8], Alan Storey [15], при злокачественной трансформации, экспрессия белка p53 увеличивается. Нами получены новые данные о том, что р53 положительные клетки сосредоточены в основном в СЭМС 2 типа (10%) и в большей степени в СЭМС 3 типа (70%), относящихся к раковым СЭМС. Последнее может быть косвенным подтверждением развития злокачественной трансформации в клетках с признаками стволо-вости, экспрессирующих Oct-4, р16 и Ki-67. Выводы 1. При патологии шейки матки на фоне ВПЧ инфекции обнаруживаются репаративные, неопластические и раковые СЭМС, участвующие в репаративных процессах и в опухолевом росте. 2. Репаративные СЭМС встречаются при хроническом цервиците и ЦИН Рис. 2. Экспрессия p53 в СЭМС при ВПЧ-ассоциированной патологии шейки матки, иммунопероксидазная реакция, Х600. A. Отсутствие экспрессии p53 в клетках репаративных СЭМС при хроническом ВПЧ-ассоциированном цервиците. B. Отсутствие экспрессии p53 в клетках репаративных СЭМС при ЦИН < II. C. Экспрессия p53 в единичных клетках неопластических СЭМС при ЦИН ≥ II. D. Экспрессия p53 в клетках раковых СЭМС при ВПЧ-ассоциированной микроинвазивной карциноме шейки матки. 3. Неопластические СЭМС встречаются при ЦИН < II, ЦИН ≥ II и в окружающей ткани при плоскоклеточном раке шейки матки, имеют большие размеры, формируются вне зависимости от сосудов, построены из эпителиаль- 4. Целесообразно выделять также и раковые СЭМС, отличающиеся от неопластических не только более крупными размерами, но и тенденцией к слиянию, а также высокой экспрессией p53. 5. Экспрессия онкомаркеров p53, p16 и Ki67 может быть использована в ранней дифференциальной диагностике предрака и плоскоклеточного рака шейки матки. фологические особенности: небольшие размеры, всегда формируются вокруг сосудов, построены из клеток типа базальных кератиноцитов, клеточный атипизм отсутствует, в клетках сфероидов имеется экспрессия Ki-67 при отсутствии экспрессии p16, отсутствует экспрессия p53.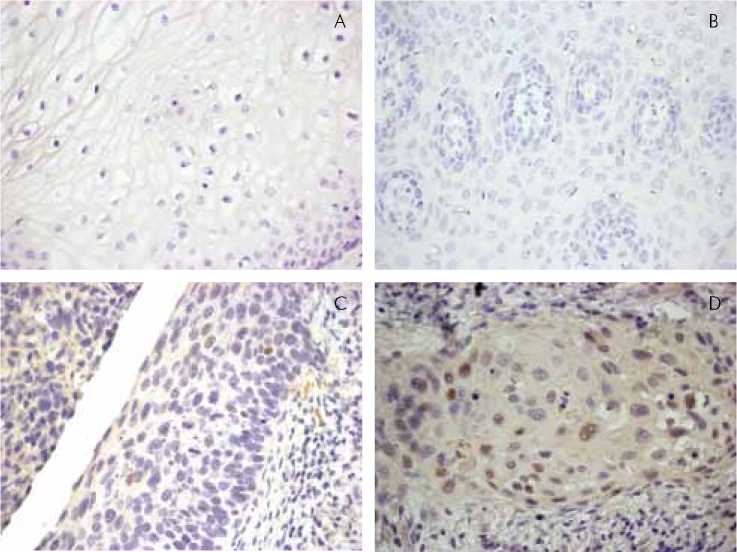
Список литературы Экспрессия Oct-4, p53, p16 и Ki67 при ВПЧ-ассоциированном предраке и раке шейки матки
- Новик В.И. Скрининг рака шейки матки. Практическая онкология, 2010, 11(2): 66-73.
- Jacobs MV, Snijders PJ, Voorhorst F J, et al. Reliable high risk HPV DNA testing by polymerase chain reaction: an intermethod and intramethod comparison. Journal of clinical pathology, 1999, 52(7): 498-503.
- Beachy PA, Karhadkar SS, Berman DM. Tissue repair and stem cell renewal in carcinogenesis. Nature, 2004, 432(7015): 324-31.
- Reya T, Morrison S J, Clarke MF, et al. Stem cells, cancer, and cancer stem cells. Nature, 2001, 414(6859): 105-111.
- Schlessinger D, Van Zant G. Does functional depletion of stem cells drive aging?. Mechanisms of ageing and development, 2001, 122(14): 1537-53.
- Crum CP. Contemporary theories of cervical carcinogenesis: the virus, the host, and the stem cell. Modern Pathology, 2000, 13(3): 243-51.
- Regezi J A, Zarbo R J, Regev E, et al. p53 protein expression in sequential biopsies of oral dysplasias and in situ carcinomas. Journal of oral pathology & medicine, 1995, 24(1): 18-22.
- Wang N, Yao Q, Li X, et al. Detection of HPV and p53 gene expressions in cervical cancer tissue. Medical Journal of Qilu, 2004, 20(2): 98-100,102.
- Scheffner M, Huibregtse JM, Vierstra RD, et al. The HPV-16 E6 and E6-AP complex functions as a ubiquitin-protein ligase in the ubiquitination of p53. Cell, 1993, 75(3): 495-505.
- Liu Y, He Y, Jin A, et al. Ribosomal protein-Mdm2-p53 pathway coordinates nutrient stress with lipid metabolism by regulating MCD and promoting fatty acid oxidation. Proceedings of the National Academy of Sciences, 2014, 111(23): E2414-E2422.
- Vousden KH, Ryan KM. p53 and metabolism. Nature Reviews Cancer, 2009, 9(10): 691-700.
- E.A. Kogan, PhD, ScD; N.M. Fayzullina, PhD; T.A. Demura, PhD; G.T. Sukhikh, PhD, ScD. Reparative Spheroids in HPV-Associated Chronic Cervicitis. Science Center of obstetrics, gynecology and perinatology n.a. acad. V.I. Kulakov Moscow, RF. International Journal of BioMedicine 2013; 3(3): 192-6.
- Castle P.E., Sadorra M., Lau T., et al. Evaluation of a prototype real-time PCR assay for carcinogenic human papilloma virus (HPV) detection and simultaneous HPV genotype 16 (HPV16) and HPV18 genotyping//J Clin Microbiol 2009; 47: 3344-47.
- Коган Е.А., Файзуллина Н.М., Ли Ц. и др. Эффективность диагностики цервикальной интраэпителиальной неоплазии шейки матки с использованием комплекса методов: жидкостной цитологии, двойного иммуноокрашивания p16/Ki67 и ВПЧ тестирования//Акушерство и гинекология. 2014. №7. С. 43-47.
- Storey A, Thomas M, Kalita A, et al. Role of a p53 polymorphism in the development of human papilloma-virus-associated cancer. Nature 1998; 393(6682): 229-34.


