Экспрессия раково-тестикулярных антигенов в клетках меланомы человека
Автор: Михайлова И.Н., Ковалевский Д.А., Бурова О.С., Голубева В.А., Морозова Л.Ф., Воронина Е.С., Утяшев И.А., Аллахвердян Г.С., Субраманиан С., Кондратьева Т.Т., Черемушкин Е.А., Киселев С.Л., Демидов Л.В., Барышников А.Ю., Бибилашвили Р.Ш.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (37), 2010 года.
Бесплатный доступ
По морфологическим и генетическим (транскриптомным) параметрам нами охарактеризована 21 клеточная линия диссеминированной меланомы кожи человека. Морфологические исследования позволили разделить полученные линии на 3 группы: высоко-, умеренно- и низкодифференцированную. ОТ-ПЦР анализом мРНК выявлено неоднородное распре- деление раково-тестикулярных маркеров. Проведенный корреляционный анализ показал взаимосвязь между увеличением экспрессии раково-тестикулярных маркеров и атипизмом раковой клетки. Полученные данные могут быть использованы для клинического прогноза заболевания и способствовать оптимизации лечения
Раково-тестикулярные антигены, дифференцировка клеток, меланома
Короткий адрес: https://sciup.org/14055590
IDR: 14055590 | УДК: 616-006.81-097:575.117
Текст научной статьи Экспрессия раково-тестикулярных антигенов в клетках меланомы человека
Опухолевая прогрессия определяется рядом факторов, которые формируют злокачественную клетку, к ним относятся самодостаточность в пролиферативных сигналах, пониженная чувствительность к ростингибирующим сигна- лам, отсутствие репликативного старения или приобретение бессмертия (иммортализация), ослабление индукции апоптоза, стимуляция неоангиогенеза, изменение подвижности и приобретение способности к инвазии и росту в другом микроокружении, изменение морфологии клеток, нарушение клеточной дифференцировки, генетическая нестабильность. Морфологически клетка становится атипичной, подвергаясь всевозможным изменениям в размере, форме и количестве ядер, соотношении между ядром, цитоплазмой и ядрышками. Иммуногеннотипически злокачественная клетка характеризуется экспрессией ряда антигенов: раково-тестикулярных (MAGE, BAGE и т.д.), дифференцировочных (дифференцировочные антигены для меланомы – тирозиназа, Melan-A/MART-1, gp100, TRP-1, TRP-2) [4], а также сниженной экспрессией антигенов гистосовместимости первого, второго класса [5]. Раково-тестикулярные антигены (РТА), которых идентифицировано более 44 семейств, состоят как из множественного количества изоформ белка (MAGEA, GAGE1 и т.д.), так и вариантов сплайсинга генов [6]. РТА кодируются генами, экспрессирующимися в герменногенных клетках, а также в опухолях различных типов. Высокий уровень РТА наблюдается при меланоме, раке мочевого пузыря, раке легкого, печени и ряде других онкологических заболеваний [3]. Некоторые авторы отмечают, что увеличение экспрессии РТА коррелирует с опухолевой прогрессией. Например, уровень экспрессии мРНК MAGE возрастает при метастатической меланоме, а экспрессия NY-ESO-1 при раке мочевого пузыря коррелирует с высоким ядерно-цитоплазматическим соотношением. Роль данных антигенов не совсем понятна. Хотя уже сейчас их функции связывают с гаметогенезом [7].
Цель работы заключалась в исследовании опухолевых клеточных линий, полученных от больных диссеминированной меланомой, для выявления корреляций между морфологическими и транскриптомными характеристиками культур, опосредованных злокачественностью клеток.
Для достижения поставленной цели необходимо было решить следующие задачи: провести морфологический анализ полученных ранее культур [1]; дополнить его кариологическими признаками (различиями), такими как соотносительная оценка размера ядер, характер их окраски, состояние хроматина и кариотипиче- ский анализ (число хромосом, симметричные транслокации в длинных хромосомах, наличие или отсутствие идентичных перестроенных хромосом в разных метафазах, нестабильные хромосомные аберрации); составить карты экспрессии раково-тестикулярных антигенов методом полимеразной цепной реакции, совмещенной с обратной транскрипцией в клеточных линиях, и выявить группы РТА методом кластерного анализа.
Материал и методы
Культивирование опухолевых клеток. Клеточные линии, полученные ранее [1], культивировали в среде RPMI 1640, содержащей 15 % ТЭС, 2 мМ L-глутамин, 1 % HEPES, пенициллин (10 ед/мл), стрептомицин (100 мкг/мл) и комплекс аминокислот и витаминов (Flow, Virginia, USA) в культуральных флаконах (Costar, Coring, USA).
Реакция поверхностной иммунофлуоресценции. 5х105 клеток инкубировали с 20 мкл моноклональных антител (МКА) в течение 30 мин при комнатной температуре, после чего 10 мин отмывали в 1 мл PBS при 1500 об/мин. К осадку клеток добавляли 20 мкл вторичных антител, конъюгированных с флюоресциин изо-тиоционатом (FITC), и инкубировали в течение 30 мин при 4 ° С. После этого клетки дважды отмывали в 1 мл PBS в тех же условиях, осадок клеток ресуспендировали в 200 мкл 1 % раствора формалина и анализировали на проточном цитометре FACSCalibur (Beckton Dickinson, USA). Первичные и вторичные МКА, использованные в работе, были получены в Институте клинической онкологии РОНЦ им. Н.Н. Блохина РАМН: ICO-218 (HMW – меланомодиффе-ренцировочный антиген) и F(ab)2 фрагменты иммуноглобулинов, конъюгированных с FITC. Использовали реактивы для буферов и фиксаторов компании ХимМед Москва, Россия).
Иммуноцитохимическое исследование. Фиксация материала. Из полученных клеточных линий готовили цитопрепараты – осаждением суспензии клеток на цитоцентрифуге Universal 16A (Hettich, Germany), просушивали на воздухе, хранили при –20ºС. Для проведения реакции стекла прогревали до комнатной температуры, фиксировали 1–2 мин в охлажденном (–20ºС)
ацетоне (ХимМед, Москва, Россия). Процедура окрашивания. Фиксированные цитопрепараты промывали в PBS 5 мин. Блокировали эндогенную пероксидазу 3 % раствором перекиси водорода (ХимМед, Москва, Россия) в течение 20 мин, образцы промывали в двух сменах PBS 10 мин. Затем инкубировали с 1 % раствором бычьего сывороточного альбумина (БСА) (Sigma, St. Louis, USA) 20 мин при комнатной температуре, после этого избыток раствора удаляли и, не промывая образцы, наносили первичные антитела, инкубировали в течение ночи на холоде (+4ºС). Образцы промывали в трех сменах PBS. Для визуализации реакции применяли систему LSAB+Detection System (Dako, USA) согласно инструкции. Выявление ферментативной активности проводили с помощью AEC (3-amino-9-ethylcarbazole containing hydrogen peroxide, stabilizers, enhancers, and anti-microbial agent) (Dako, USA), докрашивали гематоксилином (Serva, Germany). Подсчет проводили в областях с максимальным окрашиванием на 200–300 опухолевых клеток, используя микроскоп «Axiolab» (ZEISS, Germany). Для иммуноцитохимического исследования использовали следующие МКА (Novocastra Laboratories, UK): MelanA/МART-1 (маркер дифференцировки меланоцитов клон А103, в рабочем разведении 1:25), HMB45 (маркер дифференцировки меланоцитов, используется для идентификации меланоцитных опухолей, клон HMB45, в рабочем разведении 1:60), Tyrosinase (маркер дифференцировки меланоцитов, определяет биосинтез меланина, клон Т311, в рабочем разведении 1:50). Для цитологического анализа клетки меланомных линий выращивали в ростовой среде на предметных стеклах, помещенных в чашках Петри. Мазки окрашивали по методу Лейшмана.
Методика приготовления цитогенетических препаратов. Для приготовления препаратов для кариотипического анализа клетки обрабатывали колхицином в конечной концентрации 0,5 мкг/мл, вводя его в культуральные флаконы за 1,5 ч до начала фиксации. Использовались реактивы фирмы Sigma-Aldrich (St. Louis, USA). Затем клетки снимали со стенки флакона с помощью раствора Версена и 0,25 % раствора трипсина. Для отмывания от трипсина добавляли среду DMEM (5 мл), полученную су- спензию клеток центрифугировали (10 мин при 1000 об/мин), надосадочную жидкость сливали. Гипотонию проводили 0,55 % раствором KCl (12 мин при 37ºС), перед центрифугированием добавляли 3–5 капель фиксатора. Фиксация проводилась смесью метилового спирта и ледяной уксусной кислоты (в соотношении 3:1) стандартным способом, с использованием 3 смен фиксатора. Клеточные суспензии раскапывали на охлажденные влажные стекла. Высушенные препараты окрашивали по методу G-окраски.
Полимеразная цепная реакция, совмещенная с обратной транскрипцией. Суммарную РНК из культур опухолевых клеток меланомы выделяли методом с применением кислого фенола, гуанидина тиоционата (NH2C(=NH) NH2 × HSCN) и аммония тиоционата (NH4SCN) в соответствии с рекомендациями фирмы (Protocol № PT3231-1, CLONTECH, Mountain View, USA). Использованы реактивы фирмы Sigma-Aldrich (St. Louis, USA). Для выделения суммарной РНК использовали 1×106 опухолевых адгезивных клеток или такое же количество суспензионных клеток (Mel min – 15). Опухолевые клетки разрушали добавлением денатурирующего буфера непосредственно в культуральном флаконе с клетками, но без культуральной среды, или добавлением к осадку, полученному после центрифугирования, суспензионных клеток. РНК из гомогената экстрагировали последовательным добавлением кислого фенола (pH 4,0) и хлороформа и изопропанолом. Описанную процедуру выполняли дважды. Последовательности нуклеотидов ген-специфических праймеров (табл. 1) были выбраны при помощи программы Oli99 фирмы «Техноген» (Москва, Россия) и синтезированы на фирме «Синтол» (Москва, Россия). Последовательность мРНК была получена из баз данных UniGene entrez/ и AceView Национального центра для биотехнологической информации (Bethesda,USA, ncbi. . Определение степени гомологии нуклеотидных последовательностей полученных ампликонов против геномной и мРНК последовательностей проводили при помощи программы BLAST на сервере
Таблица 1
|
Семейство генов |
Название ампликона |
Символ гена (HGNC)*** |
мРНК**** |
F R* |
Последовательность нуклеотидов (5' – >3') |
Размер ампликона |
Кластер генов** |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
РТА |
Антигены (раково-тестикулярные), кодируемые этими генами, узнаются аутологичными цитотоксическими лейкоцитами. Экспрессируются в разнообразных опухолях, но не в нормальных тканях, за исключением тестикул, плаценты и незрелых (бластных) клеток различной природы. |
||||||
|
MAGE-B1 |
MAGEB1 |
NM_002363.3 |
F |
TAAGTTCATCACCCAAGATCTGGTGC |
346 |
G1a |
|
|
R |
AACAAAGTGAACAATCTGCCTGAGTTC |
||||||
|
MAGE-B2 |
MAGEB2 |
NM_002364.3 |
F |
CAGTGTTGTCTTTGGCCTTGAGCTG |
217 |
G1a |
|
|
R |
GACTCCCAACATATTCAGGAATTCCC |
||||||
|
MAGE-A4 |
MAGEA4 |
NM_002362.3 |
F |
TTCCTGTGATCTTCGGCAAAGCCTC |
204 |
G1b |
|
|
R |
TGTCGCCCTCCATTGCAATTGTGC |
||||||
|
GAGE-1-8 |
GAGE1, GAGE2, GAGE4, GAGE5, GAGE6, GAGE7, GAGE8 |
NM_001468.1 |
F |
GGCCTAGACCAAGACGCTACGTAG |
212 |
G1b |
|
|
R |
GTGACCCTGTTCCTGGCTATCAGC |
||||||
|
GAGE3 |
GAGE3 |
U19144 |
F |
AGATGAGTTGGCGAGGAAGA |
223 |
G1b |
|
|
R |
TTCCCCTTCTTCAGGTGTTG |
||||||
|
GAGE-4-7 |
GAGE4, GAGE5, GAGE6, GAGE7 |
NM_002045 |
F |
GGCCTAGACCAAGGCGCTATGTAC |
212 |
G1b |
|
|
R |
GTGACCCTGTTCCTGGCTATCAGC |
||||||
|
MAGE-A1 |
MAGEA1 |
NM_004988.3 |
F |
GGGCCAAGCACCTCTTGTATCCTG |
212 |
G1c |
|
|
R |
ATGCCAAAGACCAGCTGCAAGGAC |
||||||
|
MAGE-A10 |
MAGEA10 |
NM_021048.3 |
F |
GTTTAGTGAAGCCTCCGAGTGCATG |
192 |
G1c |
|
|
R |
TAGCCCTCTATGAAGATTATGCTTAGG |
||||||
|
MAGE-C1 |
MAGEC1 |
NM_005462.2 |
F |
AGTGGACCCTGATGACTCCTATGTC |
271 |
G1c |
|
|
R |
CCGGTACTCTAGGTAATGTTCCTGC |
||||||
|
BAGE |
BAGE |
NM_001187 |
F |
GCCAATTTAGGGTCTCCGGTATCTC |
211 |
G1c |
|
|
R |
TCTGGCCGCCATCTTACTGCTCC |
||||||
|
MG-A3 |
MAGEA2, MAGEA3, MAGEA6, MAGEA12 |
NM_005362.3 |
F |
CCCACTACCATGAACTACCCTCTC |
223 |
G2a |
|
|
R |
AATACTGCCAATTTCCGACGACACTC |
||||||
|
MG-A2 |
MAGEA2, MAGEA3, MAGEA6, MAGEA12 |
NM_175743.1 |
F |
TCCAAGGGCCCTCATTGAAACCAG |
233 |
G2a |
|
|
R |
GGAATGGGCCTCATATCACACGAG |
||||||
|
MG-A6 |
MAGEA2, MAGEA3, MAGEA6, MAGEA12 |
NM_005363.2 |
F |
TCCAAGGGCCCTCATTGAAACCAG |
233 |
G2a |
|
|
R |
GAATGGGCCTCACGTCACAGGAG |
||||||
|
MG_ A12-236 |
MAGEA2, MAGEA3, MAGEA6, MAGEA12 |
NM_005367.3 |
F |
GAAATGCTGGGGAGTGTCAT |
197 |
G2a |
|
|
R |
GTCTTGGGCACGATCTGATT |
||||||
|
CTAG1 |
Меланоцитный дифференцирующий антиген. Белки этих генов являются специфичными для опухолей и узнаются аутологичными цитотоксичными Т-лимфоцитами. (CTAG1) |
||||||
|
NY-ESO-1 |
CTAG1A, CTAG1B, CTAG2 |
NM_001327 |
F |
CTCCATCAGCTCCTGTCTCC |
209 |
G1c |
|
|
R |
CTCCTCCAGCGACAAACAAT |
||||||
Окончание табл. 1
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
ДАМ |
Дифференцировочные антигены меланомы. Компоненты меланосомы участвуют в меланогенезе. Незрелые меланосомы характерны для меланомы и фетальных клеток и распознаются моноклональными антителами HMB45. В зрелых меланосо-мах, преобладающих в меланоцитах, антиген gp100 (PMEL17) продукт гена SILV экранирован от HMB45 |
||||||
|
SILV |
SILV |
NM_006928 |
F |
GGGCCAATACTGGCAAGTTCTAGG |
375 |
G2c |
|
|
R |
AGGTAAGTATGAGTGACCACAAGTGC |
||||||
|
MLANA |
MLANA |
NM_005511.1 |
F |
GCTCATCGGCTGTTGGTATT |
190 |
G2c |
|
|
R |
ATAAGCAGGTGGAGCATTGG |
||||||
|
TYR |
TYR |
NM_000372.3 |
F |
AGCTTTCAGGCAGAGGTTCCTGTC |
290 |
G2c |
|
|
R |
GGTATGCTTTGCTAAAGTGAGGTAGG |
||||||
|
S100 |
Ca-связывающий белок из семейства S100. Белок вовлечен в регулирование развития клеточного цикла и дифференцировки. Маркер меланомы |
||||||
|
S100B |
S100B |
NM_006272.1 |
F |
AGCCCGCCATGGCCGTGTAGAC |
257 |
||
|
R |
CCAGCGCTGAGCGTTCACCTGG |
||||||
|
HLA |
Гены, кодирующие белки главного комплекса гистосовместимости |
||||||
|
HLA-E |
HLA-E, HLA-A, HLA-C, HLA-G |
NM_002127.3 |
F |
GTGACTCACCACCCCATCTC |
215 |
||
|
R |
TGGCACGTGTATCTCTGCTC |
||||||
|
HLA-G |
HLA-G |
NM_002127.3 |
F |
TATGAACAGTATGCCTACGATGGCAAG |
306 |
||
|
R |
TATGATCTCCGCAGGGTAGAAGCC |
||||||
|
ГДХ |
Ген «домашнего хозяйства». Ген глицеральдегидфосфодегидрогеназы |
||||||
|
G3PDH |
GAPDH |
NM_002046.3 |
F |
ACCACAGTCCATGCCATCAC |
452 |
||
|
R |
TCCACCACCCTGTTGCTGTA |
||||||
Примечание: * – F – прямой праймер, R – обратный праймер; ** – см. рис. 3; ***– приведены названия всех генов, хотя бы одна из альтернативных версий мРНК которых амплифицируется использованной парой праймеров; **** – описание каталожного номера мРНК: ,
Последовательность нуклеотидов ген-специфических праймеров
nlm.nih.gov/BLAST/ . Для гена глицеральдегид-3 фосфат дегидрогеназы использовались праймеры G3PDH 0.45 kb Control Amplimer Set фирмы CLONTECH (Mountain View, USA). Для реакции обратной транскрипции (ОТ) использовали обратную транскриптазу М-МLV и реактивы фирмы (Promega, Madison, USA). Объём пробы составлял 25 мкл. Сначала смешивали 1 мкг РНК с 25 пмолями смеси, случайных наномеров (Синтол, Москва, Россия) в 5 мкл воды. Смесь прогревали при 70oC 5 мин и охлаждали во льду. Затем добавляли 20 мкл смеси, содержащей 5x M-MLV буфер, 3 мкМ MgCl2 , смесь дезоксинуклеотидтрифосфатов в концентрации 0,2 мМ каждого, 200 ед. обратной транскриптазы. Реакционную смесь инкубировали при 37°C 60 мин. Реакцию останавливали прогреванием (95°C, 5 мин). Полученную одноцепочечную кДНК хранили при –20°C. Полимеразную цепную реакцию (ПЦР) проводили в программируемом термостате фирмы Hybaid, (Waltham, USA) . кДНК (1/100 часть) амплифицировали с 0,5 мкМ ген-специфических олигонуклеотидов и 2,0 ед. ДНК-полимеразы Thermus Aquaticus
(БиоМастер, Москва, Россия). Амплификацию проводили в 20 мкл смеси, содержащей 0,01М Трис-HCl (pH 8,5 при 25°C), 0,05 M KCl, 0,002 M MgCl2, 10 мкг/мл желатина, 200 мкМ каждого dNTP, 200 мкг/мл антител «TaqStart» (CLONTECH, Mountain View, USA). Для всех опытов ПЦР проводили по схеме: 94оС – 30 cек, 60оС – 60 cек, 72оС – 1 мин – 35 циклов. 72оС – 7 мин. Результаты анализировали электрофорезом 5 мкл реакционной смеси в 1,0 % или 1,5 % агарозном геле в TAE буфере с 0,002 % бромистого этидия. В качестве положительного контроля ОТ-ПЦР использовали ген GAPDH (относящийся к группе «генов домашнего хозяйства»). В качестве маркёра длин использовали GeneRuler™ 1kb DNA Ladder (Fermentas, Glen Burnie, USA, markers/. Специфичность выявляемого сигнала подтверждали отсутствием продукта амплификации ожидаемого размера в параллельных пробах, где на стадии обратной транскрипции фермент не добавлялся.
Фотографии гель-электрофореза продуктов ПЦР были оцифрованы при помощи программы
ImageQuant (Molecular Dynamics, Sunnyvale, USA) и результаты представлены в произвольных единицах. Иерархическое двухмерное кластерирование данных ОТ-ПЦР проводили при помощи программы Майкла Эйзена «Gene Cluster v3». Результаты визуализировали с помощью программы «Tree View» [2] .
Результаты и обсуждение
Проведено исследование клеточных линий, полученных от больных с диссеминированной меланомой [1]. Исследована экспрессия опухолевыми клетками четырех дифференци-ровочных антигенов меланомы (ДАМ) и 15 раково-тестикулярных генов (РТА), а также контрольные гены – HLA-G, HLA-E, GAPDH. На рис. 1 приведены электрофореграммы продуктов ОТ-ПЦР анализа ряда генов, по два представителя от каждой группы генов, выявленных с помощью кластерного анализа.
Изучение цитоморфологических особенностей меланомных клеток и определение степени дифференцировки были осуществлены для 16 из этих клеточных культур. Для этого определяли тип и размер клеток, форму и контур ядра, характер ядерной мембраны, строение хроматина и его окрашиваемость, наличие ядрышек, количество гигантских многоядерных клеток и долю клеток, находящихся в митозе. При цитологической верификации выделено 9 культур, состоящих из эпителиоподобных клеток (E), различного уровня дифференцировки, три культуры из невусоподобных клеток (N), одна культура из веретенообразных клеток (V) и три культуры смешанного клеточного состава.
При цитоморфологическом исследовании выделено три группы, классифицированные как высокодифференцированные (H), умереннодифференцированные (I) и низкодифференцированные (L) (табл. 2). Высокодифференцированные (H, 1) клеточные линии Mel min-12, Mel min-11 (рис. 2а) представлены относительно мономорфными клетками небольшого размера, с небольшим количеством гигантских многоядерных клеток; митозы практически отсутствуют. Модальное число хромосом в обеих клеточных линиях соответствовало околодиплоидному набору (46-49 хромосом в клетках культуры Mel min-11 и 47-50 хромосом в Mel min-12). Общее число хромосомных повреждений на 1 клетку составило в одной культуре 4, а во второй – 5. Умереннодифференцированные (I, 2 ) клеточные линии Mel min-9, Mel IL, Mel P, Mel min-10 (рис. 2б.) представлены полиморфными клетками: мелкими, средними и крупными; с интенсивно

Рис. 1. Электрофореграммы продуктов ОТ-ПЦР анализа генов.
ОТ-ПЦР анализ уровня транскрипции 22 генов в 6 клеточных линиях меланомы: Mel min-12, Mel min-10, Mel IL, Mel min-14, Mel min-1, Mel Ibr. Уровень экспрессии анализировался для генов: 1 – BAGE; 2 – GAGE2; 3 – GAGE3; 4 – GAGE4; 5 – HLA-E;
6 – MAGEA2; 7 – MAGEA4; 8 – MAGEA6; 9 – MAGEA10; 10 – MAGEA12; 11 – MAGEB1; 12 – MAGEB2; 13 – MAGEC1;
14 – MLANA; 15 – CTAG1B; 16 – TYR; 17 – SILV; 18 – S100B; 19 – MAGEA1; 20 – MAGEA3; 21 – HLA-G; 22 – GAPDH.
23 – контрольный ОТ-ПЦР без добавления праймеров – T – обратная транскрипция с ферментом, N – обратная транскрипция без фермента. M – маркёр длины ДНК, длины фрагментов даны в парах нуклеотидов
базофильной цитоплазмой, без четких контуров или с фестончатыми краями с эксцентрично или центрально расположенными ядрами с грубоглыбчатым гиперхромным хроматином и одним, редко двумя-тремя ядрышками. Гигантские многоядерные клетки немногочисленны; умеренное количество клеток в митозе. Число хромосомных аномалий в культурах было от 5 до 8 на 1 клетку.
Низкодифференцированные (L, 3) клеточные линии (Mel Kor, Mel min-2, Mel min-1, Mel min-3, Mel min-4, Mel Ibr, Mel min-5, Mel min-6, Mel min-7, Mel min-8) представлены резкополиморфными клетками, с множеством гигантских уродливых клеток и ядер. Выявлено большое количество округлых, овальных, удлиненных, неправильных ядер с неровными контурами. Хроматин грубоглыбчатый, ядерная оболочка утолщена и неровная; ядрышки в количестве от одного до шести в ядре; выраженная гипер-хромия. Отмечены атипичные многочисленные митозы. В пяти культурах модальное число хромосом соответствовало триплоидному набору, в двух – тетраплоидному и две были околодиплоидными. Число хромосомных аномалий во всех низкодифференцированных культурах было больше 5 на 1 клетку, в частности, в диплоидной культуре Mel min-2 оно достигло 11. Обнаружен также высокий уровень нестабильных хромосомных аберраций: хроматидные обмены, ди- и трицентрические хромосомы, кольцевые хромосомы, клетки с множественными аберрациями. Среди крайне разнообразных числовых и структурных хромосомных нарушений (транслокации, делеции, дупликации, инверсии, кольцевые хромосомы, изохромосомы, маркерные хромосомы) некоторые встречались с высоким постоянством, в том числе трисомия по хромосоме 7 или по ее короткому плечу, трисомия по короткому плечу хромосомы 6, моносомия по короткому плечу хромосомы 9, различные транслокации с участием хромосомы 1. Пример культуры клеток Mel min-5, состоящей приблизительно поровну из веретенообразных и эпителиальных клеток, показан на рис. 2в.
Исследования экспрессии генов РТА и ДАМ и последующий двумерный иерархический кластерный анализ данных ОТ-ПЦР позволили
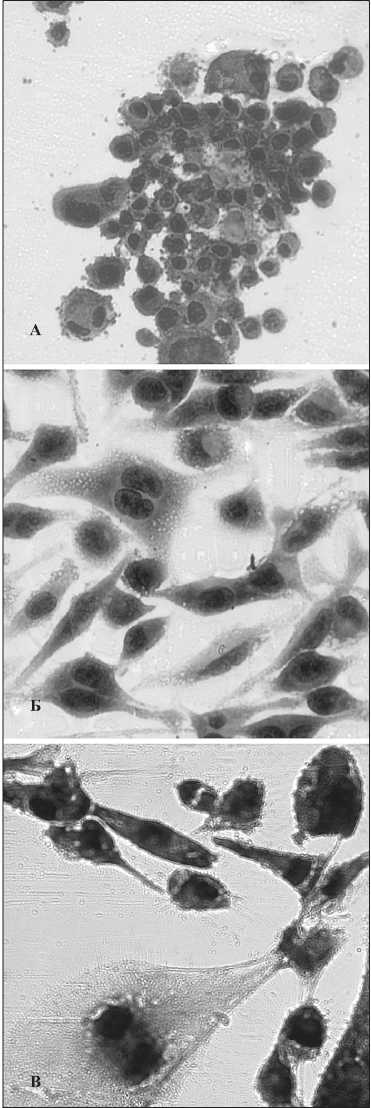
Рис. 2. Морфологические типы культур меланомы:
а) высокодифференцированная клеточная линия Mel min-11, х400;
б) умереннодифференцированная клеточная линия Mel IL, х400;
в) низкодифференцированная клеточная линия Mel min-5, х400
Таблица 2
Морфогенетическая характеристика клеточных линий метастатической меланомы человека
|
Степень дифференцировки опухолевых клеток |
Число линий |
Имя линии |
Тип* линии |
F* |
№ кластера |
Экспрессия генов кластера. Среднее по кластеру ** |
|||||
|
G1a |
G1b |
G1c |
G2a |
G2c |
|||||||
|
Высокодифференцированные |
2 |
Mel min-11 |
H |
1 |
E |
1 |
70 |
37 |
59 |
185 |
1590 |
|
Mel min-12 |
H |
1 |
V,E |
1 |
55 |
24 |
35 |
19 |
1374 |
||
|
Умереннодиффференциро-ванные |
4 |
Mel min-10 |
I |
2 |
E |
2 |
115 |
606 |
163 |
468 |
64 |
|
Mel IL |
I |
2 |
V |
3 |
76 |
447 |
53 |
881 |
1259 |
||
|
Mel P |
I |
2 |
E |
3 |
27 |
207 |
118 |
1429 |
1360 |
||
|
Mel min- 9 |
I |
2 |
N |
||||||||
|
Низкодифференцированные |
10 |
Mel min- 5 |
L |
3 |
V,E |
4 |
937 |
37 |
826 |
1459 |
689 |
|
Mel min- 8 |
L |
3 |
E |
4 |
99 |
1204 |
1328 |
1585 |
1427 |
||
|
Mel Kor |
L |
3 |
E |
5 |
48 |
306 |
1100 |
1078 |
947 |
||
|
Mel min- 1 |
L |
3 |
V |
5 |
16 |
1211 |
995 |
1569 |
1570 |
||
|
Mel min- 2 |
L |
3 |
E |
5 |
668 |
995 |
342 |
1201 |
1413 |
||
|
Mel min- 3 |
L |
3 |
E |
5 |
20 |
782 |
573 |
1300 |
1496 |
||
|
Mel Ibr |
L |
3 |
N |
6 |
511 |
940 |
1115 |
1397 |
123 |
||
|
Mel min- 4 |
L |
3 |
E |
6 |
56 |
686 |
1046 |
1196 |
55 |
||
|
Mel min- 6 |
L |
3 |
E |
6 |
22 |
605 |
583 |
1206 |
36 |
||
|
Mel min- 7 |
L |
3 |
E |
6 |
220 |
744 |
848 |
1595 |
50 |
||
|
Коэффициент корреляции по Спирману по отношению к морфологическому типу клеток |
Х |
№ кластера |
G1a |
G1b |
G1c |
G2a |
G2c |
||||
|
0.92 |
0.31 |
0.65 |
0.79 |
0.87 |
-0.34 |
||||||
|
Коэффициент корреляции по Пирсону по отношению к экспрессии ДАМ генов (G2c). |
|||||||||||
|
-0.19 |
-0.09 |
-0.25 |
-0.14 |
Х |
|||||||
Примечание: тип * – морфологический тип клеточных линий ранжирован в порядке убывания степени дифференцированности клеток, используя буквенный и цифровой коды: H=1 – мономорфные клетки; небольшое количество клеток в митозе; небольшое количество гигантских, многоядерных клеток; I=2 – клетки мелких, средних и крупных размеров; с интенсивно-базофильной цитоплазмой, без четких контуров или с фистончатыми краями с эксцентрично или центрально расположенными ядрами с грубоглыбчатым гиперхромным хроматином и одним, редко двумя-тремя ядрышками. Гигантские многоядерные клетки немногочисленны; умеренное количество клеток в митозе; L=3 – округлые, овальные, удлиненные, неправильные ядра с неровными контурами. Хроматин грубоглыбчатый, ядерная оболочка утолщена и неровная; ядрышки в количестве от одного до 6 в ядре; выраженная гиперхромия и много гигантских уродливых клеток и ядер. Отмечаются атипичные относительно многочисленные митозы. F* – форма основной части клеток линии: e – эпителиоподобная, v – веретенообразная, n – невусоподобная.
** – произвольные единицы (см. раздел «Материал и методы»)
выделить шесть групп клеточных линий (рис. 3). Культуры клеток, отнесенные к кластеру 1, являются высокодифференцированными, к кластерам 2 и 3 – умереннодифференцированными, тогда как к кластерам 4, 5 и 6 – низкодифференцированными. Сопоставление «морфологических» и «генетических» групп, представленных в табл. 2, указывает на отчетливую корреляцию между делением клеточных культур в соответствии с экспрессий РТА и ДАМ генов и классификацией культур по степени их дифференцировки. Коэффициент корреляции между морфологическими ранжироваными данными и кластерным ранжировнием экспрессионных данных составляет 0,92. Степень дифференцировки клеток, как графически отображено на
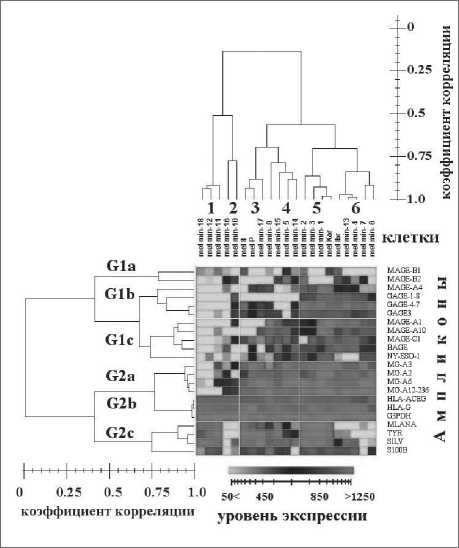
Рис. 3. Двумерный кластерный анализ экспрессии генов РТА и ДМА методом ОТ-ПЦР в культурах клеток меланомы.
Представлены результаты полносвязного кластерирования (по обоим направлениям) данных по экспрессии 22 генов в 21 культуре клеток, полученных от пациентов с диссеминированной меланомой. Кластерированию подвергался весь набор логарифмированных по основанию 2 данных ОТ-ПЦР, нормированных для каждой культуры на среднюю величину интенсивности полос ОТ-ПЦР генов HLA-G1, HLA-E и GAPDH для каждой клеточной линии. Никакой последующей центровки или нормировки данных не производилось. Для расчета меры несходства узлов дендрограмм использовалась корреляция по Спирману или эвклидово расстояние и коэффициент корреляции Пирсона, с одинаковым результатом.
Цветовая шкала, приведенная на двумерной кластерной картине и на врезке, соответствует исходной интенсивности полос на электрофореграммах, а не их логарифмированному преобразованию, использованному для расчета связности при кластерировании. Гены обозначены символами в соответствии с табл. 1, культуры клеток – с табл. 2. Шкалы коэффициентов корреляции генов (слева) и культур клеток (сверху) отвечают корреляции для узлов дерева. Для дендрограмм использованы коэффициенты корреляции по Пирсону.
При кластерировании для зондов генов с вырожденной специфичностью использованы весовые коэффициенты, обратно пропорциональные числу зондов, соответствующих их вырожденности: для GAGE-1-8 и GAGE-4-7 – 0,5; для MG-A3, MG-A2, MG-A6, MG-A12-236 – 0,25; HLA-G и HLA-A – 0,5. Дендрограмма культур клеток однозначно разбивает все клеточные линии на 6 групп, отсеченных по коэффициенту корреляции 0,75
рис. 3, падает слева направо, сопровождается ростом числа и степени экспрессии генов РТА. При этом форма клеток, эпителиальная, веретенообразная или невусоподобная, не коррелирует ни со степенью дифференцированности клеток, ни с экспрессией РТА (табл. 2.). Интересно отметить, что экспрессия ДАМ генов, в значительной степени изменяющаяся от кластера к кластеру (например, 1 и 2 или 5 и 6), не коррелирует ни со степенью дифференцировки клеток, ни с их формой, ни с активностью генов РТА.
Дендрограмма коэффициента корреляции групп генов (рис. 3, левая сторона) показывает распределение всех исследованных генов на 6 основных групп: G1a, G1b, G1c и G2a принадлежат раково-тестикулярным генам, G2b – генам главного комплекса гистосовместимости и генам домашнего хозяйства, а G2c – дифференцировоч-ным генам. Отдельного внимания заслуживают гены S100B, показывающие менее чем 75 % корреляцию с другими ДАМ генами, и ген CTAG1B (NY-ESO1), также отличающийся по экспрессии от ближайшего к нему семейства РТА генов (MAGEA1, MAGE-A10, MAGE-C1 & BAGE). Как видно из рис. 3, высокодифференцированные клетки практически не экспрессируют никаких РТА, крайне низка экспрессия РТА и в клеточных культурах 16 и 10, принадлежащих кластеру 2, полностью утративших активность генов ДАМ и отнесенных к группе умереннодифференцированных клеток. У этой группы клеточных культур, утратившей способность к синтезу мРНК генов ДАМ, наблюдается некоторая невысокая активность кластера генов G2a (ампликоны MG-A2, MG-A3, MG-A6 и MG-A12-236, отражающие экспрессию группы высокогомологичных генов MAGE-A2, MAGE-A3, MAGE-A6, MAGE-A12), но она все же заметна и проявляется систематически. В кластерах 3, 4, 5 и 6 активность этой группы генов очень велика (рис.3). Активность группы генов G1b и G1c систематически проявляется только в низкодифференцированных культурах. Тогда как активность генов MAGE-B1 и MAGE-B2, принадлежащих группе G1а, проявляется только спорадически во всех клеточных линиях. Корреляции между морфологическими данными и уровнем экспрессии генов всех обсуждаемых групп генов суммированы в табл. 2. Видно, что активность генов в группах G1а и
Таблица 3
Корреляция между экспрессией генов, определенной ОТ-ПЦР и иммунологически
|
Экспрессия антигенов |
Экспрессия ДАМ генов** |
Усредненная по кластерам экспрессия генов** |
||||||||||||||
|
Имя линии |
s о s у s s о 4 о G в f |
У g * P< S P G s |
1 |
(L> O ё |
■5? к |
Рн tzi U | К |
< z 2 |
ей > н |
5 GO |
О GO |
PU сЗ и |
о |
рц о |
рц сЗ О1 о |
S 1 О |
|
|
Mel min-18 |
1 |
1534 |
1093 |
1800 |
86 |
60 |
27 |
23 |
40 |
1476 |
||||||
|
Mel min-12 |
H |
1 |
1 |
1 |
0 |
1 |
10.5 |
1305 |
1333 |
1483 |
971 |
55 |
24 |
35 |
19 |
1374 |
|
Mel min-11 |
H |
1 |
1 |
0 |
1 |
1 |
62.0 |
1548 |
1705 |
1516 |
921 |
70 |
37 |
59 |
185 |
1590 |
|
Mel min-16 |
2 |
55 |
27 |
39 |
36 |
227 |
45 |
74 |
285 |
40 |
||||||
|
Mel min-10 |
I |
2 |
2 |
0 |
0 |
0 |
11.7 |
20 |
16 |
156 |
101 |
115 |
606 |
163 |
468 |
64 |
|
Mel Il |
I |
2 |
3 |
1 |
1 |
1 |
46.9 |
1150 |
1374 |
1255 |
556 |
76 |
447 |
53 |
881 |
1259 |
|
Mel P |
I |
2 |
3 |
0 |
0 |
1 |
89.5 |
1121 |
1537 |
1421 |
925 |
27 |
207 |
118 |
1429 |
1360 |
|
Mel min- 9 |
I |
2 |
1 |
0 |
1 |
4.8 |
||||||||||
|
Mel min-17 |
3 |
110 |
1632 |
1829 |
589 |
31 |
454 |
224 |
1257 |
1190 |
||||||
|
Mel min- 8 |
L |
3 |
4 |
0 |
0 |
0 |
67.6 |
522 |
1246 |
1074 |
1354 |
48 |
306 |
1100 |
1078 |
947 |
|
Mel min-15 |
4 |
18.0 |
1576 |
1687 |
1314 |
636 |
94 |
66 |
586 |
1228 |
1526 |
|||||
|
Mel min- 5 |
L |
3 |
4 |
0 |
1 |
1 |
3.8 |
255 |
531 |
1280 |
172 |
937 |
37 |
826 |
1459 |
689 |
|
Mel min-14 |
4 |
0 |
85 |
401 |
114 |
45 |
250 |
189 |
359 |
1527 |
200 |
|||||
|
Mel min- 2 |
L |
3 |
5 |
1429 |
1353 |
1457 |
785 |
668 |
995 |
342 |
1201 |
1413 |
||||
|
Mel min- 3 |
L |
3 |
5 |
1551 |
1519 |
1419 |
1011 |
20 |
782 |
573 |
1300 |
1496 |
||||
|
Mel min- 1 |
L |
3 |
5 |
0 |
0 |
1 |
35.7 |
1579 |
1565 |
1565 |
702 |
16 |
1211 |
995 |
1569 |
1570 |
|
Mel Kor |
L |
3 |
5 |
1 |
1 |
1 |
64.8 |
1503 |
1438 |
1340 |
997 |
99 |
1204 |
1328 |
1585 |
1427 |
|
Mel Ibr |
L |
3 |
6 |
0 |
0 |
0 |
25.3 |
27 |
90 |
251 |
864 |
511 |
940 |
1115 |
1397 |
123 |
|
Mel min-13 |
6 |
0 |
0 |
0 |
91.8 |
15 |
76 |
106 |
809 |
114 |
885 |
1076 |
1264 |
66 |
||
|
Mel min- 4 |
L |
3 |
6 |
30 |
30 |
104 |
1006 |
56 |
686 |
1046 |
1196 |
55 |
||||
|
Mel min- 7 |
L |
3 |
6 |
0 |
0 |
0 |
74 |
35 |
40 |
12 |
220 |
744 |
848 |
1595 |
50 |
|
|
Mel min- 6 |
L |
3 |
6 |
0 |
0 |
0 |
27 |
31 |
50 |
395 |
22 |
605 |
583 |
1206 |
36 |
|
|
KK * |
х |
0.92 |
-0.35 |
-0.12 |
-0.45 |
0.04 |
-0.33 |
-0.36 |
-0.32 |
-0.08 |
0.31 |
0.65 |
0.79 |
0.87 |
-0.34 |
|
|
х |
0.54 |
0.45 |
0.44 |
0.27 |
-0.23 |
0.03 |
-0.17 |
-0.30 |
0.49 |
|||||||
|
х |
0.43 |
0.41 |
0.50 |
-0.024 |
0.31 |
-0.21 |
-0.1 |
-0.08 |
0.45 |
|||||||
|
х |
0.85 |
0.81 |
0.91 |
0.21 |
0.02 |
-0.28 |
-0.35 |
-0.14 |
0.88 |
|||||||
|
х |
0.08 |
0.19 |
-0.019 |
0.59 |
-0.47 |
0.22 |
0.16 |
0.24 |
0.09 |
|||||||
Примечание: KK* – коэффициент корреляции между отмеченным крестом столбцом и уровнем экспрессии гена или кластера генов.
** – произвольные единицы (см. раздел «Материал и методы»)
G2с не коррелирует с морфологической классификацией линий клеток, тогда как активность РТА генов групп G1b G1c и G2a имеет высокую степень корреляции с морфологической классификацией.
Ранее клеточные линии были охарактеризованы по экспрессии дифференцировочных антигенов меланомы [1]. Для этого использовались следующие маркеры меланомы: моноклональные антитела к HMB45 и HMW, – распознающие соответственно в незрелых меланоцитах белок gp100/PMEL17, продукт гена SILV, и MCSP – высокомолекулярный ме-ланомный хондроитин-сульфатный протеогликан (melanoma chondroitin sulfate proteoglycan). Также были использованы антитела к Tyrosinase и MelanA/МART-1 – продуктам генов TYR и MLANA соответственно, которые, так же как и продукт гена SILV, являются компонентами меланосом. В табл. 3 продемонстрированы результаты сравнения иммунологических данных с результатами измерения концентрации мРНК. Отмечено отсутствие корреляции между результатами морфологического исследования и любыми иммунологическими измерениями; наиболее значимая величина получается для антикорреляции HMW антител и не превышает 0,45. Соответственно, и активность ни одного из ДАМ генов, ни РТА генов группы G1a не коррелирует с морфологическими данными. Напротив, активность генов групп G1c и G2a коррелирует с морфологическими данными с коэффициентом более 0,75. Иммунологические данные для MelanA не имеют высокой корреляции с экспрессией гена MLANA (0,54), тогда как иммунологические данные для НМВ45 имеют высокую степень корреляции с активностью гена SILV (0,91). Необходимо также отметить высокую степень корреляции данных для НМВ45 с экспрессией других компонент меланосом, которые почти синхронно проявляются в различных линиях (рис.3). Неожиданно высоким оказался коэффициент корреляции экспрессии гена S100B и антигена HMW.
Полученные результаты свидетельствуют о том, что между степенью дифференцировки клеточной культуры и уровнем экспрессии РТА генов существует корреляция, определяемая, вероятно, частотой митозов. Соответствующие коэффициенты корреляции между степенью дифференцированности, уровнем экспрессии генов групп G1а, G1в, G1c, G2a, G2c и морфологическим типом равны соответственно 0,3, 0,65, 0,79, 0,87 и – 0,34 (табл. 3). Следует также отметить отсутствие корреляции между экспрессией генов ДАМ и РТА (коэффициент корреляции варьирует между 0,25 и 0,09) (табл. 2), а также между экспрессией генов ДАМ и степенью дифференцировки клеток в культуре (коэффициент корреляции – 0,34).
Таким образом, наличие корреляции между уровнем экспрессии раково-тестикулярных генов и степенью дифференцировки клеток предоставляет возможность количественно оценить степень злокачественности опухолевых клеток меланомы и дать более точный клинический прогноз течения заболевания и дальнейший выбор лечения.
Работа выполнена при финансовой поддержке Правительства г. Москвы в рамках научно-технической программы «Разработка и внедрение в медицинскую практику новых методов и средств диагностики и лечения онкологических и других заболеваний».


