Экспрессия рецептора к белку программированной гибели клеток PD-1 и его лиганда PD-L1 при серозном раке яичников High-Grade
Автор: Журман В.Н., Плехова Н.Г.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
В последнее время большой интерес вызывает иммунотерапевтическое лечение рака яичников. Это связано с открытием сигнального пути чекпойнтов (контрольных точек) иммунитета PD-1/PD-L1, способных осуществлять управление выраженностью и продолжительностью аутоиммунного ответа. Цель. Определить зависимость уровня экспрессии рецептора PD-1 и его лиганда PD-L1 от степени пролиферативной активности клеток серозного рака яичников high-grade. Материалы и методы. Исследование выполнено в ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Минздрава России на базе Центральной научно-исследовательской лаборатории. Материал взят в ГБУЗ «Приморский краевой онкологический диспансер» в период с 2016 по 2021 г. Проведен анализ патологоанатомического материала методом иммуногистохимии с использованием антител p53, Ki-67, PD-L1, Anti-Hu CD279 (PD-1). В основную группу вошли 74 пациентки с серозным раком яичников high-grade, в сравнительную 26 пациенток с доброкачественными опухолями яичников. Результаты. Установлено наличие экспрессии рецептора PD-1 и лиганда PD-L1 в опухолевых тканях при раке яичников. Определено повышение позитивной реакции на Ki-67 и р53 в зависимости от степени дифференцировки и стадии опухолевого процесса. Выводы. Несмотря на заявленную иммуномодулирующую функцию, высокие уровни PD-1 и PD-L1 являются индикаторами благоприятного прогноза при раке яичников. Полученные данные показывают, что молекулы PD-1 и PD-L1 являются биологически значимыми регуляторами иммунного ответа при серозном раке яичников high-grade, что служит аргументом в пользу оценки противоопухолевых лекарственных препаратов, ингибирующих иммунные контрольные точки. Вышесказанное позволяет утверждать, что продукция лиганда PD-L1 в клетках иммунной системы, которые инфильтрируют опухоль, рассматривается как благоприятный прогностический фактор. Статистически значимая прямая связь между Ki-67 и PD-L1 доказывает прямую зависимость экспрессии лиганда PD-L1 от степени пролиферативной активности опухоли яичников. Статистически значимая обратная связь между p53 и PD-1 показывает зависимость экспрессии PD-1 от апоптотических изменений в опухоли яичников.
Рак яичников, ki-67, p53, pd-1/pd-l1
Короткий адрес: https://sciup.org/14128744
IDR: 14128744 | УДК: 61-616-018 | DOI: 10.34014/2227-1848-2023-3-95-108
Текст научной статьи Экспрессия рецептора к белку программированной гибели клеток PD-1 и его лиганда PD-L1 при серозном раке яичников High-Grade
Введение. Злокачественные опухоли яичников составляют 25 % от всех злокачественных новообразований женских половых органов, чаще выявляются на III–IV стадии и имеют высокие показатели летальности, несмотря на агрессивные хирургические подходы и разнообразие противоопухолевой лекарственной терапии [1, 2]. Средний возраст пациенток с впервые выявленным диагнозом составляет 55 лет. В структуре злокачественных новообразований яичников на эпителиальные формы рака яичников приходится до
90 % случаев, из них 70 % составляют серозные карциномы high-grade и low-grade [3].
Ингибирующие иммунологические контрольные точки (чекпойнт-ингибиторы) – это система связанных с сигнальными путями ингибиторных механизмов, регулирующих активацию и модуляцию иммунного ответа. Они способны ограничивать неадекватное распознавание иммунными клетками нормальной ткани и препятствовать запуску аутоиммунных реакций. К представителям системы иммунологических чекпойнтов относят рецептор про- граммированной клеточной гибели PD-1 и его лиганд PD-L1, ген активации лимфоцитов LAG-3, гликопротеин цитотоксических Т-кле-ток CTLA-4, а также белок-3, содержащий Т-клеточный Ig и муцин TIM-3. С помощью иммунологических контрольных точек клетки опухолей способны ускользать от иммунного ответа, приобретая тем самым устойчивость к действию иммунной системы [1, 4].
Рецептор PD-1 имеет два лиганда – PD-L1 (B7-H1, CD274) и PD-L2 (B7-DC, CD273), которые относятся к семейству CD28, и экспрессируется на активированных Т- и В-лимфоци-тах, моноцитах, NK-клетках [5]. PD-L1 экспрессируется на макрофагах, поверхности Т- и В-лимфоцитов, дендритных клеток, эндотелиальных клеток сердца, гемопоэтических, эпителиальных, глиальных клеток, клеток плаценты, паренхиматозных клеток (β-клеток поджелудочной железы, эндотелиально-сосудистых клеток) [6]. PD-L1 препятствует развитию аутоиммунных реакций, содействует диф-фе-ренцировке наивных клеток CD4+ в индуцируемые CD4+FOXP3+Treg [7, 8]. PD-L1 является продуктом гена CD274, который располагается на 9-й хромосоме. Контроль активности данного гена осуществляется за счет участия регуляторного фактора интерферона-1 (IRF-1) и транскрипционного фактора STAT1 [9].
PD-L2 в норме экспрессируется на дендритных клетках и активированных макрофагах [10].
Активация PD-1/PD-L1-пути является одним из важнейших механизмов обеспечения иммуносупрессии при злокачественных опухолях. Рецептор PD-1 и его лиганд – перспективные терапевтические мишени и предикторы эффективности анти-PD-1/PD-L-имму-нотерапии [11, 12]. Данные иммунные контрольные точки изучают в качестве молекулярных маркеров общего прогноза течения опухолевых заболеваний и выживаемости. В частности, существуют исследования, демонстрирующие негативное влияние их повышенной экспрессии на клиническое течение некоторых видов опухолей [13–15]. Выявлена взаимосвязь экспрессии рецептора PD-1 и/или его лиганда PD-L1 с метастазированием и степенью злокачественности рака яичников
[16, 17]. Также выявлена взаимосвязь с мутациями генов BRCA1/2, TP53 и микросателлит-ной нестабильностью, которая определяется в качестве маркера чувствительности опухоли к анти-PD-1/PD-L-терапии [18, 19].
Осуществляется все больше серьезных попыток применения данной терапии моноклональными антителами при раке яичников, в т.ч. резистентном к цитостатическим противоопухолевым препаратам [20–22].
Цель исследования. Определить зависимость уровня экспрессии рецептора PD-1 и его лиганда PD-L1 от степени пролиферативной активности клеток рака яичников.
Материалы и методы. Исследование выполнено в ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Минздрава России на базе Центральной научно-исследовательской лаборатории. Материал взят в ГБУЗ «Приморский краевой онкологический диспансер» в период с 2016 по 2021 г. Проведен анализ патологоанатомического материала 74 пациенток с серозным раком яичников highgrade (код по МКБ: С56) с использованием антител p53, Ki-67, PD-L1, Anti-Hu CD279 (PD-1). Средний возраст женщин составлял 57±11 лет. В сравнительную группу вошли 26 пациенток с доброкачественными опухолями яичников и отсутствием тяжелой сопутствующей патологии. Их средний возраст составлял 54±13 лет.
Для иммуногистохимического анализа срезы, зафиксированные на стекле с адгезивным покрытием, дважды депарафинизировались в ксилоле по 3 мин, дважды дегидрировались в 96 % этаноле по 3 мин, 80 % спирте 3 мин, 70 % спирте 3 мин и затем помещались в дистиллированную воду на 3 мин.
Для температурной активации и протеолитической обработки проводилась демаскировка антигена (эпитопов), восстанавливающая иммунореактивность иммуногена. Для этого срезы помещались в цитратно-натрие-вый буфер (Antigen Retrieval Buffer pH 6.0) и ставились в микроволновую печь мощностью 700 Вт на 4 мин.
Затем стекла со срезами промывались 2 раза в Tris-HCl-буфере (0,5 % TWEEN®20, pH 7.6) по 5 мин. Буфер обновлялся после каждой промывки.
Для снижения вероятности появления ложноположительных реакций наносился раствор, блокирующий активность типичных для тканей неспецифических эндогенных пероксидаз и предотвращающий связывание с ними молекул DAB-Chromogen и возникновение за счет этого неспецифической окраски – Hydrogen Peroxide Block (Spring bioscience). Проводилась инкубация во влажной камере в течение 10 мин при комнатной температуре. Затем срезы снова дважды промывались в Tris-HCl-буфере по 5 мин.
В целях предотвращения смешивания антител срезы протирались для удаления излишек буфера, но оставлялись влажными и отделялись друг от друга гидрофобным карандашом.
Для предотвращения возникновения неспецифического фонового окрашивания в результате связывания специфических первичных антител с компонентами опухолевой ткани за счет гидрофобных и электролитических взаимодействий наносилась неиммунная сыворотка, блокирующая активность неспецифических белков (Protein Block, pH 7.6, Spring bioscience), но при этом не влияющая на взаимодействие первичных антител с антигенами. Затем происходила инкубация в течение 10 мин во влажной камере с последующими двумя промывками по 5 мин.
Далее наносились первичные (специфические) антитела. Для исследования рецептора PD-1 выжидалось время до полного высыхания антител. Затем срез заключался под стекло с использованием геля Fluoromount Aqueous Mounting Medium (Sigma). Для исследования белков Ki-67, p53 и лиганда PD-L1 наносились соответствующие специфические антитела и срезы инкубировались 24 ч при +4 °С в холодильной камере.
По истечении времени инкубации срезы промывались по 4 раза в Tris-HCl-буфере, после чего наносились вторичные биотилизиро-ванные поливалентные антитела козы (Biotinylated Goat Anti-Polyvalent, Spring bioscience) и проводилась инкубация во влажной камере в течение 10 мин при комнатной температуре. Затем срезы промывались 4 раза в Tris-HCl буфере. Далее наносились меченные пероксида- зой антитела против стрептавидина (Streptavidin Peroxidase, Spring bioscience) и проводилась 10-минутная инкубация и промывка. Потом наносилась смесь хромогена и DAB-субстрата в соотношении 1:5 и проводилась инкубация в течение 1–2 мин с последующей промывкой. Для визуализации ядер на 20–120 с наносился гематоксилин Майера (BioVitrum), после чего срезы дважды промывались в дистиллированной воде и обезвоживались в 96 % спирте.
Морфометрический анализ экспрессии белков p53, Ki-67, рецептора PD-1 и его лиганда PD-L1 проводился с помощью микроскопического метода. Использовались микроскопы Axio Zeiss Scope. A1 с камерой Olympus DP74 и Olympus CX41 с камерой U-TV0.35XC-2.
Для оценки экспрессии PD-1 и PD-L1 подсчитывалось отношение клеток с позитивным окрашиванием мембраны к общему количеству клеток (TPS – tumor proportion score), результат выражался в пикселях.
Подсчет количества клеток с позитивным окрашиванием и общего количества клеток осуществлялся с помощью программы NIS-Elements BR. Для этого в программу добавлялся снимок препарата через окно «Файл» и «Открыть». После выбора нужного изображения через окно «Бинарное» выбиралось «Определить порог». После этого на экране красным цветом выделялись необходимые для подсчета области. Затем бинарное изображение копировалось в «ROI». И в окне «Измерить» выбиралось «Измерить поле и ROI». Программа, проанализировав количество клеток, открывала таблицу с цифровыми значениями, которая экспортировалась в программу Microsoft Excel. В данной программе вычислялись средние значения по 10 изображениям препаратов для каждого из пациентов и среднее отклонение.
Полученные значения были подвергнуты математической и статистической обработке в программах Microsoft Exсel 2016 и STATISTICA 12.0 (StatSoft Inc., США).
Проверка на нормальность распределения полученных сравниваемых групп осуществлялась с помощью критерия нормальности Шапиро – Уилка и критерия согласия Колмого- рова (Колмогорова – Смирнова). В дополнение к этому проверка гипотезы о нормальном распределении выборки проводилась с помощью построения гистограммы эмпирических частот, теоретической кривой и нормального вероятностного графика при их визуальном оценивании.
Поскольку все выборки демонстрировали ненормальное распределение, то определялась медиана и квартальные размахи. Для оценки статистической значимости распределений применялись U-критерий Манна – Уитни, критерий серий Вальда – Вольфовица и двухвыборочный критерий Колмогорова – Смирнова. Для выявления взаимосвязи между экспрессией рецептора PD-1, его лиганда PD-L1, маркера Ki-67, белка p53 и стадией рака яичников, степенью его дифференцировки применялся непараметрический критерий Краскела – Уоллиса. Различия считались статистически значимыми при уровне значимости p<0,05.
Результаты. По клинической стадии больные раком яичников были разделены на пациентов с I стадией – 8 (11 %) чел., со II стадией – 9 (12 %) чел., с III стадией – 31 (42 %) и с IV стадией – 26 (35 %). Значения шкалы ECOG у 70,8 % пациентов составляли 0–1, у 29,2 % больных – 2–3.
При иммуногистохимических исследованиях экспрессия белка PD-1 и его лиганда PD-L1 обнаружена на поверхности мембраны клеток у всех пациентов, в т.ч. и в группе сравнения. Наблюдались статистически значимые снижение экспрессии белка PD-1 и рост экспрессии лиганда PD-L1 при увеличении стадии рака яичников (p<0,001), что подтверждено с помощью критерия Краскела – Уоллиса (H-критерия) (табл. 1, рис. 1). Предположительно, данная зависимость связана с возможным развитием анергии или истощения иммунных клеток вследствие влияния на них опухолевых клеток.
Таблица 1
Table 1
Экспрессия PD-1 и PD-L1
в зависимости от стадии серозного рака яичников high-grade
При иммуногистохимическом анализе рецептора PD-1 положительная реакция была представлена флюоресцентным зеленым свечением мембраны иммунных клеток (рис. 2).
Положительная реакция на лиганд PD-L1 проявлялась в виде красно-коричневого окрашивания мембраны опухолевых клеток (рис. 3).
PD-1/PD-L1 expression by the stage of high-grade serous ovarian cancer
|
Стадия рака яичников Ovarian cancer stage |
n |
Показатель экспрессии маркеров Indicator of marker expression |
|||
|
PD-1 |
р |
PD-L1 |
р |
||
|
I стадия Stage 1 |
8 |
852 (785,2; 1047,0) |
<0,001 (1; 2–5) |
149,5 (66,5; 254,0) |
<0,001 (1; 2–5) |
|
II стадия Stage2 |
9 |
841 (647,0; 894,0) |
<0,001 (2; 1, 3–5) |
277 (219,0; 475,0) |
<0,001 (2; 1, 3–5) |
|
III стадия Stage 3 |
31 |
486 (291,5; 608,5) |
<0,001 (3; 1, 2, 4, 5) |
605 (552,5; 703,5) |
<0,001 (3; 1, 2, 4, 5) |
|
IV стадия Stage 4 |
26 |
287,5 (185,2; 351,2) |
<0,001 (4; 1–3, 5) |
837,5 (753,0; 1011,5) |
<0,001 (4; 1–3, 5) |
|
Группа сравнения Comparison Group |
26 |
1269,5 (1211,7; 1305,2) |
<0,001 (5; 1–4) |
70,5 (43,5; 118,5) |
<0,001 (5; 1–4) |
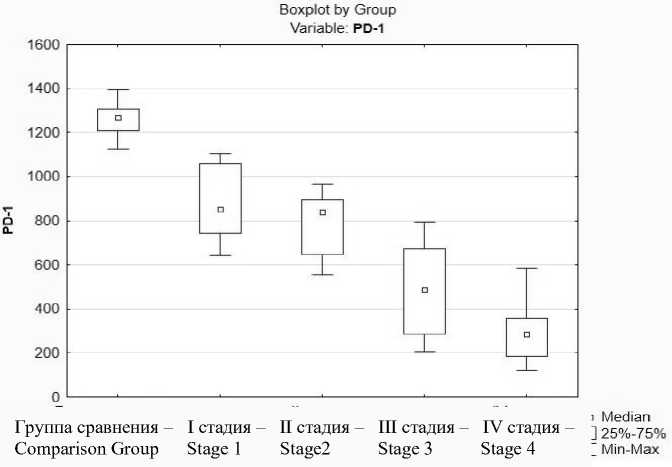
Стадия рака яичников – Ovarian cancer stage
Рис. 1. Экспрессия рецептора PD-1 в зависимости от стадии эпителиального рака яичников high-grade
Fig. 1. PD-1 expression by the stage of epithelial ovarian cancer
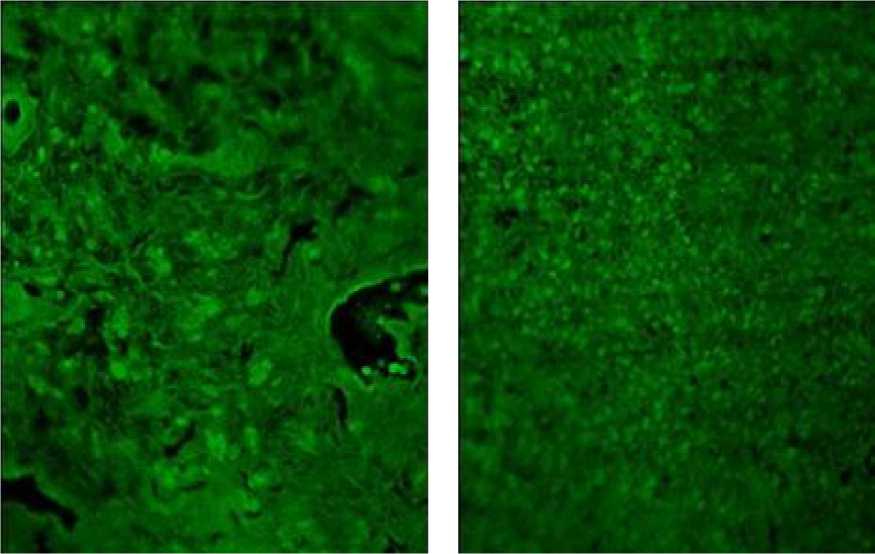
А / A Б / B
Рис. 2. Высокопозитивная реакция на наличие антигена PD-1 в тканях опухоли при серозном раке яичников high-grade:
А – фокальный пятнистый паттерн экспрессии PD-1 на инвазивном крае опухоли;
Б – цитоплазматическая локализация и иммунореактивность мембран клеток микроокружения. Иммуногистохимическое окрашивание антителами, меченными флуорохромом Alexa Fluor® 488
Fig. 2. Highly positive reaction to PD-1 in tumor tissues in high-grade serous ovarian cancer:
A – focal spotty pattern of PD-1 expression on the invasive tumor edge;
B – cytoplasmic localization and immunoreactivity of microenvironment cell membranes. Immunohistochemical staining with fluorochrome, Alexa Fluor ® 488
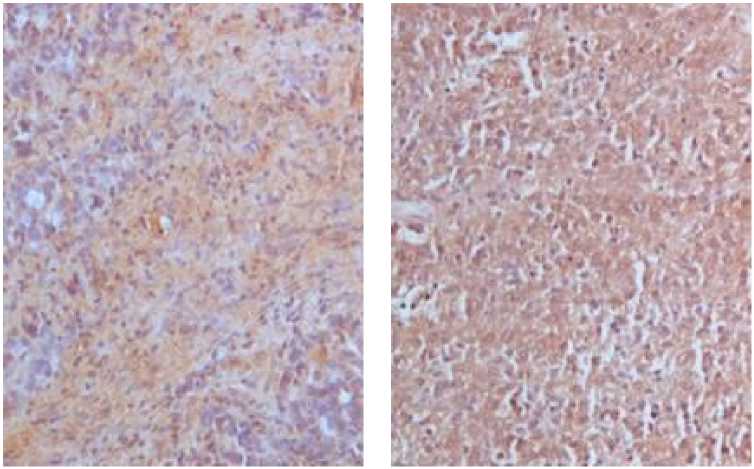
А / A
Б / B
Рис. 3. Реакция на наличие антигена PD-L1 в тканях опухоли при серозном раке яичников high-grade: А – позитивная реакция низкой степени PD-L1; Б – фокальный пятнистый паттерн высокой экспрессии PD-L1. Иммуногистохимическое окрашивание, окраска ядер гематоксилином Майера
Fig. 3. Response to PD-L1 in tumor tissues in high-grade serous ovarian cancer:
A – low-grade positive PD-L1; B – focal patchy pattern of high PD-L1 expression. Immunohistochemical staining, Mayer’s hematoxylin nuclei staining
Окрашивание мембраны опухолевых клеток в красно-коричневый цвет связано прежде всего с тем, что лиганд PD-L1 продуцируется клетками опухоли и участвует в механизмах ускользания от иммунного ответа.
При иммуногистохимическом исследовании положительная реакция на белок p53 проявлялась окрашиванием ядер опухолевых клеток в красно-коричневый цвет (рис. 4).
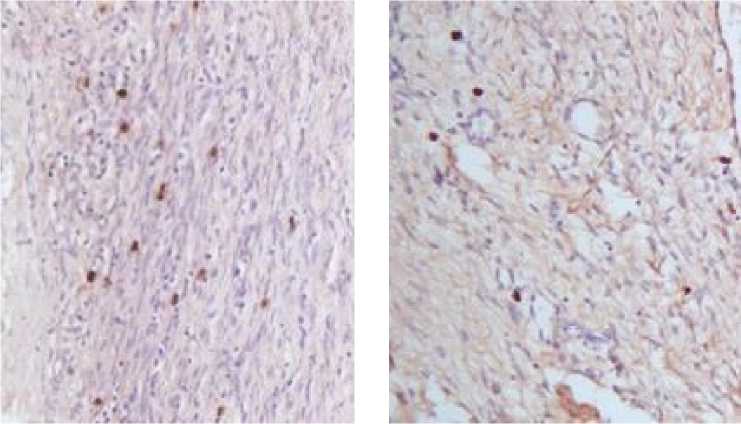
Рис. 4. Положительная реакция на белок p53 в тканях опухоли при серозном раке яичников high-grade. Иммуногистохимическое окрашивание, окраска ядер гематоксилином Майера
Fig. 4. Positive reaction to p53 protein in tumor tissues in high-grade serous ovarian cancer. Immunohistochemical staining, Mayer’s hematoxylin nuclei staining
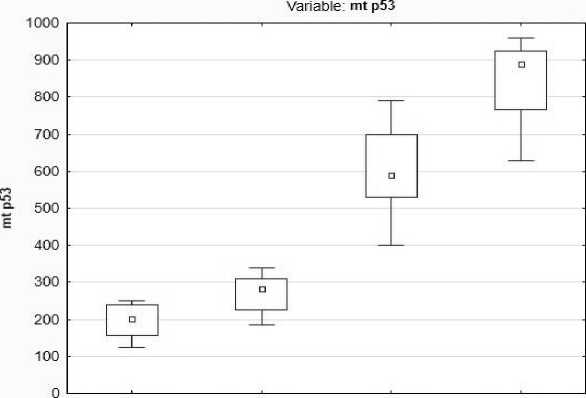
Анализ показал, что при доброкачественной опухоли маркеры p53 и Ki-67 не обнаруживаются. При увеличении стадии серозного рака яичников high-grade их экспрессия стати-
стически значимо увеличивается (табл. 2). Наблюдалось заметное повышение количества данного биологического маркера при увеличении стадии рака яичников (рис. 5).
Таблица 2
Table 2
Экспрессия маркеров Ki-67 и p53 в зависимости от стадии серозного рака яичников high-grade
Ki-67 and p53 expression by the stage of high-grade serous ovarian cancer
|
Стадия рака яичников Ovarian cancer stage |
n |
Показатель экспрессии маркеров Indicator of marker expression |
|||
|
Ki-67 |
p |
p53 |
p |
||
|
I |
8 |
676 (132,7; 771,7) |
<0,001 (1; 2–5) |
201,5 (160,7; 238,0) |
<0,001 (1; 2–4) |
|
II |
9 |
392 (295,0; 714,0) |
<0,001 (2; 1, 3–5) |
283 (227,0; 309,0) |
<0,001 (2; 1, 3–4) |
|
III |
31 |
781 (681,5; 1054,0) |
<0,001 (3; 1, 2, 4, 5) |
590 (534,5; 696,5) |
<0,001 (3; 1, 2, 4) |
|
IV |
26 |
989 (867,0; 1168,0) |
<0,001 (4; 1–3, 5) |
889 (771,7; 924,0) |
<0,001 (4; 1–3) |
|
Группа сравнения Comparison Group |
26 |
70,5 (31,5; 94,2) |
<0,001 (5; 1–4) |
- |
- |
Boxplot by Group
I стадия – II стадия – III стадия – IV стадия –
Stage 1 Stage2 Stage 3 Stage 4
□ Median
□ 25%-75%
I Min-Max
Стадия рака яичников – Ovarian cancer stage
Рис. 5. Экспрессия маркера p53 в зависимости от стадии эпителиального рака яичников
Fig. 5. p53 expression by the stage of epithelial ovarian cancer
Критерий Краскела – Уоллиса продемонстрировал статистически значимую зависимость роста экспрессии p53 от увеличения стадии рака яичников и дифференцировки опухоли (р<0,001).
Эти закономерности объясняются активным участием p53 в клеточном цикле и развитии апоптоза. В результате мутации данного гена клетки входят в клеточный цикл с дефектной ДНК и их дальнейшее деление становится неуправляемым.
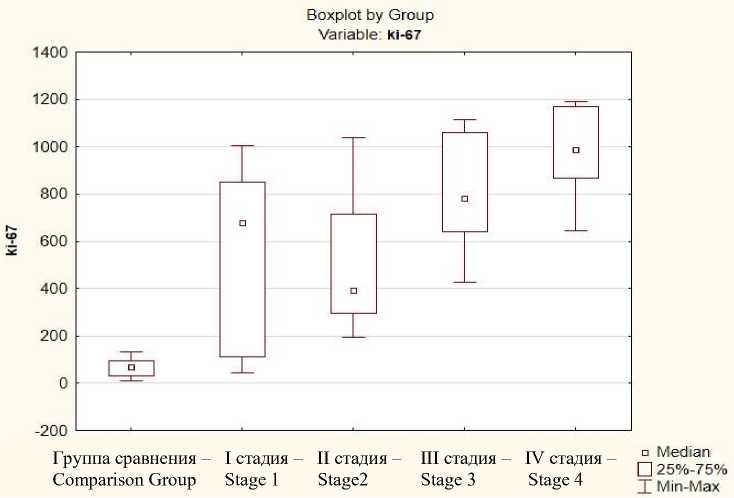
Экспрессия биомолекулярного маркера Ki-67 при исследовании образцов группы сравнения была незначительной – 70,5 (31,5; 94,2), что является очевидным при доброкачественной опухоли. При I стадии серозного рака яичников high-grade уровень экспрессии Ki-67 в ядрах составил 676,0 (132,7; 771,7), при IV стадии – 989,0 (867,0; 1168,0) (табл. 2). Наблюдался рост экспрессии маркера Ki-67 при увеличении стадии опухолевого процесса (рис. 6).
Стадия рака яичников – Ovarian cancer stage
Рис. 6. Экспрессия маркера Ki-67 в зависимости от стадии эпителиального рака яичников
Fig. 6. Ki-67 expression by the stage of epithelial ovarian cancer
Высокий уровень белка Ki-67 взаимосвязан с худшим прогнозом течения заболевания. Коэффициент ранговой корреляции Спирмена продемонстрировал статистически значимую обратную связь между Ki-67 и PD-1 с высокой корреляционной силой, что доказывает зависимость экспрессии рецептора PD-1 от степени пролиферативной активности опухоли яичников (табл. 3).
Наблюдалась статистически значимая прямая связь между Ki-67 и PD-L1 с высокой корреляционной силой, что доказывает прямую зависимость экспрессии лиганда PD-L1 от степени пролиферативной активности опухоли яичников. Также отмечена статистически значимая обратная связь между p53 и PD-1 с высокой корреляционной силой, что показывает зависимость экспрессии PD-1 от апоптотических изменений в опухоли яичников.
Таблица 3
Table 3
Статистически значимая прямая связь между Ki-67 и PD-L1 доказывает прямую зависимость экспрессии лиганда PD-L1 от степени пролиферативной активности опухоли яичников. Статистически значимая обратная связь между p53 и PD-1 показывает зависимость экспрессии PD-1 от апоптотических изменений в опухоли яичников.
Список литературы Экспрессия рецептора к белку программированной гибели клеток PD-1 и его лиганда PD-L1 при серозном раке яичников High-Grade
- Ishida Y., Agata Y., Shibahara K., Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992; 11 (11): 3887-3895. DOI: 10.1002/j.1460-2075.1992.tb05481.x.
- Zhu X., Jinghe L. The significance and therapeutic potential of PD-1 and its ligands in ovarian cancer: A systematic review. Gynecologic oncology. 2016; 142 (1): 184-189. DOI: 10.1016/j.ygyno.2016.04.002.
- Dong H., Zhu G., Tamada K., Chen L. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nat Med. 1999; 5 (12): 1365-1369. DOI: 10.1038/70932.
- Кушлинский Н.Е., Герштейн Е.С., Горячева И.О. Растворимые формы рецептора контрольной точки иммунитета PD-1 и его лиганда PD-L1 в сыворотке крови больных почечно-клеточным раком: клинико-морфологические корреляции. Онкоурология. 2019; 15 (1): 15-22.
- Nishimura H., Honjo T., Minato N. Facilitation of beta selection and modification of positive selection in the thymus of PD-1-deficient mice. J. Exp Med. 2000; 191 (5): 891-898. DOI: 10.1084/jem.191.5.891.
- Guo X., Wang J., Jin J., Chen H., Zhen Z., Jiang W., Lin T., Huang H., Xia Z., Sun X. High Serum Level of Soluble Programmed Death Ligand 1 is Associated With a Poor Prognosis in Hodgkin Lymphoma. Translational oncology. 2018; 11 (3): 779-785. DOI: https://doi.org/10.1016/j.tranon.2018.03.012.
- Francisco L.M., Salinas V.H., Brown K.E., Vanguri V.K., Freeman G.J., Kuchroo V.K., Sharpe A.H. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells. The Journal of experimental medicine. 2009; 206 (13): 3015-3029. DOI: https://doi.org/10.1084/jem.20090847.
- Sayapina M.S. Immunoregulatory functions of PD-1/PD-L1 inhibitors and development of resistance to them. Malignant Tumors. 2017; 2: 94-99.
- Gadducci Angiolo, Maria Elena Guerrieri. Immune Checkpoint Inhibitors in Gynecological Cancers: Update of Literature and Perspectives of Clinical Research. Anticancer research. 2017; 37 (11): 59555965. DOI: 10.21873/anticanres.12042.
- RosenwaldA., Wright G., Leroy K., Yu X., GaulardP., Gascoyne R.D., Chan W.C., Zhao T., Haioun C., Greiner T.C., Weisenburger D.D., Lynch J.C., Vose J., Armitage J.O., SmelandE.B., Kvaloy S., Holte H., Delabie J., Campo E., MontserratE., StaudtL.M. Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. The Journal of experimental medicine. 2003; 198 (6): 851-862. DOI: https://doi.org/ 10.1084/jem.20031074.
- Maleki V.S., Garrigos C., Duran I. Biomarkers of response to PD-1/PD-L1 inhibition. Crit Rev Oncol Hematol. 2017; 116: 116-124. DOI: 10.1016/j.critrevonc.2017.06.001.
- Yuasa T., Masuda H., Yamamoto S., Numao N., Yonese J. Biomarkers to predict prognosis and response to checkpoint inhibitors. Int J Clin Oncol. 2017; 22 (4): 629-634. DOI: 10.1007/s10147-017-1122-1.
- HuangX., Zhang W., Zhang Z., Shi D., Wu F., Zhong B., Shao Z. Prognostic Value of Programmed Cell Death 1 Ligand-1 (PD-L1) or PD-1 Expression in Patients with Osteosarcoma: A Meta-Analysis. Journal of Cancer. 2018; 9 (14): 2525-2531. DOI: https://doi.org/10.7150/jca.25011.
- Kim K.S., Sekar R.R., Patil D., Dimarco M.A., Kissick H.T., Bilen M.A., Osunkoya A.O., Master V.A. Evaluation of programmed cell death protein 1 (PD-1) expression as a prognostic biomarker in patients with clear cell renal cell carcinoma. Oncoimmunology. 2018; 7 (4): e1413519. DOI: https://doi.org/ 10.1080/2162402X.2017.1413519.
- Sacher A.G., Leena G. Biomarkers for the Clinical Use of PD-1/PD-L1 Inhibitors in Non-Small-Cell Lung Cancer: A Review. JAMA oncology. 2016; 2 (9): 1217-1222. DOI: 10.1001/jamaoncol.2016.0639.
- Darb-Esfahani S., Kunze C.A., Kulbe H., Sehouli J., Wienert S., Lindner J., Budczies J., Bockmayr M., Dietel M., Denkert C., Braicu I., Jöhrens K. Prognostic impact of programmed cell death-1 (PD-1) and PD-ligand 1 (PD-L1) expression in cancer cells and tumor-infiltrating lymphocytes in ovarian high grade serous carcinoma. Oncotarget. 2016; 7 (2): 1486-1499. DOI: https://doi.org/10.18632/oncotarget.6429.
- Drakes M.L., Mehrotra S., Aldulescu M., Potkul R.K., Liu Y., Grisoli A., Joyce C., O'Brien T.E., Stack M.S., Stiff P.J. Stratification of ovarian tumor pathology by expression of programmed cell death-1 (PD-1) and PD-ligand-1 (PD-L1) in ovarian cancer. Journal of ovarian research. 2018; 11 (1): 43. DOI: https://doi.org/10.1186/s13048-018-0414-z.
- StricklandK.C., HowittB.E., Shukla S.A., Rodig S., Ritterhouse L.L., Liu J.F., Garber J.E., Chowdhury D., Wu C.J., D'Andrea A.D., Matulonis U.A., Konstantinopoulos P.A. Association and prognostic significance of BRCA1/2-mutation status with neoantigen load, number of tumor-infiltrating lymphocytes and expression of PD-1/PD-L1 in high grade serous ovarian cancer. Oncotarget. 2016; 7 (12): 13587-13598. DOI: https://doi.org/10.18632/oncotarget.7277.
- Wieser V., Gaugg I., Fleischer M., Shivalingaiah G., Wenzel S., Sprung S., Lax S.F., ZeimetA.G., Fiegl H., Marth C. BRCA1/2 and TP53 mutation status associates with PD-1 and PD-L1 expression in ovarian cancer. Oncotarget. 2018; 9 (25): 17501-17511. DOI: https://doi.org/10.18632/oncotarget.24770.
- Inayama Y., Hamanishi J., Matsumura N., Murakami R., Abiko K., Yamaguchi K., Baba T., Horie K., Konishi I., Mandai M. Antitumor Effect of Nivolumab on Subsequent Chemotherapy for Platinum-Resistant Ovarian Cancer. The oncologist. 2018; 23 (11): 1382-1384. DOI: https://doi.org/10.1634/theon-cologist.2018-0167.
- Zhu X., Xu J., Cai H., Lang J. Carboplatin and programmed death-ligand 1 blockade synergistically produce a similar antitumor effect to carboplatin alone in murine ID8 ovarian cancer model. J Obstet Gynaecol Res. 2018; 44 (2): 303-311. DOI: 10.1111/jog.13521.
- Юдина А.С., Абизяева И.Л., Юдин С.В., Жерновой М.В. Организационные проблемы профилактической онкологии органов репродуктивной системы женщин. Тихоокеанский медицинский журнал. 2007; 4: 83-84.
- Mittendorf E.A., PhilipsA.V., Meric-Bernstam F., Qiao N., Wu Y., Harrington S., SuX., Wang Y., Gonzalez-Angulo A.M., Akcakanat A., Chawla A., Curran M., Hwu P., Sharma P., Litton J. K., Molldrem J.J., Alatrash G. PD-L1 expression in triple-negative breast cancer. Cancer immunology research. 2014; 2 (4): 361-370. DOI: https://doi.org/10.1158/2326-6066.CIR-13-0127.
- Wimberly H., Brown J.R., Schalper K., Haack H., Silver M.R., Nixon C., Bossuyt V., Pusztai L., Lannin D.R., Rimm D.L. PD-L1 Expression Correlates with Tumor-Infiltrating Lymphocytes and Response to Neoadjuvant Chemotherapy in Breast Cancer. Cancer immunology research. 2015; 3 (4): 326-332. DOI: https://doi.org/10.1158/2326-6066.CIR-14-0133.
- Ding Y., Sun C., Li J., Hu L., Li M., Liu J., Pu L., Xiong S. The Prognostic Significance of Soluble Programmed Death Ligand 1 Expression in Cancers: A Systematic Review and Meta-analysis. Scandinavian journal of immunology. 2017; 86 (5): 361-367. DOI: https://doi.org/10.1111/sji.12596.
- Theodoraki M.N., Yerneni S.S., Hoffmann T.K., Gooding W.E., Whiteside T.L. Clinical Significance of PD-L1+ Exosomes in Plasma of Head and Neck Cancer Patients. Clin Cancer Res. 2018; 24 (4): 896-905. DOI: 10.1158/1078-0432.CCR-17-2664.
- Wei W., Xu B., Wang Y., Wu C., Jiang J., Wu C. Prognostic significance of circulating soluble programmed death ligand-1 in patients with solid tumors: A meta-analysis. Medicine (Baltimore). 2018; 97 (3): e9617. DOI: 10.1097/MD.0000000000009617.


