Экспрессия транскрипционных факторов, сосудистого эндотелиального фактора роста и активность внутриклеточных протеиназ у больных с локализованным и диссеминированным раком почки
Автор: Спирина Людмила Викторовна, Усынин Евгений Анатольевич, Кондакова Ирина Викторовна, Юрмазов Захар Александрович, Слонимская Елена Михайловна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (64), 2014 года.
Бесплатный доступ
Цель исследования. Изучение экспрессии транскрипционных факторов NF-κB, HIF-1, ростового фактора VEGF, активности протеасом и кальпаинов у больных с локализованным и диссеминированным раком почки. Материал и методы. В исследование вошли 87 больных со светлоклеточным раком почки. Содержание транскрипционных и ростовых факторов изучено методом ИФА, активность протеасом и кальпаинов - с помощью флюорометрического метода. Результаты. Рост содержания транскрипционных факторов NF-κB, HIF-1 происходит при развитии единичных и множественных гематогенных метастазов. Коэффициент NF-κB р65/р50, свидетельствующий о количестве активных форм фактора, повышается при появлении единичных метастатических очагов и снижается при развитии множественных. Сходная динамика изменений наблюдается и в отношении содержания эндотелиального фактора роста VEGF. Отмечается низкая активность протеасом при развитии метастазирования. Характер изменения активности кальпаинов сходен с данными по содержанию активных форм NF-κB и VEGF. Заключение. Выявлены изменения в содержании транскрипционных факторов NF-κB, HIF-1, ростового фактора VEGF и активности протеиназ, регулирующих их уровень, у больных с локализованным и диссеминированным раком почки. Коэффициент NF-κB p65/ p50, содержание VEGF и активность кальпаинов можно рассматривать в качестве потенциальных молекулярных критериев, ассоциированных с прогнозом течения заболевания.
Локализованный рак почки, диссеминированный рак почки, протеасомы, кальпаины
Короткий адрес: https://sciup.org/14056444
IDR: 14056444 | УДК: 616.61-006.6:577.152.34:611-018.74
Текст научной статьи Экспрессия транскрипционных факторов, сосудистого эндотелиального фактора роста и активность внутриклеточных протеиназ у больных с локализованным и диссеминированным раком почки
По частоте встречаемости в России рак почки (РП) занимает второе место среди опухолей мочевыводящих путей, а по темпу прироста заболеваемости (43,9 %) уступает лишь раку предстательной железы [1, 2]. Основной причиной летальности больных раком почки является ранняя диссеми-нация опухоли, что определяет низкие показатели выживаемости. В настоящее время отсутствуют значимые клинические критерии и молекулярные маркеры, позволяющие предсказать характер течения заболевания и оценить возможный риск развития гематогенных метастазов. Это обусловливает важность изучения молекулярных механизмов метастазирования при РП и поиск информативных прогностических показателей.
Известно, что рак почки представляет собой гетерогенную группу опухолей, из которых 75–80 % приходится на светлоклеточный почечноклеточный рак [17], связанный с мутационными изменениями белка фон Хиппель-Линдау (VHL), которые приводят к активации ядерного фактора HIF-1 и гиперэкспрессии эндотелиального фактора роста (VEGF) [22]. Также в патогенезе рака почки важную роль играет фактор транскрипции NF- κ B (nuclear factor kappa-В), который вовлечен в регуляцию апоптоза и пролиферации клеток [14].
Одним из механизмов регуляции роста опухоли и прогрессирования заболевания является внутриклеточный протеолиз, осуществляемый протеасо-мами и кальпаинами [7]. Протеасомы представляют собой мультиферментативные каталитические комплексы, где происходит деградация до 80 % собственных белков клетки [24]. Для разрушения фактора транскрипции HIF-1 важно связывание его с белком VHL – одним из компонентов Е3 лигазы, которая в условиях нормы присоединяет убиквитины к транскрипционному фактору HIF-1α и способствует его дальнейшей деградации в протеасомах [19, 20]. При светлоклеточном почечноклеточном раке мутационные изменения белка VHL приводят к неспособности транскрипционного фактора HIF-1α утилизироваться в протеасомном комплексе, что, соответственно, обусловливает его накопле- ние в клетке [8, 19]. Следствием данных изменений является рост экспрессии VEGF, активация неоангиогенеза и прогрессирование заболевания.
Активация транскрипционного фактора NF- κ B также осуществляется протеасомами. В отсутствие стимулирующих сигналов NF- κ B находится в цитоплазме в ассоциации с ингибитором (I- κ B). Ключевым этапом активации NF- κ B является освобождение его из комплекса с I- κ B и про-теасомная деградация последнего [16]. В ткани светлоклеточного почечноклеточного рака в отсутствие функционально-активного белка VHL наблюдается повышение экспрессии и активности транскрипционного фактора NF- κ B [21]. В ранее опубликованных работах нами был показан рост экспрессии транскрипционных факторов NF- κ B, HIF-1 и ростового фактора VEGF у больных раком почки при развитии гематогенных метастазов, что сопровождается снижением активности протеасом [5, 6].
Кальцийзависимая кальпаиновая система деградации представлена внутриклеточным семейством нелизосомальных цистеиновых протеаз [4, 15, 27]. Предполагается, что кальпаины способствуют изменению структуры белков и делают их восприимчивыми для дальнейшего протеасомного расщепления [15]. По нашим данным, активность кальпаинов в ткани рака почки возрастает при развитии как лимфогенных, так и отдаленных метастазов [5]. Эти результаты согласуются с исследованием C. Braun et al., в котором показано, что уровень экспрессии кальпаина-I (m-кальпаин) в ткани светлоклеточного рака почки повышен у больных с наличием регионарных метастазов [11]. Таким образом, исследование транскрипционных и ростовых факторов, а также активности протеиназ, регулирующих их содержание, в ткани светлоклеточного рака почки является актуальным для выяснения механизмов диссеминации опухолевого процесса.
Цель исследования состоит в изучении содержания NF-κB, HIF-1α, сосудистого эндотелиального фактора роста, активности протеасом и кальпаинов в тканях рака почки у больных с локализованным и диссеминированным опухолевыми процессами.
Материал и методы
В исследование вошли 87 больных с верифицированным светлоклеточным раком почки (средний возраст – 57,6 ± 2,2 года). Локализованная форма (T1–3N0M0) рака почки выявлена у 48 больных, диссеминированный процесс – у 39 пациентов (T2–4N0–1M1), из них у 17 – диагностированы единичные гематогенные метастазы, у 22 – множественные. Больные с локализованным РП были подвергнуты хирургическому лечению в объеме резекции почки или нефрэктомии. У пациентов с метастатическим РП на этапе первичного обследования для верификации диагноза, проведения молекулярных исследований и планирования комбинированного лечения выполнялась биопсия почки. Комбинированное лечение больных с диссеминированным РП включало предоперационную таргетную терапию Вотриентом в рекомендованной дозе 800 мг ежедневно или Афинитором 10 мг в течение 2 мес. По окончании курса предоперационного лечения производилась оценка эффекта на основании критериев RECIST. Далее пациентам с диссеминированным раком почки проводилась паллиативная нефрэктомия. Проведение данной работы одобрено этическим комитетом ФГБУ «НИИ онкологии» СО РАМН.
Материалом для исследования протеасом явились образцы опухолевой ткани, полученные при выполнении диагностической биопсии у больных с множественными метастазами и из операционного материала пациентов с локализованным и диссеминированным раком почки, которые после забора замораживались и хранились при – 80°С.
Получение осветленных гомогенатов. Замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10000g и 4°С.
Определение активности протеасом. Химо-трипсинподобную активность протеасом определяли в осветленных гомогенатах опухолевых и неизмененных тканей, а также во фракциях про-теасом по гидролизу флуорогенного олигопептида N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcou- marin, утилизирующегося химотрипсинподобными центрами протеасом [10], на флуориметре «Hitachi-850» (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. Реакционная смесь для определения активности 20S протеасом содержала 20 мМ трис-HCl (pH=7,5), 1 мМ дитиотреитол, 30 мкМ N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin. Для определения активности 26S протеасом в реакционную смесь дополнительно вводили 5 мМ хлорида магния и 1 мМ АТФ. Реакцию проводили при 37°С в течение 20 мин и останавливали 1 % додецил сульфатом натрия. Для оценки активности примесных протеаз в образцах применяли специфический ингибитор протеасом – MG132. Удельную активность протеасом выражали в единицах активности на 1 мг белка. Содержание белка определяли по методу Лоури.
Определение активности кальпаинов. Активность кальпаинов определяли в осветленных гомогенатах тканей по методу Sandmann [23]. В качестве субстрата использовали тот же флуорогенный олигопептид N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, который был использован для определения активности протеасом. Такая модификация метода Sandmann предложена Kohli [18]. Реакционная смесь содержала 100 мМ Tris-HCl (pH=7,3), 145 мМ NaCl. Реакцию проводили, добавляя к 30 мкМ Suc-LLVY-AMC, растворенному в реакционной смеси, 5 мкл супернатанта и инкубируя при 25°С в течение 30 мин в присутствии или отсутствии 10 мМ CaCl2 и 0,4 мкM ингибитора N-ацетил-Leu-Leu-норлейцинал (Sigma). Ингибитор N-ацетил-Leu-Leu-норлейцинал ингибирует как кальпаины Кi=190 (220) нМ, так и протеасомы Кi=6000 нМ. Учитывая такую значительную разницу в константе ингибирования, можно считать, что этот ингибитор в высоких концентрациях (50–100 мкM) ингибирует протеасомы, а в используемой концентрации 0,4 мкМ он ингибирует кальпаины [9, 26].
Статистическая обработка. Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 6.0. В зависимости от вида распределения результаты представлены как m±M, где m – среднее выборочное, M – ошибка среднего, или как медиана с интерквартильным размахом (25-й и 75-й процентили). Значимость различий исследовали с помощью t-критерия Стьюдента или критерия Манна – Уитни. Корреляционный анализ был проведен с использованием непараметрического критерия Спирмена.
Результаты исследования
Проанализированы показатели экспрессии транскрипционных факторов NF-κB p65, NF-κB p50, HIF-1α и ростового фактора VEGF, а также исследована активность протеолитических ферментов – протеасом и кальпаинов в опухолевой ткани локализованного и диссеминированного рака почки (табл. 1). Оказалось, что уровень активной формы транскрипционного фактора NF-κB p65 был выше при наличии гематогенных метастазов и не зависел от их количества. Изменений в содержании неактивной формы NF-κB p50 отмечено не было. Коэффициент NF-κB p65/ p50, характеризующий количество активных форм фактора [12], при этом имел сложную динамику изменения: он был значимо выше у больных с наличием единичных метастазов и снижался у пациентов с множественными метастазами, достигая уровня локализованного процесса. На основании полученных данных можно полагать, что соотношение NF-κB p65/ p50 можно рассматривать в качестве информативного критерия, ассоциированного с прогрессированием рака почки.
Изучение динамики изменений экспрессии ядерного фактора HIF-1 показало, что его уровень был повышен у больных как с наличием единичных, так и множественных метастазов. Вероятно, высокий уровень транскрипционного фактора HIF-1, наряду с NF- κ B, уже на начальных этапах метастазирования приводит к росту продукции ростового фактора VEGF. По нашим данным, содержание его увеличивается в 2,87 раза по сравнению с больными без признаков прогрессии. Однако развитие множественных гематогенных метастазов сопровождается снижением количества VEGF. Можно полагать, что такая ситуация обусловлена его быстрым выходом в кровеносное русло [3, 26]. Следует отметить сходную динамику изменений содержания VEGF и коэффициента NF- κ B p65/ p50 в зависимости от уровня гематогенного метастазирования.
Анализ активности протеасом и кальпаинов в опухолевой ткани показал снижение химотрип-синподобной активности протеасом у больных с единичным отдаленным и множественными метастазами в 1,33 и 1,36 раза соответственно, по сравнению с пациентами с локализованным РП (табл. 2).
Содержание транскрипционных факторов NF- κ b p65, NF- κ b p50, HiF-1 α и ростового фактора VEGF у больных раком почки
Таблица 1
|
Группы больных |
Содержание NF- κ B p65, УЕ/мг белка в лунке |
Содержание NF- κ B p50, УЕ/мг белка в лунке |
Коэффициент NF- κ B p65/p50 |
Экспрессия HIF-1 α , УЕ/ мг белка в лунке |
Содержание VEGF, пг/мг белка |
|
Локализованный РП |
5,0 (2,0–7,9) |
6,4 (3,3–10,0) |
0,6 (0,3–2,0) |
4,2 (2,2–7,8) |
71,5 (38,3–139,7) |
|
РП с единичными метастазами |
11,3 (6,8–15,7)* |
6,2 (4,4–9,7) |
3,0 (1,6–3,0)* |
7,9 (6,2–8,5)* |
205,4 (131,7–261,5)* |
|
РП с множественными метастазами |
11,5 (6,7–32,5)* |
10,6 (6,3–37,7) |
0,92 (0,83–1,07)** |
18,7 (4,2–19,4)* ** |
26,8 (11,0–99,2)* ** |
Примечание: * – различия статистически значимы по сравнению с группой больных с локализованным РП (p<0,05); ** различия статистически значимы по сравнению с группой больных с единичным метастазом РП (р<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 4
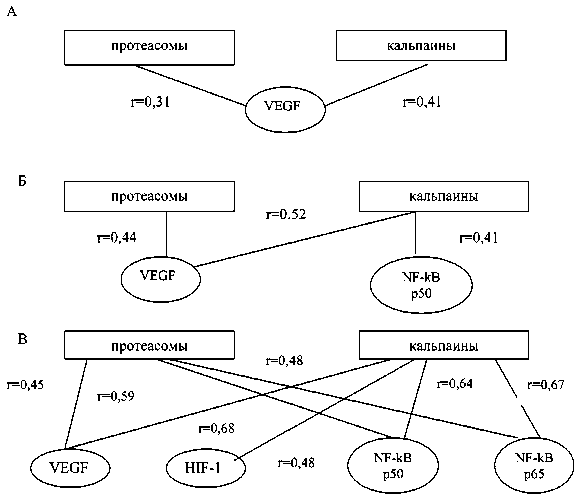
Рис. 1. Корреляционные связи между активностью протеасом, кальпаинов и экспрессией транскрипционных факторов HIF-1, NF-κB и содержанием ростового фактора VEGF у больных раком почки: А – у больных с локализованным раком почки; Б – у больных с единичным отдаленным метастазом; В – у больных со множественными метастазами; r – коэффициент корреляции Спирмена
При изучении общей кальпаиновой активности выявлена волнообразная динамика изменения этого показателя, которая была связана с распространенностью процесса. Так, увеличение активности кальпаинов в ткани опухоли почки совпало с начальным этапом метастазирования. Дальнейшее прогрессирование заболевания сопровождается резким падением активности этих ферментов, и у больных с множественными метастазами данный показатель снижен по сравнению как с больными с локализованным процессом, так и с пациентами, у которых диагностированы единичные метастазы. Учитывая однонаправленность изменений содержания VEGF и активности кальпаинов, наблюдаемых в процессе метастазирования, можно предположить, что именно кальпаины осуществляют протеолитическую регуляцию уровня этого ростового фактора и обеспечивают его быстрый внутриклеточный метаболизм. Исследованиями последних лет была обозначена роль кальпаинов в процессах деградации белков в клетке, которая наблюдается в отсутствие необходимого количества протеасом, а также при угнетении их ферментативной активности [25]. Возрастающая активность внутриклеточного протеолиза в этих условиях обеспечивается именно кальпаинами. Кроме того, химотрипсинподобная активность протеасом и активность кальпаинов у больных раком почки
Таблица 2
|
Группы больных |
Активность протеасом в опухолевой ткани, ×103 Ед/мг белка |
Активность кальпаинов в опухолевой ткани, ×103 Ед/мг белка |
|
Локализованный РП (n=48) |
36,1 (20,0–102,0) |
33,5 (16,8–33,5) |
|
РП с единичным метастазом (n=17) |
27,0 (5,5–43,1)* |
44,7 (18,6–54,3)* |
|
РП с множественными метастазами (n=22) |
26,4 (4,1–50,0)* |
7,6 (4,1–22,2)* ** |
Примечание: * – различия статистически значимы по сравнению с группой больных с локализованным РП (p<0,05); ** различия статистически значимы по сравнению с группой больных с единичным метастазом РП (р<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 4
известна их значимость в активации локомоторных свойств опухолевых клеток [13]. Возможно, в связи с этим фактом можно обсуждать их роль в развитии гематогенного метастазирования у больных раком почки.
Для подтверждения связи между содержанием транскрипционных факторов, VEGF и внутриклеточными протеиназами в опухолевой ткани при локализованном и диссеминированном раке почки был проведен корреляционный анализ (рис. 1). Оказалось, что при локализованных процессах содержание VEGF в ткани опухоли коррелировало с тотальной активностью протеасом (r=0,31) и активностью кальпаинов (r=0,41). У больных с единичными метастазами рака почки дополнительно наблюдалось формирование связи между активностью кальпаинов и содержанием NF- κ B p50 (r=0,41). Развитие множественных метастазов сопровождалось возникновением корреляций между экспрессией транскрипционного фактора NF- κ B p65, активностью протеасом (r=0,48) и каль-паинов (r=0,67), а также между уровнем ядерного фактора HIF-1 и активностью кальпаинов (r=0,68). Полученные данные свидетельствуют о значимости протеолитической регуляции содержания транскрипционных и ростовых факторов, которая ассоциирована с прогрессированием заболевания. Также подтверждена важная роль кальпаинов в регуляции экспрессии ядерного фактора HIF-1, поскольку они способны модифицировать данный белковый комплекс. Важно отметить, что полное разрушение транскрипционного фактора HIF-1 в ткани рака почки возможно только при участии 26S протеасом [16, 22]. Вероятно, кальпаины осуществляют его частичный гидролиз, тем самым регулируя его содержание [17].
Заключение
Изучение особенностей экспрессии транскрипционных и ростовых факторов и определение особенностей внутриклеточного протеолиза, осуществляющего их регуляцию, в ткани опухоли у больных с локализованной и диссеминированной формой рака почки свидетельствует о значимости этих процессов в патогенезе заболевания. Уже на этапе появления единичных метастатических очагов наблюдается выраженный рост уровня активных форм NF- κ B, содержания HIF-1 α и VEGF. На этом этапе также возрастает активность каль-паинов, тогда как активность протеасом снижается.
Дальнейшее развитие процесса метастазирования сопровождается снижением содержания активных форм NF- κ B, VEGF и угнетением активности каль-паинов. Вероятно, сопряженность уровня транскрипционных, ростовых факторов с активностью внутриклеточных протеиназ и распространенностью заболевания позволяет рассматривать эти факторы в качестве дополнительных информативных прогностических параметров. К их числу, по нашим данным, можно отнести активность каль-паинов, соотношение NF- κ B p65/ p50 и содержание VEGF, использование которых позволит с высокой вероятностью прогнозировать риск появления гематогенных опухолевых очагов.


