Экспрессия васкулоэндотелиального и тромбоцитарного факторов роста в первичной опухоли колоректального рака как фактор прогноза раннего рецидива
Автор: Богомолова И.А., Долгова Д.Р., Антонеева И.И., Генинг Т.П., Кузнецова Т.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Прогностическими факторами, определяющими тактику лечения при колоректальном раке (КРР), являются стадия заболевания, степень дифференцировки опухоли, микросателлитная нестабильность, степень инвазии, индекс пролиферативной активности. При этом оценка эффективности адъюватной химиотерапии при КРР не предполагает оценку ангиогенных факторов в первичной опухоли. Цель работы - оценить прогностическую роль экспрессии PDGFAA и VEGFA в опухолевой ткани на II-III стадиях колоректального рака. Материалы и методы. В качестве материала для исследования использованы парафиновые блоки первичной опухоли КРР (n=50). С помощью метода ИГХ исследована экспрессия васкулоэндотелиального и тромбоцитарного факторов роста путем расчета ИГХ-балла в опухолевой паренхиме и строме КРР. Результаты. По результатам ИГХ-окрашивания опухоль КРР экспрессирует факторы VEGFA и PDGFAA в 92 % случаев, в линии резекции - в 37 % образцов. Отличий в экспрессии VEGFA и PDGFAA в опухолевой паренхиме при КРР в зависимости от стадии процесса, степени дифференцировки выявлено не было. Кумулятивный риск прогрессирования заболевания в течение года после операции у больных с КРР II-III стадий при гиперэкспрессии VEGFA+PDGFAA в первичной опухоли выше в 4,9 раза (ДИ 2,123-11,089, р=0,011) по сравнению с группой пациентов со сниженной продукцией изученных ангиогенных факторов. Выводы. Полученные данные позволяют предполагать, что коэкспрессия ангиогенных факторов VEGFA и PDGFAA в опухоли может отражать исходный профиль КРР в отношении неоангиогенеза. При ИГХ-балле VEGFA и/или PDGFAA выше или равном 6 возрастает риск рецидива заболевания в течение 1 года от момента начала наблюдения, что является неблагоприятным прогностическим фактором.
Колоректальный рак, васкулоэндотелиальный фактор роста, тромбоцитарный фактор роста, адъювантная химиотерапия
Короткий адрес: https://sciup.org/14117598
IDR: 14117598 | УДК: 616.34-006.6:616-08-059 | DOI: 10.34014/2227-1848-2020-4-74-86
Текст научной статьи Экспрессия васкулоэндотелиального и тромбоцитарного факторов роста в первичной опухоли колоректального рака как фактор прогноза раннего рецидива
Введение. Колоректальный рак (КРР) занимает лидирующие позиции в структуре онкологической заболеваемости в мире и РФ, причем в последние 10 лет отмечается неуклонная тенденция к росту заболеваемости. Среднегодовой прирост заболеваемости в период 2008–2018 гг. составил 1,47 % (стандартизированные показатели на 100 тыс. населения), заболеваемость КРР в России в этот период возросла с 77,6 до 111,6 на 100 тыс. населения [1, 2].
Адъювантная полихимиотерапия (АХТ) по схемам FOLFOX и HELOX, являясь стан- дартом лечения КРР на II–III стадиях заболевания после проведенного радикального оперативного вмешательства, сопровождается низкой ожидаемой эффективностью. Значительная часть пациентов, особенно на III стадии заболевания, не получает преимуществ от АХТ, что приводит в 30 % случаев к возникновению отдаленного метастазирования в течение 1 года после окончания лечения. В исследовании PETACC-8 эффективность АХТ не была установлена и не меняла значений безрецидивной выживаемости [3]. Проблема ранних рецидивов при стандартном химиоте- рапевтическом подходе при КРР состоит в том, что назначение АХТ на II–III стадиях заболевания в настоящее время проводят без определения каких-либо предиктивных молекулярно-генетических маркеров чувствительности опухоли. В 30 % случаев это приводит к использованию малоэффективных препаратов, развитию выраженных побочных эффектов и вторичной химиорезистентности. Прогностическими факторами, определяющими тактику лечения при КРР, являются стадия заболевания, степень дифференцировки опухоли, микросателлитная нестабильность, степень инвазии, индекс пролиферативной активности [4]. Клиническими маркерами для оценки эффективности полихимиотерапии (ПХТ) являются определение СА19/9 и РЭА в сыворотке крови пациентов с КРР в динамике лечения, однако чувствительность данного метода невелика.
Семейство факторов роста тромбоцитов (PDGF) включает 5 изоформ специфических лигандов: PDGF-AA, PDGFAB, PDGFBB, PDGFCC и PGDFDD, которые взаимодействуют с тремя димерами их рецепторов и инициируют комплексный сигнальный каскад МАP-киназы. Показано, что PDGF являются важными факторами для нормального роста и деления тканей, участвующих в формировании кровеносных сосудов. При этом сигнальный путь PDGFs/PDGFRs` участвует в ангиогенезе в основном за счет перицитов и гладкомышечных клеток сосудов. Каскад МАP-ки-назы, инициируемый PDGF, активирует специфические гены, участвующие в ангиогенезе, пролиферации, инвазии и метастазировании [5].
Существует точка зрения, что тромбоцитарный фактор роста регулирует миграцию, инвазию, пролиферацию, апоптоз и метастазирование в различных раковых клетках. Сверхэкспрессия PDGFD наблюдается при ряде злокачественных новообразований человека, включая рак груди, простаты и поджелудочной железы. Также показано, что PDGFD активируется не только в тканях при КРР, но также и в клеточных линиях КРР [6]. Результаты исследований, выполненных на клеточной линии рака толстой кишки DLD-1, позволили авторам представить инициацию КРР с экспрессией TGFb, который секретируется клетками КРР, активирует рецепторы TGFb в опухолевых клетках и усиливает экспрессию PDGFD. Последний активирует сверхэкспрессию рецепторов PDGFR в опухолевых клетках. Таким образом, процесс замыкается на аутокринных или паракринных механизмах. Далее, по мнению авторов, PDGFRb активирует сигнальную молекулу FP3 в мембране; в итоге THBS4 секретируется во внеклеточное пространство и индуцирует адгезию, ангиогенез и пролиферацию в опухоли [7].
В то же время, по данным ряда авторов, не наблюдалось различий в тканевых уровнях экспрессии PDGFD в опухолевых и нормальных тканевых лизатах при КРР [8], либо экспрессия белка PDGFD была сильнее в нормальной ткани по сравнению с опухолевой тканью [9].
Показано, что экспрессия PDGFB в основном локализовалась как в нормальных эпителиальных клетках, выстилающих кровеносные сосуды, так и в связанных с опухолью стромальных клетках злокачественного микроокружения. А экспрессия активированной формы рецептора phPDGFR-b наблюдалась как в эпителиальных клетках нормальной ткани, так и в строме опухолевой ткани [10, 11].
Роль VEGF в прогрессировании КРР трудно переоценить. Анти-VEGF-терапия входит в стандарт лечения. В то же время при локализованном процессе антиангиогенные препараты не демонстрируют должной эффективности [12, 13]. При этом вклад VEGF в канцерогенез КРР не ограничивается стимуляцией ангиогенеза и васкулогенной мимикрии [14]. В исследованиях in vitro показано, что ингибирование внутриклеточной передачи сигналов VEGF сильно подавляет миграцию и инвазию опухолевых клеток, воздействуя на белки, участвующие в подвижности клеток [15]. В то же время данные литературы о прогностической ценности VEGFA противоречивы [16].
Цель исследования. Оценить прогностическую роль экспрессии PDGFAA и VEGFA в опухолевой ткани КРР.
Материалы и методы. Ретроспективное исследование выполнено на базе ГУЗ Областной клинический онкологический диспансер г. Ульяновска (УОКОД). Исследуемая группа пациентов имела верифицированный рак толстого кишечника, подтвержденный гистологическим исследованием опухоли до проведения специального лечения. За период 2014– 2018 гг. отобрана группа пациентов (n=50), проходивших лечение в ГУЗ УОКОД и подписавших добровольное информированное согласие на участие в исследовании.
Описание клинико-морфологических параметров опухоли в исследуемой группе пациентов с КРР представлено в табл. 1. В большинстве случаев опухоль локализовалась в левой половине ободочной кишки и прямой кишке – 74 % (n=37), локализация опухоли в правом отделе встретилась в 26 % случаев (n=13) (табл. 1). Общее состояние пациентов оценивалось по 4-балльной шкале ECOG и на момент прохождения специального лечения не превышало 2 баллов. Ожидаемая продолжительность жизни у всех пациентов была не менее 12 мес. АХТ по схеме: 5-фторпирими-дины + оксалиплатин (FOLFOX/XELOX) – всем пациентам назначалась через 4–6 нед. после операции. Оценка клинической эффективности лечения проводилась каждые 2 мес. (4 курса FOLFOX / 2 курса XELOX), а также после завершения всех курсов АХТ. План обследования включал общеклинический и биохимический анализ крови, общий анализ мочи, кровь на РЭА, СА 19/9, лучевые методы (рентгенография органов грудной клетки в двух проекциях, УЗИ органов брюшной полости, малого таза, забрюшинного пространства). При сомнительных результатах стандартных методов обследования выполнялась мультиспиральная компьютерная томография или магнитно-резонансная томография органов грудной клетки, брюшной полости, ма- лого таза с внутривенным контрастированием. По окончании лечения пациенты находились под динамическим наблюдением врача-онколога с периодическим контрольным обследованием в соответствии со стандартными критериями ВОЗ.
Учитывая промежуток времени от момента окончания АХТ до прогрессирования заболевания все пациенты были разделены на группы:
-
- платиночувствительные – длительность бесплатинового интервала более 6 мес.;
-
- платинорезистентные – длительность бесплатинового интервала менее 6 мес.;
-
- платинорефрактерные – прогрессирование процесса во время АХТ или в течение одного месяца после лечения.
Анализировалась безрецидивная выживаемость – промежуток времени с момента начала ПХТ до развития рецидива или появления метастазов. Время до прогрессирования заболевания определялось как промежуток времени от момента начала наблюдения до даты фиксирования рецидива или метастазирования опухоли.
Критериями исключения из исследования стали: IV стадия заболевания, отдаленные метастазы, предоперационная лучевая или хи-миолучевая терапия, АХТ только фторпирими-динами, соматические заболевания в стадии декомпенсации, противопоказания к проведению ПХТ, «положительный» край резекции при гистологическом исследовании опухоли.
Все исследования проводились после одобрения локальным этическим комитетом Института медицины, экологии и физической культуры ФГБОУ ВО «Ульяновский государственный университет» (протокол № 9 от 15.09.2017).
Таблица 1
Table 1
Характеристика больных КРР, включенных в экспериментальную группу
Characteristics of CRC patients included in the experimental group
|
Показатель Characteristic |
Количество Number |
|
Пол: Gender: мужской male женский female |
25 (50 %) 25 (50 %) |
|
Возраст: Age: 25–44 45–59 60–75 |
7 (14 %) 26 (54 %) 17 (32 %) |
|
Стадия заболевания: Disease status: II III |
13 (26 %) 37 (74 %) |
|
Локализация опухоли: Tumor localization: С18 С19 С20 |
32 (64 %) 3 (6 %) 15 (30 %) |
|
Степень дифференцировки опухоли (G): Tumor grade (G): низкодифференцированная (G3) high (G3) умеренно дифференцированная (G2) moderate (G2) высокодифференцированная (G1) low (G1) |
4 (8 %) 21 (42 %) 13 (26 %) |
|
Показатель T: T score: 2 3 4 |
2 (4 %) 33 (66 %) 15 (30 %) |
|
Показатель N: N score: 0 1 2 |
20 (36 %) 24 (50 %) 6 (14 %) |
|
Наличие мутаций EGFR-сигнального пути (nRAS, kRAS, BRAF): EGFR signaling pathway mutations (nRAS, kRAS, BRAF): есть yes нет no |
21 (42 %) 29 (58 %) |
ИГХ-исследование выполнялось на парафиновых срезах опухолевой ткани. Срезы толщиной 5 мкм, содержащие не менее 70–80 % клеток аденокарциномы толстого кишечника, переносились на предметные стекла SuperFrost. Затем срезы в горизонтальном положении помещались в термостат на 30 мин при температуре 60 °С. Инкубация с первичными антителами (табл. 2) проводилась в течение 45 мин при комнатной температуре. В качестве визуализирующей системы использовали Н-Gistofain Simple Stain Max (Nicherei, Yapan) в комплексе с DAB. В качестве позитивного контроля – ткань почки. Полуколиче-ственная оценка проводилась с помощью рас- чета ИГХ-балла, представляющего собой произведение баллов процента и интенсивности положительно окрашенных опухолевых/стро-мальных клеток [17, 18]. Количество положительно окрашенных клеток оценивалось следующим образом: нет положительных клеток – 0 баллов; 1–25 % – 1 балл; 26–50 % – 2 балла; 50 % и более – 3 балла. Интенсивность ИГХ-окрашивания определялась по следующим критериям: отсутствие окрашивания – 0; слабая – 1; умеренная – 2; сильная – 3. Таким образом, ИГХ-балл в образцах опухоли КРР варьировал от 0 до 9. В качестве внутреннего контроля использовался образец нормальной слизистой оболочки толстой кишки (n=5).
Таблица 2
Table 2
|
Антитела Antibody |
Разведение, концентрация Dilution, concentration |
Каталожный номер, фирма производитель Catalog number, manufacturer |
|
VEGFA (Rabbit Polyclonal antibody to VEGF (Vascular endothelial growth factor A) |
1:800 1,36 mg/ml |
GTX102643 GeneTek, USA |
|
PDGFAA (Rabbit Polyclonal antibody to PDGFAA (Platelet Derived Growth Factor AA) |
1:250 0,31 mg/ml |
PAA523Hu01 Cloud Clone, USA |
Характеристика использованных первичных антител Characteristics of the primary antibodies used
Результаты. С целью оценки комплексного влияния ангиогенных факторов в опухоли на время до прогрессирования у больных с КРР II–III стадий был использован ИГХ-балл, учитывающий и VEGFА-, и PDGFAA-статус. ИГХ-балл, равный или более 6, указывает на умеренную или сильную экспрессию белка более чем в 50 % опухолевых клеток (рис. 1, 2).
Нами установлено, что в 92 % случаев опухоль КРР экспрессирует VEGFA и PDGFAA, в линии резекции – в 37 % образцов. При ИГХ-реакции опухолевая паренхима в большинстве препаратов окрашивается од- нородно, включая от 50 до 100 % опухолевых клеток. Строма в подавляющем числе случаев окрашена диффузно, очагово и менее интенсивно. Яркую позитивную реакцию дают отдельные клетки микроокружения (фибробласты, лимфоциты).
Отличий в экспрессии VEGFA и/или PDGF-AA в опухолевой паренхиме при КРР в зависимости от стадии процесса, степени дифференцировки выявлено не было. При разделении пациентов с КРР на группы по чувствительности к препаратам платины отличий между ИГХ-баллами по VEGFA и PDGFAA также не установлено (рис. 3).
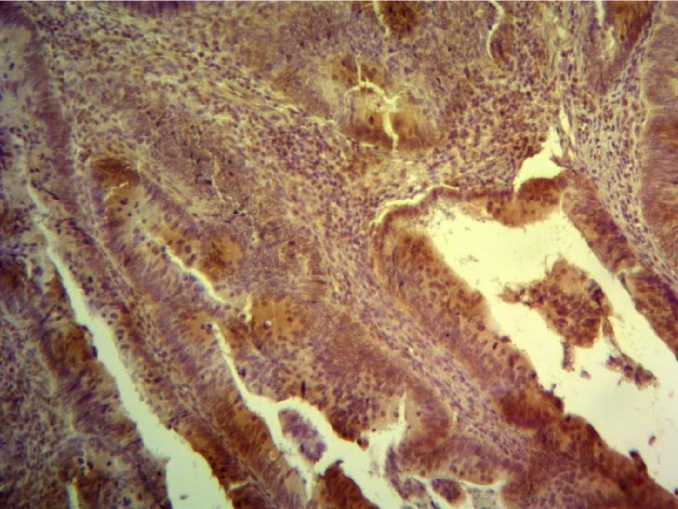
А А
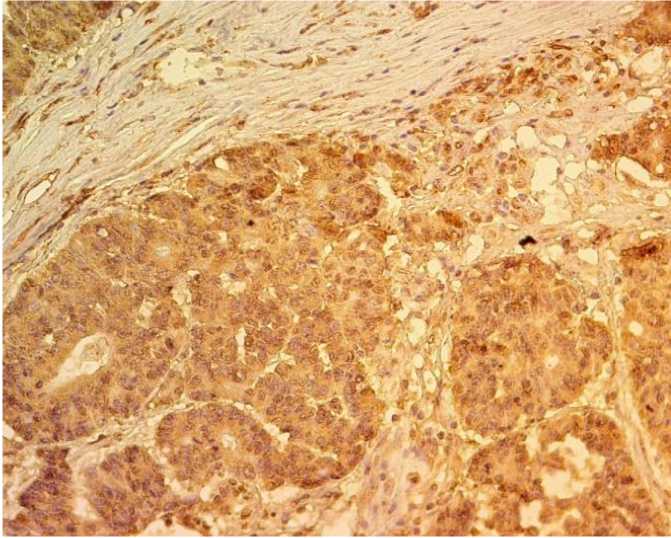
Б В
Рис. 1. ИГХ-реакция для VEGFA в аденокарциноме толстой кишки: А – неоднородное умеренное цитоплазматическое окрашивание опухоли, ×400; Б – выраженная ИГХ-реакция, ×400
-
Fig. 1. IHC staining for VEGFA in colon adenocarcinoma: A – non-homogeneous moderate cytoplasmic tumor staining, ×400;
B – strong IHC staining, ×400
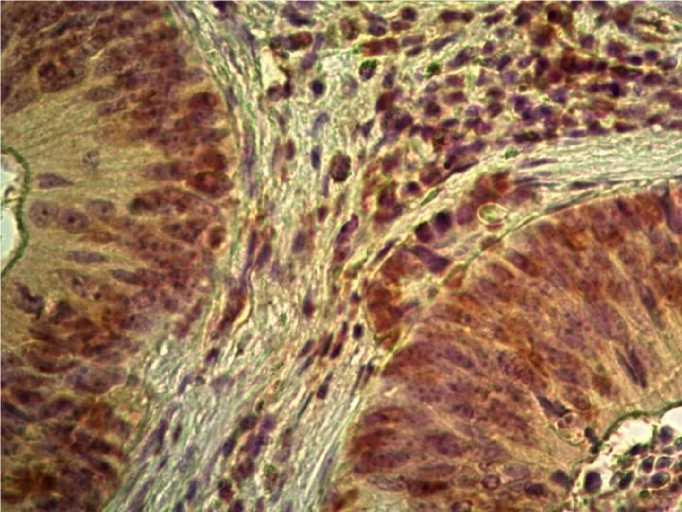
А А
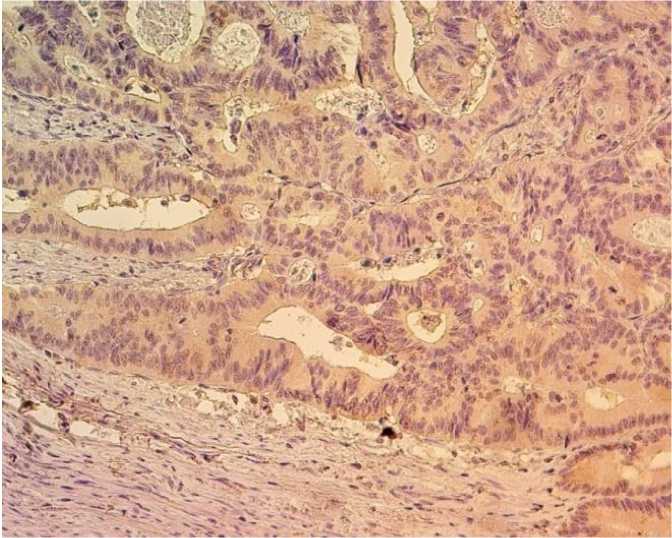
Б В
Рис. 2. ИГХ-реакция для PDGFAA:
А – умеренная цитоплазматическая и ядерная реакция в умеренно дифференцированной аденокарциноме толстого кишечника при отсутствии стромального окрашивания (ИГХ-балл равен 6), ×1000;
Б – слабая однородная реакция (ИГХ-балл равен 3), ×400
-
Fig. 2. IHC staining for PDGFAA:
A – moderate cytoplasmic and nuclear staining in moderately differentiated colon adenocarcinoma without stromal staining (IHC score = 6), ×1000;
B – weak homogeneous staining in adenocarcinoma cells (IHC score = 3), ×400

I платиночувствительные platinum-sensitive
Рис. 3. ИГХ-балл VEGFA и PDGFAA в первичной опухоли КРР в группах пациентов с разной платиночувствительностью
Fig. 3. IHC score for VEGFA and PDGFAA in primary CRC tumor in patients with different platinum sensitivity
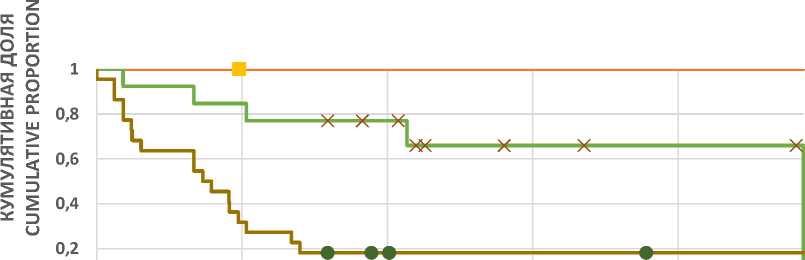
Анализ выживаемости по Каплану–Майеру в зависимости от ИГХ-балла, учитывающий суммарный экспрессионный профиль VEGFA и/или PDGFAA, свидетельствует о выраженном укорочении времени без прогрессирования у тех пациентов с КРР II–III стадий,
у которых в первичной опухоли ИГХ-балл составил 6 и более. Медиана показателя выживаемости в группе пациентов с ИГХ-бал-лом менее 6 не была достигнута, c ИГХ-бал-лом от 6 составила 12 мес. (log-rank-критерий p=0,0003) (рис. 4).
^^^^^^a ИГХ балл VEGFA/PDGFAA <6 ICH score of VEGFA/PDGFAA<6
X ИГХ балл VEGFA/PDGFAA <6 ICH score of VEGFA/PDGFAA<6-cens ^^^^^^^B ИГХ балл VEGFA/PDGFAA ≥6 ICH score of VEGFA/PDGFAA ≥6
0 500 1000 1500 2000
ДНИ DAYS
Рис. 4. Кривая выживаемости без прогрессирования больных с КРР в зависимости от ИГХ-балла VEGFA/PDGFAA в опухоли
Fig. 4. Curve of progression-free survival in CRC patients depending on the IHC score for VEGFA/PDGFAA in the tumor tissue
Кумулятивный риск прогрессирования заболевания в течение года после операции у больных с КРР II–III стадий при гиперэкспрессии VEGFA+PDGFAA в первичной опухоли оказался выше в 4,9 раза (ДИ 2,123–11,089, р=0,011) по сравнению с группой пациентов со сниженной продукцией изученных ангиогенных факторов.
Обсуждение. Патогенез КРР связан с процессами активации онкогенов и инактивации антионкогенов. Полученные нами результаты, подтверждающие значимое усиление экспрессии PDGF в опухолевой ткани по сравнению с парными нормальными образцами ткани толстого кишечника, позволяют предполагать важную роль фактора роста тромбоцитов в канцерогенезе толстой кишки.
Среди ряда факторов, участвующих в ангиогенезе, VEGFA широко исследован в качестве прогностических маркеров, но его значимость в прогнозировании исхода больных КРР довольно спорная. Действительно, в то время как некоторые исследования показывают связь между сверхэкспрессией VEGFA и плохими исходами КРР [19–21], другие демон-
стрируют, что либо VEGFA не имеет значительной прогностической ценности у пациентов с КРР [22–25], либо он предполагает прогностическую значимость только в сочетании с другими факторами [26, 27]. Нами обнаружена положительная связь средней силы по Пирсону между процентом позитивно окрашенных опухолевых клеток к VEGFA и PDGFAA (R=0,461; p=0,026). Коэкспрессия ангиогенных факторов в опухоли может отражать исходный профиль КРР в отношении неоангиогенеза.
Заключение. Гиперэкспрессия VEGFA и PDGFAA в опухоли является фактором неблагоприятного прогноза при КРР и связана с высокой частотой рецидивов и возникновения опухолевых диссеминатов на фоне или в течение одного года после проведения АХТ. Опухолевые клетки при аденокарциноме толстого кишечника одновременно экспрессируют эти белки, включенные в процесс васкуляризации на разных этапах неоангиогенеза. Представляется целесообразной совместная ИГХ-оценка этих факторов, что имеет прогностическую значимость в отношении эффективности АХТ на II–III стадиях КРР.
Список литературы Экспрессия васкулоэндотелиального и тромбоцитарного факторов роста в первичной опухоли колоректального рака как фактор прогноза раннего рецидива
- Каприна А.Д., Старинский В.В., Петрова Г.В., ред. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена, филиал ФГБУ "НМИЦ радиологии"; 2019. 236.
- Федянин М.Ю. Адъювантная терапия больных раком толстой кишки II стадии - трудное решение для химиотерапевта. Злокачественные опухоли. 2019; 9 (3s1): 15-22.
- Laurent-Puig P., Marisa L., Taieb J. Colon cancer molecular subtype intratumoral heterogeneity and its prognostic impact: An extensive molecular analysis of the PETACC-8. Annals of Oncology. 2018; 29 (suppl. 8): 60.
- Bosman F. T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumors the digestive system. Vol. 3. 4th Edition. Lyon; 2010. 417.
- Roberta M., Manzat S., Balacescu L., Gherman C., Chira R.I., Craiu A., Mircea P.A., Lisencu C., Balacescu O. The Role of PDGFs and PDGFRs in Colorectal Cancer. Mediators of Inflammation. 2017; 2017: 4708076.
- Jiang B., Chen J., Yuan W., Ji J., Liu Z., Wu L., Tang, Q., Shu X. Platelet-derived growth factor-D promotes colorectal cancer cell migration, invasion and proliferation by regulating Notch1 and matrix metalloproteinase-9. Oncology Letters. 2018; 15 (2): 1573-1579.
- Kim M.S., Choi H.S., Wu M. Potential Role of PDGFRp-Associated THBS4 in Colorectal Cancer Development. Cancers (Basel). 2020; 12 (9): 2533.
- Chen J., Yuan W., Wu L., Tang Q., Xia Q., Ji J. PDGF-D promotes cell growth, aggressiveness, angiogenesis and EMT transformation of colorectal cancer by activation of Notch1/Twist1 pathway. Oncotarget. 2017; 8 (6): 9961-9973.
- Olsen R.S., Dimberg J., Geffers R., Wagsater D. Possible Role and Therapeutic Target of PDGF-D Signalling in Colorectal Cancer. Cancer Invest. 2019; 37 (2): 99-112.
- Lindmark G., Sundberg C., Glimelius B., Pahlman L., Rubin K., Gerdin B. Stromal expression of platelet-derived growth factor beta-receptor and platelet-derived growth factor B-chain in colorectal cancer. Lab. Invest. 1993; 69 (6): 682-689.
- Sundberg C., Ljungstrom M., Lindmark G., Gerdin B., Rubin K. Microvascular pericytes express platelet-derived growth factor-beta receptors in human healing wounds and colorectal adenocarcinoma. Am. J. Pathol. 1993; 143 (5): 1377-1388.
- Федянин М.Ю., Гладков О.А., Гордеев С.С., Рыков И.В., Трякин А.А. Практические рекомендации по лекарственному лечению рака ободочной кишки и ректосигмоидного соединения. Злокачественные опухоли. 2019; 9 (3s2): 324-364.
- Chibaudel B., Henriques J., Rakez M., Brenner B., Won Kim T., Martinez-Villacampa M., Gallego-Plazas J., Cervantes A., Shim K., Jonker D., Guerin-Meyer V., Mineur L., Banzi C., Dewdney A., Dejthevaporn T., Bloemendal H., Roth A., Moehler M., Aranda E., Cutsem E.V., Tabernero J., Schmoll H.-J., Hoff P., Andre T., de Gramont A. Association of Bevacizumab Plus Oxaliplatin-Based Chemotherapy With Disease-Free Survival and Overall Survival in Patients With Stage II Colon Cancer: A Secondary Analysis of the AVANT Trial. JAMA Network Open. 2020; 3 (10): e2020425.
- Lizarraga-Verdugo E., Avendano-Felix M., Bermudez M., Ramos-Payan R., Perez-Plasencia C. Cancer Stem Cells and Its Role in Angiogenesis and Vasculogenic Mimicry in Gastrointestinal Cancers. Frontiers in oncology. 2020; 10: 413.
- Bhattacharya R., Fan F., Wang R., Ye X., Xia L., Boulbes D., Ellis M.L. Intracrine VEGF signalling mediates colorectal cancer cell migration and invasion. Br. J. Cancer. 2017; 117: 848-855.
- Dinami R., Porru M., Amoreo C.A., Sperduti I., Mottolese M., Buglioni S., Marinelli D., Maugeri-SaccaM., Sacconi A., Blandino G., Leonetti C., Di Rocco G., Verdina A., Spinella F., Fiorentino F., Ciliberto G., Biroccio A., Zizza P. TRF2 and VEGF-A: an unknown relationship with prognostic impact on survival of colorectal cancer patients. J. Exp. Clin. Cancer Res. 2020; 39: 111.
- Medves S., Duhoux F., Ferrant A., Toffalini F., Ameye G., Libouton J.-M., Poirel H.A., Demoulin J.-B. KANK1, a candidate tumor suppressor gene, is fused to PDGFRB in an imatinib responsive myeloid neoplasm with severe thrombocythemia. Leukemia. 2010; 24: 1052-1055.
- Terris B., Scoazec J.Y., Rubbia L., Bregeaud L., Pepper M.S., Ruszniewski P., Belghiti J., Flejou J., De -gott C. Expression of vascular endothelial growth factor in digestive neuroendocrine tumours. Histo-pathology. 1998; 32: 133-138.
- Kang S.M., Maeda K., Onoda N., Chung Y.S., Nakata B., Nishiguchi Y., Sowa M. Combined analysis of p53 and vascular endothelial growth factor expression in colorectal carcinoma for determination of tumor vascularity and liver metastasis. Int. J. Cancer. 1997; 74 (5): 502-507.
- Zafrellis K., Agrogiannis G., Zachaki A., Gravani K., Karameris A., Kombouras C. Prognostic significance of VEGF expression evaluated by quantitative immunohistochemical analysis in colorectal cancer. J. Surg. Res. 2008; 147 (1): 99-107.
- Des Guetz G., Uzzan B., Nicolas P., Cucherat M., Morere J.F., Benamouzig R., Breau J.-L., Perret G.-Y. Microvessel density and VEGF expression are prognostic factors in colorectal cancer. Meta-analysis of the literature. Br. J. Cancer. 2006; 94 (12): 1823-1832.
- Lee J.C., Chow N.H., Wang S.T., Huang S.M. Prognostic value of vascular endothelial growth factor expression in colorectal cancer patients. Eur. J. Cancer. 2000; 36 (6): 748-753.
- Takahashi Y., Tucker S.L., Kitadai Y., Koura A.N., Bucana C.D., Cleary K.R., Ellis L.M. Vessel counts and expression of vascular endothelial growth factor as prognostic factors in node-negative colon cancer. Arch. Surg. 1997; 132 (5): 541-546.
- Zheng S., Han M.Y., Xiao Z.X., Peng J.P., Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularizationin colorectal carcinoma. World J. Gastroenterol. 2003; 9 (6): 1227-1230.
- Zygon J., Szajewski M., Kruszewski W.J., Rzepko R. VEGF, Flt-1, and microvessel density in primary tumors as predictive factors of colorectal cancer prognosis. Mol. Clin. Oncol. 2017; 6 (2): 243-248.
- Saad R.S., Liu Y.L., Nathan G., Celebrezze J., Medich D., Silverman J.F. Endoglin (CD105) and vascular endothelial growth factor as prognostic markers in colorectal cancer. Mol. Pathol. 2004; 17 (2): 197-203.
- Martins S.F., Reis R.M., Rodrigues A.M., Baltazar F., Filho A.L. Role of endoglin and VEGF family expression in colorectal cancer prognosis and anti-angiogenic therapies. World J. Clin. Oncol. 2011; 2 (6): 272-280.


