Экстракт проантоцианидов виноградной косточки в технологии получения живых кормов
Автор: Зеленченкова А.А., Мамонова А.С., Шишанов Г.А., Липпо И.Е.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 3 (55), 2024 года.
Бесплатный доступ
Обобщены современные фундаментальные и экспериментальные знания об эффективности, возможных механизмах и целесообразности применения экстракта растительного происхождения в качестве кормового компонента. Объектом исследования являлись цисты и науплии Артемии (Artemia salina) алтайской популяции. Цель исследования - изучить влияние экстракта проантоцианидов виноградных косточек (ЭПВК) на инкубационную активность и биоинкапсуляционные свойства науплиусов артемии. Задача эксперимента - исследовать ЭПВК в концентрации 7 и 14 мг/мл в качестве активатора и антиоксиданта. Инкубация цист проводилась стандартным методом в аппаратах «Вейса» без декапсуляции. В результате проведенных опытов установлено увеличение вылупления науплиусов с одновременным повышением антиоксидантного статуса. Процент выклева определяли через 24 ч и 36 ч после начала инкубации, подсчитывая свободноплавающие науплии в поле зрения микроскопа. Выход живых науплиусов артемии составил от 65 до 85%. Полученные образцы живых науплиусов артемии исследованы на суммарную концентрацию водорастворимых антиоксидантов (СКВА) как в нативном виде, так и после высушивания при 60 °C. Уровень антиоксидантов в нативных образцах составлял 0,575-0,661 мг/г, после высушивания - 3,08-3,64 мг/г. Результаты исследования расширяют знания о влиянии методов получения живого корма для аквакультуры путем добавления девяностопятипроцентного экстракта проантоцианидов виноградных косточек (Vitis vinifera L.) в инкубационный раствор. Это позволяет повысить эффективность инкубации и антиоксидантную активность свободно плавующих науплиев артемии, что может повысить питательную ценность стартовых кормов для личинок рыб.
Экстракт проантоцианидов виноградных косточек, науплиусы артемии, живые корма, антиоксиданты, осетровые рыбы
Короткий адрес: https://sciup.org/142242315
IDR: 142242315 | УДК: 639.3.05
Текст научной статьи Экстракт проантоцианидов виноградной косточки в технологии получения живых кормов
Аквакультура является одним из наиболее быстрорастущих секторов производства продуктов питания в мире, обеспечивая почти 50% всей рыбы для потребления человеком. Ожидается, что в кратко- и среднесрочной перспективе (2030 г.) эта сумма вырастет еще на 22% [1]. В РФ в ноябре 2019 г. утверждена стратегия развития рыбохозяйственной отрасли до 2030 г. Ожидается, что объем добычи водных биоресурсов увеличится на 5,6%, до 5,396 млн т в год. Объем производства продукции товарной аквакультуры к 2030 г., согласно документу, возрастет в 2,6 раза и составит 618 тыс. т [2], следовательно, возрастает потребность в полноценных и высококачественных кормах [3;4].
Особенности физиологического развития пищеварительного тракта личинок рыб не позволяют при современной технологии искусственного разведения ценных пород аквакультуры полностью отказаться от применения живых стартовых кормов [5]. Чебанов М.С. и Галич Е.В. (2011) рекомендуют: «начинать кормление личинок осетровых с науплий артемий Artemia , мелкорубленых олигохет и небольшого количества мелкого зоопланктона из расчета 3–5 г корма на 1000 личинок, однако могут использоваться в качестве живого корма и дафнии ( Daphnia magna ), моины ( Moina macrocopa ), веслоногие рачки ( Copepoda ), мелкие жаброногие Branchiopods ( Streptocephalus torvicornis ), коловратка ( Rotatoria ), личинки хирономид ( Chironomus plumosus ), гаммариды ( Gammaridae ), олигохеты Oligochaeta (белые черви Enchitreusalbus ), трубочник ( Tubifextubifex ) и калифорнийский червь ( Eisenia foetida ) [6].
Науплии артемии ( Artemia sp. Leach 1819) – примитивная группа ракообразного класса Brachiopoda , широко используемая в индустрии аквакультуры [7]. Артемию изучают в различных областях, например, в качестве живого корма для личинок рыб [8], как потенциальный модельный организм для оценок токсичности [9], как потенциальный фильтр-питатель [10], а также как потенциальный кандидат для определения воздействия различных факторов окружающей среды [ 11]. Также были разработаны новые методики для повышения питательности артемий в качестве экзогенного корма для личинок различных рыб или ракообразных [12] и их оптимального выращивания в различных условиях культивирования [ 13].
Vestnik of Omsk SAU, 2024, no. 3 (55) VETERINARY AND ZOOTECHNY
Артемия с ее неселективным пищевым поведением делает ее идеальным биологическим носителем для биоинкапсулирования (обогащения живой пищи) важнейших питательных веществ, что улучшает выживаемость, развитие и качество водных личинок рыб [14]. Быстрая реакция артемии на питание запускается визуальными и химическими сигналами, включая движение и выработку химических аттрактантов (свободных аминокислот, бетаина и пептидов). После попадания в кишечник личинок рыб науплии артемии могут играть решающую функцию в процессе переваривания корма [15].
Артемия сама по себе – неполный источник пищи из-за нехватки некоторых необходимых элементов в ее составе, таких как, например, полиненасыщенные жирные кислоты n3 и n6 (PUFAs), часто необходимые для успешного развития личинок, поэтому для снижения коэффициента конверсии корма и, соответственно, увеличения выживаемости, темпов роста личинок и их устойчивости к стрессу рекомендуется использовать метод биоинкапсуляции – обогащение науплий ω-3 высоконенасыщенными жирными кислотами [16]. Альтернативно кормление артемии различными типами кормовых добавок в системах суспензионного культивирования позволило обогатить их более высоким содержанием жирных кислот и использовать в качестве носителя других питательных веществ (например, витаминов), противомикробных веществ, вакцин и пробиотиков [17; 18].
В последнее время наблюдается рост интереса к производству кормов для рыб с использованием агропищевых отходов и побочных продуктов [19] и «безантибиоти-ческого» подхода [20]. Некоторые органические заменители антибиотиков, такие как вторичные химические вещества растений (полифенолы и дубильные вещества), уже давно используются в питании человека и животных, только недавно им стало уделяться особое внимание в медицине [20]. Было показано, что среди этих соединений танины предотвращают развитие бактерий, используя различные механизмы, включая хелатирование железа, ингибирование образования клеточной стенки, разрушение клеточной мембраны и блокирование путей биосинтеза жирных кислот. Танины обладают способностью ингибировать экспрессию различных факторов вирулентности, включая биопленки, ферменты, адгезины и яды, а также действовать как ингибиторы кворум сенсинга (quorum sensing inhibitors – QSI). Гидрогели и наночастицы, насыщенные танином, проявляют сильные антибактериальные свойства [21].
Виноградные выжимки, основной побочный продукт виноградарства, представляют твердые органические отходы, получаемые после извлечения сока из винограда, состоящие из прессованной виноградной мякоти и кожицы, а также виноградных косточек и стеблей.
Формы, в которых можно применять производные винограда, разнообразны: мука из виноградных выжимок, экстракт виноградных косточек, масло виноградных косточек, а в 2020 г. в своих исследованиях Костой и др. продемонстрировали, что инкапсуляция экстракта виноградных выжимок (GPE), полученного путем ферментативной экстракции с последующей лиофилизацией, инкапсулированного в наночастицы хитозана и альгината, снижает проницаемость ксилобиозы, тем самым обеспечивая благоприятное время удерживания в кишечнике и потенциально улучшая пребиотический потенциал экстракта виноградных выжимок. Технологии экстракции и обработки, такие как добавление ферментов или процессы предварительной обработки, очень часто используют для улучшения биодоступности побочных продуктов винограда из-за высокого уровня танинов, которые являются антиоксидантами, но в то же время антипитательными веществами [22].
Некоторые из биологически активных компонентов побочных продуктов винограда могут быть использованы против бактерий пищевого происхождения, таких как
Vestnik of Omsk SAU, 2024, no. 3 (55) VETERINARY AND ZOOTECHNY
Campylobacter jejuni, Escherichia coli, Listeria monocytogenes, Salmonella enterica, Staphylococcus aureus, Vibrio cholerae и микробных токсинов (охратоксин А, шига-токсин) в пищевых продуктах, поскольку они повышают микробиологическую безопасность пищевых продуктов, предотвращают или лечат болезни животных и человека, а также максимально увеличивают использование винограда и побочных продуктов [23].
Хотя использование цист артемии кажется простым, несколько факторов имеют решающее значение для выведения больших количеств, необходимых для производства личинок рыбы. К ним относят дезинфекцию или декапсуляцию цист перед инкубацией и вылупление при следующих оптимальных условиях: постоянная температура 25–28 °C, соленость 15–35 ppm, минимальный pH 8,0, уровень насыщения кислородом, максимальная плотность цист 2 г/г. л и сильное освещение 2000 лк. Эти факторы повлияют на скорость вылупления и максимальную продуктивность, следовательно, и на себестоимость собранных науплиев артемии [24; 25].
Существует множество факторов, влияющих на процесс вылупления цист артемии, поэтому процесс выведения в соответствии с приведенными выше условиями инкубации часто не обеспечивает ожидаемого эффекта выведения.
В 2007 г. Синьюй Фань и Яньли Ма разработали «Метод выведения свободноплавающих науплий из цист артемии», в котором вылупление цист артемии проводят в инкубационной среде одновременно с добавкой органического материала, содержащего один или несколько о-гидроксибензолов. Метод достигает около 90% вылупления цист в течение 24 часов путем прерывания диапаузы [25].
Проантоцианидины виноградных косточек представляют фенольные соединения со структурным разнообразием и сложностью по сравнению с соединениями в других растениях или растительных продуктах питания, таких как яблоки, груши и какао. Состоят из -15% (+) катехина, (-) эпикатехина; 80% (-) –эпикатехина 3- O -галлата, димеров, тримеров, тетрамеров и их галлатов и 5% пентамеров, гексамеров, гептамеров и их галлатов [26]. Проантоцианидины виноградных косточек – одни из самых мощных антиоксидантов, защищают клетки от повреждений, контролируя окислительное повреждение, уменьшая повреждение тканей и поддерживая антиоксидантный статус и уменьшая высвобождение провоспалительных медиаторов [27].
Цель настоящего исследования – оценить эффективность 95%-ного комплекса проантоцианидинов из экстракта виноградной косточки в качестве антиоксидантного активатора инкубационной среды для получения науплиусов артемии.
Материалы и методы
Работа выполнена в лаборатории фундаментальных основ питания сельскохозяйственных животных и рыб ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста в условиях аквариаль-ной лаборатории ВНИИР (филиал ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста).
Объектом исследования являлись цисты и науплии Артемии (Artemia salina) алтайской популяции.
Инкубация цист проводилась в аппаратах «Вейса» с применением солевого раствора с концентрацией NaCl 30 г/л при температуре 28 ºС и постоянном освещении. Для постоянной аэрации к аппарату присоединен обратный клапан, через который по трубке подавался воздух с помощью компрессора мощностью 3600 л/ч. Объем цист для одного аппарата с объемом воды 7 л составил 21 г (рис. 1). Время инкубации составило 24 ч, по истечении которых были отобраны пробы для расчета процента выклева. Вычисляли процент путем подсчета количества вылупившихся науплий артемии и цист в поле зрения микроскопа, после оценивалось их соотношение в процентах.
Vestnik of Omsk SAU, 2024, no. 3 (55)
VETERINARY AND ZOOTECHNY

Рис. 1. Инкубация цист артемии в аппаратах «Вейса»
В качестве активатора использовали тонкодисперсный порошок комплекса про-антоцианидов (95%) из экстракта виноградной косточки ( Vitis vinifera L.) в концентрации 50 и 100 мг на один аппарат.
Таблица 1
Схема исследования
|
Группа |
Объем цист артемии, г/ 7 л |
Инкубационный раствор |
|
1-я контрольная (С) |
21 |
NaCl 30 г/л |
|
2-я опытная (Е50) |
21 |
NaCl 30 г/л + 7,2 мг/л проантоцианидов (95%) |
|
3-я опытная (Е100) |
21 |
NaCl 30 г/л + 14,3 мг/л проантоцианидов (95%) |
Опыт по влиянию активатора проведен в трех аппаратах «Вейса»: 1-й был контрольным без добавления активатора, во 2-й и 3-й после 24-часовой инкубации дополнительно добавляли 50 и 100 мг раствора проантоцианидов (95%) в качестве активатора.
Через 8 ч после обогащения были отобраны повторные пробы для вычисления процента выклева и оценки выживаемости науплиусов в экспериментальном инкубационном растворе. Таким образом, общая продолжительность инкубации – 32 ч.
Полученные образцы живых науплиусов артемии исследованы на суммарную концентрацию водорастворимых антиоксидантов (СКВА) как в нативном виде, так и после высушивания при 60 °C.
Измерения проводили амперометрическим методом с помощью прибора «ЦветЯуза-01-АА» в диапазоне от 0,2 до 4000 мг галловой кислоты.
Массовую концентрацию водорастворимых антиоксидантов измеряли, используя градуировочный график зависимости выходного сигнала от концентрации галловой кислоты. Амперометрический метод основан на измерении силы электрического тока, который возникает в момент окисления молекул антиоксиданта на поверхности рабочего стеклоуглеродного электрода при заданном потенциале, который после усиления преобразуется в цифровой. Прибор работал в постоянно-токовом режиме, потенциал рабочего электрода U = + 1,3 В, скорость подачи элюента (раствор ортофосфорной кислоты с молярной концентрацией 0,0022 моль/дм3) перистальтическим насосом – 1,2 см3/мин.
Измерительные исследования проводили в два этапа: в нативных образцах науплиусов артемии и после высушивания. На антиоксидантную активность исследовался экстрактом процианидина виноградных косточек (GSPE).
Vestnik of Omsk SAU, 2024, no. 3 (55)
VETERINARY AND ZOOTECHNY
Математическая обработка результатов проведена с помощью программного обеспечения «Мультихром» амперометрического детектора «ЦветЯуза-01-АА» согласно инструкции производителя. Предел допускаемого относительного среднего квадратического отклонения (СКО) площадей пиков Ot составлял не более 5%.
Результаты и их обсуждение
Процент выклева науплиусов по истечении 24 ч инкубации во всех исследуемых группах составлял не более 50%.
Через 8 ч после добавления экстракта виноградной косточки в инкубационный раствор наблюдалось существенное увеличение живых науплиусов. Во 2-й опытной группе выклев составил 65%, в 3-й группе – 85%. В первой контрольной группе количество живых науплиусов не увеличилось (рис. 2).
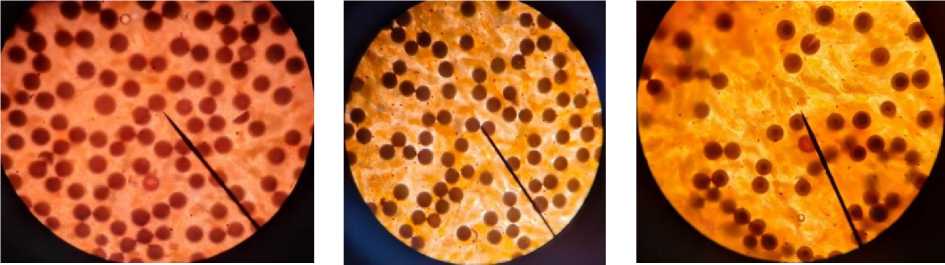
А Б С
Рис. 2. Выклев свободноплавающих науплиусов: А – 1-я-контрольная группа (С), Б – 2-я опытная группа (Е50), В – 3-я опытная группа (Е100)
При этом выбранная концентрация экстракта виноградной косточки не повлияла на жизнеспособность свободноплавающих науплиев артемии и выживаемость во второй и третьей экспериментальных группах после 8 часов обогащения составила 100%.
Причинами, вследствие которых наблюдается низкий процент выклева науплий артемии, может быть не только несоблюдение условий, но и такой фактор, как малое количество запасенной энергии или затянувшаяся диапауза у некоторых цист [28]. Прекращение последней достигается деблокированием нейроэндокринных центров в ходе спонтанной, холодовой или фотопериодической реактивации. При инкубации артемии довольно часто применяется способ дезактивации диапаузы с помощью декап-сулирования с применением гипохлорида натрия или перекиси водорода. При этом достаточно сильно усложняется процесс производства живого корма и увеличиваются затраты на обработку, так как после обработки требуется промывание водой для удаления используемых химических веществ. Самым большим негативным фактором является гибель науплиусов из-за неправильно подобранной концентрации действующего вещества или слишком длительного времени декапсуляции.
В нашем исследовании применение экстракта виноградной косточки c 95% про-антоцианидинов позволило не только увеличить количество живых науплиев артемии, но и избежать вышеописанных причин снижения процента выклева. Эти данные согласуются с работой Фань С. и Ма Я. (2007), которые добавляли ЭВК вместе с галловой кислотой в раствор для инкубации цист артемии, что привело к увеличению вылупления науплиусов до 90% [25].
Далее было проведено сопоставление измерений содержания антиоксидантов в образцах науплиев артемии до и после высушивания и ЭВК (95% проантоцианидов) (табл. 2–4).
Vestnik of Omsk SAU, 2024, no. 3 (55)
VETERINARY AND ZOOTECHNY
Таблица 2
Суммарное содержание водорастворимых антиоксидантов в тонкодисперсном порошке экстракта виноградных косточек, содержащем 95% проантоцианидов амперометрическим методом
|
Показатель |
Экстракт виноградных косточек (95% проантоцианидов) |
|
|
М |
СКО, % |
|
|
СКВА*, мг/г (стандарт- галловая кислота) |
5 707 |
2,35 |
* СКВА – суммарная концентрация водорастворимых антиоксидантов
Яшин А.Я. отмечает: «Амперометрический метод – единственный, при котором непосредственно измеряется содержание всех антиоксидантов в пробе» [30]. В своей работе автор отмечает: СКВА экстракта косточек винограда составляет 5 062 мг/г, в нашем исследовании данный показатель составил 5 707 мг/г. Разница в показателях может быть объяснена в технологии экстракции и обработки получаемого вещества, на что следует обращать внимание при применении.
Содержание антиоксидантов в нативных образцах во всех группах составляла от 0,604 до 0,575 мг/г, при этом во 2-й опытной группе данный показатель выше на 9,4 %, в 3-й опытной ниже на 4,8 % контроля (табл. 3).
Таблица 3 Суммарное содержание водорастворимых антиоксидантов в нативных образцах науплии Артемии амперометрическим методом
|
Показатель |
Группа |
|||||
|
1-я контрольная (С) |
2-я опытная (Е50) |
3-я опытная (Е100) |
||||
|
М |
СКО, % |
М |
СКО, % |
М |
СКО, % |
|
|
СКВА*, мг/г (стандарт-галловая кислота) |
0,604 |
1,86 |
0,661 |
1,89 |
0,575 |
2,88 |
* СКВА – суммарная концентрация водорастворимых антиоксидантов
В исследованиях Наварро Д.С. и др. (1992) проанализирован липидный состав цист артемии. Основным компонентом являлись триацилглицериды, составляя ≈ 50% от общего количества липидов, холестерин составлял 10%, а эфиры холестерина колебались от 3 до 10%. Фосфолипиды, в основном фосфатидилхолин и фосфатидилэтано-ламин в соотношении 2:1, составляли 10–20% от общего количества липидов. Обнаружено, что пигменты и свободные жирные кислоты очень изменчивы [30].
В исследованиях обозначено, что мицеллярная растворимость холестерина снижается димерами и тримерами проантоцианидина (процианидин B2, B5, C1) [31], а мицелла холестерина может далее разрушаться процианидином A1 и тримером [эпикатехин-(4β→6)-эпикатехин-(2β→O→7, 4β→8)-катехин] [32], также было показано, что холестеринэстераза значительно ингибируется экстрактом процианидина виноградных косточек (GSPE) в зависимости от дозы [33].
В наших исследованиях увеличение концентрации в GSPE в 2 раза привело к снижению антиоксидантов нативных науплиусов, однако после высушивания данный показатель увеличился в 6 раз.
Таблица 4 Суммарное содержание водорастворимых антиоксидантов в образцах науплии Артемии при 60°C высушивании амперометрическим методом
|
Показатель |
Группа |
|||||
|
1-я контрольная (С) |
2-я опытная (Е50) |
3-я опытная (Е100) |
||||
|
М |
СКО, % |
М |
СКО, % |
М |
СКО, % |
|
|
СКВА*, мг/г (стандарт- галловая кислота) |
2,51 |
2,62 |
3,08 |
2,89 |
3,64 |
1,89 |
* СКВА – суммарная концентрация водорастворимых антиоксидантов
Vestnik of Omsk SAU, 2024, no. 3 (55)
VETERINARY AND ZOOTECHNY
Высушивание сырья приводит к усадке, изменению окраски, затвердеванию, нарушению восстанавливающей способности, потере летучих веществ [34].
Суммарное количество антиоксидантов в 3-й опытной группе высушенных науплий артемии составило 3,64 мг/г (больше 1-й контрольной на 1,13 мг/г; 2-й опытной – на 0,56 мг/г). Концентрация 0,5 мг/мл раствора проантоцианидов (95%) из ЭВК во 2-й опытной группе увеличила количество антиоксидантов на 0,57 мг/г по сравнению с 1-й контрольной группой высушенных образцов.
Заключение
Добавление девяностопятипроцентного экстракта проантоцианидов виноградных косточек ( Vitis vinifera L. ) в концентрации 50–100 мг в инкубированный раствор повышает эффективность инкубации и способствует повышению антиоксидантной активности свободно плавующих науплиев артемии, что может повысить питательную ценность стартовых кормов для личинок рыб.
Список литературы Экстракт проантоцианидов виноградной косточки в технологии получения живых кормов
- The State of World Fisheries and Aquacul-ture 2022. Towards Blue Transformation. Rome: FAO, 2022.
- Стратегия развития рыбхозяйственного комплекса Российской Федерации на период до 2030 года [Электронный ресурс] // Федеральное агентство по рыболовству: [сайт]. URL: https://fish.gov.ru/otraslevaya-deyatelnost/ekonomika-otrasli/ (дата обращения 15.07.2024).
- Савкина Л., Броун Е. Отечественные корма для аквакультуры. [Электронный ресурс] // Ценовик: [сайт] [2024]. URL: https://www.tsenovik.ru/articles/obzory-i-prognozy /otechestvennye-korma-dlya-akvakultury/?ysclid= lx8lxa08ci733611408 (дата обращения 19.06.2024).
- Волошин Г.В., Акимов Е.Б., Артемов Р.В., Гершунская В.В. Состояние и перспективы развития рынка комбикормов для индустриальной аква-культуры в Российской Федерации. Экономика, международное сотрудничество и нормативные правовые основы рыбохозяйственной деятельности // Труды ВНИРО. 2022. Т. 190. С. 163–169.
- Портная Т.В., Другакова А.Д. Живые корма в стартовом кормлении молоди осетровых // Актуальные проблемы интенсивного развития животноводства. 2018. № 21-1. С. 180–186.
- Чебанов М.С., Галич Е.В. Руководство по искусственному воспроизводству осетровых рыб // Технические доклады ФАО по рыбному хозяйству и аквакультуре. № 558. Анкара: ФАО. 2011. 297 с.
- Azra M.N., Noor M.I.M., Burlakovs J. [et al.] Trends and New Developments in Artemia Re-search // Animals (Basel). 2022. № 12(18): 2321.
- Sorgeloos P., Dhert P., Candreva P. Use of the brine shrimp, Artemia spp., in marine fish larvi-culture. Aquaculture. 2001. Vol. 200. P.147–159.
- Wang Y., Zhang D., Zhang M. et al. Effects of ingested polystyrene microplastics on brine shrimp, Artemia parthenogenetica // Environ. Pollut. 2019. Vol. 244. P. 715–722.
- Riisgård H.U., Jeune N., Pleissner D. [et al.] Adaptation of the brine shrimp Artemia salina (bran-chiopoda: Anostraca) to filter-feeding: Effects of body size and temperature on filtration and respiration rate // J. Crustac. Biol. 2015. Vol. 35. P. 650–658.
- Henry J., Bai Y., Williams D. et al. Impact of test chamber design on spontaneous behavioral re-sponses of model crustacean zooplankton Artemia franciscana // Lab. Anim. 2022. Vol. 51 P. 81–88.
- Aragão C., Conceição L.E., Dinis M.T., Fyhn H.-J. Amino acid pools of rotifers and Artemia under different conditions: Nutritional implications for fish larvae // Aquaculture. 2004. Vol. 234. P. 429–445.
- Кряхова, Н.В., Ковачева Н.П., Глазунов А.А. Влияние пероксида водорода на выклев науплиев артемии Artemia sp. // Рыбное хозяйство. 2023. № 3. С. 81–87.
- Dey C.J., Tan Q.J., O’Connor C.M. [et al.] Dominance network structure across reproductive contexts in the cooperatively breeding cichlid fish Neolamprologus pulcher // Curr. Zool. 2015. Vol. 61. P. 45–54.
- Hire J. Effect of probiotic, Bacillus spp. enriched artemia on growth of gold fish, Carassius auratus (Linnaeus, 1758) larvae. // J. Exp. Zool. 2020. Vol. 23. P. 741–745.
- Hafezieh, M., Kamarudin, M.S., Saad, C.R.B. et al. Effect of enriched Artemia urmiana on growth, survival and composition of larval Persian sturgeon // Turkish Journal of Fisheries and Aquatic Sciences. 2009. № 9. P. 201–207.
- Azimirad M., Meshkini S., Ahmadifard N., Hoseinifar S.H. The effects of feeding with synbiotic (Pediococcus acidilactici and Fructooligosa charide) enriched adult Artemia on skin mucus immune re-sponses, stress resistance, intestinal microbiota and performance of angelfish (Pterophyllum scalare) // Fish Shellfish Immunol. 2016. Vol. 54. P. 516–522.
- Результаты применения биоинкапсули-рованных науплий артемии в качестве стартового корма для личинки и молоди стерляди / А.С. Елизарова, Г.А. Шишанов, И.Е. Липпо [и др.] // Ветеринария и кормление. 2023. №5. С. 31–34
- Prabakusuma A.S., Wardono B., Fahlevi M. [et al.] A bibliometric approach to understanding the recent development of self-sufficient fish feed produc-tion utilizing agri-food wastes and by-products towards sustainable aquaculture // Heliyon. 2023. № 9. e17573
- European Platform for the Responsible Use of Medicines in Animals (EPRUMA) 2018 [Элек-тронный ресурс] // EPRUMA Best-Practice Frame-work for the Use of Antibiotics in Food-Producing Animals Reaching for the Next Level. 2018. URL: http://www.epruma.eu/ (дата обращения 11.06.2024)
- Peng K., Chen B., Wang Y. [et al.] Con-densed tannins protect against aflatoxin B1-induced toxicity in Lateolabrax maculatus by restoring intesti-nal integrity and regulating bacterial microbiota // Aquaculture. 2022. Vol. 555 738255
- Costa J.R., Xavier M., Amado I.R. [et al.] Polymeric nanoparticles as oral delivery systems for a grape pomace extract towards the improvement of biological activities // Mater. Sci. Eng. C. 2021. Vol. 119:111551.
- Farha A.K., Yang Q.-Q., Kim G. et al. Tan-nins as an alternative to antibiotics // Foo Biosci. 2020. Vol. 38: 100751.
- Lavens P., Sorgeloos P. Manual on the pro-duction and use of live food for aquaculture FAO // Tech. Pap. 1996, 361. P. 295
- Fan X., Ma Y., inventor; Hospira. Method to hatch free swimming nauplii from artemia cysts. China patent. 101081015. 2007 Dec 05 URL: https://patents.google.com/patent/WO2008022569A1/en
- Gabetta B., Fuzzati N., Griffini A. [et al.] Characterization of proanthocyanidins from grape seeds // Fitoterapia. 2000. Vol. 71. P. 162–175
- Aysun C., Leylagul K., Ismail K. [et al.] Effect of grape seed extract on radiation-induced oxi-dative stress in rat liver // Turkey J. Gastroenterol. 2008. Vol. 19. P. 92–98
- Van S.G. Introduction, biology and ecology of Artemia // In: Manual on the production and use of live food for aquaculture. Belgium: Laboratory of Aquaculture and Artemia Reference Center, Univer-sity of Ghent. 1996. P. 79–136.
- Яшин А.Я. Методология определения антиоксидантной активности пищевых продуктов и биологических жидкостей // Аналитика. 2021. Т 11. № 5. С. 370–371.
- Navarro J.C., Amat F., Sargent J. R. Lipid composition of cysts of the brine shrimp Artemia sp. from Spanish populations // J. Exp. Mar. Biol. Ecol. 1992. Vol. 155. P. 123–131.
- Yasuda A., Natsume M., Sasaki K. [et al.] Cacao procyanidins reduce plasma cholesterol and increase fecal steroid excretion in rats fed a high-cholesterol diet // Biofactors. 2008. Vol. 33. P. 211–223.
- Tamura T., Inoue N., Ozawa M. [et al.] Pea-nut-skin polyphenols, procyanidin A1 and epicatechin-(4β→6)-epicatechin-(2β→O→7, 4β→8)-catechin, exert cholesterol micelle-degrading activity in vitro // Biosci Biotechnol Biochem. 2013. Vol. 77:1306–9.
- Moreno D.A., Poulev A., Brasaemle D.L. et al. Inhibitory effects of grape seed extract on lipases // Nutrition. 2003. Vol. 19. P. 876–879.
- Киселева Т.Ф. Технология сушки: учеб.-метод. комплекс // Кемеровский технологический инсти-тут пищевой промышленности. Кемерово, 2007. 117 с.


