Элементы технологии производства микробиопрепаратов на основе перспективных бактериальных штаммов антагонистов возбудителя сухой гнили подсолнечника
Автор: Маслиенко Л.В., Дейнега Л.А., Ефимцева Е.А.
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 3 (195), 2023 года.
Бесплатный доступ
Разработаны элементы технологии производства микробиопрепаратов в препаративной форме смачивающийся порошок при стационарном культивировании перспективных бактериальных штаммов антагонистов возбудителя сухой гнили подсолнечника. Определены оптимальные источники азотного и углеродного питания и сложные питательные среды для выращивания трех перспективных штаммов бактерий из родов Bacillus и Pseudomonas. Для штамма 5Б-1 Bacillus subtilis лучшим источником азотного питания установлен кукурузный экстракт, а источниками углеродного питания - глицерин и меласса. Наибольший вес сухой бактериальной биомассы штамма D 1-1 Bacillus sp . установлен на питательной среде, где в качестве азотного питания выступал азотнокислый натрий, а в качестве источников углерода - сахароза и меласса. Для обоих штаммов бактерий рода Bacillus определены оптимальные сложные питательные среды: Чапека для бактерий и Тайлона-3. Для культивирования штамма 14-4 Pseudomonas sp . лучшими источниками азотного питания установлены кукурузный экстракт и азотнокислый натрий, а углеродного - сахароза. Наиболее оптимальными сложными питательными средами для этого штамма определены Кинга В и Чапека для бактерий.
Бактерии-антагонисты, сухая гниль подсолнечника, микробиопрепараты, стационарное культивирование, источники углеродного и азотного питания, питательные среды
Короткий адрес: https://sciup.org/142239664
IDR: 142239664 | УДК: 633.854.78:632.937 | DOI: 10.25230/2412-608X-2023-3-195-63-68
Текст научной статьи Элементы технологии производства микробиопрепаратов на основе перспективных бактериальных штаммов антагонистов возбудителя сухой гнили подсолнечника
Введение. В регионах с теплым климатом наблюдается тенденция увеличения распространения и вредоносности сухой гнили подсолнечника, возбудителем которой являются грибы рода Rhizopus Eh- renb. [1]. Болезнь распространена во многих странах возделывания подсолнечника. При благоприятных условиях потери урожая от сухой гнили могут достигать 40 %, что наносит значительный экономический урон сельхозтоваропроизводителям [2; 3; 4; 5; 6].
В современной экологической ситуации назрела крайняя необходимость биологи-зации сельскохозяйственного производства. Поэтому разработка биотехнологий получения и применения современных конкурентоспособных микробных препаратов для сельского хозяйства, позволяющих снизить отрицательные последствия применения химическких пестицидов, становится первоочередной задачей социально-экономического развития государств. В нашей стране нет зарегистрированных биологических препаратов для защиты подсолнечника от сухой гнили.
В лаборатории биометода агротехноло-гического отдела ФГБНУ ФНЦ ВНИИМК с 2021 г. ведутся исследования по разработке микробиологического метода снижения вредоносности сухой гнили подсолнечника. Так, в результате ступенчатого скрининга коллекционных бактериальных штаммов антагонистов к агрессивному изоляту возбудителя сухой гнили подсолнечника Rhizopus oryzae Went & Prins. Geerl. было выделено три штамма, обладающих антифунгальной активностью in vitro, а также защитным и колонизирующим эффектом на фоне искусственного заражения патогеном. Отобранные штаммы не проявляли фитотоксичности к культуре, а, напротив, обладали ростостимулирующей активностью [7; 8; 9].
Данные исследования посвящены разработке элементов технологии производства микробиопрепаратов на основе выделенных трех перспективных бактериальных антагонистов из родов Bacillus и Pseudomonas , включающих подбор оптимальных источников азотного и углеродного питания, а также сложных жидких питательных сред при стационарном культивировании штаммов.
Материалы и методы . Объектами исследований служили два штамма бактерий из рода Bacillus – D 1-1 Bacillus sp . и 5Б-1 Bacillus subtilis, и один из рода Pseudomonas – 14-4 Pseudomonas sp . , источники азотного и углеродного питания, а также сложные питательные среды.
Определение оптимальных элементов питания для выращивания перспективных штаммов-продуцентов микробиопрепаратов проводили на жидкой питательной среде Чапека для бактерий [10], которая являлась эталоном. Источниками азотного питания служили пептон, азотнокислый натрий, дрожжевой и кукурузный экстракты, с неизменным источником углеродного питания – сахароза (эталон). Источниками углеродного питания служили глюкоза, сахароза, глицерин и меласса, при этом неизменным компонентом азотного питания был азотнокислый натрий (эталон). Стационарное выращивание антагонистов осуществляли при температуре 25 °С в течение 10 суток в колбах Эрленмейера (250,0 мл) с объемом питательной среды 100,0 мл, при этом в каждую колбу высевали одинаковый агаровый блок со штаммом антагонистом.
Определение оптимальных сложных жидких питательных сред проводили при стационарном культивировании бактериальных штаммов. Испытывали среды: Тайлона-3 – для бактерий из рода Bacillus , Кинга В – для бактерии из рода Pseudomonas , а также Чапека для бактерий, мясо-пептонный бульон (МПБ) и пептон-дрожжевую среду [11; 12; 13].
По окончании культивирования штаммов определяли вес сухой биомассы путем осаждения и высушивания выращенной бактериальной пленки при температуре 105 °С до постоянного веса. Повторность в каждом опыте трехкратная.
Результаты и обсуждение. В процессе выполнения исследований нами была разработана шкала для учета роста бактериальных штаммов при стационарном культивировании на жидких питательных средах (рис. 1), где:
0 баллов – отсутствие роста или только обрастание посевного блока;
-
1 балл – рост бактерии поверхностный отдельными колониями или только по краю в колбе, может присутствовать и слабый глубинный рост;
-
2 балла – тонкая сплошная поверхностная бактериальная пленка или только глубинный рост бактерии;
-
3 балла – плотная складчатая поверхностная бактериальная пленка.

0 баллов 1 балл

2 балла 3 балла
Рисунок 1 – Шкала оценки роста бактериальных штаммов на жидких питательных средах при стационарном культивировании, 2023 г. (ориг.)
Для бактериального штамма 5Б-1 Bacillus subtilis в качестве наиболее благоприятного источника азотного питания выступил кукурузный экстракт, где образовалась тонкая сплошная поверхностная пленка (2 балла) и вес сухой биомассы составил 0,43 г/100 мл среды, что существенно по отношению к эталону. При выращивании на питательной среде с добавлением дрожжевого экстракта и азотнокислого натрия наблюдали менее обильный поверхностный рост бактерии (1 балл), но присутствовал слабый глубинный. Вес бактериальной биомассы в этих вариантах был примерно одинаковым – 0,32–0,33 г/100 мл среды. Неблагоприятным источником азотного питания для бациллярного штамма оказался пептон, при добавлении которого на поверхности среды формировались лишь отдельные колонии бактерии (1 балл) и вес сухой биомассы составил всего 0,27 г/100 мл среды (рис. 2).
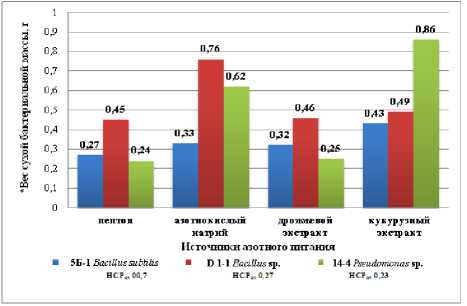
Рисунок 2 – Влияние различных источников азотного питания на рост бактериальных штаммов на питательной среде Чапека для бактерий, через 10 суток стационарного культивирования, 2023 г. (ориг.)
* вес сухой бактериальной биомассы в расчете на 100 мл питательной среды
Для штамма D 1-1 Bacillus sp. максимальный вес бактериальной биомассы установлен на питательной среде, где в качестве азотного питания выступал азотнокислый натрий (эталон) – 0,76 г/100 мл среды, при этом в данном варианте выявлен глубинный рост бактерии (2 балла). При добавлении пептона, дрожжевого и кукурузного экстрактов наблюдался слабый глубинный рост (1 балл), поэтому вес сухой биомассы был значительно ниже эталона и варьировал от 0,45 до 0,49 г/100 мл среды.
Лучшими источниками азотного питания для культивирования штамма
14-4 Pseudomonas sp. оказались кукурузный экстракт и азотнокислый натрий, при добавлении которых формировалась тонкая сплошная пленка (2 балла), а вес сухой биомассы составил 0,86 г и 0,62 г/100 мл среды соответственно. Тогда как при добавлении пептона и дрожжевого экстракта рост штамма псевдомонады был слабым (1 балл), а вес снижался в 2,5–3,6 раза и составил 0,24–0,25 г/100 мл среды.
Лучшими источниками углеродного питания для бактериального штамма 5Б-1 Bacillus subtilis установлены глицерин и меласса. При добавлении глицерина в среде сформировались отдельные поверхностные колонии и слабый глубинный рост (1 балл), а вес сухой биомассы составил 0,46 г/100 мл среды, что существенно по отношению к эталону. При добавлении мелассы выросла сплошная тонкая поверхностная пленка (2 балла) при весе сухой бактериальной биомассы 0,40 г/100 мл среды. Неблагоприятными источниками углерода установлены глюкоза и сахароза, при добавлении которых рост колоний был слабым (1балл) и установлен минимальный вес сухой бактериальной биомассы – 0,26–0,33 г/100 мл среды соответственно (рис. 3).
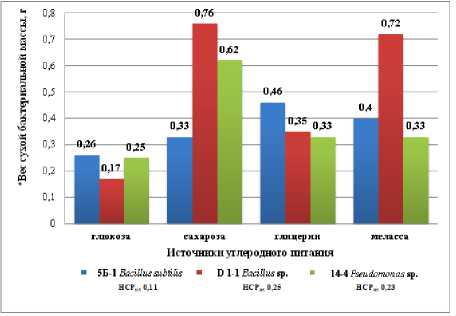
Рисунок 3 – Влияние различных источников углеродного питания на рост бактериальных штаммов на питательной среде Чапека для бактерий, через 10 суток стационарного культивирования, 2023 г. (ориг.)
* вес сухой бактериальной биомассы в расчете на 100 мл питательной среды
При стационарном культивировании штамма D 1-1 Bacillus sp . было выявлено два лучших элемента в качестве источника углерода – сахароза (эталон) и меласса, между которыми не было существенных различий. Следует отметить, что в среде с мелассой сформировалась плотная сплошная бактериальная поверхностная пленка (3 балла), а с сахарозой – отдельные колонии глубинного роста (2 балла), но при этом вес сухой биомассы отличался незначительно – 0,76 и 0,72 г/100 мл среды соответственно. Глюкоза и глицерин оказались неблагоприятными для выращивания данного штамма, так как при их добавлении отмечался слабый рост колоний (1 балл), а вес снижался в 2,1– 4,5 раза и составил 0,17–0,35 г/100 мл среды соответственно.
Для бактерии 14-4 Pseudomonas sp. оптимальным источником углерода установлена сахароза (эталон), при добавлении которой к среде наблюдалось формирование отдельных поверхностных колоний и глубинного роста (2 балла), и при этом установлен максимальный вес сухой биомассы (0,62 г/100 мл среды). Тогда как добавление глюкозы, глицерина и мелассы тормозило рост штамма (1 балл), а вес сухой бактериальной биомассы снижался в 2 раза, составив 0,25– 0,33 г/100 мл среды, что существенно по отношению к эталону.
С целью определения оптимальных питательных сред для культивирования штаммов бактерий изучали пять сложных сред (Тайлона-3, Кинга В, пептон-дрожжевую, Чапека для бактерий и мясопептонный бульон (МПБ)).
Для штаммов 5Б-1 Bacillus subtilis и D 1-1 Bacillus sp. максимальный вес сухой бактериальной биомассы (0,33 и 0,76 г/100 мл среды соответственно) получен на синтетической универсальной среде Чапека для бактерий (эталон), при этом в колбах отмечен глубинный рост отдельными колониями (2 балла). На среде Тайлона-3 эти штаммы сформировали плотную поверхностную пленку (3 бал- ла), однако вес сухой бактериальной биомассы снижался в 1,3–1,5 раз (0,25 и 0,48 г/100 мл среды соответственно), что существенно по отношению к эталону.
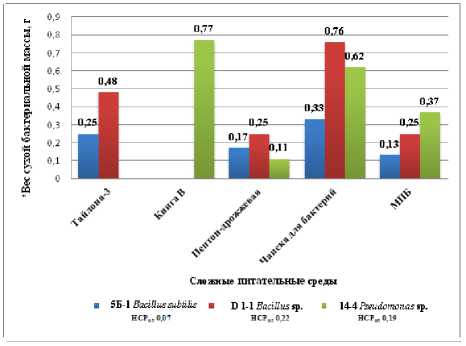
Рисунок 4 – Влияние сложных питательных сред на рост бактериальных штаммов, через 10 суток культивирования, 2023 г. (ориг.)
* вес сухой бактериальной массы в расчете на 100 мл питательной среды
Для бактерии 14-4 Pseudomonas sp. максимальный рост поверхностной пленки (3 балла) и вес сухой биомассы выявлен на среде Кинга В – 0,77 г/100 мл среды, что не существенно по отношению к эталону, так как на среде Чапека для бактерий при глубинном росте этот показатель был достаточно высокий – 0,62 г/100 мл среды. Показатели роста и веса на двух других средах (МПБ и пеп-тон-дрожжевая) были существенно ниже эталона.
Заключение. Определены оптимальные условия выращивания перспективных бактериальных штаммов-продуцентов для разработки элементов технологии производства микробиопрепаратов в препаративной форме смачивающийся порошок. Для штамма 5Б-1 Bacillus subtilis установлен наиболее благоприятный источник азотного питания – кукурузный экстракт, с наибольшим весом сухой биомассы – 0,43 г/100 мл среды. Лучшими источниками углеродного питания вы- ступили глицерин, при добавлении которого в среде наблюдался слабый глубинный рост при весе сухой биомассы 0,46 г/100 мл среды, и меласса с формированием тонкой сплошной поверхностной пленки – 0,40 г/100 мл среды. Наиболее благоприятной сложной питательной средой оказалась Чапека для бактерий с весом сухой биомассы 0,33 г/100 мл среды и Тайлона-3 – 0,25 г/100 мл среды.
Наибольший вес сухой бактериальной массы для штамма D 1-1 Bacillus sp . установлен на питательной среде, где в качестве азотного питания выступал азотнокислый натрий при весе сухой бактериальной массы 0,76 г/100 мл среды, а в качестве источников углерода – сахароза и меласса (0,76 и 0,72 г/100 мл среды соответственно). Оптимальной средой, на которой штамм рос в глубине среды отдельными колониями, определена Чапека для бактерий при весе сухой бактериальной биомассы 0,76 г/100 мл среды, а максимальная поверхностная пленка установлена на среде Тайлона-3 (0,48 г/100 мл среды).
Лучшими источниками азотного питания для культивирования штамма 14-4 Pseudomonas sp. являются кукурузный экстракт и азотнокислый натрий, при добавлении которых вес сухой биомассы составил 0,86 и 0,62 г/100 мл среды соответственно. Максимальный вес сухой биомассы (0,62 г/100 мл среды) выявлен при использовании сахарозы в качестве единственного источника углерода в питательной среде. Наиболее оптимальными сложными питательными средами установлены Кинга В с весом сухой биомассы 0,77 г/100 мл среды и Чапека для бактерий (0,62 г/100 мл среды).
Список литературы Элементы технологии производства микробиопрепаратов на основе перспективных бактериальных штаммов антагонистов возбудителя сухой гнили подсолнечника
- Бородин С.Г., Котлярова И.А., Соснина Ю.М. Грибы рода Rhizopus Ehrenb. на подсолнечнике // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2007. - Вып. 2 (137). - С. 55-57.
- Шинкарев В.П., Масленникова Т.И. Распространение болезней подсолнечника и борьба с ними за рубежом: обзорная информация. - М., 1990. - С. 38-39.
- Rogers C.E., Thompson T.E., Zimmer D.E. Rhizopus head rot of sunflower; etiology and severity in the southern plains // Plant Dis. - 1978. - Vol. 62. - No 9. - P. 769 - 771.
- Yang S.M. [et al.]. Rhizopus head rot of cultivated sunflower in Texas // Plant Diss. Rep. - 1979. - Vol. 63. -No 10. - P. 833-835.
- Acimovic M. Occurrence of sunflower diseases in Bulgaria, Romania, Hungary and Yugoslaviji // Helia. - 1980. - No 3. - Р. 33-36.
- Acimovic M. Prouzrokovaci bolesti suncokreta i njihovo suzbijanje. - Nolit-Beograd, 1983. - Р. 104.
- Lyubov Maslienko, Lyubov Datsenko and Evgeniya Efimtseva. Primary screening of fungal antagonist strains from the collection of V.S. Pustovoit All-Russian Research Institute of Oil Crops against the sunflower dry rot pathogen Rhizopus oryzae // AIP Conference Proceedings. - 2023. - 2777. -020013. DOI: 10.1063/5.0140254.
- Lyubov Maslienko, Lyubov Datsenko and Evgeniya Efimtseva. Primary screening of bacterial antagonist strains to the sunflower dry rot pathogen Rhizopus oryzae // AIP Conference Proceedings. -2023. - 2817. - 020059. DOI: 10.1063/5.0148452.
- Дейнега Л.А., Маслиенко Л.В., Ефимцева Е.А. Способность перспективных штаммов антагонистов возбудителя сухой гнили Rhizopus oryzae колонизировать растущий корень подсолнечника на фоне искусственного заражения проростков в лабораторных условиях // В сб.: Защита растений от вредных организмов: материалы XI междунар. науч-практ. конференции. - Краснодар: КубгАу. -2023. - С. 117-119.
- Скворцова, И.Н. Идентификация почвенных бактерий рода Bacillus. - М.: Изд-во Моск. ун-та, 1984. - 26 с.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. - М.: Изд-во Моск. ун-та, 1957. - 78 с.
- King, E.O., Ward M.K., and D.E. Raney. Two simple media for the demonstration of pyocyanin and fluorescin // J. Lab. Clin. Med. - 1954. - Vol. 44 (2). -P. 301-307.
- Тихонович И.А., Оследкин Ю.С. Каталог культур микроорганизмов. - СПб.-Пушкин, 2005. - 88 с.


