Эмульсии с -3 жирными кислотами как компонент иммунонутритивной поддержки в хирургической клинике
Автор: Вторенко В.И., Покровский К.А., Евсеев М.А., Никитин В.Е.
Журнал: Хирургическая практика @spractice
Рубрика: Современное состояние проблемы: обзоры, лекции
Статья в выпуске: 2, 2014 года.
Бесплатный доступ
В статье представлен обзор по возможностям применения содержащих ω-3 жирные кислоты жировых эмульсий как компонента иммунонутритивной поддержки у пациентов в хирургической клинике.
Сепсис, нутритивная поддержка, иммуномодуляция, хирургическая травма
Короткий адрес: https://sciup.org/142211572
IDR: 142211572 | УДК: 616.15;
Текст научной статьи Эмульсии с -3 жирными кислотами как компонент иммунонутритивной поддержки в хирургической клинике
В настоящее время становится все более очевидным, что инфузии жировых эмульсий, содержащих ω-3 жирные кислоты, должны рассматриваться отнюдь не только как компонент парентерального питания. Более того, данный тип жировых эмульсий является в настоящее время неотъемлемой частью стратегии иммунонутритивной поддержки у пациентов с синдромом системной воспалительной реакции (ССВР). Не будет преувеличением утверждение о том, что именно данная категория больных является наиболее проблематичной в хирургических клиниках различного профиля. Это и пациенты, поступающие с уже имеющимся ССВР на фоне обширного некротического (панкреонекроз) или инфекционного процесса (распространенный перитонит), это и пациенты с политравмой и обширными ожогами (рис. 1), это и пациенты с развившимися в послеоперационном периоде гнойно-септическими осложнениями. Доказанные иммуномодулирующие свойства ω-3 жирных кислот послужили закономерной предпосылкой к исследованию их протективного действия именно у хирургических пациентов и прежде всего – у пациентов с сепсисом.
По классическому на сегодняшний день определению R. Bone (1997) сепсис определяется как «системный воспалительный ответ, который возник во время инфекционного процесса». При этом под самим ССВР подразумевается неконтролируемый воспалительный ответ с генерализованным повреждением тканевых структур, обусловленный чрезмерной продукцией провоспалительных медиаторов, прежде всего – фактора некроза опухолей ТNF-α, интерлейкинов IL-1β, IL-6 и IL-8. В 1998 году M. Vervolet высказал суждение о том, что «эти медиаторы (в том числе и провоспалительные цитокины) в значительной степени, если не полностью, ответственны за кли- нические проявления и симптомы септического состояния в ответ на бактериальную инфекцию» (рис. 2). И действительно, исследованиями последнего десятилетия ушедшего века было показано, что у пациентов с сепсисом были достоверно увеличены концентрации циркулирующих ТNF-α, ТNF-рецепторов 1, IL-1β, антагонистов к рецепторам IL-1, IL-6, NFκB. Причем высокие концентрации провоспалительных цитокинов четко коррелировали с высокой вероятностью летальных исходов.
Экспериментальные исследования на животных также подтвердили факт чрезмерного повышения уровня провоспали-
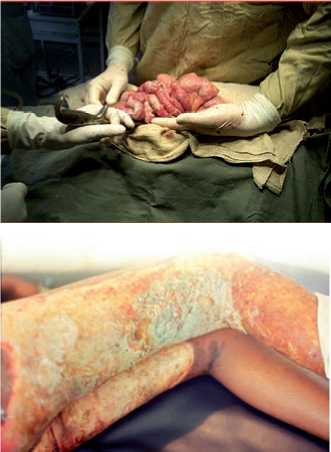
Рис. 1. Распространенный перитонит (а) и обширные инфицированные ожоги, (б) – типичные примеры септических состояний с выраженным ССВР
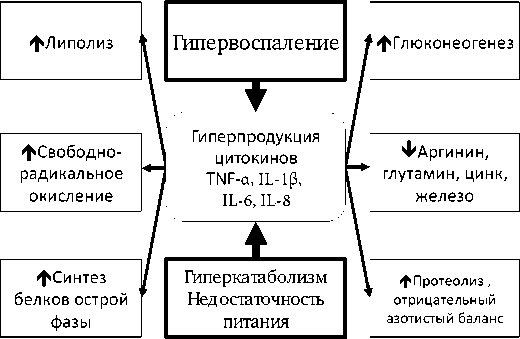
Рис. 2. Метаболические следствия синтеза провоспалительных цитокинов
тельных цитокинов в ответ на введение в системный кровоток бактериальных эндотоксинов. Ранними исследованиями R. Beutler et al. (1985), H. Alexander et al. (1991) и A. Marchant et al. (1994) было установлено увеличение выживаемости подопытных животных в модели сепсиса при введении им антицито-киновых иммуноглобулинов, антагонистов к рецепторам цитокинов и противовоспалительных цитокинов (например, IL-10). Однако одновременно с этим исследования M. Eskandari et al. (1992), S. Opal et al. (1996) и C. Fisher et al. (1996) показали, что далеко не у всех септических пациентов отмечалось увеличение концентрации ТNF-α или IL-1β. Более того, выявлено, что блокирование ТNF-α как в эксперименте, так и в клинических исследованиях, значительно ухудшало выживаемость при сепсисе.
Известно, что само по себе септическое состояние ассоциируется с более или менее выраженной иммуносупрессией: увеличивается концентрация IL-10 и IL-4, снижается продукция T-хелперами интерферона Υ, экспресия моноцитами HLA, пролиферативная и секреторная активность Т-лимфоцитов. Весьма распространена точка зрения, согласно которой сепсис начинается с фазы гипервоспаления, что проявляется развитием ССВР. Затем воспалительная реакция ограничивается компенсаторной противовоспалительной системой (Counter Anti-inflammatory Response System), что выражается состоянием иммуносупрессии. В то же время существует аргументированное мнение о том, что про- и противовоспалительная активность развиваются синхронно. В этой связи очевидно, что как неконтролируемая гиперактивация продукции провос-палительных цитокинов, так и их полная инактивация в равной степени определяют критические нарушение гомеостаза и гибель организма. В первом случае чрезмерно выраженный ССВР обусловливает генерализованное повреждение эндотелия, системную гипоперфузию и полиорганную недостаточность. Во втором случае дополнительная внешняя стимуляция компенсаторной противовоспалительной системы приводит к иммуносупрессии и закономерному развитию экзо- и эндогенной инфекции. Баланс SIRS – CARS весьма неустойчив и зависит от целого ряда факторов: распространенности и зоны первичного повреждения, выраженности контаминации и патогенности микрофлоры, индивидуальных различий в продукции провоспалительных цитокинов, чувствительности тканей к их повреждающему действию, а также к ингибированию их активности.
Очевидно, что прямое воздействие на систему про- и противовоспалительных цитокинов лимитируется не столько сложностью, сколько потенциальными рисками неконтроли-руемости. Вследствие этого в последнее десятилетие акценты во многих исследованиях стали смещаться в сторону изучения активности и эффектов других медиаторов воспаления: производных арахидоновой кислоты, продуктов свободнорадикального окисления, оксида азота. При этом применение в качестве иммуномодуляторов жировых эмульсий, содержащих ω-3 жирные кислоты, являлось не эмпирическим, а теоретически обоснованным положением о возможности замещения в клеточных мембранах арахидоновой кислоты и ее провоспа-лительных производных на эйкозопентаеновую и докозогекса-геновую кислоты и соответствующие противовоспалительные продукты их метаболизма. Последующие экспериментальные и клинические исследования показали, что введение жировых эмульсий, содержащих рыбий жир, сопровождалось снижением концентраци провоспалительных тромбоксана ТxВ 2 и лейкотриена LTС 4 и содружественным повышением концентрации противовоспалительных тромбоксана ТxВ 3 , лейкотриена LTС 5 и простагландинов PgA 1 , PgD 2 , PgF 2α (рис. 3, табл. 1).
По данным I. Breil et al. (1996), замещение эмульсий из соевого масла на эмульсии из рыбьего жира в ходе инфузионной терапии приводило к 50% снижению концентрации LTC 4 с синхронным возрастанием на ту же величину концентрации LTC 5 . S. Sane (2000) в ходе клинико-экпериментальных исследований доказал, что значимое улучшение функции жизненно важных
ω-3 жирные кислоты
Мембрана лейкоцитов
Арахидоновая кислота
PgE2, TxB2, ▼ LTC4, б-кето-PgFi a
Эйкозопентаеновая я Докозогексагеновая я кислоты
*
t PgAi, PgD2, PgF2a TxB3, LTC5
Противовоспалительная активность
Против овоспалительная активность
Рис. 3. Иммуномодулирующее действие ω-3 жирных кислот, основанное на изменении синтеза эйкозаноидов
Таблица 1
Суммарные эффекты инфузии ω-3 жирных кислот на фоне введения бактериального эндотоксина в биологическом эксперименте (по M. Murray и S. Sane, 2000)
Клинические исследования последнего десятилетия убедительно продемонстрировали выраженный позитивный эффект применения жировых эмульсий с ω-3 жирными кислотами у больных с хирургическим сепсисом. В работе I. Grecu et al. (2003) приводятся данные о том, что целенаправленное применение эмульсий с производными рыбьего жира у пациентов, оперированных по поводу распространенных гнойных процессов, и отвечающих критериям сепсиса, обусловило снижение количества повторных операций, уменьшение длительности нахождения в ОРИТ и продолжительности госпитализации. Подобных результатов не было отмечено при использовании соевых эмульсий. Авторами было отмечено, что введение жировых эмульсий с содержанием ω-3 жирных кислот не менее 30% от всех липидов и продолжительностью более 5 суток приводит к снижению концентрации С-реактивного белка у пациентов с абдоминальным сепсисом на 88%.
K. Mayer et al. (2003), также констатируя улучшение исходов лечения больных с абдоминальным сепсисом при использовании эмульсий с ω-3 жирными кислотами, приводит наблюдения за некоторыми позитивными иммунологическими девиациями. А именно: инфузия эмульсий с дериватами рыбьего жира в течение 5–10 суток определяла снижение числа лейкоцитов периферической крови и концентрации С-реактивного белка, увеличение продукции лейкотриена LTB5, стимулирующего нейтрофилы. При этом, в отличие от соевых эмульсий, инфузии эмульсий с ω-3 жирными кислотами не способствовали увеличению концентрации провоспалительных медиаторов ТNF-α, IL-1β, IL-6, IL-8.
В исследование A. Heller et al. (2006) было включено 268 пациентов с абдоминальным сепсисом. Все пациенты получали только эмульсии с ω-3 жирными кислотами, однако дозировка вводимых липидов различалась. Было установлено, что частота прогрессирования сепсиса, длительность нахождения в ОРИТ и продолжительность госпитализации были достоверно меньше у больных, получавших жировые эмульсии с количеством рыбьего жира > 0,05 г на килограмм массы тела в сутки, по сравнению с больными, получавшими те же эмульсии, но в меньшей дозировке. Достоверное снижение летальности было отмечено у пациентов, получавших эмульсии с количеством рыбьего жира > 1 г на килограмм массы тела в сутки. По мнению авторов исследования, включение в программу ведения пациентов с хирургическим сепсисом эмульсий с ω-3 жирными кислотами в адекватной дозировке способно принципиально улучшить результаты лечения и поэтому должно являться обязательным.
Вполне очевидно, что наличие синдрома системной воспалительной реакции у хирургических больных констатируется не только при развитии септического состояния. ССВР является неизбежным спутником и неотъемлимой составной частью патогенеза любого обширного травматического повреждения, в том числе и операционной травмы (см. рис. 4).
Оперативные вмешательства большого объема (см. табл. 2) закономерно вызывают и (или) усиливают системный воспалительный ответ, что увеличивает риск послеоперационных осложнений, нередко связанных с развитием органной и по-лиорганной недостаточности (ПОН). ПОН в свою очередь является следствием гиперпродукции провоспалительных медиаторов, ишемическо-реперфузионного повреждения тканей, которые на фоне состояния гиперкатаболизма приводят к системной органной дисфункции. В этой связи проведенное опе-
Стресс-реакция эндокринной системы
-
• Г иперл родухция гипофимарник гормонов
• Гиперпродукцмя адреналина и ГкС _______________:____ Hn«WWPtiHCTtHTNPCT>
Гиперкатаболимя
Иммунологические и гематологические девиации паперпродукция цитоаиано» - реакция острой фаты - нейтрофильный лейиоцнтоэ лейкоцитарная пролиферация

Операционная
травма
Гипертермия
Граиулоцитоз
Синтез белков острой фазы в печени С-реактиомий бело* • фе«6рим<хен • а^-макроглобуяни
Изменение концентрации транспортных белков поеы мекке концентрации церулоплаэммна снижение коаецеитрации трансферрине, ____________________ альбумине
Изменение концентрации двухвалентных катионов
-
• поеышеаеие коицеитрацни средмаа молекул - оамже ние концентрации (ынка и жеми
Рис. 4. Синдром системной воспалительной реакции после оперативных вмешательств
Таблица 2
Классификация оперативных вмешательств по объему
ративное вмешательство большого объема априорно требует контроля над балансом про- и противовоспалительной системы. В настоящее время не подвергается сомнению утверждение о том, что именно поддержание необходимого уровня активности иммунной системы с предотвращением как гипервоспаления, так и имуносупрессии (в том числе и методами иммуно-нутритивной поддержки) способно принципиально улучшить непосредственные результаты оперативных вмешательств.
Влияние содержащих ω-3 жирные кислоты жировых эмульсий на особенности изменений общего состояния и клиниколабораторных показателей у оперированных больных, а также на само течение послеоперационного периода изучалось достаточно давно. Еще в 1991 году S. Meydani et al. показали, что инфузии эмульсий из рыбьего жира в течение 5 суток послеоперационного периода у пациентов, перенесших вмешательства на пищеварительном тракте, изменяют композицию жирных кислот в мембране лейкоцитов, выраженно повышая в ней долю эйкозапентаеновой кислоты. Логично было предположить, что это повлечет за собой изменение профиля эйкозаноидов – производных арахидоновой и эйкозопентаеновой кислот. Действительно B. Morlion et al. (1996), P. Wachtler et al. (1997) и I. Keibel et al. (2002) показали, что инфузия эмульсий из рыбьего жира непосредственно после оперативных вмешательств сопровождалась снижением в стимулированных ex vivo лейкоцитах производных арахидоновой кислоты – лейкотриенов LTB 4 , LTC 4 и тромбоксана TXA2 при одновременном повышении уровня производных эйкозопентаеновой кислоты – лейкотриенов LTB 5 и LTС 5 .
Еще одним свойством ω-3 жирных кислот, определяющим их иммунонутритивный эффект, является способность оказывать модулирующее действие на метаболизм аргинина. Влияние аргинина на течение послеоперационного периода изучается до- статочно давно. На сегодняшний день установлено, что обширная операционная травма определяет возникновение дефицита аргинина, что влечет за собой иммуносупрессивное состояние и достоверно увеличивает риск инфекционных осложнений. P. Marik et al. (2010) приводят данные о том, что операционная травма приводит к снижению количества циркулирующего аргинина с увеличением активности аргиназы. B. Mizock et al. (2010) указывают, что дефицит аргинина возникает уже на ранних стадиях сепсиса и усугубляется при его прогрессировании. В мета-анализе J. Drover et al. (2011) приводятся свидетельства того, что дополнительное введение аргинина ассоциируется со снижением числа инфекционных осложнений после различных типов оперативных вмешательств и уменьшением продолжительности госпитализации. В уже упомянутом исследовании P. Marik et al. (2010) отмечается, что параллельные введению аргинина инфузии ω-3 жирных кислот уменьшают активность аргиназы-1 – фермента, определяющего биодеградацию аргинина. Соответственно нормализация уровня аргинина может и должна достигаться не только его экзогенным введением (что чревато чрезмерным повышением его концентрации с последующими негативными девиациями иммунитета), но и параллельным снижением активности аргиназы-1, что возможно при инфузии эмульсий с дериватами рыбьего жира (рис. 5).
В последующих клинических исследованиях авторы сосредоточили свое внимание на установлении связи между применением жировых эмульсий с ω-3 жирными кислотами и особенностями течения послеоперационного периода. Прежде всего, при инфузиях эмульсий из рыбьего жира не было выявлено негативного клинически значимого влияния на иммунную систему оперированных пациентов. Более того, в исследовании G. Weiss et al. (2002) были проанализированы формальные результаты оперативного лечения на фоне инфузий
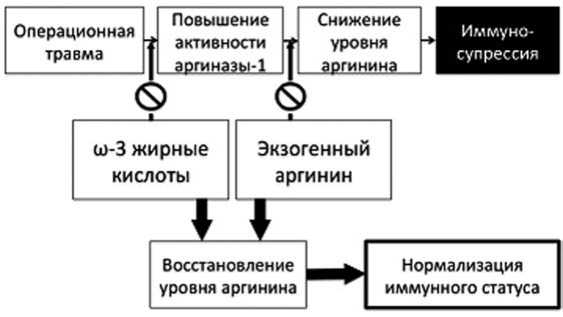
Рис. 5. Один из иммунонутритивных эффектов ω-3 жирных кислот у оперированных пациентов: нормализация уровня аргинина изучаемых жировых эмульсий, такие как продолжительность госпитализации, показывающие клиническую эффективность применения ω-3 жирных кислот. В данной работе пациенты c абдоминальной хирургической патологией получали липиды в виде эмульсии из рыбьего жира в количестве 10 г/сут. Первая инфузия проводилась накануне операции, последующие инфузии – в первые 5 суток послеоперационного периода. На 4 и 5 сутки пациенты дополнительно получали 50 г липидов в составе LCT-жировых эмульсий. При сравнении с группой пациентов, получавших в составе парентерального питания только LCT-жировые эмульсии, достоверных различий в числе инфекционных осложнений выявлено не было. Однако имелось достоверное снижение продолжительности нахождения в ОРИТ и длительности госпитализации у пациентов, получавших эмульсии из рыбьего жира.
E. Tsekos et al. (2004) также сообщили о значительном снижении длительности госпитализации и повторных переводах из общехирургического отделения в ОРИТ (очевидно вследствие системных осложнений) у пациентов после обширных абдоминальных вмешательств на фоне парентеральной нутритивной поддержки с включением ω-3 жирных кислот. Авторы, подчеркивая вышеуказанными данными значимость преимуществ применения эмульсий, содержащих в своем составе дериваты рыбьего жира, у оперированных больных, отмечали, помимо этого, достоверное уменьшение длительности ИВЛ и, что самое главное, снижение уровня послеоперационной летальности. В исследовании A. Heller (2004) было показано, что при пятисуточной инфузии эмульсий, содержащих 20% дериватов рыбьего жира, у пациентов после расширенных операций на пищеварительном тракте лабораторные параметры функции печени и поджелудочной железы нормализовались достоверно быстрей, чем при введении LCT-жировых эмульсий. При этом было отмечено, что у пациентов с объективно высоким риском развития септических состояний продолжительность пребывания в ОРИТ оказалась принципиально меньше на фоне нутритивной поддержки с ω-3 жирными кислотами. Эти же авторы в исследовании 2006 года отметили, что введение дериватов рыбьего жира в количестве 0,11 г/кг/сут в течение 3 дней не влияет на основные показатели послеоперационного периода. При увеличении дозировки до 0,15 г/кг/сут имели место снижение длительности нахождения пациентов в ОРИТ и продолжительность госпитализации. I. Keibel et al. (2002) пришли к выводу о том, что инфузия оперированным пациентам эмульсий в течение 5 суток послеоперационного периода определяет тенденцию к снижению числа гнойно-септических осложнений, длительности нахождения в ОРИТ и продолжительности госпитализации и, что более важно, к снижению послеоперационной летальности. M. Wichmann et al. (2004), используя для парентерального питания у оперированных пациентов исключительно эмульсию Lipoplus, отметили значительное снижение продолжительности госпитализации и послеоперационной летальности. В 2010 году группой авторов во главе с С. Wei при мета-анализе 6 клинических исследований, посвященных применению эмульсий с дериватами рыбьего жира у оперированных пациентов, отмечено, что инфузия этих эмульсий сопровождается снижением числа послеоперационных инфекционных осложнений, длительности нахождения в ОРИТ (более чем на 2 суток) и продолжительности госпитализации.
Данные исследования весьма интересны и, очевидно, весьма убедительны. Однако, как справедливо замечает J. Geert (2007) в этих исследованиях недостаточно подробно (или нарочито скромно вследствие «не полного соответствия» догмам доказательности) описаны многие важные нюансы, иллюстрирующие влияния ω-3 жирных кислот на метаболизм и соответствующие изменения клинического статуса пациентов в послеоперационном периоде. Тем не менее проведенные исследования достаточно убедительно показывают те преимущества, основой которых является всего лишь дополнение парентерального питания пациентов в периоперационном периоде эмульсиями с дериватами рыбьего жира. J. Geert склонен полагать, что основой этих преимуществ являются описанные в вышеуказанных исследованиях процессы инкорпорирования длинноцепочечных полиненасыщенных ω-3 жирных кислот в мембраны лейкоцитов и клеток других тканей. При этом, как и предполагалось ранее, индуцированная ω-3 жирными кислотами иммуномодуляция играет ключевую роль в возникновении позитивных эффектов их применения. Так, P. Wachtler et al. (1997) показали, что на фоне пятисуточного применения жировых эмульсий с дериватами рыбьего жира на 6–10 сутки инфузии концентрация α-TNF, IL-6 в плазме пациентов оказались достоверно ниже, чем при приеме MCT/LCT-жировых эмульсий. В уже упомянутом исследовании G. Weiss et al. (2002) инфузии дериватов рыбьего жира начинали накануне оперативного вмешательства на толстой кишке. При этом на 5 сутки послеоперационного периода были установлены снижение стимулированной бактериальными эндотоксинами продукции α-TNF и интерлейкинов IL-6. В работе P. Schauder et al. (2002) при сравнении влияния на иммунитет оперированных пациентов инфузий LCT-жировых эмульсий и эмульсий, содержащих ω-3 жирные кислоты, продемонстрировано, что различий в количестве популяций циркулирующих лимфоцитов, как и в ин- тенсивности пролиферации Т-лимфоцитов, в пред- и в послеоперационном периоде нет. При этом продукция интерлейкинов IL-2 и интерферонов γ оказывалась достоверно выше в группе пациентов, получавших эмульсии с ω-3 жирными кислотами. Исследование, проведенное в 2012 году группой авторов во главе с Y. Han, показало, что использование жировых эмульсий с дериватами рыбьего жира в противоположность МСТ/LCT-жировым эмульсиям имело своим следствием достоверное снижение концентрации провоспалительных цитокинов в плазме. Отмечалось снижение концентрации IL-1 и IL-8, интерферона γ на 4 сутки послеоперационного периода, а также IL-1, IL-8, интерферона γ, IL-6, ТNF-α на 7 сутки послеоперационного периода. Помимо этого у пациентов, получавших ω-3 жирные кислоты, было выявлено снижение частоты печеночной дисфункции на 17% и числа послеоперационных инфекционных осложнений на 14%.
По мнению авторов всех приведенных выше исследований, включение в программу нутритивной поддержки у пациентов, подвергнутых оперативным вмешательствам на пищеварительном тракте, жировых эмульсий с производными рыбьего жира позволяет контролировать продукцию эйкозаноидов и цитокинов, что в свою очередь является профилактикой индуцированного операционной травмой снижения антигенпрезентирующей клеточной активности и продукции цитокинов Т-лимфоцитами.
В качестве обзора, резюмирующего клинический опыт применения эмульсий с ω-3 жирными кислотами у оперированных пациентов, авторы считают необходимым привести анализ 505 сообщений о проведенных по различному дизайну исследованиях, представленный в 2010 году Bo Chen. В данном мета-анализе, включавшем 892 пациента, изучались корреляции между инфузией эмульсий с производными рыбьего жира оперированным больным и особенностями течения и результатами ближайшего послеоперационного периода. Все пациенты были подвергнуты оперативным вмешательствам большого объема, более половины из которых выполнялись по поводу злокачественных новообразований. Продолжительность инфузий варьировала от 5 до 7 суток послеоперационного периода. Доза вводимых ω-3 жирных кислот составила 0,07–0,225 г/кг/сут. Побочных реакций и осложнений при инфузии изучавшихся препаратов не было ни у одного пациента, что дало основание авторам сделать заключение о безопасности данного типа жировых эмульсий. Проведенный мета-анализ позволил сделать выводы об обусловленном именно ω-3 жирными кислотами достоверном уменьшении длительности госпитализации (WMD – 2,98; 95% Cl) и продолжительности пребывания в ОРИТ (WMD – 1,8; 95% Cl), снижении числа послеоперационных инфекционных осложнений (OR 0,56; 95% Cl). Установлено, что инфузии эмульсий с производными рыбьего жира определяли снижение активности АсАТ (WMD – 8,73; 95% Cl), АлАТ (WMD – 7,61; 95% Cl) и, напротив, увеличивали плазменную концентрацию α-токоферола (WMD 15,44; 95% Cl). При этом изменений уровня билирубина и триглицеридов в плазме выявлено не было. Данные факты говорят, с одной стороны, об отсутствии гепатотоксического эффекта данного типа жировых эмульсий, а с другой стороны – об их гепатопротективном действии в условиях ССВР. Вполне закономерно были установлены повышение плазменной концентрации эйкозопентаено-вой и докозогексагеновой кислот, существенного изменения концентрации арахидоновой кислоты в плазме выявлено не было. Несмотря на констатируемые во многих исследованиях тенденции к снижению послеоперационной летальности, формальной статистически достоверной разницы в летальности у больных без применения и с применением ω-3 жирных кислот авторы установить не смогли (OR 0,53–3,8).
В 2011 году группой авторов во главе с J. Gao были представлены данные об экономической эффективности применения липидных эмульсий с ω-3 жирными кислотами у пациентов, перенесших обширные оперативные вмешательства, и у аналогичной группы пациентов с установленным наличием ССВР. Применение эмульсий с производными рыбьего жира достоверно снизило частоту инфекционных осложнений, повторных операций, длительность госпитализации и пребывания в ОРИТ. При этом уменьшение числа повторных операций у больных без явлений ССВР позволило снизить затраты на лечение одного пациента на $17, уменьшение числа инфекционных осложнений привело к снижению затрат на $26 и, наконец, уменьшение летальности определило снижение затрат на $14. В аналогичных ситуациях, но уже у пациентов с ССВР экономия выглядела более впечатляющей – $107, $45 и $35 на лечение одного больного соответственно.
Общеизвестно, что обширные травматические повреждения, затрагивающие изолированно или совместно структуры опорно-двигательного аппарата, внутренние органы и покровные ткани закономерно определяют возникновение выраженных метаболических изменений, способствующих развитию системной иммуноcупрессии, септических осложнений и органной недостаточности. Посттравматический (в том числе и послеожоговый) метаболизм, инициированный активацией симпатоадреналовой системы, в своем развитии характеризуется состоянием гиперметаболизма с резким повышением энергопотребления, белковым катаболизмом, гипергликемией, связанной с активацией процессов глюконеогенеза, инсулино-резистентностью, снижением толерантности к глюкозе и высокой концентрацией инсулина плазмы (так называемый «травматический диабет»).
Наряду с гиперметаболическим состоянием обширное травматическое повреждение тканей посредством массивного высвобождения провоспалительных цитокинов и системы комплемента запускает каскад ССВР. Экзогенная контаминация и (или) бактериальная транслокация, обусловленная гемоперфузионными нарушениями при травматическом, геморрагическом и ожоговом шоке, в еще большей степени усиливает метаболические нарушения и системное воспаление. Работы L. Plank (1999), G. Lavery (2000) и K. Trayer (2003) показали, что посттравматические осложнения имеют в своем основании именно гиперметаболические процессы и связанные с ними гипергликемию, лактатный ацидоз и иммуносупрессию. В этой связи, аналогично нутритивной поддержке в послеоперационном периоде, нутритивная поддержка у пациентов с политравмой и обширными ожогами должна обеспечивать компенсацию энергетических потребностей без усиления гипергликемии, нивелировать дефицит белка и контролировать баланс про- и противовоспалительной активности. При ожоговой болезни потребности организма обожженных в энергии возрастают соответственно на 50% (при ожогах 10–20% поверхности тела), на 100% (при ожогах 20–40%) и на 150% (при ожогах площадью более 40%). Таким образом, потребности организма обожженных в энергии могут достигать 4000–5000 ккал/сут.
Очевидно, что компенсация энергопотребностей у пациентов с травматическими повреждениями должна достигаться инфузиями жировых эмульсий: доля липидов в небелковой энергии должна составлять не менее 50%, их количество – 2–3 г/кг/сут. Однако также очевидно и то, что только энергообеспечение не в состоянии решить всех метаболических проблем, обусловленных повреждением, у данного контингента больных необходимо целенаправленное проведение иммуно-нутритивной поддержки. Тем более, что процессы гиперметаболизма и ССВР являются звеньями одной патологической цепи. N. Ward (2010) отметил, что гиперпродукция цитокинов, включая TNF-α, IL-1 и IL-6, играет существенную роль в пролонгации гиперметаболического состояния.
К сожалению, в настоящее время работы в данной области крайне немногочисленны и касаются по большей части опыта применения при обширных повреждениях глутамина. Тем не менее в ряде исследований показана позитивная роль жировых эмульсий у пациентов с политравмой, в том числе и как компонента иммунонутритивной поддержки. Еще в 1995 году F. Battistella установил, что введение в программу парентерального питания жировых эмульсий (тогда речь шла лишь о LCT-эмульсиях) достоверно снижает длительность ИВЛ, срок нахождения в ОРИТ, длительность госпитализации и улучшает выживаемость при политравме за счет уменьшения числа инфекционных осложнений, в том числе пневонии и сепсиса. В 2005 году G. Huschak опубликовал отчет уже о сравнении результатов применения у пациентов с политравмой LCT или MCT/LCT (Lipofundin) жировых эмульсий. Автор отметил почти двукратное снижение длительности ИВЛ и продолжительности пребывания пациентов в ОРИТ на фоне инфузии Lipofundin. Применяя те же MCT/LCT жировые эмульсии у больных с обширными ожогами, A. Garcia-de-Lorenzo (2005) установил уменьшение длительности нахождения пациентов в ОРИТ на 9 суток, длительности госпитализации на 8 суток и снижение летальности на 10% по сравнению с пациентами, получавшими LCT-жировые эмульсии.
В качестве резюме по проблеме использования жировых эмульсий в качестве компонента иммунонутритивной поддержки в хирургии вполне логичным будет представить фрагмент ESPEN Guidelines on Parenteral Nutrition (2009), ка- сающийся именно хирургических пациентов. В рекомендациях указывается , что «оптимальный режим парентерального питания у хирургических больных в критических состояниях должен включать дополнение ω-3 жирными кислотами». Комментируя данное весьма лаконичное положение, M. Braga и со-авт. указывают, что включение в программу парентерального питания жировых эмульсий само по себе уменьшает углеводную нагрузку и осмолярность вводимых растворов. Однако замещение углеводных калорий на калории жировых эмульсий несет в себе целый ряд метаболических эффектов. Являвшиеся многие годы стандартом в парентеральном питании соевые эмульсии с ω-6 полиненасыщенными жирными кислотами обладают выраженным провоспалительным действием и многочисленные исследования показали наличие зависимости между дозировкой данных эмульсий и их побочным действием. С учетом данных обстоятельств были предприняты попытки уменьшения количества вводимых ω-6 жирных кислот без снижения в инфузируемых питательных смесях доли липидных калорий. Так появились MCT/LCT-жировые эмульсии, где доля длинноцепочечных ω-6 жирных кислот была сведена к физиологически возможному минимуму (полностью отказаться от применения длинноцепочечных жирных кислот невозможно вследствие реальной угрозы дефицита незаменимых жирных кислот). Общеизвестно, что применение МСТ/LCT жировых эмульсий сопровождалось принципиальным уменьшением иммуносупрессивных эффектов. Дополнительное введение ω-3 жирных кислот в состав МСТ/LCT-жировых эмульсий придало последним противовоспалительные и иммуномодулирующие свойства: отмечено снижение интенсивности воспалительного ответа на введение бактериальную эндотоксемию без явлений иммуносупрессии, применение ω-3 жирных кислот в больших дозах способствовало снижению частоты инфекционных осложнений и органной недостаточности, уменьшению длительности нахождения в ОРИТ и сроков госпитализации у хирургических пациентов с явлениями ССВР. Данные обстоятельства позволяют считать необходимым и возможным применение MCT/LCT-эмульсий с ω-3 жирными кислотами (например, Lipoplus) в качестве эффективного донатора энергии и компонента иммунонутритивной поддержки у больных после оперативных вмешательств большого объема, у пациентов с сепсисом, у больных с обширными травматическими повреждениями и с ожогами.
Список литературы Эмульсии с -3 жирными кислотами как компонент иммунонутритивной поддержки в хирургической клинике
- Лейдерман И.Н., Гирш А.О., Евсеев М.А. Жировые эмульсии для парентерального питания в хирургии и интенсивной терапии. С.-Пб., 2013. 150 с.
- Calder P. C. N-3 fatty acids, inflammation, and immunity-relevance to post-surgical and critically ill patients//LIPIDS. 2004. Vol. 39 (12). P. 1147-1161.
- Chambrier C., Laville M., Rhzioual Berrada K., Odeon M., Bouletreau P., Beylot M. Insulin sensitivity of glucose and fat metabolism in severe sepsis//Clin. Sci. (Lond). 2000. Vol. 99(4). P. 321-328.
- АКЕ recommendations for enteral and parenteral nutirition in adults. Version 2008-2010. English Pocket Edition, p. 143.
- Wachtler P., König W., Senkal M., Kemen M., Köller M. Influence of a total parenteral nutrition enriched with o-3 fatty acids on leukotriene synthesis of peripheral leukocytes an systemic cytokine levels in patients with major surgery//J. Trauma. 1997. Vol. 42. P. 191-199.
- Linseisen J., Hoffmann J., Lienhard S., Jauch K-W., Wolfram G. Antioxidant status of surgical patients receiving TPN with an omega-3-fatty acid-containing lipid emulsion supplemented with a-tocopherol//Clin. Nutr. 2000. Vol. 19(3). P. 177-184.
- Wanten Geert J. A., Calder Philip C. Immune mo dulation by parenteral lipid emulsions//Am. J. Clin. Nutr. 2007. Vol. 85. P. 1171-1184.
- Garnacho-MonteroJ., Ortiz-LeybaC., Jimenez-Jimenez F.J., Garcia-Garmendia J.L., Jimenez-Jimenez L. M., Garnacho-Montero M. C., Barrero-Almodovar A. Clinical and metabolic effects of two lipid emulsions on the parenteral nutrition of septic patients//Nutrition. 2002 Feb. Vol. 18(2). P. 134-138.
- Faucher M., Bregeon F., Gainnier M., Thirion X. et al. Cardiopulmonary Effects of Lipid Emulsions in Patients With ARDS//Chest. 2003. Vol. 124. P. 285-291.
- Lekka M., Liokatis S., Vasiliki N. et al. The impact of intravenous fat emulsion administration in acute lung injury//Am. J. Respir. Crit. Care Med. 2004. Vol.169. P. 638-644.
- Reinhart K. et al. Diagnose and Therapie der Sepsis//Anaesthesist. 2006. Suppl. 1. B. 55. S. 43-56.
- Calder P.C. Long-chain n-3 fatty acids and inflammation: potential application in surgical and trauma patients//Braz. J. Med. Biol. Res. 2003. Vol. 36. P. 433-446.
- Morlion B.J., Torwesten E., Lessire H., Sturm G., Peskar B. M., Fωrst P., and Puchstein C. The effect of parenteral fish oil on leukocyte membrane fatty acid composition and leukotriene-synthesizing capacity in patients with postoperative trauma//Metabolism. 1996. Vol. 45. P. 1208-1213.
- Weiss G., Meyer F., Matthies B., Pross M., Koenig W., Lippert H. Immunomodulation by perioperative administration of n-3 fatty acids//Br. J. Nutr. 2002. Vol.87 (suppl. 1). S89-S94.
- Tsekos E., Reuter C., Stehle P., Boeden G. Perioperative administration of parenteral fish oil supplements in a routine clinical setting improves patient outcome after major abdominal surgery//Clinical Nutrition. 2004. Vol. 23. P. 325-330.
- Wan J.M.F., Teo T.C., Babayan V.K., and Blackburn G.L. Invited comment: lipids and the development of immune dysfunction and infection//JPEN. 1988. Vol.12. Supplement. 43S-52S.
- Barbosa V.M., Miles E.A., Cainau C., Lafuente E., Calder P. Effects of fish oil containing lipid emulsion on plasma phospholipid fatty acids, in flammatory markers, and clinical outcomes in septic patients: a randomized, controlled clinical trial//Critical Care. 2010. Vol. 14. R5.
- Wang X., Li W, Li N, Li J. Ω-3 fatty acids supplemented parenteral nutrition decreases hyperinflammatory response and attenuates systemic disease sequelae in severe acute pancreatitis: a randomized and controlled study//JPEN. 2006. Vol. 32, № 3. P. 226-241.


