Эндокардиальная имплантация левожелудочкового электрода для кардиоресинхронизирующей терапии
Автор: Кропоткин Евгений Борисович, Иваницкий Эдуард Алексеевич, Сакович Валерий Анатольевич, Дробот Дмитрий Борисович, Ганкин Марк Исаакович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.30, 2015 года.
Бесплатный доступ
С целью оценки эффективности и безопасности кардиоресинхронизирующей терапии, где левожелудочковый электрод имплантирован эндокардиально, были проанализированы данные обследования и лечения 10 последовательных пациентов.
Сердечная недостаточность, сердечная ресинхронизирующая терапия, левый желудочек, эндокардиальная стимуляция, фракция выброса, транссептальная пункция, трансапикальный доступ
Короткий адрес: https://sciup.org/14919989
IDR: 14919989 | УДК: 616.12-008.313.2
Текст научной статьи Эндокардиальная имплантация левожелудочкового электрода для кардиоресинхронизирующей терапии
Сердечная ресинхронизирующая терапия на сегодняшний день является общепризнанным методом лечения застойной сердечной недостаточности с дисфункцией левого желудочка (ЛЖ) [1]. С этой целью имплантируется трехкамерный кардиоресинхронизирующий электрокардиостимулятор, где левожелудочковый электрод позиционируется через коронарный синус в одну из латеральных или заднюю вену сердца. С момента имплантации первого кардиоресинхронизирующего устройства была проведена огромная работа по усовершенствованию систем доставки левожелудочкового электрода и самой методики имплантации [2–4]. Несмотря на это, доля безуспешной эндоваскулярной имплантации левожелудочкового электрода в систему коронарного синуса составляет 10–15%. Причинами тому могут быть особенности анатомии ветвей коронарного синуса: наличие ветвей с очень маленьким диаметром, отхождение ветвей под острым углом, что делает практически невозможным проведение электрода и его стабильность дистальнее места ангуляции. Крайне редко может встречаться наличие мембран в области устья коронарного синуса или в его просвете. Высокие пороги стимуляции миокарда ЛЖ, стимуляция диафрагмального нерва также ограничивают трансвенозный доступ к эпикардиальной стимуляции ЛЖ. Следствием всего вышеописанного является имплантация электрода в существующие, но менее подходящие для этих целей ветви, что увеличивает процент нереспонде-ров методики [5, 6]. Дислокация левожелудочкового электрода в раннем или отдаленном послеоперационном пе- риоде может составлять, согласно данным анализа шести крупных исследований, 5,7% [13]. В ряде случаев сразу после начала сердечной ресинхронизирующей терапии был отмечен ее отрицательный эффект [10, 11], от 20 до 40% пациентов с имплантированными CRT-устройствами, по данным ряда авторов, не отвечают на терапию [13]. При невозможности имплантации левожелудочкового электрода обычным путем используют торакотомный или торакоскопический доступы [7, 8]. Такие доступы достаточно травматичны для пациентов, страдающих застойной сердечной недостаточностью, и могут увеличивать смертность этой когорты пациентов. Более того, торако-томный и торакоскопический доступы не всегда могут обеспечить имплантацию электрода в целевое место, так как эпикардиальная поверхность ЛЖ ограничена сосудами, эпикардиальным жиром и наличием рубцов [9]. Очевидна необходимость поиска более эффективных и надежных способов доставки электрода к миокарду ЛЖ. На данный момент в литературе уже описаны методики транссептальной имплантации левожелудочкового электрода в различных модификациях [14, 15], трансапикальной имплантации [16], и также методика, где осуществлялась пункция межжелудочковой перегородки [17]. Все указанные выше альтернативные методики эндокардиальной имплантации левожелудочкового электрода имеют свои ограничения.
Тромбоэмболический синдром. Если тромбообразова-ние на электродах, расположенных в правых полостях сердца, грозит тромбоэмболией легочной артерии [18], то тромбообразование на электродах слева может стать причиной более серьезной системной тромбоэмболии, включая эмболии в сосуды головного мозга [19, 20]. Более того, не исключается возможность парадоксальной тромбоэмболии, способствовать которой может легочная гипертензия, часто присутствующая у пациентов, страдающих застойной сердечной недостаточностью.
Взаимодействие электродов с митральным клапаном. В случае транссептального доступа электрод позиционируется в полости ЛЖ через митральный клапан. Такое тесное взаимодействие может привести к риску формирования митральной недостаточности или инфекционного эндокардита на клапане. В существующих публикациях, касающихся транссептально имплантированных электродов, нет указаний на формирование митральной недостаточности, которая гипотетически может быть следствием тесного контакта с электродом. Более серьезной проблемой может быть риск развития инфекционного эндокардита, принимая во внимание нарастающую проблему увеличения инфекционных осложнений, связанных с имплантируемыми устройствами. Трудным представляется процесс эндоваскулярного удаления электродов из левых полостей сердца при наличии вегетаций, а операции удаления электродов в условиях искусственного кровообращения у данной категории пациентов представляют высокий риск. В противовес всему вышеупомянутому можно противопоставить положительные эффекты эндокардиальной стимуляции ЛЖ:
-
1. Любой из доступов обеспечивает возможность выбора места для имплантации электрода. Это, с одной стороны, может решить проблему тех нереспондеров, у которых электрод был имплантирован в субоптимальную область из-за отсутствия ветвей коронарного синуса в нужной области. С другой стороны, свобода манипуляций в ЛЖ дает возможность поиска областей с самыми оптимальными параметрами стимуляции. Следствием этого может быть немалый вклад в продление срока службы имплантированного устройства, а это экономическая составляющая процесса. Появляется возможность уменьшить количество реимплантаций устройств по причине истощения батареи, а также избежать более высокого риска возникновения инфекционных осложнений, связанных с заменой стимулирующих систем.
-
2. Эндокардиальная стимуляция ЛЖ является более физиологичной по сравнению с эпикардиальной. Так, в исследованиях было показано, что при стимуляции соответствующих областей ЛЖ эндокардиальная стимуляция сопровождалась увеличением соотношения dp/dt max на 90%, а ударная работа ЛЖ – на 50% в сравнении с эпикардиальной. Также имеются данные о развитии желудочковых аритмий в результате эпикардиальной стимуляции ЛЖ, поскольку нарушается нормальная последовательность активации миокарда ЛЖ в направлении от эндокарда к эпикарду [10, 11].
Материал и методы
В исследование были последовательно включены 10 пациентов, средний возраст – 60,5 лет, у которых были показания для кардиоресинхронизирующей терапии, а также не было выявлено противопоказаний для антикоагулянтной терапии. Характеристики пациентов представлены в таблице 1. Попытки имплантации левожелудочкового электрода через коронарный синус у всех пациентов были безуспешными. У 9 пациентов на догоспитальном этапе была диагностирована фибрилляция предсердий (1 – пароксизмальная форма, 8 – длительно существующая персистирующая форма), назначена антикоагулянтная терапия варфарином. За трое суток до операции варфарин отменялся, и пациенту проводилась терапия прямыми антикоагулянтами. Чреспищеводная эхокардиография выполнялась не более чем за 24 ч до операции для исключения наличия тромбов в левых полостях сердца.
После операции пациенту вновь назначался варфа-рин. При достижении целевого значения МНО 2,5–3,5 низкомолекулярные гепарины отменялись, и пациент выписывался из стационара. Восьми пациентам были имплантированы системы CRT – D, двум CRT – P. Трем пациентам одномоментно была выполнена радиочастотная аблация АВ-соединения. Двум пациентам левожелудочковый электрод был имплантирован с использованием трансапикального доступа по причине блока на уровне левой подключичной и верхней полой вены.
Транссептальная имплантация левожелудочкового электрода. Оперативное лечение осуществлялось в рен-тгеноперационной под местной анестезией и медикаментозной седацией пациента. Использовались три доступа: левый подключичный и оба бедренных. Левый бедренный доступ использовался для проведения катетера внутрисердечной эхокардиографии AcuNav (Biosense Webster) с целью осуществления визуализации структур сердца. Через правый бедренный доступ проводился многоцелевой интродьюсер Preface (Biosense Webster) в правые отделы сердца. Preface проводился через ранее установленный 11F интродьюсер (Cordis). После этого осуществлялась системная гепаринизация пациента путем внутривенного введения раствора гепарина под контролем АСТ (целевые значения 300–400 с) Под контролем внутрисердечной эхокардиографии выполнялась транссептальная пункция, и интродьюсер Preface проводился в полость левого предсердия, по которому проводился электрод CapSure Fix 85 см (Medtronic, Minneapolis, USA) с актив-
Таблица 1
Характеристики пациентов
|
№ |
Возраст |
Пол |
Тип кардиомиопатии |
ФК СН по NYHA |
Фракция выброса ЛЖ |
Доступ для имплантации ЛЖ электрода |
|
1 |
62 |
ж |
ДКМП |
III |
34% |
Транссептальный |
|
2 |
72 |
ж |
ИКМП |
III |
20% |
Транссептальный |
|
3 |
61 |
м |
ДКМП |
III |
22% |
Транссептальный |
|
4 |
67 |
ж |
ДКМП |
III |
40% |
Транссептальный |
|
5 |
64 |
м |
ИКМП |
III |
21% |
Трансапикальный |
|
6 |
59 |
ж |
ИКМП |
III |
35% |
Транссептальный |
|
7 |
34 |
ж |
ДКМП |
III |
23% |
Трансапикальный |
|
8 |
61 |
м |
ИКМП |
III |
32% |
Транссептальный |
|
9 |
64 |
м |
ИКМП |
III |
26% |
Транссептальный |
|
10 |
61 |
м |
ДКМП |
III |
29% |
Транссептальный |
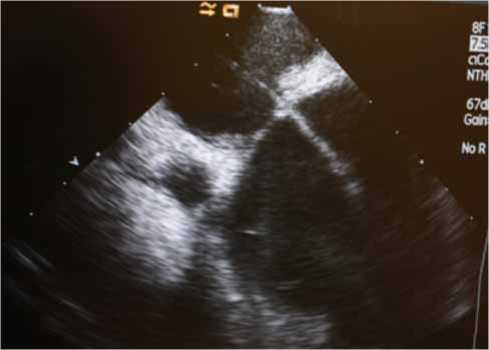
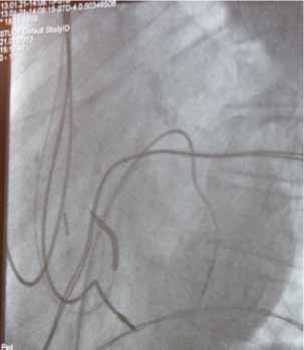
Рис. 1. Р-скопический и Эхо-контроль имплантации левожелудочкового электрода
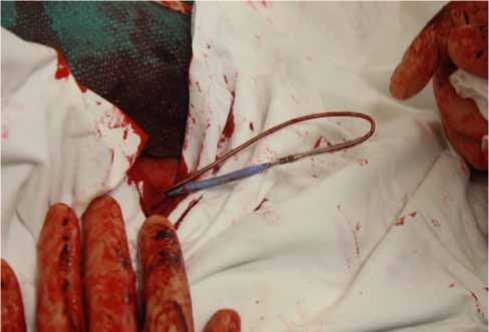
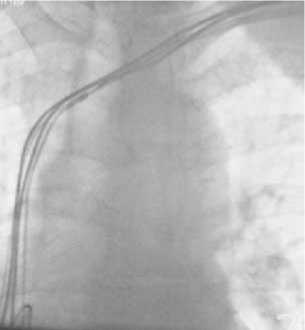
Рис. 2. Проведение коннекторной части электрода из бедренного доступа в подключичную рану
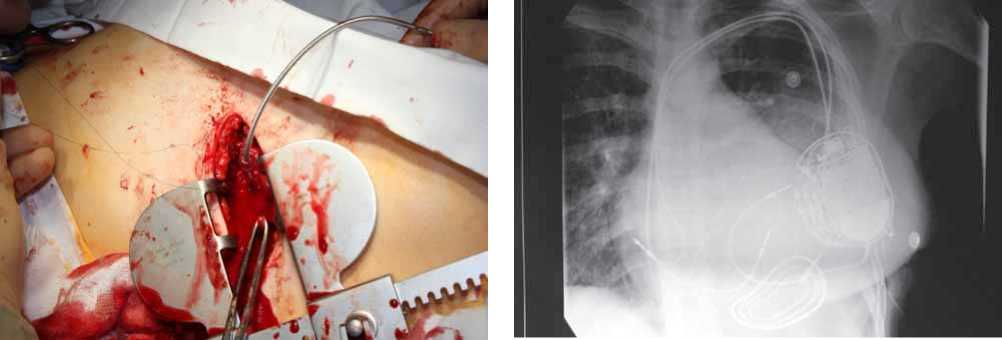
Рис. 3. Трансапикальное введение электрода в полость ЛЖ
ной фиксацией. Дальнейшее проведение электрода в полость ЛЖ осуществлялось под одновременным контролем рентгеноскопии и внутрисердечной эхокардиографии (рис. 1). Электрод позиционировался в задне-базальных сегментах ЛЖ. Интродьюсер выводился из полости левого предсердия и полностью удалялся из правой бедренной области с использованием инструментария для удаления обычных систем доставки электродов. Проводник Super Stiff (Boston Scientific, Boston, MA, USA) проводился через 11F интродьюсер, в котором уже находился проксимальный конец левожелудочкового электрода, в правое предсердие. Из раны в левой подключичной об-
Рис. 4. Р-скопический контроль позиционирования левожелудочкового электрода ласти по интродьюсеру проводилась ловушка Goose Neck (Boston Scientific, Boston, MA, USA) в полость правого предсердия для захвата проводника, который выводился в левую подключичную область. По нему из подключичного доступа в бедренный проводился коронарный катетер Amplatz (Boston Scientific, Boston, MA, USA). После извлечения проводника из коронарного катетера и удаления 11F интродьюсера из бедренного доступа коннек-торная часть электрода фиксировалась в просвете катетера, под контролем рентгеноскопии выводилась в левую подключичную область и соединялась с CRT (рис. 2).
Трансапикальная имплантация левожелудочкового электрода. Оперативное лечение осуществлялось в условиях общей анестезии с искусственной вентиляцией легких. Под контролем рентгеноскопии намечалось место будущего торакотомного доступа с прицелом на верхушку ЛЖ. Минидоступ над вехушкой ЛЖ, перикард вскрывался кпереди от диафрагмального нерва. На бессосудистую зону миокарда ЛЖ накладывался кисетный шов на прокладках. Одномоментно осуществлялось внутривенное введение гепарина под контролем АСТ (целевые значения 300–400 с). По методике Сельдингера осуществлялась пункция ЛЖ, и электрод проводился в его полость (рис. 3). Под контролем рентгеноскопии электрод позиционировался в задне-базальных сегментах, и осуществлялся контроль параметров стимуляции. Если параметры стимуляции были удовлетворительны, электрод фиксировался спиралью (рис. 4). С помощью манжеты и кисетного шва электрод фиксировался к верхушке ЛЖ и с оставлением запаса к мягким тканям в области торако-томного доступа, затем с помощью туннелятора подкожно проводился в ложе и соединялся с CRT. Плевральная полость дренировалась и рана ушивалась послойно.
Результаты
Все электроды были имплантированы с первой попытки. В одном случае наблюдалось образование гематомы ложа ЭКС, устранено пункционно. Тромбоэмболических осложнений с момента имплантации устройств и до настоящего времени диагностировано не было. Все пациенты регулярно осуществляли визиты согласно установленному и обсужденному с ними сроку: 6, 12, 24 мес. Хронические пороги стимуляции ЛЖ были сопоставимы с таковыми в правом желудочке (табл. 2).
Все пациенты были респондерами кардиоресинхро-низирующей терапии. Согласно выполненному эхокардиографическому исследованию 3D Strain, у всех пациентов отмечалось улучшение насосной функции ЛЖ. Осложнений, связанных с имплантацией левожелудочкового электрода, не было. В одном случае после трассепталь-ной имплантации левожелудочкового электрода нагноение ложа потребовало удаления системы и реимплантации на контрлатеральную сторону. Одна пациентка, вклю-
Таблица 2
Пороги стимуляции эндокардиального левожелудочкового электрода
Ограничения
Ограничивающими факторами данного исследования являются: малое количество пациентов, относительно небольшой срок наблюдения, а также тот факт, что исследование является одноцентровым.
Список литературы Эндокардиальная имплантация левожелудочкового электрода для кардиоресинхронизирующей терапии
- Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM)//Eur. J. Heart Fail. -2008. -Vol. 29. -P. 2388-2442.
- Cazeau S., Alonso C., Jauvert G. et al. Cardiac resynchronization therapy//Europace. -2004. -Vol. 5. -P. 42-48.
- Leon A.R., Abraham W.T., Curtis A.B. et al. Safety of transvenous cardiac resynchronization system implantation in patients with chronic heart failure: combined results of over 2,000 patients from a multicenter study program//J. Am. Coll. Cardiol. -2005. -Vol. 46. -P. 2348-2356.
- Gras D., Bocker D., Lunati M. et al. Implantation of cardiac resynchronization therapy systems in the CARE-HF trial: procedural success rate and safety//Europace. -2007. -Vol. 9. -P. 516-522.
- Becker M., Altiok E., Ocklenburg C. Analysis of LV lead position in cardiac resynchronization therapy using different imaging modalities//J. Am. Coll. Cardiol. Cardiovasc. Imaging. -2010. -Vol. 3. -P. 472-481.
- Ypenburg C., Schalij M.J., Bleeker G.B. et al. Impact of viability and scar tissue on response to cardiac resynchronization therapy in ischaemic heart failure patients//Eur. Heart J. -2007. -Vol. 28. -P. 33-41.
- Puglisi A., Lunati M., Marullo A.G. et al. Limited thoracotomy as a second choice alternative to transvenous implant for cardiac resynchronisation therapy delivery//Eur. Heart J. -2004. -Vol. 25. -P. 1063-1069.
- Mair H., Jansens J.L., Lattouf O.M. et al. Epicardial lead implantation techniques for biventricular pacing via left lateral mini-thoracotomy, video-assisted thoracoscopy, and robotic approach//Heart Surg. Forum. -2003. -Vol. 6. -P. 412-417.
- Miller A.L., Kramer D.B., Lewis E.F. et al. Event-free survival following CRT with surgically implanted LV leads versus standard transvenous approach//Pacing Clin. Electrophysiol. -2011. -Vol. 34. -P. 490-500.
- Fish J.M., Di Diego J.M., Nesterenko V.V. et al. Epicardial activation of left ventricular wall prolongs QT interval and transmural dispersion of repolarization: implications for biventricular pacing//Circulation. -2004. -Vol. 109. -P. 2136-2142.
- Fish J.M., Brugada J., Antzelevitch C. Potential proarrhythmic effects of biventricular pacing//J. Am. Coll. Cardiol. -2005. -Vol. 46. -P. 2340-2347.
- Abraham W.T., Fisher W.G., Smith A.L. et al. MIRACLE Study Group. Multicenter Insync Randomized Clinical Evaluation//Ann. Thorac. Surg. -2009. -Vol. 87. -P. 650-652.
- Van Rees J.B., de Bie M.K., Thijssen J. et al. Implantation-related complications of implantable cardioverter-defibrillators and cardiac resynchronization therapy devices: a systematic review of randomized clinical trials//J. Am. Coll. Cardiol. -2011. -Vol. 58. -P. 995-1000.
- Pierre Bordachar P., Derval N., Ploux S. et al. Left ventricle endocardial stimulation for severe heart failure//J. Am. Coll. Cardiol. -2010. -Vol. 56. -P. 747-753.
- Morgan J.M., Scott P.A., Turner N.G. et al. Targeted left ventricular endocardial pacing using a steerable introducing guide catheter and active fixation pacing lead//Europace. -2009. -Vol. 11. -P. 502-506.
- Kassai I., Foldesi C., Szekely A. et al. Alternative Method for Cardiac Resynchronization: Transapical Lead Implantation//Ann. Thorac. Surg. -2009. -Vol. 87. -P. 650-652.
- Betts T.R., Gamble J.H.P., Khiani R. et al. Development of a technique for left ventricular endocardial pacing via puncture of the interventricular septum//Circ. Arrhythm. Electrophysiol. -2014. -Vol. 7. -P. 17-22.
- Karavidas A., Lazaros G., Matsakas E. et al. Early pacemaker lead thrombosis leading to massive pulmonary embolism//Echocardiography. -2004. -Vol. 21. -P. 429-432.
- Jais P., Takahashi A., Garrigue S. et al. Mid-term follow-up of endocardial biventricular pacing//Pacing Clin. Electrophysiol. -2000. -Vol. 23. -P. 1744-1747.
- Leclercq F., Hager F.X., Macia J.C. et al. Left ventricular lead insertion using a modified transseptal catheterization technique: a totally endocardial approach for permanent biventricular pacing in end-stage heart failure//Pacing Clin. Electrophysiol. -1999. -Vol. 22. -P. 1570-1575.
- Van Deursen C., Van Geldorp I.E., Rademakers L.M. et al. Left ventricular endocardial pacing improves resynchronization therapy in canine left bundle-branch hearts//Circ. Arrhythm. Electrophysiol. -2009. -Vol. 2. -P. 580-587.


