Эндоскопическая коррекция пузырно-мочеточникового рефлекса у детей: дифференцированный выбор метода, материала и его дозирования
Автор: Байбиков Р.С., Шадеркина В.А., Погодина Мария Александровна, Успенский С.А., Миронова М.Г.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Детская урология
Статья в выпуске: 4 т.14, 2021 года.
Бесплатный доступ
Введение. Трендом современной медицины в последнее десятилетие является все более частый приоритет малоинвазивных технологий и максимально возможная отсрочка обширных хирургических вмешательств по показаниям, что особенно актуально в детской урологической практике. Материалы и методы. Представленная работа посвящена анализу составов, эффектов и последействия применения различных гелевых имплантатов для коррекции пузырно-мочеточниковогорефлюкса (ПМР). Всего для публикации отобраны 19российских, 30 зарубежных научных публикаций и 3 Приказа Минздрава России. Оценивали изолированные свойства полимерных материалов, их прогнозируемое поведение in vitro в различных внешних условиях, после имплантации в биологические ткани, а также клинические данные, полученные практикующими специалистами в области детской урологии. Результаты. Различные объемообразующие гели применяются для эндоскопической коррекции ПМР у детей в течение 40 лет, однако ряд вопросов по выбору протокола первичного эндоскопического лечения и коррекции в настоящее время остается открытым. Первый шаг при лечении ПМР остается за эндоскопической коррекцией (ЭК), а хирургией второго шага является реимплантация мочеточника. Хотя методика ЭК и является зрелой, более глубокое изучение ранее известных полимеров и появление новых объемобразующих агентов (ООА) на основе различных субстанций постепенно подводит к переосмыслению подходов к выбору ООА. Инертный и биосовместимый полиакриламидный гель 3-го поколения Рефлюксин уже за 1 год клинического применения показал свою стабильную эффективность и безопасность в ближайшем периоде после имплантации при разных степенях ПМР. Выводы. Разработки и достижения современных подходов в лечении ПМР в будущем обещают стандартизировать выбор методики ЭК и помочь выстроить алгоритм для определения оптимальной тактики эндоскопической коррекции рефлюкса с применением всего имеющего спектра объемообразующих агентов.
Детская урология, дети, пузырно-мочеточниковый рефлюкс, эндоскопическая коррекция, объемообразующий агент, полимер, рефлюксин, полиакриламид, пааг, ppc, dxha, коллаген
Короткий адрес: https://sciup.org/142231526
IDR: 142231526 | DOI: 10.29188/2222-8543-2021-14-4-114-130
Текст научной статьи Эндоскопическая коррекция пузырно-мочеточникового рефлекса у детей: дифференцированный выбор метода, материала и его дозирования
Пузырно-мочеточниковый рефлюкс (ПМР) у детей является социально значимым заболеванием, так как сохранность функции почек является ключевой задачей детского уролога, выявившего данную патологию. Это заболевание имеет различную встречаемость у детей разного возраста и пола. Так, у 0,4–1,8% пациентов детского возраста рефлюкс протекает бессимптомно, при рецидивирующих инфекциях мочевыводящих путей (ИМП) он выявляется у 30%. При этом среди всех детей с ИМП, вероятность ПМР у мальчиков выше, чем у девочек (29% и 14% соответственно), что обусловлено более высоким гидродинамическим сопротивлением при микции вследствие анатомических различий. Именно у мальчиков рефлюкс более высоких степеней в раннем возрасте имеет значительно более высокую тенденцию к самостоятельному разрешению в процессе роста и развития органов мочевыделительной системы, и на первый план выходит значимость заболевания и необходимость его излечения среди маленьких пациентов женского пола, у которых должны быть исключены риски развития гидронефроза и рецидивирующих пиелонефритов на фоне будущей гестации [1-3].
Выявление ПМР всегда требует методичного на блюдения и дифференцированного подхода в выборе лечебной тактики. Эндоскопическая коррекция как способ трансуретрального хирургического малоинва зивного лечения рефлюкса становится все более рас пространенным методом выбора.С совершенствованием аппаратуры для выполнения эндоскопических вмешательств появились открытые возможности для широкого применения малоинвазивного лечения,раз личными производителями начаты разработки им плантируемых гелевых медицинских изделий, в связи с чем накоплен уже 40-летний опыт применения самых различных объемообразующих агентов (ООА), исполь зуемых с целью фиксации устья мочеточника при реф люксе [4-12].
Разработано несколько методик эндоскопического лечения, в том числе с применением не единственной точки вкола при введении урологического имплантата (УИ). Помимо аутологичных материалов, применяемых в качестве ООА (в зарубежных источниках применяется термин bulking agents), урологи также стали активно использовать самые различные полимерные средства с целью достижения стабильного состояния уродинамики мочевыводящих путей (МВП) [5, 8-12, 13]. Тем не менее, несмотря на достигнутые очевидные успехи в коррекции ПМР путем имплантации ООА и в то же время увеличение количества работ об обструктивных осложнениях, на наш взгляд, в настоящее время требуется тонкая доработка способов коррекции, в том числе применительно к типам имплантируемых медицинских изделий, а именно: с учетом сочетания «возраст и пол пациента – анатомо-функциональное проявление патологии соустья – способ инъекционной коррекции – вид полимерного агента» [14-17].
Чем больше становилось разных артифициальных УИ с различным составом и, как следствие, свойствами, тем чаще специалисты стали сталкиваться с тем фактом, что имплантируемые гели не стоит рассматривать как взаимозаменяемые ООА, к которым применим стандартный подход в выборе протокола введения, типа УИ и даже дозировании объема геля при выполнении коррекции ПМР [13, 16, 18, 19].
В данной работе мы рассмотрим особенности основных ООА, присутствующих в настоящее время на урологическом рынке, через призму современных представлений о полимерной химии и гистологических реакциях на имплантацию. Почему был выбран именно такой подход для анализа проблемы? Имплантируемые медицинские изделия являются полимерными материалами, обладающие различной длительностью биодеградации и особенностями выведения из организма. Типичные методики изучения действия, эффектов и реакций при выведении из организма, с помощью которых оцениваются свойства лекарственных препаратов (биоэквивалентность, фармакокинетика и фармакодинамика), абсолютно не применимы к медицинским изделиям, что определяет обособленную позицию данной отрасли медицинской науки и ставит принципиально новые задачи перед исследователями и практиками.
МАТЕРИАЛЫ И МЕТОДЫ
Данная статья носит обзорный характер. Для анализа и интерпретации данных применяли открытые источники литературы, литературных обзоров, а также патентные базы данных. Всего для публикации отобраны 19 российских, 30 зарубежных научных публикаций и 3 Приказа Минздрава России.
Перечень полимерных материалов, по которым в целом производился поиск информации для обзора: полиакриламидный гель, полиакрилатно-поливини-ловый сополимер с глицеролом,стабилизированная гиалуроновая кислота неживотного происхождения с декстраномером ДЕАЕ Сефадекс А 25, очищенный коллаген животного происхождения (polyacrylamide gel, polyacrylate-polyvinyl copolymer with glycerol, stabilized non-animal hyaluronic acid with dextranomer DEAE Sephadex A 25, purified collagen of animal origin).
Использованные медицинские базы данных – NCBI, Google Scholar, Medline, Embase, ResearchGate, Cochrane Library, E-Library. Базы данных по полимерам использовали с целью анализа физико-химических свойств искомых искусственных полимерных соединений,их устойчивости и потенциальных биологических рисков – Material Data Center, PoLyInfo. Также использовали патентные базы данных для поиска производственных технологических особенностей или анализа свойств материалов – WIPO, PatentScope, USPTO, EPO, EUIPO, ФИПС.
Оценивали изолированные свойства полимерных материалов, их прогнозируемое поведение in vitro в различных внешних условиях, после имплантации в биологические ткани,а также клинические данные, полученные практикующими специалистами в области детской урологии.
РЕЗУЛЬТАТЫ
Обзор методов коррекции
Эндоскопическая коррекция (ЭК) является минимально инвазивным высокотехнологичным методом хирургического лечения несостоятельности уретеро-везикального соустья (УВС) при ПМР разной степени выраженности и выполняется в следующих случаях:
-
• первичный ПМР II-IV степени с нарушением функции почки и уродинамики и частыми рецидивами пиелонефрита;
-
• ПМР II-IV степени с дисфункцией мочевого пузыря и рефлюкс-нефропатией с нарушением функционирования уретеровезикального сегмента;
-
• ПМР I-II степени с рецидивами ИМП, устойчивый к консервативной терапии свыше 1-1,5 лет [18].
При выборе между неоимплантацией мочеточника и малоинвазивным лечением специалисты ориентируются в том числе на противопоказания к использованию ЭК:
-
• сочетанное нарушение эвакуаторной и замыкательной функции УВС;
-
• выраженная латерализация устья мочеточника с укорочением подслизистого туннеля менее 5 мм;
-
• эктопии устья мочеточника.
Известно, что для выполнения ЭК требуется краткосрочный общий наркоз, и период послеоперационной реабилитации сокращен до минимальных сроков. Операция ЭК считается простой малоинвазивной хирургической процедурой, но так ли это на самом деле? Эффективность ЭК варьирует от 52-68% до 86-92%, что само по себе уже является очень широким разбегом по эффективности лечения и заставляет задуматься о необходимости дальнейшей доработки протоколов, поскольку результаты лечения могут зависеть от множества факторов – правильно выбранных показаний, техники выполнения процедуры и от используемого УИ [20-22].
Было предложено несколько методик миниинва-зивной коррекции, которые подбираются в зависимости от степени ПМР, особенностей анатомического расположения УВС и формы дистальной части мочеточника. Имплантация ООА увеличивает ткани, что обеспечивает коаптацию дистального отдела мочеточника во время наполнения и сокращения мочевого пузыря. Известно несколько методик введения УИ при ЭК рефлюкса. Субуретеральная инъекция в стенку мочевого пузыря ниже устья мочеточника – процедура
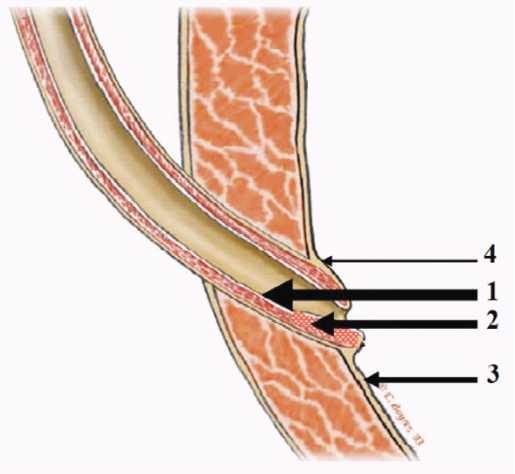
Рис. 1. Алгоритм инъекционной имплантации по Kirsch A [29]
Толщина стрелок – частота применения метода ЭК. 1 – проксимальный HIT, 2 – дистальный HIT, 1+2 – Double-HIT, 3 – STING, 4 – надмочеточниковый метод
Fig. 1. Algorithm of injection implantation according to Kirsch A [29]
The thickness of the arrows is the frequency of the EC method. 1 – proximal
HIT, 2 – distal HIT, 1 + 2 – Double-HIT, 3 – STING, 4 – suprareteral method
STING (Subureteral Transurethral Injection), введение полимера в проксимальный или дистальный участок интрамурального отдела мочеточника – процедура HIT (Hydrodistention Implantation Technique). Также применяется единовременное введение полимера в дистальный и проксимальный участки интрамурального отдела мочеточника – процедура Double-HIT, которая является усовершенствованием метода HIT и, как сообщается, приводит к более высоким показателям клинического успеха. Чаще всего применяется дистальный HIT, за ним следует проксимальный HIT, часто применяется Double-HIT, при этом STING занимает третье место по частоте применения, и самый редкий, применяемый в особо сложных случаях способ коррекции – надтуннельное введение полимера (рис. 1) [23-29].
Согласно накопленному многолетнему опыту применения ЭК, определение метода введения необходимо осуществлять с учетом индивидуальных анатомических особенностей устья мочеточника каждого конкретного больного. W. Cerwinka и соавт. предложили в 2008 году классификацию степени зияния мочеточника, которая определяется путем проведения теста на динамическую гидродистенцию УВС (HD-тест – dynamic ureteral hydrodistention). Этот тест не коррели рует в полной мере со степенью рефлюкса и поэтому не является диагностически ценным, поэтому позволяет использовать его для выбора методики введения агента (рис. 2) [30, 31]. При выявлении устья типа H0 и H1 рекомендуется использовать метод STING, если выявляют устье типа H2 и H3 применяется метод HIT [15]. Если устье мочеточника не полностью совпадает с точкой однократной интрауретеральной инъекции, может быть рассмотрена методика Double-HIT или может быть выполнена имплантация STING. Безусловно при выполнении любой из методик инъекции в подслизистый слой необходимо соблюдать оптимальную глубину вкола иглы, чтобы УИ был распределен в подслизистом слое так как при более поверхностном введении гель не фиксируется смыкающимися после удаления иглы тканями и вытекает наружу (до 99% случаев), а при более глубокой имплантации на 50-60% увеличивается вероятность введения в детрузор или мышечный слой мочеточника, что исключает возможность корректного формирования болюса [6]. Большинство детских урологов применяют
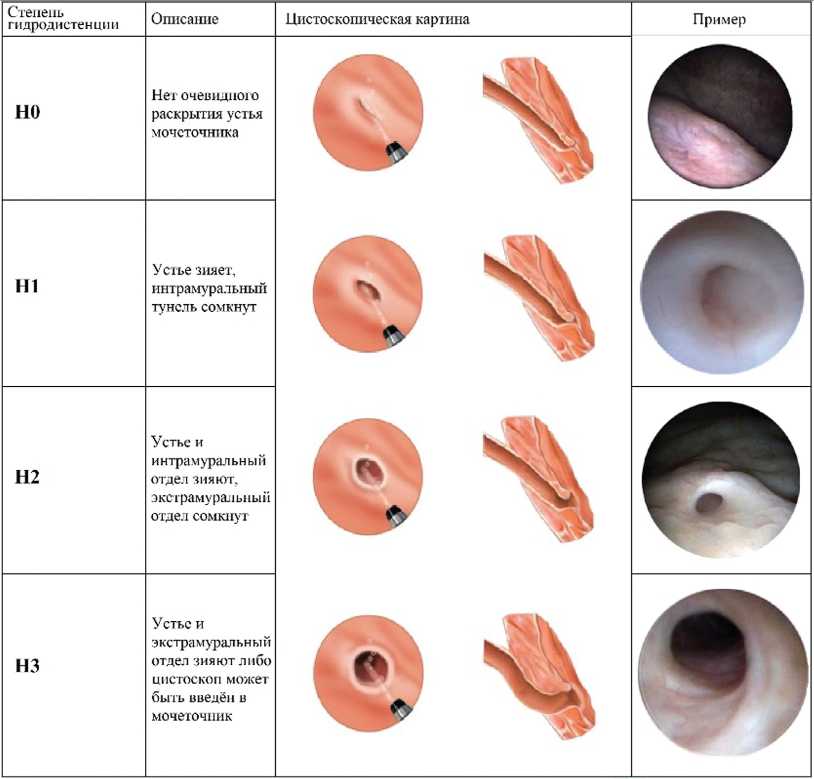
Рис. 2.HD-тест по Krisch. A [30]. Визуализированный алгоритм определения степени зияния устья мочеточника и его отделов. [30, перевод авторов].
Fig. 2. HD classification according to Kirsch A [30]. A visualized algorithm for determining the degree of dehiscence of the orifice of the ureter and its parts. [30, translated by the authors].
технику «замок», создавая в конце имплантации допол нительный микроболюс на выходе иглы из мышечного слоя, запирая им созданный вколом тоннель.
При благоприятной имплантации в послеоперационном периоде такие пациенты не требуют постоянной катетеризации и обычно могут мочиться без каких-либо проблем вслед за восстановлением после наркоза. После лечения выполняется контрольная микционная цисто-уретрография с целью определения купирования рефлюкса. При отсутствии рецидивирующего пиелонефрита и признаков обструкции при ультразвуковом исследовании (УЗИ) МВП, выполненном через 3 и 6 месяцев после операции, контрольная цистоуретрография выполняется спустя 1 год. При рецидивах пиелонефрита цистоскопия при необходимости проводится через 3 или 6 месяцев. Ряд работ сообщает о том, что успешность ЭК зависит в основном от степени рефлюкса [32-35], но по мнению других специалистов рекомендации по эндоскопическому лечению в отношении различных степеней ПМР, положений устья мочеточника, стадий рефлюксной нефропатии и ассоциации с другими пороками развития МВП окончательно не определены [8, 11, 13, 19, 36].
Авторы говорят не только о способе введения УИ, но также о выборе «дозы», то есть количестве ООА в мл. По опубликованным данным, пациентам вводят некую среднюю дозу ООА, которая была установлена ранее опытным путем и доработана с учетом анализа результатов практикующими специалистами. Если при выполнении манипуляции видно, что условная средняя доза полимера не обеспечивает эффекта in situ, оператор вводит объем, основываясь на данных визуального наблюдения за «смыканием устья», а также результатах контрольного HD-теста [18, 36]. Принятие решения на основании субъективных данных при выполнении ЭК нередко может приводить с одной стороны к неэффективному лечению, с другой – к осложнениям манипуляции. В качестве неэффективного лечения авторы рассматривают формирование болюса малого размера, не обеспечивающего адекватную коаптацию дистального отдела мочеточника и получение достаточной длины УВС и, как следствие, недостаточное купирование рефлюкса, что требует в дальнейшем проведения докоррек-ции. Напротив, при превышении предельно допустимых размеров болюса анатомические структуры УВС не всегда в состоянии удерживать УИ в фиксированном положении. Лимит возможностей мягких тканей может привести к смещению ООА, микротравме, отслойке слизистой оболочки и нарушению локальной микроциркуляции, что запускает воспаление в периимплантацион-ной зоне. В зависимости от хода патологического процесса дальнейшие события могут реализовываться в различном направлении:
-
• воспалительные изменения затрагивают УИ, и он начинает проявлять свойства избыточного набухания, вызывая обструкцию УВС;
-
• при компрессии тканей в сочетании с их ишемией происходит отторжение УИ через формирующийся дефект, болюс изливается в просвет и возникает рецидив ПМР.
На сегодняшний день для практикующих детских урологов доступно несколько ООА с абсолютно отличающимся полимерным составом, также встречается множество публикаций, отражающих успехи при имплантационной коррекции ПМР, сравнивающих эффективность основных продуктов [4, 6-13]. Но если о положительном опыте применения есть много публикаций, то реже встречаются статьи о неудачных исходах, тем более со всесторонним анализом ситуации [8, 13, 33].
Мы проанализировали публикации, касающиеся ключевой проблемы, с которой периодически сталкиваются детские урологи при ЭК – обструктивные осложнения после применения различных ООА. Изначально при внедрении ЭК результаты не могли оценивать в отдаленном периоде, поэтому на том этапе развития метода складывалось впечатление, что обструкция УВС является крайне редким осложнением с частотой не более 1%, и что ЭК является безопасной альтернативой урете-роцистоанастомоза (УЦА), поэтому были разработаны и оперативно внедрены методы STING, HIT и Double-HIT. Впоследствии при накоплении данных были получены менее оптимистичные показатели: увеличение частоты осложнений в виде острой (ОО) или отсроченной обструкции (ОтО), которые сопровождались стойким расширением мочеточника, лоханки и чашечек, выявляемых при реносонографии свыше показателей до ЭК, и признаками обструкции УВС по данным при диуретической ренографии [37]. В другой работе авторы на примере 179 клинических случаев коррекции ПМР полиакри-латно-поливиниловым сополимером проанализировали результаты ЭК, применяя классификацию осложнений протезирующей пластики – шкалу Clavien–Dindo. Осложнения III степени (ситуации, для разрешения которых необходимо выполнить хирургическое вмешательство) были выявлены при I-III степени рефлюкса в 9,2% случаев, при IV-V степени – в 35,6% случаев, поэтому некоторым пациентам был выполнен УЦА, другим проведена повторная ЭК в связи с рецидивом ПМР [15].
В другой работе были систематизированы осложнения ЭК при анализе 20-летней работы 10 детских урологических центров России и Белоруссии. Авторы сравнили частоту обструкции после ЭК на 5702 мочеточниках у 3816 детей и выявили несколько закономерностей Отмечено: 1) влияние на повышение риска осложнений более раннего возраста пациентов: средний возраст всех пациентов составил 49,5 месяцев, при этом средний возраст пациентов с осложнениями был с 28,25 месяцев. 2) Определена техника ЭК, которая чаще вызывала ОО и ОтО: по сравнению с 0,4% осложнений при применении STING частота обструкций при HIT составила 2,1%, что по сути характеризует риск более эффективного метода коррекции. 3) Подвергнуто сомнению утвержде ние в некоторых работах, что объем вводимого УИ не оказывает влияния на риск развития обструкции,так как не всегда оценивали данный показатель в связке с анатомическими особенностями УВС и методом ЭК. 4) Выявлено, что полиакрилатно-полиспиртовой сополи мер (PPC) обладает наибольшей частотой обструкций следовательно, состав УИ имеет значение при оценке таких рисков. Наименьший процент осложнений отме чался при применении УИ на основе Collagen и поли акриламидного геля (PAAH), чаще – при введении стабилизированного гиалуроната с декстраномером (DxHA) и максимально часто – при применении PPC причем в последнем случае, учитывая сроки ОтО, ав торы сделали вывод о необходимости очень длитель ного наблюдения за пациентами [38].
Отдельно мы изучили работы, посвященные срав нительному анализу факторов риска обструкции при изолированном применении PPC или PPC в сравнении с DxHA. При мультицентровом исследовании примене ния PPC на 1133 мочеточниках у 774 пациентов сопо ставляли группы без обструктивных осложнений и с таковыми. В группе с осложнениями чаще применялась методика HIT (58,5%). Обструкция возникала чаще после повторного введения УИ, чем после первичного (8,5% против 4,4%). В большей половине случаев (70,7%) осложнения развивались в течение первого года после ЭК, однако общий интервал для ОО и ОтО при приме нении PPC колебался от 1 до 41 месяцев [37]. В другой работе перечислен тот же набор факторов риска разви тия обструкции – младший возраст, мужской пол, вы сокая степень ПМР, методика HIT, повторная ЭК применение PPC, но при этом был рекомендован срок катамнестического обследования пациентов после вве дения PPC уже 60 месяцев, то есть 5 лет [39]. В сравни тельном исследовании 2495 пациентов, которым проводилась ЭК разными УИ (DxHA 71,74% и PPC – 28,26%)), частота обструктивных осложнений, развив шихся у детей с III-V степенью ПМР спустя 2-49 меся цев после введения 1,2±0,6 мл УИ, составила 0,5% при применении DxHA и 1,3% – при использовании PPC при этом во второй группе пациентам были вынуждены выполнить УЦА. При применении DxHA и PPC авторы выделили следующий перечень факторов риска развития обструкции: более высокие степени ПМР, особая клювовидная форма УВС и воспалительное состояние слизистой мочевого пузыря перед выполнением ЭК [40].
Таким образом, эффективность и безопасность ЭК с применением полимерных агентов не может зависеть только от четко определенных показаний и выбора методики имплантации, но также напрямую связаны и с типом вводимого ООА. При этом мы не обнаружили в публикациях урологов стандартных алгоритмов, которые позволяют выбрать оптимальный состав среди всей имеющейся панели УИ в зависимости от клинической ситуации, а также нет структурированной информации, освещающей отличительные свойства полимерных агентов, которые они могут проявлять в критических ситуациях. Так, если бы разбор осложнений включал в себя, например, ошибки фармакологического лечения или технические ошибки в хирургическом протоколе, подобный подход был бы привычен специалистам с медицинским профилем. Однако следует понимать, что внедрение в хирургическую практику новых материалов сопровождается необходимостью смены парадигмы разработки протоколов лечения, оценки результатов ЭК и анализа осложнений, если таковые происходят. Определение причинно-следственной связи и выводов при неудачных имплантациях и формулировка дальнейшей тактики работы должны быть построены на междисциплинарном подходе, то есть на стыке нескольких специальностей – хирургия, патологическая анатомия (гистология), полимерная химия. Для анализа данной тематики мы изучили доступную информацию, привлекая специалистов в области полимерной химии и химии биологи-чески-активных соединений.
Обзор гелей и их сравнение
Состав ООА
Все доступные ООА, занимающие прочное положение на рынке, относятся к имплантируемым медицинским изделиям III класса риска на основе полимерных составов или водорастворимых композиций высокомолекулярных соединений с длительным сроком биодеградации (табл. 1). Медицинские изделия не оцениваются
Таблица 1. Динамика физического развития Table 1. Dynamics of physical development
|
Наименование полимера Свойства |
Полиакриламидный гель с ионизированным серебром (PAAH) Refluxsyn |
Полиакрилатно-полиспиртовой сополимер (PPC) |
Стабилизированный натрия гиалуронат с декстраномером (DxHA) |
Коллаген животного происхождения (Collagen) |
|
Состав |
Трехмерный полиакриламид, стабилизирующий рН-буфер, ионизированное серебро, очищенная вода |
Полиакрилатно-поливини-ловый сополимер, глицерол, физиологический раствор |
Стабилизированный натрия гиалуронат неживотного происхождения (NASHA), диэтиламиноэтил Сефадекс А 25, хлорид натрия, очищенная вода |
Гелевая форма очищенного коллагена животного происхождения (из кожи крупного рогатого скота), хлорид натрия |
|
Размер микрочастиц |
Единая макромолекула |
PPC 300 ± 190 μm |
Dx 40-120 μm |
Размер фибрилл неизвестен |
|
Молекулярная масса полимера |
Mr 15 ± 3 млн Да |
Mr ≈ 10 млн Да |
Mr HA неизвестна |
Mr неизвестна |
с позиции биоэквивалентности, фармакокинетики и фармакодинамики, в том числе по той причине, что они являются полимерными веществами с особым механизмом распада и выведения из организма. Любые подобные составы, если они не являются постоянными имплантатами, присутствующими в организме пожизненно, имеют отличные от лекарственных препаратов характеристики: это биодеградация, метаболизм и элиминация.
Биодеградация представляет собой процесс постепенного разрушения полимерного агента на составные части меньшего размера (олигомеры) при совокупном воздействии внешних химических, термических, ферментативных, гуморальных и клеточных факторов. Когда макромолекула становится олигомером, биологические ткани начинают процесс постепенного выведения фрагментов из зоны имплантации в локус промежуточного депо, и фильтром первого уровня в данном случае является соединительная ткань и лимфатическая система [41-43]. Если олигомеры не становятся биологически востребованным строительным или иным материалом в зоне имплантации или в зоне депо и не могут быть утилизированы тканями, они подготавливаются к третьему этапу – элиминации. Выведение из организма осуществляется основными фильтрующими органами, которыми зачастую являются печень и почки.
Прежде всего мы бы хотели обратить внимание на сам термин «полимер» как наиболее часто употребляемый по отношению к ООА. Полимеры – вещества, макромолекулы которых состоят из многочисленных элементарных звеньев (мономеров) одинаковой структуры. В том случае, когда звенья имеют различающийся состав, корректным названием для такого конечного вещества будет «сополимер». Существуют полимеры и сополимеры линейные, разветвленные и трехмерные. Самыми простыми описательными категориями, дающими общее представление о различных УИ, являются состав, размер микрочастиц в микронах и молекулярная масса в Дальтонах полимера или сополимера, которые уникальны для каждого продукта.
При разработке новых полимеров проводят всестороннее тестирование субстанций и готовят их к выводу в практику: на доклиническом этапе оценивают их упруго-вязкостные свойства, общетоксическое, цитотоксическое действие и т.д. Проводится серия имплантационных тестов и оценка хронической токсичности и онкогенности при длительном введении в ткани на животном материале. Ранее в практике урологов присутствовали ООА, имеющие ряд сомнительных свойств, но на сегодняшний день медицинские изделия с длительным сроком биодеградации не являются абсолютной новизной, и в этой связи произошла оптимизация и усовершенствование протоколов доклинического тестирования полимерных материалов, поэтому в практику детского уролога теперь поступают только те изделия, которые подтвердили свою биологическую безопасность, стабиль- ность, гистосовместимость, адгезивность и обладающие тканесохраняющими свойствами [44].
Таким образом, все зарегистрированные в настоя щее время ООА для коррекции ПМР, обладают свой ствами, позволяющими применять их в детской прак тике. Поскольку не все долгосрочные эффекты возможно отследить на дорегистрационном этапе, за жизненный цикл медицинских изделий после регистрации отвечает система мониторинга безопасности Росздравнадзора [45, 46].
Дозирование ООА
Существует ли взаимозаменяемость гелевых УИ и возможно ли применять трансфер дозы ООА при планировании ЭК? Компания Bionoltra SA провела маркетинговое исследование топовых полимеров на российском рынке, в результате была определена информация, что для образования эффективного болюса применяются различные объемы УИ. С чем может быть связан факт, что в зависимости от разного состава полимера применяются совершенно разные объемы вязких гелей?
В практике урологического отделения Детской республиканской клинической больницы Минздрава республики Татарстан при выполнении ЭК 734 пациентам (на 1105 мочеточниках) мы применили практически все доступные виды УИ: на основе Collagen, DxHA, PPC, новый имплантат Рефлюксин (Refluxsyn, Bionoltra SA, Швейцария) который используется уже около 1 года. Изначально в отделении с 2000 года была внедрена эндоскопическая методика коллагенопластики несостоятельности УВС [47]. Ранее детям в возрасте до 1 года и старше применяли Collagen, однако при больших рефлюксах, особенно после ранее перенесенных УЦА, мы сталкивались с тем, что для купирования ПМР биологическим имплантатом даже 2,0–4,0 мл было недостаточно, а очень короткий срок существования болюса побудил нас применять новые ООА. В отделении с 2011 мы применяли PPC, с 2018 года подключили DxHA, а с 2021 – Рефлюк син на основе полиакриламидного геля. В настоящее время мы имеем выбор из 3-х имплантатов: в возрасте до 3-х лет мы применяем DxHA, старше 3-х лет – PPC, при этом за последний год с появлением Рефлюксина при выполнении ЭК детям от 1 года мы в первую очередь ра ботаем именно с ним,чтобы накопить максимальное количество данных для оценки его эффективности и безопасности.
На сегодняшний день нами пролечено 15 пациентов (22 мочеточника). Мы предпочитаем применять гибкую эндоскопическую иглу с прозрачными стенками, что позволяет свободно контролировать полное наполнение ее просвета перед вколом во избежание пустого «мертвого пространства». Хотя при использовании других непрозрачных эндоскопических игл полное заполнение также можно контролировать, но только тестом «капли», то есть путем выведения геля до появления первой капли геля на срезе иглы. Перед началом введения УИ необхо- димо отметить то количество геля, которое уже располо жено внутри иглы путем определения оставшейся части в шприце. На эту часть манипуляции, как правило, уходит до половины содержимого шприца, и при непосредственном формировании болюса нередко достаточно порядка 0,2 – 0,3 мл чтобы сомкнуть зияющее устье.
Распределение ООА
Для активного введения в практику отделения работу с гелем Рефлюксин мы изучили доступные материалы, касающиеся вероятной разницы в распределении различных гелей при их введении в ткани. Так, ни в одном из источников мы не нашли упоминаний о том, что УИ с различным составом формируют отличающиеся болюсы или что необходимая форма болюса из разных УИ требует применения каких-то особых технических подходов [7, 8, 11, 32, 47-49]. При выполнении методики STING разными ООА авторы описывают достижение выпуклого образования в виде объемной фигуры, имеющей в основном полусферическую форму, напоминающей холмик, в стенке мочевого пузыря в подслизистом слое под основанием УВС. Болюс под интрамуральным отделом мочеточника служит упором для задней стенки указанного отдела, увеличивая его длину, вследствие чего нормализуется форма УВС. Последнее при этом смыкается и приобретает серповидную форму или форму «рыбьего рта». При выполнении дистальной или проксимальной техники HIT описано получение выпуклого образования, обеспечивающего первичное закрытие устья или просвета интрамурального отдела мочеточника. В нашей работе существенных различий мануальных ощущений, поведения УИ в тканях, формы и консистенции болюса при введения различных ООА нами отмечено не было. В дальнейшей работе мы планируем проводить более точную дифференцировку.
При выполнении ЭК мы сопоставляли эндоскопические иглы разных производителей: «МИТ» (Россия) калибром от 23G до 21G (0,6–0,8 мм) и производителя Promedon (Аргентина) калибром от 23G до 22G (0,6–0,7 мм), отметив факт разного распределения одного и того же геля вокруг отверстия среза игл разных производителей. При применении игл Promedon с тупым углом среза при вколе приходится делать значительное усилие практически на всю стенку пузыря, корригируя глубину погружения наконечника, что не всегда обеспечивает точность и безопасность инъекции. В нашей работе мы предпочли применять иглы «МИТ», имеющие выгодный угол среза, которым легче войти в нужный слой подслизистой, минимально повреждая ткани при вколе, а также получить равномерное распределение геля от среза иглы на требуемых градусах за счет управляемого поворота иглы. При применении игл «МИТ» мы исключили случаи распределения ООА непосредственно под эпителием слизистой мочевого пузыря, что позволило предотвратить риск развития атрофии стенки и миграции имплантата. В зависимости от поведения геля в тканях, формы УВС и методики (STING, HIT) по показаниям могли выполнять технику «замок» в конце имплантации, которая также показана при применении крупного калибра иглы (21G), так как после ее извлечения визуализируется зияющий просвет места вкола. Однако для таких случаев в отделении мы имеем ассортимент эндоскопических игл разного калибра, и пациентам раннего детского возраста применяем иглы с калибром 23G.
При необходимости максимально эффективного использования всего объема шприца мы пользуемся техникой финального введения физраствора, тем самым избегая потерь УИ в просвете длинной иглы. Такая простая методика позволила нам сократить расход Рефлюксина – чаще всего 1 мл имплантата достаточно на 2 устья при ЭК двустороннего ПМР (табл. 2). Так как полимерный имплантат имеет высокую вязкость, отличающуюся от плотности физраствора, то при довведении последнего мы контролируем полное выведение УИ из иглы, ориентируясь на изменение сопротивления давления поршня в шприце. Вкол полностью заполненной иглой позволяет контролировать расход и минимизировать потери количества ООА, уменьшить риск обструктивных осложнений, а также рецидивов ПМР. При применении Рефлюксина мы не наблюдали в раннем или отсроченном послеоперационном периоде несостоятельности болюса, миграции геля или обструктивных осложнений. Также по опросу родителей наших пациентов не было отмечено мочеиспусканий с примесью гелеобразного содержимого после ЭК, что ранее мы замечали при применении других УИ.
Таблица 2. Расход ООА для коррекции ПМР
Table 2. Consumption of bulking agents for VUR correction
|
Наименование полимера Параметры, мл |
Полиакриламидный гель с ионизированным серебром (PAAH) Refluxsyn |
Полиакрилатно-полиспиртовой сополимер (PPC) |
Стабилизированный натрия гиалуронат с декстраномером (DxHA) |
Коллаген животного происхождения (Collagen) |
|
Объем ООА в шприце |
1,0 |
1,0 |
1,0 |
2,0 или 5,0 |
|
Легкая степень (I-II) |
0,25 / 0,5 |
0,15 – 0,35 |
0,50 – 0,65 |
1,75 – 2,00 |
|
Средняя степень (III) |
0,45 / 0,75 |
0,35 – 0,50 |
0,75 – 1,00 |
2,00 – 2,50 |
|
Высокая степень (IV-V) |
0,85 / 1,00 |
0,65 – 1,00 |
1,25 – 1,75 |
3,00 – 4,00 |
|
1-инъекционное введение (STING, HIT) |
0,50 – 0,70 / 0,75 |
0,25 – 0,50 |
0,75 – 1,35 |
1,50 – 2,00 |
|
2-инъекционное введение (Double-HIT) |
0,50 – 1,00 / 1,00 |
0,45 – 1,00 |
0,80 – 1,75 |
1,85 – 4,00 |
Особые свойства ООА
При выборе различных ООА также необходимо опираться на понимание их принципа действия,ги-стосовместимости,особенностей интеграции и биодеградации в тканях. Согласно инструкции производителей, гель Рефлюксин рекомендован для применения с 1 года жизни, в инструкциях полимеров PPC, DxHA и Collagen указания на возраст отсутствуют, также нам не удалось найти показания по применению коллагена при лечении ПМР. Опираясь на имеющиеся данные о биодеградации, можно сделать вывод, что наименее стойкие полимеры более применимы в самом раннем детском возрасте,тогда как длительно деградирующие или не деградирующие субстанции логично использовать для более старшей возрастной группы, чтобы не деградируемый болюс не оказывал влияние на активный рост и развитие МВП [1, 6].
Существует мнение, что в процессе введения разных УИ возникает разное сопротивление в шприце при выдавливании упругих гелей,что требует отработки мануальной практики в зависимости от каждого типа материала. Чем может быть обусловлена такая разница? Зависит ли сопротивление материала от его температуры при подготовке к введению в ткани, от полимерного состава и вспомогательных компонентов, от размера макромолекул (молекулярной массы полимеров), и каким образом можно объяснить эту минимальную, но порой ощутимую разницу? В зависимости от состава и структуры полимерные соединения отличаются друг от друга серией особых характеристик,которые раскрывают их различные качества при распределении в толще мягких тканей. Рефлюксин на основе трехмерного полиакриламида (PAAH) и DxHA, состоящий из стабилизированного гиалуроната с декстраномером, являются сетчатыми полимерами, Collagen относится к линейному сополимеру биологического происхождения, который имеет сложную трехмерную пространственную сборку в виде агрегатов. Проанализировав доступные источники, мы нашли косвенные указания на структуру PPC – данный сополимер является разветвленным, однако отсутствуют данные по процентному взаимоотношению между компонентами сополимера: полиакрилатом (PAA) и поливиниловым спиртом (PVA).
Ключевыми параметрами ООА являются упругость (эластичность) и вязкость (пластичность), благодаря которым они способны образовывать болюс. Эластичность – это способность геля восстанавливать исходную форму после воздействия внешних деформационных сил, то есть способность УИ к обратимой деформации. Пластичность – остаточная деформация геля после прекращения деформирующего усилия, то есть мера сопротивления полимера сдвиговому усилию. Эти характеристики имеют отличия у разных
ООА именно в силу разного состава и типа поли мера/сополимера и вносят существенную разницу в способность ООА распределяться в тканях после вве дения,сопротивляться внешним механическим воз действиям. Вероятно также, что при введении разных УИ получают болюсы, отличающиеся друг от друга по своей упругости и адгезивным способностям по отно шению к окружающим тканям, хотя подобной инфор мации в доступной литературе мы не нашли.
Принцип действия полиакриламидного гидро геля Рефлюксин состоит в образовании инертного бо люса, который длительно присутствует в зоне, очень медленно и постепенно деградируя. Аналогичные свойства заявлены производителем PPC, однако в ли тературе были найдены как клинические, так и хими ческие отсылки на его свойства, характерные для «сухого» полимера, способного набухать. Так, относи тельно PPC мы нашли информацию от производителя, что основное вещество – полиакрилатно-поливинило вый сополимер, – в виде эластичных частиц находится во взвешенном состоянии в смеси с носителем. «Среда-носитель представляет собой 40% раствор гли церола, которая сразу же после имплантации уда ляется ретикулоэндотелиальной системой без метаболизации и выводится из организма через почки, в результате остаются только частицы самого введенного вещества,которые обеспечивают посто янное набухание тканей».Производитель не описы вает целевое назначение присутствия глицерола в составе продукта с PPC, при этом есть указание, что такой полимер очень легко имплантируется через иглу с наконечником калибром 23G [48]. Однако наши кол леги-химики объясняют целесообразность добавле ния глицерола – он является вспомогательным веществом, выполняющим непосредственно во время введения функцию любриканта в просвете иглы,а далее утилизируется тканями, не участвуя в формиро вании ядра болюса. ООА на основе DxHA по сути яв ляется двухкомпонентным продуктом, содержащим стабилизированный гиалуронат натрия, в гелевой среде которого свободно взвешены микрочастицы декстраномера (диэтиламиноэтил Сефадекс А 25), из чего следует его двухэтапное действие.Изначально формируется условно инертный болюс за счет объема гидрогеля из полимеризованного гиалуроната, позже происходит параллельная деградация и гиалуроната, и гранул декстраномера, при этом объем болюса уменьшается, а фрагменты деградирующего декстра номера являются своего рода искусственными сиг нальными молекулами, привлекающими фибробласты и стимулирующими синтез каркаса соединительной ткани. Таким образом, результатом действия DxHA является замещение в болюсе гиалуроната на собст венную соединительную ткань. УИ на основе Collagen формируют изначально не инертный болюс, содержи мое которого сразу вызывает стимуляцию ткане вых процессов – сначала расщепление артифициаль-ного коллагена и замещение его на собственный (табл. 3).
По результатам доклинических и клинических исследований были получены средние сроки деградации полимерных материалов,которые имеют существенные различия внутри обсуждаемой группы ООА. Так, Рефлюксин деградирует через гидролиз и макрофагальный фагоцитоз до 10 лет, PPC как карбоцепной полимер не имеет механизмов деградации в биологических тканях, соответственно, срок его службы превышает 20 лет [11, 13]. DxHA в относительно быстрые сроки до 1-1,5 лет расщепляется гиалуронидазами и фибробластами, что подтверждено клиническими дан-ными:уплощение болюса в течение одного года происходит в среднем на 25% [8]. Самый короткий срок присутствия в тканях показал Collagen, который сразу начинает расщепляться коллагеназами и фибробластами тканей, поэтому болюс из Collagen может уплощаться на 75% и более за 6 месяцев [8].
Имплантируемые полимерные соединения перед внедрением в практику также исследуют на свойство сохранения изначального объема и гистосовместимость. Важнейшими характеристиками совместимости ООА являются их особенности интеграции,способ-ность оставаться инертными и не вызывать воспаление в демаркационной зоне,способствовать формированию наиболее благоприятной окружающей кап- сулы и не вызывать реакцию организма в процессе биодеградации (табл. 4).
Если глобально смотреть на понятие инертность то оно складывается из ареактогенности УИ не только по отношению к окружающим тканям после имплан тации,но также и к системам и органам в процессе прохождения полимера по цепочке биодеградация-ме таболизм-элиминация. Нам встречалась не подкреп ленная научными данными информация о том, что PAAH обладают вредными свойствами при выведении из организма. Согласно работе исследователей из Мичиганского университета, в серии тестов на экспе риментальном животном материале показана дина мика биодоступности после внутривенного введения микросфер из PAAH, меченных изотопами, и их пол ное и безопасное выведение из организма через печень и почки с калом и мочой, что было подтверждено уменьшением накопления радиоактивных меток в плазме крови и увеличением их накопления в экскре тируемых биологических субстанциях. Этот экспери мент максимально приближен к нативной ситуации так как PAAH в организме биодеградируют до олиго меров. Доказано отсутствие влияния на функцию внутренних органов и их гистологическое строение при том,что внутривенно животным вводили сверх большие дозы микросфер PAAH. Таким образом PAAH безопасны при введении в ткани и выведении из организма, а скорость элиминации их метаболитов за висит от индивидуальных особенностей [43].
Таблица 3. Принцип действия и исход биодеградации ООА
Table 3. Principle of action and biodegradation outcome of bulking agents
|
Наименование полимера Характеристики |
Полиакриламидный гель с ионизированным серебром (PAAH) Refluxsyn |
Полиакрилатно-полиспиртовой сополимер (PPC) |
Стабилизированный натрия гиалуронат с декстраномером (DxHA) |
Коллаген животного происхождения (Collagen) |
|
Принцип действия |
Инертный болюс |
Инертный болюс |
Условно инертный болюс, стимулирует рост ткани |
Не инертный болюс, стимулирует коллагеногенез |
|
Срок биодеградации |
10 лет |
Более 20 лет |
1 – 1,5 года |
3 – 6 месяцев |
|
Разрушающий агент |
Гидролиз, макрофагальный фагоцитоз |
Не существует |
Гиалуронидазы, фибробласты |
Коллагеназы, фибробласты |
|
Исход биодеградации |
Олигомеры полиакриламида |
Карбоцепной полимер, в организме не деградирует |
Декстран, углекислота, вода |
Гидроксипролин, пролин, глицин, галактоза |
Таблица 4. Гистосовместимость ООА
Table 4. Histocompatibility of bulking agents
|
Наименование полимера Характеристики |
Полиакриламидный гель с ионизированным серебром (PAAH) Refluxsyn |
Полиакрилатно-полиспиртовой сополимер (PPC) |
Стабилизированный натрия гиалуронат с декстраномером (DxHA) |
Коллаген животного происхождения (Collagen) |
|
Набухание |
Не имеет тенденции к набуханию [10, 11] |
«Сухой» полимер, может набухать до 5 лет после имплантации [12, 40, 50, 51] |
Не набухает при отсутствии воспаления [52] |
Не имеет тенденции к набуханию [49] |
|
Перифокальное воспаление и общая реакция организма при имплантации |
Инертен. Лимфо-макрофагальная инфильтрация, нейтрофилы и эозинофилы отсутствуют [11, 49] |
Инертен. Лимфо-макрофагальная инфильтрация, нейтрофилы и эозинофилы отсутствуют [33, 53] |
Может проявлять гидрофильность при воспалении и усугублять его течение [33, 40, 52] |
Может вызывать перифокальное гранулематозное воспаление. Сероконверсия, гиперреактивность [54-56] |
|
Капсула, формирующаяся вокруг УИ |
Капсула из тонкой рыхлой соединительной ткани толщиной 50-90 μm [49, 57] |
Тонкая капсула из соединительной ткани толщиной до 70 μm [33, 53] |
Возможное образование псевдокапсулы из воспалительной клеточной инфильтрации [58-63] |
Возможное образование очага гипотрофического рубца. Возможное образование кальцинатов [54, 64] |
Доказано, что не все УИ могут проявлять пол ностью инертные свойства. Так, при неуспешной интег рации вокруг DxHA или Collagen может образовываться псевдокапсула из воспалительной перифо кальной гранулематозной клеточной инфильтрации. Было доказано формирование сероконверсии и гипер реактивности на введение Collagen, поскольку он со стоит из животных белков на 100% не повторяющих структуру человеческого 3D-протеина. При склонности к дисплазии соединительной ткани, нередко присущей детям с аномалиями развития нижних МВП, не всегда на имплантацию Collagen возникает ожидаемый ткане вой процесс – вместо замещения болюса из животного материала собственной соединительной тканью воз можна его трансформация в очаг гипотрофического рубца или кальцификация не до конца организованных остатков фибрилл (табл. 4).
Неразрывно с благоприятным течением имплан тации связано такое свойство ООА как набухаемость – увеличение объема полимерного образца вследствие поглощения им контактирующей жидкости. Это явле ние характерно для материалов вследствие способно сти низкомолекулярных жидкостей проникать между макромолекулами или надмолекулярными образова ниями, что приводит к гидратации, насыщению поли мера и увеличению его совокупного объема. К параметрам, влияющим на кинетику набухания, относятся условия синтеза полимеров, природа полимерной мат рицы, природа сшивающего агента и количество уча стков сшивки, природа полярной группы и противоиона, а также размеры макромолекулы и про странственная структура образца [65]. Принято опери ровать понятием «насыщение» (молекулами воды), то есть это некое равновесное состояние по достижению набора жидкости полимером в процессе набухания субстанции. Если равновесие отклонено в сторону гид рофильности, то полимер продолжает набухать, если же после пика насыщения пройдена критическая точка, то такой полимер начинает процесс растворения и те ряет свои объемообразующие свойства. Соответ ственно, ООА разработаны таким образом, чтобы после имплантации находиться в фазе равновесного насыщения. Такова ли ситуация на самом деле и как можно объяснить периодически встречающееся набу хание УИ, которое вкупе с другими причинами может приводить к обструкции УВС? Ранее мы обсуждали не гативные последствия,возникающие вследствие пре вышения предельно допустимых размеров болюса, а также касались рисков слишком поверхностного вве дения УИ, которые могут повлечь за собой расслоение мягких тканей и старт воспалительного процесса. Также в этой связи следует задуматься и о вероятных причинах острой и отсроченной обструкции, если до пустить, что при исходно нормальных показателях при финальном HD-тесте впоследствии блокада оттока мочи через УВС возникает не только по причине отека мягких тканей, но в том числе и из-за избыточного набухания УИ. Способен ли любой ООА вне зависимости от состава и свойств сохранять свою инертность при воспалении тканей?
Риски избыточного набухания ООА
Согласно данным литературы, PPC является сополимером, наиболее склонным к рискам формирования ОО и ОтО, на втором месте стоит полимер DxHA, а на последнем месте – равнозначно PAAH и Collagen, поэтому рассмотрим потенциальную способность к избыточному набуханию с позиции особенностей их строения.
Прежде всего PPC является разветвленным сополимером, что в первую очередь уже повышает его гидрофильные способности в отличие от трехмерных полимеров (DxHA, PAAH и Collagen), так как его структура предполагает наличие большой площади для формирования связей с молекулами воды и свободу разворачивания цепи сополимера, тогда как сетчатые полимеры имеют более жесткую структуру, которая не способна сильно расширяться и, как следствие, вбирать в себя избыточное количество воды. Исходно PPC недостаточно насыщен водой,в противном случае при увеличении ее количества сополимер потеряет свои превосходные механические свойства [66]. Соответственно, предполагаем, что УИ на основе PPC является частично набухшим сополимером, так как он обладает высокой упругостью, которая позволяет ему формировать болюс. При этом PPC является сополимером с гибридными свойствами, так как он состоит из PVA, повышающего эластичность,устойчивость к изменениям температуры и рН и обеспечивающего равновесие гидрофильности, и PAA, отвечающего за высокую прочность за счет водородных связей [67, 68]. Такие образом, это сополимер с ярко выраженными механическими свойствами за счет большого количества связей и с низким содержанием воды [66]. При сдвиге равновесия и набухании свыше критической точки происходит разрыв водородных связей между PVA и PAA, высвобождение высоко гидрофильного PAA, а далее субстанция показывает поведение, которое способствует неконтролируемому набуханию и увеличению объема УИ [67]. Так как производитель не приводит соотношение между компонентами PVA и PAA в сополи-мере,то в силу недостаточности информации невозможно сделать однозначные прогнозы, какие условия необходимо соблюсти для исключения рисков ОО и ОтО после имплантации урологическим пациентам. Так как данный сополимер в других клинических областях практически не применяется, то мы также ограничены в возможностях по анализу опыта наших коллег из смежных специальностей.
Химически стабилизированный гиалуронат натрия широко известен и применим как гелевый имплан- тат не только в урологии. DxHA защищен от высокой гидрофильности, не проявляет в тканях свойств, связанных с быстрым и выраженным набуханием [52]. Однако при перифокальном воспалении на начальном этапе процесса в тканях возникает сдвиг рН в сторону ацидоза, появляется избыток свободных ионов Н+, стимулирующих разрушение диэфирных BDDE-связей в DxHA через гидролиз. При разрушении мостиков, образованных сшивающим агентом, высвобождается большое количество свободных мест на акцепторных участках гиалуроната, что приводит к более выраженным гидрофильным свойствам. Такой механизм объясняет резкое повышение набухания DxHA при старте локального воспаления в демаркационной зоне, прилежащей к УИ [52, 69, 70].
Полимерные материалы на основе PAAH впервые были разработаны в 1980х годах, в связи с чем они также были хорошо изучены. Коммерческие субстанции для клинического применения имеют свойства равновесных насыщенных гидрогелей, которые благодаря насыщению водой обладают высокими эластичными свойствами. Они находятся в фазе после пика насыщения, в связи с чем после имплантации в различные ткани они не проявляют свойств избыточного набухания [10, 43, 57, 71-73].
Collagen является основным каркасным белком соединительной ткани у млекопитающих, по этой причине особенности строения полимера предопределены его биологической задачей обеспечивать прочность и постоянство структуры организма, что не связано с необходимостью его набухания. Таким образом объясняется отсутствие у данной субстанции поведения, способного спровоцировать избыточное набухание.
Мы привели данный подраздел для всестороннего понимания разницы между ООА, активно применяемыми при ЭК рефлюкса, чтобы высветить все вероятные предпосылки осложнений,с которыми может столкнуться уролог при гиперкоррекции ПМР, миграции болюса вследствие отслойки тканей или его отторжении, при ОО и ОтО.
ОБСУЖДЕНИЕ
Проанализировав 40-летний опыт применения ЭК, мы отметили, что остается острая потребность в формировании консенсуса в части оказания помощи пациентам с ПМР, который должен строиться на более глубоких исследованиях, отвечающих прежде всего на вопросы, связанные с алгоритмированием выбора тактики при коррекции рефлюкса [15]. В рекомендациях EAU Guidelines on Pediatric Urology 2021 года было повторно показано, что из-за отсутствия достаточного количества рандомизированных исследований невозможно разработать качественные алгоритмы выбора метода ЭК и вида УИ. Также рекомендации упоминают о низ- кой эффективности при применении Collagen и относят DxHA и PPC к более эффективным ООА при коррекции рефлюкса, хотя указывают на частые рецидивы в тече ние двух лет после введения DxHA и значительное пре обладание риска обструкции при введении PPC пациентам с высокой степенью ПМР и расширенными мочеточниками [74]. Рекомендации отображают не обходимость применения ЭК при выполнении первого хирургического шага и ставят метод в более приоритет ную позицию по сравнению с антибиотикопрофилакти кой восходящей инфекции МВП, однако в них не описаны критерии перехода от консервативного лече ния к хирургической тактике.
На наш взгляд, дальнейший дифференцированный поиск метода коррекции, выбора материала и его дози рования должен строиться на сочетании множества факторов. Для успешного лечения, прогноза рецидива, минимизации риска осложнений при ЭК ПМР необхо димо отталкиваться от возраста пациента, особых со стояний организма, степени рефлюкса, особенностей строения УВС,частоты рецидивирования инфекции, наличия или отсутствия предшествующих вмеша тельств (УЦА или ранее проведенных имплантаций, в том числе закончившихся неудачей), особенностей взаимодействия тканей с ранее примененными ООА и других факторов.
Дифференцированный подход к выбору УИ в за висимости от возраста пациента диктует особые усло вия, которые неразрывно связаны с нежностью и рыхлостью тканей, незрелостью тканевых процессов и самой анатомией УВС. ООА в этом случае должен под бираться, исходя из логики: в более раннем возрасте болюс должен быть быстро биодеградируемый, чтобы дать возможность тканям беспрепятственно разви ваться в необходимом направлении, а в случае веро ятных ошибок его элиминация должна произойти быстро и не нанести вреда. В более старшем возрасте коррекция УВС, напротив, должна иметь перманент ный характер. Поэтому необходимо соблюдать так на зываемое разведение ООА по возрасту: от 6 месяцев – до 1 года – Collagen, от 1-1,5 лет – DxHA, старше 1 года – PAAH (когда требуется длительная коррекция), старше 1-1,5 лет – DxHA (если не критичен короткий срок деградации и рецидив), старше 3 лет – PPC, при условии понимания прогноза анатомической пере стройки и минимизации рисков смещения болюса.
Общесоматический статус и тканевые особенности также могут вносить свои коррективы, поэтому при по вышенной активности или реактогенности организма вероятны отклонения от безупречной имплантации по лимеров, которые не являются полностью инертными, либо возможно уменьшение ожидаемой длительности действия. Так, разный срок службы болюса из Collagen или DxHA зависит от индивидуальной активности кол лагеназ или гиалуронидаз соответственно [41].
DxHA при воспалении начинает проявлять повышен ные гидрофильные свойства, поэтому повышается риск развития обструктивных осложнений. Вероятно, что и PPC также может набухать при сдвиге равновесного со стояния, которое, скорее всего также запускается вос палительным процессом. Collagen и DxHA в редких случаях провоцируют перифокальное гранулематозное воспаление. Collagen доказанно реактогенен и может вызывать сероконверсию,а при диспластических со стояниях не всегда обеспечивает замещение болюса полноценным соединительнотканным очагом, что сни жает его ценность при планировании долгосрочного эффекта коррекции [3].
Для максимально успешного выбора методики и имплантата необходимо также всесторонне оценивать локальные особенности: рефлюкс – подтверждение природы ПМР и исключение противопоказаний к про ведению ЭК, степень рефлюкса, расположение устья, строение УВС. HIT, Double-HIT показаны при рефлюк сах высокой степени, при остальных степенях – STING или HIT в зависимости от цели, наиболее подходящей под форму УВС, при полном удвоении почки STING с предшествующей ретроградной катетеризацией одного из устьев мочеточника для лучшей визуализации и наиболее точного хода коррекции.При выполнении HIT, если УВС после первого вкола не смыкается, по казан переход к Double-HIT для «поднятия» и замыка ния устья [14]. Известны факторы риска ОО при применении DxHA и PPC: более высокие степени ПМР, особая клювовидная форма УВС и воспалительное со стояние слизистой мочевого пузыря перед выполне нием ЭК [40]. По данным производителя, PPC является сверхабсорбирующим полимером благодаря своей структуре, также известно неблагоприятное примене ние PPC при рубцовых изменениях УВС, на что указы вает сам производитель, что, вероятно, связано с затрудненным распределением плотного ООА в руб цово-измененных тканях [75]. Учитывая наибольшую эффективность HIT и Double-HIT вместе с более высо кими рисками развития острой и отсроченной об струкции,с одной стороны подбор УИ должен быть продиктован длительностью его действия, с другой – минимальными рисками его набухания, поэтому, на наш взгляд, стоит отдавать предпочтение стойким по лимерам с наименьшей склонностью к увеличению объема.
В процессе анализа литературы мы отметили, что термин «миграция полимера» употребляется по отно шению к самым разным явлениям, что является некор ректным описанием отличающихся друг от друга процессов. В зарубежной литературе миграцией назы вают процесс метаболизма и последующего перманент ного накопления продуктов частичной деградации в зонах депо и внутренних органах, выявив такие эф фекты по УИ на основе Тефлона и не доказав их с PPC
[74, 75]. Некоторые авторы миграцией называют упло щение болюса в отсроченном периоде после импланта ции, хотя данный процесс отображает биодеградацию полимера и уменьшение его количества в зоне введе ния. При практическом применении распределение ООА при их введении в ткани нередко также называют миграцией, если непосредственно во время инъекции гели по-разному заполняют ткани и формируют болюс не идеальной формы. Мы считаем, что в данном случае распределение УИ является следствием особенностей тканей и планирования ЭК, и получение необходимого результата – это взвешенная подготовка к манипуля ции, техника ее выполнения и оперативная пере стройка протокола имплантации при выявлении нежелательных эффектов или достижении недостаточ ной эффективности от одного вкола. Наконец, истин ной миграцией чаще всего считают смещение лока лизации болюса в проксимальном, дистальном направ лении, в стенку детрузора, экстравезикализацию УВС. В большей степени в таких ситуациях необходимо за думаться о технической подготовке мочевого пузыря к манипуляции, точном попадании в слой, корректности выбора метода, а также не произошла ли переоценка объема введения и расслоение тканей в процессе или после введения [7, 8, 18, 36, 47, 48].
В конце нашего обзора хотели бы вернуться к теме взаимозаменяемости ООА. Работа уролога с новыми медицинскими изделиями, тем более имеющими срок биодеградации свыше 1-1,5 лет, должна строиться на понимании того, какое поведение ожидать от каждого полимера в тканях. Не существует взаимозаменяемости и понятие эквивалентность дозы не применимо ни к одному из существующих на рынке УИ с абсолютно разными составами и свойствами. Планирование объема вводимого ООА до тех пор пока не разрабо таны стандартные алгоритмы лечения производится индивидуально в зависимости от множества факторов. Принятие решения об объеме эндопластики должно за висеть от целого спектра разобранных свойств и эф фектов, состояния тканей, степени рефлюкса, анатоми ческих особенностей УВС, первичная ли это коррекция или повторная, были ли в анамнезе у пациента ранее истинные миграции ООА и т.д.
И здесь врач может стать заложником ситуации, выбирая между рисками гиперкоррекции и рецидивом ПМР в случае имплантации недостаточного объема УИ. При высокой степени ПМР функция почки стра дает больше, и требуется тем более радикальный под ход для ее сохранения, что может мотивировать выполнить коррекцию одним этапом с большим объе мом имплантата. Такая тактика имеет риски гиперкор рекции и существенно повышает вероятность обструкции, особенно если применяются УИ, способные набу хать в тканях [15, 40]. Мы считаем, что наибольший вред может принести не столько рецидив рефлюкса, сколько ОО или ОтО, которые даже при своевременной тактике (вскрытие болюса, катетеризация мочеточника, фармакотерапия) не всегда позволят обойтись без большой хирургии с наложением УЦА. Не во всех работах мы увидели однозначную трактовку успешности ЭК и оценку рецидивов ПМР. Нередко встречаются ситуации при высокой степени ПМР, когда после первого введения ООА степень рефлюкса сокращается, но не устраняется полностью, в связи с чем требуется провести докоррек-цию, однако даже такие результаты можно считать успешным лечением, так как нагрузка на верхние отделы МВП снижается [76]. Соответственно, при статистической обработке результатов ЭК, на наш взгляд, необходимо более детально рассматривать варианты исхода лечения, учитывая также и то, закладывалась ли в схему поэтапная коррекция и на сколько степеней произошло уменьшение рефлюкса. В зависимости от особенностей тканей докоррекция может быть произведена другим методом ЭК или иным ООА с большей эффективностью и безопасностью, который дополнит эффект фиксации УВС, но не перегрузит зону избыточным объемом, наличие которого может быть критично и способно вызвать обструкцию или смещение болюса.
ЗАКЛЮЧЕНИЕ
Существует мнение, что открытый, лапароскопический или пневмовезикоскопический УЦА необходимо рассматривать как метод лечения пациентов со вторичным ПМР, с эктопированными мочеточниками, мегауретером, которым требуется хирургическое сокращение калибра интра-и экстрамурального сегмента мочеточника, а также тех, у кого выполнение 2-3 этапных ЭК не привело к достижению ремиссии ПМР [15]. Тем не менее, описанные методы зачастую успешной ЭК продолжают развиваться и конкурировать с реимплан тацией мочеточника. ЭК доказала свою эффективность в сложных случаях, которые ранее считались противо показаниями для такого лечения,включая ЭК в ранее имплантированный мочеточник, дисфункцию мочеис пускания, удвоение мочеточника, ПМР высокой сте пени и парауретеральные дивертикулы [15, 77, 78]. Помимо применяемых методов разрабатываются новые инъекционные подходы для ЭК, например, ме тодика создания множественного дробного внутри мочеточникового болюса SMHIT (Termed Systematic Multi-Site HIT) [79]. Принято решение, что первый шаг при лечении ПМР остается за ЭК, а хирургией второго шага является реимплантация мочеточника [74].
Краткосрочные результаты после ЭК ПМР иден тичны для различных ООА и в большинстве случаев сопоставимы с показателями успешности после реим плантации.Отмечена относительно высокая частота рецидивов, особенно при использовании DxHA, что вызывает необходимость дальнейшего поиска альтер нативных полимеров [13]. Современные УИ должны сохранять большую часть объема после введения, при этом их вязкость не должна создавать проблем во время имплантации,вызывать минимальное количе ство иммунных и тканевых реакций и не осложнять выполнение второго шага,если в нем возникает не обходимость в дальнейшем [8]. Существует нехватка научно обоснованной литературы по долгосрочному наблюдению после ЭК ПМР различными ООА. Несо мненно, существует проблема высокой частоты реци дивов при длительном наблюдении после ЭК DxHA и более частые обструктивные осложнения после при менения PPC, и, вероятно, отсутствует надлежащая оценка долгосрочной эффективности других агентов. Требуется проведение долгосрочных исследований после выполненных ЭК ПМР [13].
Таким образом, хотя методика ЭК и является зре лой, более глубокое изучение ранее известных полиме ров и появление новых ООА на основе различных субстанций постепенно подводит к переосмыслению подходов к выбору ООА.Инертный и биосовмести мый полиакриламидный гель 3-его поколения Рефлюк син уже за один год клинического применения показал свою стабильную эффективность и безопасность в ближайшем периоде после имплантации при разных степенях ПМР. В завершении хотим отметить, что новые формулы УИ не вымещают уже имеющиеся про дукты, но благодаря новым свойствам PAAH раскры вают многообразие подходов и позволяют детским урологам закрыть критичные зоны, когда применение других имплантатов показало свою неэффективность или высокие риски осложнений.
Разработки и достижения современных подходов в лечении ПМР в будущем обещают, с одной стороны, стандартизировать выбор методики ЭК, с другой – по мочь выстроить многогранный алгоритм для опреде ления оптимальной техники (или сочетания техник) вместе с выбором вида полимера применительно к множеству важнейших факторов, которые в совокуп ности влияют на эффективность и безопасность ЭК рефлюкса с применением всего имеющего спектра объемообразующих агентов.
ЛИТЕ РАТУPA/REFEREN CE S
-
1. Меновщикова Л.Б., Рудин Ю.Э., Гарманова Т.Н., Шадеркина В.А. Клини- ina V.A. Clinicsical recommendations for pediatric urology-andrology. M .: Pub-
ческие рекомендации по детской урологии-андрологии. М.: Издательство lishing house «Pero», 2015;240 p. (in Russian)].
-
3. Крыганова Т.А., Аксёнова М.Е., Длин В.В. Пузырно-мочеточниковый рефлюкс и его осложнения у детей в зависимости от степени выраженности дисплазии соединительной ткани. Российский вестник перинатологии и педиатрии 2016(4):93-97. [Kryiganova T.A., AksYonova M.E., Dlin V.V. Vesicoureteral refluxury and its complications in children, depending on the severity of displasma of connective tissue. Rossiyskiy vestnik perinatologiii pediatrii = Russian Bulletin of perinatology andpediatrics 2016(4):93-97. (in Russian)].
-
4. Абдуллаев Ф.К., Николаев В.В., Кулаев В.Д. Эволюция эндоскопического метода лечения пузырно-мочеточникового рефлюкса у детей. Детская больница 2013(1):57-63. [Abdullaev F.K., Nikolaev V.V., Kulaev V.D. Evolution of endoscopic treatment of vesicoureteral reflux. Detskaya bolnitsa = Children Hospital 2013(1):57-63. (in Russian)].
-
5. Исмаилова А.М., Макаров А.В., Туховская Е.А., Белоус Г.И., Аполихина И.А., Саидова А.С., и соавт. Новый объемообразующий препарат для лечения стрессового недержания мочи на основе частиц поли-Е-капролактона. Экспериментальная и клиническая урология 2019(1):18-23. [Ismailova A.M., Makarov A.V., Tuhovskaya E.A., Belous G.I., Apolihina I.A., Saidova A.S., i soavt. A new bulking agent for the treatment of stress urinary incontinence based on poly-E-caprolactone particles. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2019(1):18-23. (in Russian)].
-
6. Коварский С.Л., Шмыров О.С., Текотов А.Н. Осложнения эндоскопической коррекции пузырно-мочеточникового рефлюкса. Детская хирургия 2012(3):51-54. [Kovarskiy S.L., Shmyirov O.S., Tekotov A.N. Complications of endoscopic correction of vesicoureteral reflux. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(3):51-54. (in Russian)].
-
7. Левитская М.В., Меновщикова Л.Б., Мокрушина О.Г., Шумихин В.С., Склярова Т.А., Гуревич А.И. и соавт. Отдаленные результаты эндоскопической коррекции патологии уретеровезикального сегмента у младенцев. Российский вестник детской хирургии, анестезиологии и реаниматологии 2012;2(3):41-50. [Levitskaya M.V., Menovschikova L.B., Mokrushina O.G., Shumihin V.S., Sklyarova T.A., Gurevich A.I.i soavt. Late resultsof endoscopic correction the pathology of the ureter-vesical segment in infants. Rossiyskiy vestnik detskoy hirurgii, anesteziologii i reanimatologii = Russian journal of pediatric surgery, anesthesia and intensive care 2012;2(3):41-50. (in Russian)].
-
8. Сизонов В.В., Макаров А.Г.,Добросельский М.В., Макаров Г.А., Клюка И.В., Шалденко О.А. Тридцать лет применения объемообразующих препаратов в лечении пузырно-мочеточникового рефлюкса (литературный обзор). Вестник урологии 2013(1):61-68. [Sizonov V.V., Makarov A.G., Dobroselskiy M.V., Makarov G.A., Klyuka I.V., Shaldenko O.A. Thirty years of use of bulking agents in treatment of vesicoureteral reflux (literature review). Vestnik urologii = Urology herald 2013(1):61-68. (in Russian)].
-
9. Kocaoglu C. Endoscopic treatment of grades IV and V vesicoureteral reflux with two bulking substances: Dextranomer hyaluronic acid copolymer versus polyacrylate polyalcohol copolymer in children. J Pediatr Surg 2016;51(10):1711-5.
-
10. Lemire F, Blais AS, Moore K, Bolduc S. Use of polyacrylamide hydrogel for vesicoureteral reflux treatment, a review. J Nephrol Sci 2019;1(1):2-6.
-
11. Osipov I, Lebedev D, Sosnin E, Osipov A, Levandovsky A, Lifanova M, et al. Our experience in endoscopic treatment of vesico-ureteral reflux in children. Arch Ital Urol e Androl 2005;77(3): 146-148.
-
12. Warchol S, Krzemien G, Szmigielska A, Bombiński P, Toth K, Dudek-Warchoł T, et al.Endoscopic correction of vesicoureteral reflux in children using polyacry-late-polyalcohol copolymer (Vantris): 5-years of prospective follow-up. Cent European J Urol 2017(70):314-9.
-
13. Chertin B, Kocherov S, Chertin L, Natsheh A, Farkas A, Shenfeld OZ, Halachmi S. Endoscopic bulking materials for the treatment of vesicoureteral reflux: a review of our 20 years of experience and review of the literature. Adv Urol 2011;2011:309626.
-
14. Гасанов Д.А., Барская М.А., Терехин С.С. и соавт. Подход к эндоскопическому лечению пузырно-мочеточникового рефлюкса у детей. Современные проблемы науки и образования 2016(6):148. [Gasanov D.A., Barskaya M.A., TerYohin S.S. i soavt.Approach to endoscopic treatment of vesicoureteral reflux in children. Sovremennyie problemyi nauki i obrazovaniya = Modern Problems of Science and Education 2016(6):148. (in Russian)].
-
15. Пирогов А.В., Сизонов В.В.,Коган М.И. Сравнительная эффективность и безопасность трансуретральной и везикоскопической хирургии первичного пузырно-мочеточникового рефлюкса у детей. Вестник урологии 2020;8(3):58-68. [Pirogov A.V., Sizonov V.V., Kogan M.I.Comparative effectiveness and the danger of transurethral and vesicoscopic surgery of the primary. Ureteral reflux in children. Vestnik urologii = Urology herald 2020;8(3):58-68. (in Russian)].
-
16. Текотов А.Н. Дифференцированный подход к выбору эндоскопического имплантата в лечении пузырно-мочеточникового рефлюкса у детей. Авто-реф. дисс. соиск. степ. к.м.н. Москва 2013;34 с. [Tekotov A.N. Differentiated approach to the choice of endoscopic implant in the treatment of vesicoureteral reflux in children. Autoref. diss. job search. step. Ph.D. Moscow 2013; 34 p.(in Russian)].
-
17. Yap TL, Chen Y, Nah SA, Ong CC, Jacobsen A, Low Y. STING versus HIT technique of endoscopic treatment for vesicoureteral reflux: A systematic review and meta-analysis. J Pediatr Surg 2016;51(12):2015-20. [(in Russian)].
-
18. Зоркин С.Н., Шахновский Д.С., Туров Ф.О., Галузинская А.Т., Дьяконова Е.Ю. Эффективность эндоскопической коррекции пузырно-мочеточникового рефлюкса высокой степени у детей. Детская хирургия 2020;24(5):292-296. [Zorkin S.N., Shahnovskiy D.S., Turov F.O., Galuzinskaya A.T., Dyakonova E.Yu. The effectiveness of endoscopic correction of vesicoureteral high reflux in children. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2020;24(5):292-296. (in Russian)].
-
19. Яцык С.П., Буркин А.Г., Шарков С.М., Абрамов К.С. и соавт. Сравнительная оценка методов хирургической коррекции пузырно-мочеточникового рефлюкса у детей. Вопросы современной педиатрии 2014;13(2):129-131. [Yat-syik S.P., Burkin A.G., Sharkov S.M., Abramov K.S. i soavt. Comparative evaluation of methods of surgical correction of vesicoureteral reflux in children. Voprosyi sovre-mennoy pediatrii= CurrentPediatrics 2014;13(2):129-131. (in Russian)].
-
20. Ander AH. Endoscopic treatment of vesicoureteral reflux. Abstract Book from 8 th Mediterranean video-endoscopic urology and European society of urological technology, Antalya, Turkey 2006;13-14 p.
-
21. Kirsh A, Heensle T, Scherz H. Injection therapy: Advancing the treatment of vesicoureteral reflux. J PedUrol 2006(2):539-44.
-
22. Lakgren G. Endoscopic treatment of vesicoureteral reflux:Current status. Indian J Urol 2009(25):34–9.
-
23. Caldamone AA. Injection therapy for vesicoureteral reflux.5th ed. Kelalis-King-Belman Textbook of Clinical Pediatric Urology. Docimo SG, editor-in-chief. Informa HealthcareUK 2007;691-710 p.
-
24. Cerwinka WH, Kirsch AJ. Endoscopic treatment of vesicoureteral reflux.7th ed. Glenn's Urologic Surgery. Graham Jr. SD, Keane TE, eds. Wolters Kluwer 2010;676-80 p.
-
25. Diamond DA, Mattoo TK. Endoscopic treatment of primary vesicoureteral reflux. N Engl J Med 2012;366(13):1218-26.
-
26. Hodges SJ. STING procedure for reflux. 3rd ed. Smith's Textbook of Endourology. Smith AD, Badlani GH, Preminger GM, Kavoussi LR, eds. Wiley-Blackwell 2012;1633-9 p.
-
27. Kalisvaart JF, Scherz HC, Cuda S, Kaye JD, Kirsch AJ. Intermediate to long-term follow-up indicates low risk of recurrence after double-HIT endoscopic treatment for primary vesico-ureteral reflux. J Pediatr Urol 2012;8(4):359-65.
-
28. Kirsch AJ, Perez-Brayfield M, Smith EA, Scherz HC, et al. The modified STING procedure to correct vesicoureteral reflux: improved results with submucosal implantation within the intramural ureter. J Urol 2004;171(6):2413–2416.
-
29. Molitierno JA, Scherz H, Kirsch A. Endoscopic treatment of vesicoureteral reflux using dextranomer hyaluronic acid copolymer. J Ped Urol 2008;4(3):221-8.
-
30. Cerwinka WH, Scherz HC, Kirsch AJ. Dynamic hydrodistention classification of the ureter and the double HIT method to correct vesicoureteral reflux. Arch Esp Urol 2008;61(8):882-7.
-
31. Kirsch AJ, Kaye JD, Cerwinka WH, Watson JM, Elmore JM, Lyles RH, et al. Dynamic hydrodistention of the ureteral orifice: a novel grading system with high interobserver concordance and correlation with vesicoureteral reflux grade. J Urol 2009(182):1688-93.
-
32. Chertin B, Colhoun E, Velayudham M, Puri P, et al. Endoscopic treatment of vesicoureteral reflux: 11 to 17 years of followup. J Urol 2002;167(3):1443–5.
-
33. Chertin B, Kocherov S. Long-term results of endoscopic treatment of vesicoureteric reflux with different tissue-augmenting substances. J Ped Urol 2010;6(3):251–6.
-
34. Puri P, Chertin B, Velayudham M, Dass L, Colhoun E, et al.Treatment of vesicoureteral reflux by endoscopic injection of dextranomer/hyaluronic acid copolymer: preliminary results. J Urol 2003;170(4):1541–4.
-
35. Routh JC, Vandersteen DR, Pfefferle H, Wolpert JJ, Reinberg Y, et al.Single center experience with endoscopic management of vesicoureteral reflux in children. J Urol 2006;175(5):1889–93.
-
36. Зоркин С.Н., Борисова С.А. Эндоскопическая коррекция пузырно-мочеточникового рефлюкса у детей. Лечащий врач 2013(1). [Zorkin S.N., Borisova S.A. Endoscopic correction of vesicoureteral reflux in children. Lechaschiy vrach = Journal attending physician 2013(1). (in Russian)].
-
37. Сизонов В.В., Каганцов И.М., Пирогов А.В. и соавт. Факторы риска формирования обструктивных осложнений эндоскопического лечения пузырно-мочеточникового рефлюкса с использованием кополимера полиалкоголя полиакрилата: мультицентровое исследование. Экспериментальная и клиническая урология 2019(1):128-31. [Sizonov V.V., Kagantsov I.M., Pirogov A.V. i soavt. Risk factors for monitoring of obstructive complications of endoscopic treatment of ocular-ureteral reflux using copolymer polyalcohol polyacrylate: a multicenter study. Eksperimentalnaya i klinicheskaya urologiya = Experimentaland clinical urology 2019(1):128-31. (in Russian)].
-
38. Сизонов В.В., Акрамов Н.Р., Бондаренко С.Г., Долгов Б.Л., Дубров В.И., Каганцов И.М. и соавт. Обструктивные осложнения эндоскопического лечения пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2016;20(4):181-4. [Sizonov V.V., Akramov N.R., Bondarenko S.G., Dolgov B.L., Dubrov V.I., Kagantsov I.M. i soavt. Obstructive complications of endoscopic treatment of vesicoureteral reflux of children. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2016;20(4):181-4. (in Russian)].
-
39. Sizonov VV, Kagantsov IM, Mayr JM et al. Risk factors for obstructive complications after endoscopic correction of vesico-ureteral reflux using polyacrylate polyalcohol copolymer. Medicine 2020;99:22(e20386).
-
40. Chertin B, Mele E, Kocherov S, Zilber S, Nappo SG, Capozza N, et al.What are the predictive factors leading to ureteral obstruction following endoscopic correction of VUR in the pediatric population? JPediatr Urol 2018;14(6):538.e1-538.e7.
-
41. Henrotin Y, Deberg M, Mathy-Hartert M, Deby-Dupont G. Biochemical biomarkers of oxidative collagen damage. Adv Clin Chem 2009(49):31-55.
-
42. Tnibar A, Persson B, Jensen HE. Mechanisms of action of an intraarticular 2.5% polyacrylamide hydrogel (Arthramid Vet) in a goat model of osteoarthritis: preliminary observations. J Biomed Eng 2017;3(3):1022-8.
-
43. Wenger Y, Schneider RJ, Reddy GR, Kopelman R, Jolliet O, Philbert MA, et al. Tissue distribution and pharmacokinetics of stable polyacrylamide nanoparticles following intravenous injection in the rat. Toxicol Appl Pharmacol 2011;251(3):181–90. 44. Приказ Минздрава России от 09.01.2014 N 2н «Об утверждении Порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий» (с изменениями и дополнениями от 22.04.2019). [Prikaz Minzdrava Rossii ot 09.01.2014 N 2n «Ob utverzhdenii Poryadka provedeniya otsenki sootvetstviya meditsinskih izdeliy v forme tehnicheskih ispyitaniy,toksikologicheskih issledovaniy,klinich-eskih ispyitaniy v tselyah gosudarstvennoy registratsii meditsinskih izdeliy» (s izme-neniyami i dopolneniyami ot 22.04.2019). (in Russian)].
-
45. Приказ Минздрава России от 15.09.2020 N 980н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий». [Prikaz Minzdrava Rossii ot 15.09.2020 N 980n «Ob utverzhdenii Poryadka os-uschestvleniya monitoringa bezopasnosti meditsinskih izdeliy». (in Russian)].
-
46. Приказ Минздрава России от 19.10.2020 N 1113н «Об утверждении Порядка сообщения субъектами обращения медицинских изделий обо всех случаях выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий». [Prikaz Minzdrava Rossii ot 19.10.2020 N 1113n «Ob utverzhdenii Poryadka soobscheniya sub'ektami obrascheniya meditsinskih izdeliy obo vseh sluchayah vyiyavleniya pobochnyih deystviy, ne ukazannyih v instruktsii po primeneniyu ili rukovodstve po eksplu-atatsii meditsinskogo izdeliya, o nezhelatelnyih reaktsiyah pri ego primenenii, ob osobennostyah vzaimodeystviya meditsinskih izdeliy mezhdu soboy, o faktah i ob obstoyatelstvah, sozdayuschih ugrozu zhizni i zdorovyu grazhdan i meditsinskih rabotnikov pri primenenii i ekspluatatsii meditsinskih izdeliy». (in Russian)].
-
47. Бабанин И.Л., Гельдт В.Г., Казанская И.В. Метод профилактики миграции синтетических имплантатов при эндоскопическом лечении пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2012(4):15-8. [Babanin I.L., Geldt V.G., Kazanskaya I.V. Migration prevention method synthetic implants for endoscopic treatment of vesicoureteral reflux of children.. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(4):15-8. (in Russian)].
-
48. Барсегян Е.Р., Зоркин С.Н. Сравнительная оценка результативности применения различных полимеров при эндоскопической коррекции пузырномочеточникового рефлюкса у детей. Детская хирургия 2014(5):4-8. [Barsegyan E.R., Zorkin S.N. Sravnitelnaya otsenka rezultativnosti primeneniya razlichnyih polimerov pri endoskopicheskoy korrektsii puzyirno-mochetochnikovogo reflyuksa u detey. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2014(5):4-8. (in Russian)].
-
49. Осипов И.Б., Лебедев Д.А., Левандовский А.Б. Эндоскопическое лечение пузырно-мочеточникового рефлюкса у детей. Учебное пособие для врачей. М.,: «Научный центр «Биоформ» 2006; 80 с. [Osipov I.B., Lebedev D.A., Levandovskiy A.B. Endoscopic treatment vesicoureteral reflux of children. A textbook for doctors. M.,: "Scientific Center" Bioform "2006; 80 p. (in Russian)].
-
50. Alizadeh F, Mazdak H, Khorrami MH, Khalighinejad P, Shoureshi P, et al.Post-operative ureteral obstruction after endoscopic treatment of vesicoureteral reflux with polyacrylate polyalcohol copolymer (Vantris®). J Pediatr Urol 2013 Aug;9(4):488-92.
-
51. Şencan A, Yildirim H, Ozkan KU, Basak Uçan, Karkıner A, Hoşgor M. Late ureteral obstruction after endoscopic treatment of vesicoureteral reflux with polyacrylate polyalcohol copolymer. PedUrology 2014;84(5):1188-93.
-
52. NASHА ТМ – The monograph. Q-Med AB. Sweden, Uppsala 2008; 28 p.
-
53. Kocherov S, Nikolaev S, Gaber G et al.Incidence of UVJ obstruction during long - term follow - up after endoscopic correction of VUR utilizing polyacrylate polyalcohol copolymer (PPC). J Ped End Surg 2020(2):183-7.
-
54. Elzayat EA, Karsenty G, Bismar TA, et al.Volume changes and histological response to injected dextranomer/hyaluronic acid copolymer (Zuidex) and collagen (Contigen) in rats. Int Urogynecol JPelvic Floor Dysfunct 2008 Feb;19(2):247-52.
-
55. Sabetkish S, Mohseni MJ, Sabetkish N, Kajbafzadeh AM. Local tissue reaction and histopathological characteristics of three different bulking agents: a rabbit model. Int Braz J Urol 2021;47(2):322-32.
-
56. Inoue K, Nakamoto T, Usui A, Usui T. Evaluation of antibody class in responce to endoscopic subureteral collagen injection in patients with vesicoureteral reflux. J Urol Baltimore 2001;165(2):555-8.
-
57. Christensen LH, Nielsen JB, Mouritsen L, Sorensen M, Lose G. Tissue Integration of Polyacrylamide Hydrogel: An Experimental Study of Periurethral, Perivesical, and Mammary Gland Tissue in the Pig. Dermatol Surg 2008;34(1):68-77.
-
58. Abid HA, Almarzooqi S. Pathological changes associated with DEFLUX use in vesicoureteric reflux. Int J Case Rep Images 2019(10):101044Z01HA2019.
-
59. Kazuto S, Yanai T, Kawakami H, et al.Deterioration of autoimmune condition associated with repeated injection of dextranomer/hyaluronic acid copolymer: A case report. J Ped Surg Case Rep 2016(4):10-2.
-
60. Rayahin JE, Buhrman JS, Zhang Y, Koh TJ, Gemeinhart RA. High and low mo-
-
61. Rubenwolf PC, Ebert AK, Ruemmele P, Ruemmele P, Rosch WH. Delayed-onset ureteral obstruction after endoscopic dextranomer/hyaluronic acid copolymer (Deflux) injection for treatment of vesicoureteral reflux in children: a case series. Urology 2013;81(3):659-62.
-
62. Stenberg A, Larsson E, Lackgren G. Endoscopic treatment with dextranomer-hyaluronic acid for vesicoureteral reflux: histological findings. J Urol 2003;169(3):1109-13.
-
63. Życzkowski M, Prokopowicz G, Zajęcki W, Paradysz A. Complications following endoscopic treatment of vesicoureteric reflux with Deflux® – two case studies. Centr Eur J Urol 2012;65(4):230-1.
-
64. Nepple KG, Knudson MJ, Cooper CS, Austin JC. Symptomatic calcification of subureteral collagen ten years after injection. Urology 2007;69(5):982.e1-2.
-
65. Ферапонтов Н.Б., Токмачев М.Г., Гагарин А.Н. и соавт. Влияние свойств полимеров на условия их набухания в воде и в водных растворах. Сорбционные и хроматографические процессы 2014;14(5):795-812. [Fer-apontov N.B., Tokmachev M.G., Gagarin A.N. i soavt. Influence of properties polymers on the conditions of their swelling in water and in aqueous solutions. Sorbtsionnyie i hromatograficheskie protsessyi = Sorption and chromatography processes 2014;14(5):795-812. (in Russian)].
-
66. Liu T, Jiao C, Peng X, Chen YN, Chen Y, He C. et al.Super-strong and tough poly(vinyl alcohol)/poly(acrylic acid) hydrogels reinforced by hydrogen bonding. J Mater Chem B 2018(6):8105-14.
-
67. Byun H, Hong B, Nam SY, et al. Swelling Behavior and Drug Release of Poly (vinyl alcohol) Hydrogel Cross-Linked with Poly(acrylic acid). Macromol Res 2008;16(3):189-93.
-
68. Cheng Н, Hu Y, Xu M, Qin M, Lan W, Huang D, et al. High strength Polyvinyl alcohol/Polyacrylic acid (PVA/PAA) hydrogel fabricated by Cold-Drawn method for cartilage tissue substitutes. J Biomat Science, Polymer Edition 2020;31(14):1836-51.
-
69. De Boulle K, Glogau R, Kono T, Nathan M, Tezel A, Roca-Martinez JX, et al. A review of the metabolism of 1,4-butanediol diglycidyl ether–crosslinked hyaluronic
acid dermal fillers. Dermatol Surg 2013;39(12):1758-66.
-
70. Khunmanee S, Jeong Y, Park H. Crosslinking method of hyaluronic-based hydrogel for biomedical applications. J Tissue Engin 2017(8):1–16.
-
71. Lopatin VV, Askadskii AA. Influence of the preparation mode on structure and properties of gels based on poly(acrylamide). Russ Polymer News 2003;8(3):47-53.
-
72. Lopatin VV, Askadskii AA, Peregudov AS. Spectral analysis of water gels based on poly(acrylamide) prepared by different ways. Russ Polymer News 2003;8(4):8-14.
-
73. Lapasin R, Segatti F, Mercuri D, et al. Rheological studies dedicated to the development of a novel injectable polymeric blend for viscosupplementation treatment. Chem Biochem EngQ. 2015;29(4):511–18.
-
74. EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4.
-
75. Ormaechea M, Paladini M, Pisano R. Vantris®, a biocompatible, synthetic, non-biodegradable, easy-to-inject bulking substance: evaluation of local tissular reaction, localized migration and long-distance migration. ArchEsp Urol 2008;61(2):263-8.
-
76. Меновщикова Л.Б., Коварский С.Л., Николаев С.Н. и соавт. Использование нового объемообразующего синтетического материала Вантрис для лечения первичного пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2012(4):12-5. [Menovschikova L.B., Kovarskiy S.L., Nikolaev S.N. i soavt. Use new bulking synthetic material Vantris for treatment of primary vesicoureteral reflux in children. Children surgery. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(4):12-5. (in Russian)].
-
77. Capozza N, Nappo S, Caione P. Endoscopic treatment of vesicoureteral reflux in the previously reimplanted ureter: technical aspects and results. Arch Esp Urol 2008;61(2):249-253.
-
78. Kim SW, Lee YS, Han SW. Endoscopic injection therapy. Investig Clin Urol 2017;58(1):38-45.
-
79. Nakamura S, Tanabe K, Hyuga T, Kubo T, Inoguchi S, Kawai S, et al.Mid-Term Safety and Efficacy of the Modified Double Hydrodistention Implantation Technique (HIT), Termed Systematic Multi-Site HIT (SMHIT), for Patients with Primary Vesicoureteral Reflux. Res Rep Urol 2020(12):517-25.
«Перо», 2015;240 с. [Menovschikova L.B., Rudin Yu.E., Garmanova T.N., Shaderk- 2. Козлов Ю.А., Распутин А.А., Ковальков К.А. и соавт. Минимально инвазивное
ЛНТЕРАТУPA/REFERENCE S лечение обструкции пиелоуретерального сегмента у новорождённых и младенцев. Современное состояние проблемы. Детская хирургия 2020;24(5):331-339. [Kozlov Yu.A., Rasputin A.A., Kovalkov K.A. i soavt.Minimally invasive treatment of obstruction of the pyeloureteral segment in newborns and infantsev. Current state of the problem. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2020;24(5):331-339. (in Russian)].
Список литературы Эндоскопическая коррекция пузырно-мочеточникового рефлекса у детей: дифференцированный выбор метода, материала и его дозирования
- Меновщикова Л.Б., Рудин Ю.Э., Гарманова Т.Н., Шадеркина В.А. Клинические рекомендации по детской урологии-андрологии. М.: Издательство «Перо», 2015;240 с. [Menovschikova L.B., Rudin Yu.E., Garmanova T.N., Shaderkina V.A. Clinicsical recommendations for pediatric urology-andrology. M .: Publishing house «Pero», 2015;240 p. (in Russian)].
- Козлов Ю.А., Распутин А.А., Ковальков К.А. и соавт. Минимально инвазивное лечение обструкции пиелоуретерального сегмента у новорождённых и младенцев. Современное состояние проблемы. Детская хирургия 2020;24(5):331-339. [Kozlov Yu.A., Rasputin A.A., Kovalkov K.A. i soavt. Minimally invasive treatment of obstruction of the pyeloureteral segment in newborns and infantsev. Current state of the problem. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2020;24(5):331-339. (in Russian)].
- Крыганова Т.А., Аксёнова М.Е., Длин В.В. Пузырно-мочеточниковый рефлюкс и его осложнения у детей в зависимости от степени выраженности дисплазии соединительной ткани. Российский вестник перинатологии и педиатрии 2016(4):93-97. [Kryiganova T.A., AksYonova M.E., Dlin V.V. Vesicoureteral refluxury and its complications in children, depending on the severity of displasma of connective tissue. Rossiyskiy vestnik perinatologii i pediatrii = Russian Bulletin of perinatology and pediatrics 2016(4):93-97. (in Russian)].
- Абдуллаев Ф.К., Николаев В.В., Кулаев В.Д. Эволюция эндоскопического метода лечения пузырно-мочеточникового рефлюкса у детей. Детская больница 2013(1):57-63. [Abdullaev F.K., Nikolaev V.V., Kulaev V.D. Evolution of endoscopic treatment of vesicoureteral reflux. Detskaya bolnitsa = Children Hospital 2013(1):57-63. (in Russian)].
- Исмаилова А.М., Макаров А.В., Туховская Е.А., Белоус Г.И., Аполихина И.А., Саидова А.С., и соавт. Новый объемообразующий препарат для лечения стрессового недержания мочи на основе частиц поли-Е-капролактона. Экспериментальная и клиническая урология 2019(1):18-23. [Ismailova A.M., Makarov A.V., Tuhovskaya E.A., Belous G.I., Apolihina I.A., Saidova A.S., i soavt. A new bulking agent for the treatment of stress urinary incontinence based on poly-E-caprolactone particles. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2019(1):18-23. (in Russian)].
- Коварский С.Л., Шмыров О.С., Текотов А.Н. Осложнения эндоскопической коррекции пузырно-мочеточникового рефлюкса. Детская хирургия 2012(3):51-54. [Kovarskiy S.L., Shmyirov O.S., Tekotov A.N. Complications of endoscopic correction of vesicoureteral reflux. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(3):51-54. (in Russian)].
- Левитская М.В., Меновщикова Л.Б., Мокрушина О.Г., Шумихин В.С., Склярова Т.А., Гуревич А.И. и соавт. Отдаленные результаты эндоскопической коррекции патологии уретеровезикального сегмента у младенцев. Российский вестник детской хирургии, анестезиологии и реаниматологии 2012;2(3):41-50. [Levitskaya M.V., Menovschikova L.B., Mokrushina O.G., Shumihin V.S., Sklyarova T.A., Gurevich A.I. i soavt. Late resultsof endoscopic correction the pathology of the ureter-vesical segment in infants. Rossiyskiy vestnik detskoy hirurgii, anesteziologii i reanimatologii = Russian journal of pediatric surgery, anesthesia and intensive care 2012;2(3):41-50. (in Russian)].
- Сизонов В.В., Макаров А.Г., Добросельский М.В., Макаров Г.А., Клюка И.В., Шалденко О.А. Тридцать лет применения объемообразующих препаратов в лечении пузырно-мочеточникового рефлюкса (литературный обзор). Вестник урологии 2013(1):61-68. [Sizonov V.V., Makarov A.G., Dobroselskiy M.V., Makarov G.A., Klyuka I.V., Shaldenko O.A. Thirty years of use of bulking agents in treatment of vesicoureteral reflux (literature review). Vestnik urologii = Urology herald 2013(1):61-68. (in Russian)].
- Kocaoglu C. Endoscopic treatment of grades IV and V vesicoureteral reflux with two bulking substances: Dextranomer hyaluronic acid copolymer versus polyacrylate polyalcohol copolymer in children. J Pediatr Surg 2016;51(10):1711-5.
- Lemire F, Blais AS, Moore K, Bolduc S. Use of polyacrylamide hydrogel for vesicoureteral reflux treatment, a review. J Nephrol Sci 2019;1(1):2-6.
- Osipov I, Lebedev D, Sosnin E, Osipov A, Levandovsky A, Lifanova M, et al. Our experience in endoscopic treatment of vesico-ureteral reflux in children. Arch Ital Urol e Androl 2005;77(3): 146-148.
- Warchol S, Krzemien G, Szmigielska A, Bombiński P, Toth K, Dudek-Warchoł T, et al. Endoscopic correction of vesicoureteral reflux in children using polyacrylate-polyalcohol copolymer (Vantris): 5-years of prospective follow-up. Cent European J Urol 2017(70):314-9.
- Chertin B, Kocherov S, Chertin L, Natsheh A, Farkas A, Shenfeld OZ, Halachmi S. Endoscopic bulking materials for the treatment of vesicoureteral reflux: a review of our 20 years of experience and review of the literature. Adv Urol 2011;2011:309626.
- Гасанов Д.А., Барская М.А., Терехин С.С. и соавт. Подход к эндоскопическому лечению пузырно-мочеточникового рефлюкса у детей. Современные проблемы науки и образования 2016(6):148. [Gasanov D.A., Barskaya M.A., TerYohin S.S. i soavt. Approach to endoscopic treatment of vesicoureteral reflux in children. Sovremennyie problemyi nauki i obrazovaniya = Modern Problems of Science and Education 2016(6):148. (in Russian)].
- Пирогов А.В., Сизонов В.В., Коган М.И. Сравнительная эффективность и безопасность трансуретральной и везикоскопической хирургии первичного пузырно-мочеточникового рефлюкса у детей. Вестник урологии 2020;8(3):58-68. [Pirogov A.V., Sizonov V.V., Kogan M.I. Comparative effectiveness and the danger of transurethral and vesicoscopic surgery of the primary. Ureteral reflux in children. Vestnik urologii = Urology herald 2020;8(3):58-68. (in Russian)].
- Текотов А.Н. Дифференцированный подход к выбору эндоскопического имплантата в лечении пузырно-мочеточникового рефлюкса у детей. Автореф. дисс. соиск. степ. к.м.н. Москва 2013;34 с. [Tekotov A.N. Differentiated approach to the choice of endoscopic implant in the treatment of vesicoureteral reflux in children. Autoref. diss. job search. step. Ph.D. Moscow 2013; 34 p.(in Russian)].
- Yap TL, Chen Y, Nah SA, Ong CC, Jacobsen A, Low Y. STING versus HIT technique of endoscopic treatment for vesicoureteral reflux: A systematic review and meta-analysis. J Pediatr Surg 2016;51(12):2015-20. [(in Russian)].
- Зоркин С.Н., Шахновский Д.С., Туров Ф.О., Галузинская А.Т., Дьяконова Е.Ю. Эффективность эндоскопической коррекции пузырно-мочеточникового рефлюкса высокой степени у детей. Детская хирургия 2020;24(5):292-296. [Zorkin S.N., Shahnovskiy D.S., Turov F.O., Galuzinskaya A.T., Dyakonova E.Yu. The effectiveness of endoscopic correction of vesicoureteral high reflux in children. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2020;24(5):292-296. (in Russian)].
- Яцык С.П., Буркин А.Г., Шарков С.М., Абрамов К.С. и соавт. Сравнительная оценка методов хирургической коррекции пузырно-мочеточникового рефлюкса у детей. Вопросы современной педиатрии 2014;13(2):129-131. [Yatsyik S.P., Burkin A.G., Sharkov S.M., Abramov K.S. i soavt. Comparative evaluation of methods of surgical correction of vesicoureteral reflux in children. Voprosyi sovremennoy pediatrii = Current Pediatrics 2014;13(2):129-131. (in Russian)].
- Ander AH. Endoscopic treatment of vesicoureteral reflux. Abstract Book from 8 th Mediterranean video-endoscopic urology and European society of urological technology, Antalya, Turkey 2006;13-14 p.
- Kirsh A, Heensle T, Scherz H. Injection therapy: Advancing the treatment of vesicoureteral reflux. J Ped Urol 2006(2):539-44.
- Lakgren G. Endoscopic treatment of vesicoureteral reflux: Current status. Indian J Urol 2009(25):34–9.
- Caldamone AA. Injection therapy for vesicoureteral reflux. 5th ed. Kelalis-King-Belman Textbook of Clinical Pediatric Urology. Docimo SG, editor-in-chief. Informa Healthcare UK 2007;691-710 p.
- Cerwinka WH, Kirsch AJ. Endoscopic treatment of vesicoureteral reflux. 7th ed. Glenn's Urologic Surgery. Graham Jr. SD, Keane TE, eds. Wolters Kluwer 2010;676-80 p.
- Diamond DA, Mattoo TK. Endoscopic treatment of primary vesicoureteral reflux. N Engl J Med 2012;366(13):1218-26.
- Hodges SJ. STING procedure for reflux. 3rd ed. Smith's Textbook of Endourology. Smith AD, Badlani GH, Preminger GM, Kavoussi LR, eds. Wiley-Blackwell 2012;1633-9 p.
- Kalisvaart JF, Scherz HC, Cuda S, Kaye JD, Kirsch AJ. Intermediate to long-term follow-up indicates low risk of recurrence after double-HIT endoscopic treatment for primary vesico-ureteral reflux. J Pediatr Urol 2012;8(4):359-65.
- Kirsch AJ, Perez-Brayfield M, Smith EA, Scherz HC, et al. The modified STING procedure to correct vesicoureteral reflux: improved results with submucosal implantation within the intramural ureter. J Urol 2004;171(6):2413–2416.
- Molitierno JA, Scherz H, Kirsch A. Endoscopic treatment of vesicoureteral reflux using dextranomer hyaluronic acid copolymer. J Ped Urol 2008;4(3):221-8.
- Cerwinka WH, Scherz HC, Kirsch AJ. Dynamic hydrodistention classification of the ureter and the double HIT method to correct vesicoureteral reflux. Arch Esp Urol 2008;61(8):882-7.
- Kirsch AJ, Kaye JD, Cerwinka WH, Watson JM, Elmore JM, Lyles RH, et al. Dynamic hydrodistention of the ureteral orifice: a novel grading system with high interobserver concordance and correlation with vesicoureteral reflux grade. J Urol 2009(182):1688-93.
- Chertin B, Colhoun E, Velayudham M, Puri P, et al. Endoscopic treatment of vesicoureteral reflux: 11 to 17 years of followup. J Urol 2002;167(3):1443–5.
- Chertin B, Kocherov S. Long-term results of endoscopic treatment of vesicoureteric reflux with different tissue-augmenting substances. J Ped Urol 2010;6(3):251–6.
- Puri P, Chertin B, Velayudham M, Dass L, Colhoun E, et al. Treatment of vesicoureteral reflux by endoscopic injection of dextranomer/hyaluronic acid copolymer: preliminary results. J Urol 2003;170(4):1541–4.
- Routh JC, Vandersteen DR, Pfefferle H, Wolpert JJ, Reinberg Y, et al. Single center experience with endoscopic management of vesicoureteral reflux in children. J Urol 2006;175(5):1889–93.
- Зоркин С.Н., Борисова С.А. Эндоскопическая коррекция пузырно-мочеточникового рефлюкса у детей. Лечащий врач 2013(1). [Zorkin S.N., Borisova S.A. Endoscopic correction of vesicoureteral reflux in children. Lechaschiy vrach = Journal attending physician 2013(1). (in Russian)].
- Сизонов В.В., Каганцов И.М., Пирогов А.В. и соавт. Факторы риска формирования обструктивных осложнений эндоскопического лечения пузырно-мочеточникового рефлюкса с использованием кополимера полиалкоголя полиакрилата: мультицентровое исследование. Экспериментальная и клиническая урология 2019(1):128-31. [Sizonov V.V., Kagantsov I.M., Pirogov A.V. i soavt. Risk factors for monitoring of obstructive complications of endoscopic treatment of ocular-ureteral reflux using copolymer polyalcohol polyacrylate: a multicenter study.Eksperimentalnaya i klinicheskaya urologiya = Experimental and clinical urology 2019(1):128-31. (in Russian)].
- Сизонов В.В., Акрамов Н.Р., Бондаренко С.Г., Долгов Б.Л., Дубров В.И., Каганцов И.М. и соавт. Обструктивные осложнения эндоскопического лечения пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2016;20(4):181-4. [Sizonov V.V., Akramov N.R., Bondarenko S.G., Dolgov B.L., Dubrov V.I., Kagantsov I.M. i soavt. Obstructive complications of endoscopic treatment of vesicoureteral reflux of children. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2016;20(4):181-4. (in Russian)].
- Sizonov VV, Kagantsov IM, Mayr JM et al. Risk factors for obstructive complications after endoscopic correction of vesico-ureteral reflux using polyacrylate polyalcohol copolymer. Medicine 2020;99:22(e20386).
- Chertin B, Mele E, Kocherov S, Zilber S, Nappo SG, Capozza N, et al. What are the predictive factors leading to ureteral obstruction following endoscopic correction of VUR in the pediatric population? J Pediatr Urol 2018;14(6):538.e1-538.e7.
- Henrotin Y, Deberg M, Mathy-Hartert M, Deby-Dupont G. Biochemical biomarkers of oxidative collagen damage. Adv Clin Chem 2009(49):31-55.
- Tnibar A, Persson B, Jensen HE. Mechanisms of action of an intraarticular 2.5% polyacrylamide hydrogel (Arthramid Vet) in a goat model of osteoarthritis: preliminary observations. J Biomed Eng 2017;3(3):1022-8.
- Wenger Y, Schneider RJ, Reddy GR, Kopelman R, Jolliet O, Philbert MA, et al. Tissue distribution and pharmacokinetics of stable polyacrylamide nanoparticles following intravenous injection in the rat. Toxicol Appl Pharmacol 2011;251(3):181–90.
- Приказ Минздрава России от 09.01.2014 N 2н «Об утверждении Порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий» (с изменениями и дополнениями от 22.04.2019). [Prikaz Minzdrava Rossii ot 09.01.2014 N 2n «Ob utverzhdenii Poryadka provedeniya otsenki sootvetstviya meditsinskih izdeliy v forme tehnicheskih ispyitaniy, toksikologicheskih issledovaniy, klinicheskih ispyitaniy v tselyah gosudarstvennoy registratsii meditsinskih izdeliy» (s izmeneniyami i dopolneniyami ot 22.04.2019). (in Russian)].
- Приказ Минздрава России от 15.09.2020 N 980н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий». [Prikaz Minzdrava Rossii ot 15.09.2020 N 980n «Ob utverzhdenii Poryadka osuschestvleniya monitoringa bezopasnosti meditsinskih izdeliy». (in Russian)].
- Приказ Минздрава России от 19.10.2020 N 1113н «Об утверждении Порядка сообщения субъектами обращения медицинских изделий обо всех случаях выявления побочных действий, не указанных в инструкции по применению или руководстве по эксплуатации медицинского изделия, о нежелательных реакциях при его применении, об особенностях взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан и медицинских работников при применении и эксплуатации медицинских изделий». [Prikaz Minzdrava Rossii ot 19.10.2020 N 1113n «Ob utverzhdenii Poryadka soobscheniya sub'ektami obrascheniya meditsinskih izdeliy obo vseh sluchayah vyiyavleniya pobochnyih deystviy, ne ukazannyih v instruktsii po primeneniyu ili rukovodstve po ekspluatatsii meditsinskogo izdeliya, o nezhelatelnyih reaktsiyah pri ego primenenii, ob osobennostyah vzaimodeystviya meditsinskih izdeliy mezhdu soboy, o faktah i ob obstoyatelstvah, sozdayuschih ugrozu zhizni i zdorovyu grazhdan i meditsinskih rabotnikov pri primenenii i ekspluatatsii meditsinskih izdeliy». (in Russian)].
- Бабанин И.Л., Гельдт В.Г., Казанская И.В. Метод профилактики миграции синтетических имплантатов при эндоскопическом лечении пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2012(4):15-8. [Babanin I.L., Geldt V.G., Kazanskaya I.V. Migration prevention method synthetic implants for endoscopic treatment of vesicoureteral reflux of children.. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(4):15-8. (in Russian)].
- Барсегян Е.Р., Зоркин С.Н. Сравнительная оценка результативности применения различных полимеров при эндоскопической коррекции пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2014(5):4-8. [Barsegyan E.R., Zorkin S.N. Sravnitelnaya otsenka rezultativnosti primeneniya razlichnyih polimerov pri endoskopicheskoy korrektsii puzyirno-mochetochnikovogo reflyuksa u detey. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2014(5):4-8. (in Russian)].
- Осипов И.Б., Лебедев Д.А., Левандовский А.Б. Эндоскопическое лечение пузырно-мочеточникового рефлюкса у детей. Учебное пособие для врачей. М.,: «Научный центр «Биоформ» 2006; 80 с. [Osipov I.B., Lebedev D.A., Levandovskiy A.B. Endoscopic treatment vesicoureteral reflux of children. A textbook for doctors. M.,: "Scientific Center" Bioform "2006; 80 p. (in Russian)].
- Alizadeh F, Mazdak H, Khorrami MH, Khalighinejad P, Shoureshi P, et al. Postoperative ureteral obstruction after endoscopic treatment of vesicoureteral reflux with polyacrylate polyalcohol copolymer (Vantris®). J Pediatr Urol 2013 Aug;9(4):488-92.
- Şencan A, Yildirim H, Ozkan KU, Basak Uçan, Karkıner A, Hoşgor M. Late ureteral obstruction after endoscopic treatment of vesicoureteral reflux with polyacrylate polyalcohol copolymer. Ped Urology 2014;84(5):1188-93.
- NASHА ТМ – The monograph. Q-Med AB. Sweden, Uppsala 2008; 28 p.
- Kocherov S, Nikolaev S, Gaber G et al. Incidence of UVJ obstruction during long-term follow-up after endoscopic correction of VUR utilizing polyacrylate polyalcohol copolymer (PPC). J Ped End Surg 2020(2):183-7.
- Elzayat EA, Karsenty G, Bismar TA, et al. Volume changes and histological response to injected dextranomer/hyaluronic acid copolymer (Zuidex) and collagen (Contigen) in rats. Int Urogynecol J Pelvic Floor Dysfunct 2008 Feb;19(2):247-52.
- Sabetkish S, Mohseni MJ, Sabetkish N, Kajbafzadeh AM. Local tissue reaction and histopathological characteristics of three different bulking agents: a rabbit model. Int Braz J Urol 2021;47(2):322-32.
- Inoue K, Nakamoto T, Usui A, Usui T. Evaluation of antibody class in responce to endoscopic subureteral collagen injection in patients with vesicoureteral reflux. J Urol Baltimore 2001;165(2):555-8.
- Christensen LH, Nielsen JB, Mouritsen L, Sorensen M, Lose G. Tissue Integration of Polyacrylamide Hydrogel: An Experimental Study of Periurethral, Perivesical, and Mammary Gland Tissue in the Pig. Dermatol Surg 2008;34(1):68-77.
- Abid HA, Almarzooqi S. Pathological changes associated with DEFLUX use in vesicoureteric reflux. Int J Case Rep Images 2019(10):101044Z01HA2019.
- Kazuto S, Yanai T, Kawakami H, et al. Deterioration of autoimmune condition associated with repeated injection of dextranomer/hyaluronic acid copolymer: A case report. J Ped Surg Case Rep 2016(4):10-2.
- Rayahin JE, Buhrman JS, Zhang Y, Koh TJ, Gemeinhart RA. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater Sci Eng 2015;1(7):481-93.
- Rubenwolf PC, Ebert AK, Ruemmele P, Ruemmele P, Rosch WH. Delayed-onset ureteral obstruction after endoscopic dextranomer/hyaluronic acid copolymer (Deflux) injection for treatment of vesicoureteral reflux in children: a case series. Urology 2013;81(3):659-62.
- Stenberg A, Larsson E, Lackgren G. Endoscopic treatment with dextranomer-hyaluronic acid for vesicoureteral reflux: histological findings. J Urol 2003;169(3):1109-13.
- Życzkowski M, Prokopowicz G, Zajęcki W, Paradysz A. Complications following endoscopic treatment of vesicoureteric reflux with Deflux® – two case studies. Centr Eur J Urol 2012;65(4):230-1.
- Nepple KG, Knudson MJ, Cooper CS, Austin JC. Symptomatic calcification of subureteral collagen ten years after injection. Urology 2007;69(5):982.e1-2.
- Ферапонтов Н.Б., Токмачев М.Г., Гагарин А.Н. и соавт. Влияние свойств полимеров на условия их набухания в воде и в водных растворах. Сорбционные и хроматографические процессы 2014;14(5):795-812. [Ferapontov N.B., Tokmachev M.G., Gagarin A.N. i soavt. Influence of properties polymers on the conditions of their swelling in water and in aqueous solutions. Sorbtsionnyie i hromatograficheskie protsessyi = Sorption and chromatography processes 2014;14(5):795-812. (in Russian)].
- Liu T, Jiao C, Peng X, Chen YN, Chen Y, He C. et al. Super-strong and tough poly(vinyl alcohol)/poly(acrylic acid) hydrogels reinforced by hydrogen bonding. J Mater Chem B 2018(6):8105-14.
- Byun H, Hong B, Nam SY, et al. Swelling Behavior and Drug Release of Poly (vinyl alcohol) Hydrogel Cross-Linked with Poly(acrylic acid). Macromol Res 2008;16(3):189-93.
- Cheng Н, Hu Y, Xu M, Qin M, Lan W, Huang D, et al. High strength Polyvinyl alcohol/Polyacrylic acid (PVA/PAA) hydrogel fabricated by Cold-Drawn method for cartilage tissue substitutes. J Biomat Science, Polymer Edition 2020;31(14):1836-51.
- De Boulle K, Glogau R, Kono T, Nathan M, Tezel A, Roca-Martinez JX, et al. A review of the metabolism of 1,4-butanediol diglycidyl ether–crosslinked hyaluronic acid dermal fillers. Dermatol Surg 2013;39(12):1758-66.
- Khunmanee S, Jeong Y, Park H. Crosslinking method of hyaluronic-based hydrogel for biomedical applications. J Tissue Engin 2017(8):1–16.
- Lopatin VV, Askadskii AA. Influence of the preparation mode on structure and properties of gels based on poly(acrylamide). Russ Polymer News 2003;8(3):47-53.
- Lopatin VV, Askadskii AA, Peregudov AS. Spectral analysis of water gels based on poly(acrylamide) prepared by different ways. Russ Polymer News 2003;8(4):8-14.
- Lapasin R, Segatti F, Mercuri D, et al. Rheological studies dedicated to the development of a novel injectable polymeric blend for viscosupplementation treatment. Chem Biochem Eng Q. 2015;29(4):511–18.
- EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4.
- Ormaechea M, Paladini M, Pisano R. Vantris®, a biocompatible, synthetic, non-biodegradable, easy-to-inject bulking substance: evaluation of local tissular reaction, localized migration and long-distance migration. Arch Esp Urol 2008;61(2):263-8.
- Меновщикова Л.Б., Коварский С.Л., Николаев С.Н. и соавт. Использование нового объемообразующего синтетического материала Вантрис для лечения первичного пузырно-мочеточникового рефлюкса у детей. Детская хирургия 2012(4):12-5. [Menovschikova L.B., Kovarskiy S.L., Nikolaev S.N. i soavt. Use new bulking synthetic material Vantris for treatment of primary vesicoureteral reflux in children. Children surgery. Detskaya hirurgiya = Russian journal of Pediatric Surgery 2012(4):12-5. (in Russian)].
- Capozza N, Nappo S, Caione P. Endoscopic treatment of vesicoureteral reflux in the previously reimplanted ureter: technical aspects and results. Arch Esp Urol 2008;61(2):249-253.
- Kim SW, Lee YS, Han SW. Endoscopic injection therapy. Investig Clin Urol 2017;58(1):38-45.
- Nakamura S, Tanabe K, Hyuga T, Kubo T, Inoguchi S, Kawai S, et al. Mid-Term Safety and Efficacy of the Modified Double Hydrodistention Implantation Technique (HIT), Termed Systematic Multi-Site HIT (SMHIT), for Patients with Primary Vesicoureteral Reflux. Res Rep Urol 2020(12):517-25.


