Эндоскопическая резекция соматостатиномы ампулы большого дуоденального сосочка под контролем ультразвукового исследования у больной с наследственным нейрофиброматозом
Автор: Тавобилов Михаил Михайлович, Карпов Алексей Андреевич, Коржева Ирина Юрьевна, Паклина О.В., Сетдикова Галия Равилевна, Шабунин Алексей Васильевич, Бедин Владимир Владимирович, Бурдюков Михаил Сергеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
Описание клинического случая. Пациентка В., 50 лет, страдающая наследственным нейрофиброматозом 1-го типа, обратилась в ГКБ им. С.П. Боткина в связи с выявленным образованием в проекции большого дуоденального сосочка (БДС). Проведена папилэктомия с последующим морфологическим и иммуногистохимическим исследованием. Обсуждение. Частота встречаемости соматостатиномы составляет около 1 случая на 40 млн. человек. Сочетание нейрофиброматоза 1-го типа и соматостатиномы именно ампулы БДС исчисляется единицами. Благодаря визуализации распространения опухоли во всех слоях стенки кишки и БДС посредством эндосонографии появилась возможность выполнять радикальные эндохирургические операции. выводы. Применение органосберегающих эндоскопических резекционных вмешательств у больных с сочетанием наследственного нейрофиброматоза и соматостатиномы ампулы большого дуоденального сосочка малых размеров может служить альтернативой панкреатогастродуоденальной резекции.
Соматостатинома, нейрофиброматоз 1-го типа, эндоскопическая резекция, эндосонография
Короткий адрес: https://sciup.org/140254100
IDR: 140254100 | УДК: 616.37-006+616-006.38.03-056.7]-072.1-089-073.48 | DOI: 10.21294/1814-4861-2017-16-1-98-103
Текст научной статьи Эндоскопическая резекция соматостатиномы ампулы большого дуоденального сосочка под контролем ультразвукового исследования у больной с наследственным нейрофиброматозом
Нейроэндокринные опухоли (НЭО) являются редко встречающимися новообразованиями, ежегодно выявляется 1–4 случая на каждые 100 тыс. человек [1]. Нейроэндокринные опухоли желудочно-кишечного тракта (ЖКТ) диагностируются у больных любого возраста, но наиболее часто на пятом десятке жизни [2]. Lanhans впервые описал карциноидную опухоль тонкой кишки в 1867 году. Классификация гормонпродуцирующих опухолей двенадцатиперстной кишки (ДПК) основана на виде гормональной активности, потому как каждый из гормонов проявляется собственным клиническим синдромом. Около 70 % НЭО рас- положены в тонкой кишке, из них 22 % – в ДПК. По классификации ВОЗ 2010 года эти опухоли относятся к группе grade 1 или 2 НЭО (или же карциноиды) и отделены от низкодифференцированных нейроэндокринных карцином grade 3. Высокодифференцированные опухоли двенадцатиперстной кишки составляют около 2,6 % от общего числа НЭО. Карциноиды двенадцатиперстной кишки (ДПК) являются, как правило, гормонально неактивными опухолями [3].
Соматостатинома – редкая опухоль, возникающая, как правило, в поджелудочной железе (ПЖ) или ДПК с частотой 1 случай на 40 млн человек.
Впервые панкреатическая соматостатинома описана Larsson в 1977 году, и начиная с этого момента появились сообщения лишь о 200 заболевших [4]. Соматостатин продуцирующие опухоли дают начало соматостатин ассоциированному ингибирующему синдрому, впервые описанному Kreijs в 1979 году [1]. Классический соматостатиновый синдром включает триаду признаков: сахарный диабет, холедохолитиаз, стеаторрею (иногда в сочетании с гипо- или ахлоргидрией) и проявляется с увеличением размера опухоли. Соматостатиномы ДПК зачастую ассоциированы с нейрофиброматозом 1-го типа (НФ 1) и крайне редко метастазируют [5].
В представленном клиническом случае доопе-рационный диагноз был до конца не ясен.
Пациентка В., 50 лет, страдающая наследственным нейрофиброматозом 1-го типа, обратилась в ГКБ им. С.П. Боткина в связи с выявленным образованием в проекции большого дуоденального сосочка (БДС) в ходе подготовки для планового оперативного лечения по поводу кистозного поражения яичников. По данным МРТ (рис. 1) и УЗИ брюшной полости визуализировано образование в проекции БДС, размером до 2 см, при этом отмечались признаки билиарной и панкреатической гипертензии (холедох диаметром до 17 мм, долевые печеночные протоки – до 7,5 мм, главный панкреатический проток (ГПП) в головке – до 7,5 мм, в теле – 5 мм, в хвосте – 1,5 мм). Обращало на себя внимание повышение ферментов холестаза (гамма-глутаминтрансфереза (ГГТ) – более 400 Ед/л, АСТ и АЛТ – до 130 Ед/л). Уровень опухолевых маркеров не превышал показателей нормы. По данным рентгенографии органов грудной клетки очаговых поражений легких не выявлено.
Стандартным исследованием пациентов с подозрением на НЭО является ПЭТ с 18F-флюрин-флюоро-2-деоксиглюкозой, ПЭТ с 68Gа, сцинтиграфия с меченным октреотидом («Octreoscan», Октреоскан) [6], но выполнение этих исследований в наших условиях было невозможно по техническим причинам.
С учетом наличия признаков объемного образования БДС было решено выполнить дуоденоскопию (рис. 2), эндо-УЗИ с тонкоигольной биопсией. По данным эндо-УЗИ (рис. 3), в ампуле БДС определялось объемное образование размером до 20 мм, стенка ампулы БДС толщиной до 5 мм, отмечалось нарушение дифференцировки слоев. Объемное образование инфильтрировало слизистый и подслизистый слои, мышечный слой был свободен от опухолевых масс. Холедох расширен до 17 мм. ГПП диаметром 7,5 – 5,0 – 1,5 мм соответственно.
Больная обсуждена на консилиуме, после чего было решено выполнить эндоскопическую папил-лэктомию под контролем эндо-УЗИ, с симультанным стентированием Вирсунгова протока и холедоха с целью предупреждения развития
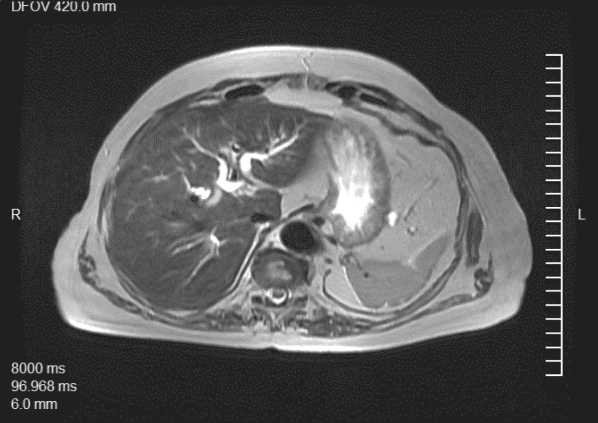
Рис. 1. МРТ брюшной полости (билиарная гипертензия)
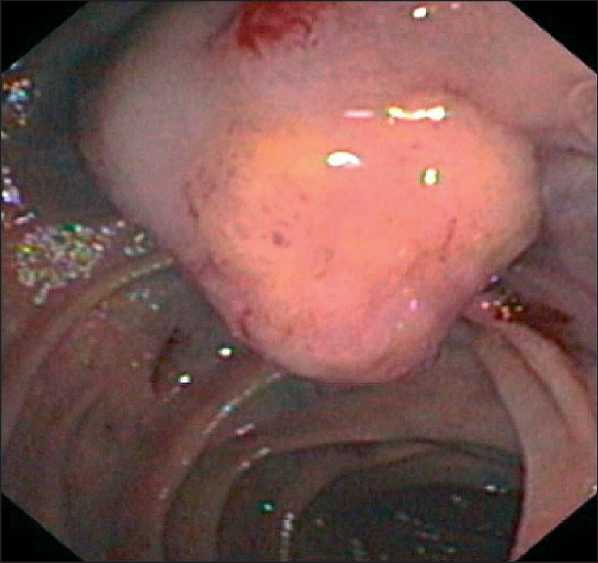
Рис. 2. Видеодуоденоскопия. Новобразование БДС
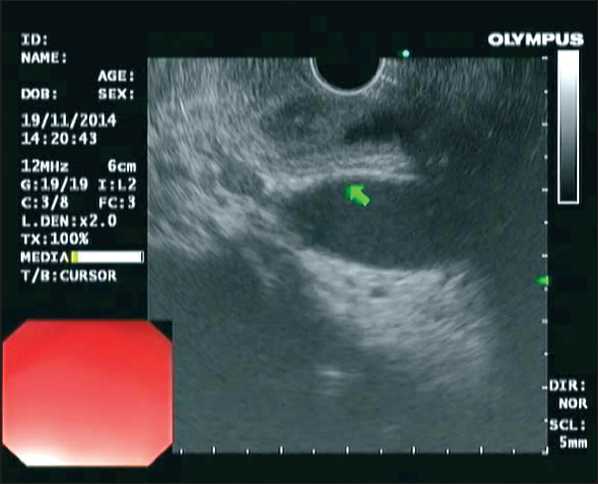
Рис. 3. Эндосонография. Новообразование БДС
острого панкреатита и стеноза терминального отдела холедоха. В послеоперационном периоде осложнений не отмечено.
При микроскопическом исследовании опухоль представляла собой разрастания тубуло-железистых структур в слизистом, подслизистом и мышечном слоях. Опухолевый рост имел диффузный характер, без тенденции к формированию узла (рис. 4). Опухолевые клетки с мелкозернистой эозинофильной цитоплазмой и центральнорасположенным округлым ядром, с равномерно распределенным хроматином в виде «соль и перец». Строма опухоли коллагеновая с псаммомными тельцами (рис. 5). Митотическая активность низкая, одна фигура митоза в 10 ПЗ. В крае резекции опухолевого роста нет (R0). При иммуногистохимическом исследовании отмечалась диффузная положительная реакция с синаптофизином (рис. 6), хромогранином А, соматостатином (рис. 7) и отрицательная реакция с инсулином, глюкагоном, гастрином, серотонином. Индекс мечения с Ki67 не
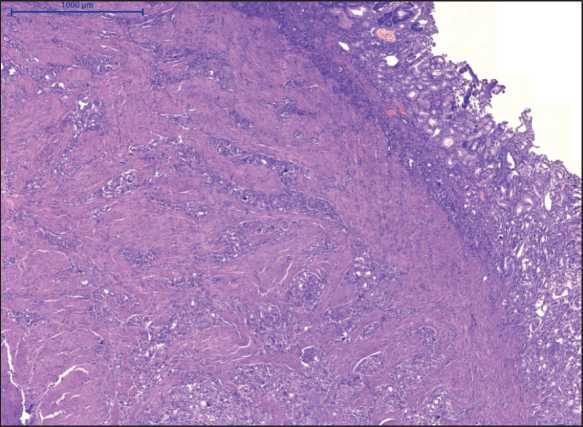
Рис. 4. Микрофото. Разрастания тубуло-железистых структур в слизистом, подслизистом и мышечном слоях стенки ДПК, без формирования опухолевого узла. Окраска гематоксилином и эозином, ×100
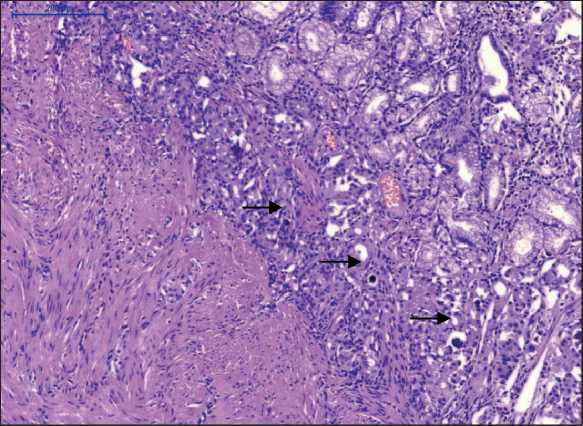
Рис. 5. Микрофото. Псаммомные тельца, обозначены стрелкой. Окраска гематоксилином и эозином, ×200
превышал 2 %. Гистологическое заключение: высокодифференцированная нейроэндокринная опухоль (grade 1) ампулярной области, функциональный тип (соматостатинома). Опухоль инфильтрирует слизистый, подслизистый и мышечный слои, размером 1,5 см (рТ2). В крае резекции опухолевого роста нет (R0).
Через две недели после оперативного вмешательства пациентке была выполнена контрольная дуоденоскопия с щипковой биопсией. При осмотре поверхности резекции визуализирован эпителизи-рующийся язвенный дефект, стенты из холедоха и ГПП удалены. При повторном гистологическом исследовании в крае резекции опухолевых клеток не обнаружено.
Обсуждение
Как правило, карциноиды ДПК в большинстве своем представляют собой НЭО низкой степени злокачественности [7]. Термин «нейроэндокринные» основывается на схожей с нервными клетками экспрессии этими опухолевыми клетками специфических белков (синаптофизин, нейроспе-цифическая енолаза, хромогранин А). Эти опухоли берут свое начало из энтерохромаффинных клеток желудочно-кишечного тракта (ЖКТ). ЖКТ содержит до 14 различных типов эндокринных клеток, включая энтерохромаффинные клетки, которые и ассоциируются с карциноидными опухолями. Как правило, карциноидные опухоли ДПК – это нефункционирующие, единичные, хорошо дифференцированные и медленно растущие образования. До 22 % НЭО тонкой кишки представлены образованиями начальных отделов ДПК. Эндоскопически на ранних стадиях они представляют собой полиповидные разрастания. Клинически могут проявлять себя болевым синдромом, тошнотой, рвотой, кровотечениями. Большинство пациентов не имеют отдаленных метастазов. Для сомато-статиномы ДПК соматостатин-ассоциированный синдром может присутствовать только при образованиях более 4 см [8, 9].
Частота встречаемости соматостатиномы составляет около 1 случая на 40 млн человек с медианой возраста возникновения около 50 лет. НФ 1-го типа, известный также как болезнь фон Реклин-
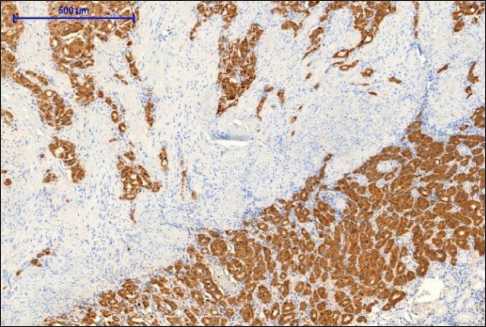
Рис. 6. Микрофото. Иммуногистохимическое исследование. Выраженная диффузная реакция с синаптофизином, ×200
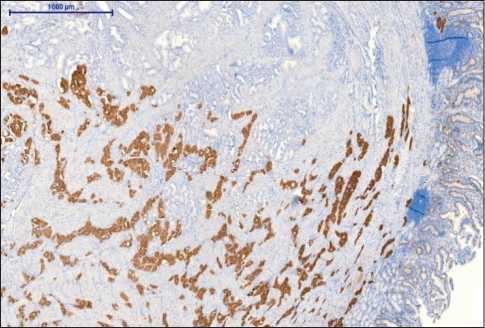
Рис. 7. Микрофото. Иммуногистохимическое исследование. Выраженная диффузная реакция с соматостатином, ×100
гаузена, – аутосомно-доминантное заболевание с частотой около 1 на 3 000 рождающихся. Пери-ампуллярные нейрофибромы и НЭО сопутствуют этому заболеванию. При этом число пациентов с сочетанием НФ 1 и соматостатиномой именно ампулы БДС исчисляется единицами [12].
За последние 35 лет, благодаря новым визуа-лизационным возможностям, совершенствованию лабораторной диагностики, а также техники выполнения эндоскопических исследований рост выявляемости НЭО составил до 500 %. При этом 5-летняя выживаемость больных с НЭО выросла на 20 %, с соматостатиномами – на 60 %, продолжительность жизни больных без метастазов в печень и лимфоузлы – на 100 % [2]. При использовании современной эндоскопической техники выявляются НЭО небольшого размера. Наиболее точным диагностическим методом является эндоУЗИ, который позволяет выявить вовлечение слоев стенки ДПК [13].
Пока нет единой хирургической тактики, касающейся лечения НЭО. В литературе описаны единичные случаи, когда больные с сочетанием НФ 1 и соматостатиномы ДПК были прооперированы в объеме панкреатогастродуодельной резекции (ПГДР), но с учетом особенности патоморфологии,
Список литературы Эндоскопическая резекция соматостатиномы ампулы большого дуоденального сосочка под контролем ультразвукового исследования у больной с наследственным нейрофиброматозом
- Krejs G.J., Orci L., Conlon J.M., Ravazzola M., Davis G.R., Ras-kin P., Collins S.M., McCarthy D.M., Baetens D., Rubenstein A., Aldor T.A., Unger R.H. Somatostatinoma syndrome. Biochemical, morphologic and clinical features. N Engl J Med. 1979 Aug 9; 301 (6): 285-92
- Oller B., Haetta H.H., Lorenzo-Zúñiga V., Julián J.F., de Vega V.M., Fernández-Llamazares J., Boix J. Double somatostatinoma and double papillectomy in a patient with type 1 neurofibromatosis (von Recklinghausen’s disease) Endoscopy. 2012; 44 Suppl 2 UCTN: E344-5. DOI: 10.1055/s-0032-1309912
- Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO Classification of Tumor of the Digestive System. Lyon, IARC Press. 2010; 417 p
- Williamson J.M., Thorn C.C., Spalding D., Williamson R.C. Pancreatic and peripancreatic somatostatinomas. Ann R Coll Surg Engl. 2011 Jul; 93 (5): 356-60. DOI: 10.1308/003588411X582681
- Bhandari R., Riddiough G., Lokan J., Weinberg L., Efthymiou M., Nikfarjam M. Somatostatinoma of the minor papilla treated by local excision in a patient with neurofibromatosis type 1. JOP. 2015 Jan 31; 16 (1): 81-4. DOI: 10.6092/1590-8577/2906


