Эндоваскулярная окклюзия ушка левого предсердия при фибрилляции предсердий: современные представления и перспективы (обзор)
Автор: Канорский С. Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Несмотря на все более широкое применение эндоваскулярной окклюзии ушка левого предсердия (ЭОУЛП) в практике лечения пациентов с фибрилляцией предсердий (ФП), выбор оптимальной тактики выполнения процедуры, особенно последующей антитромботической терапии, остается малоизученным. Настоящий обзор проведен с целью критической оценки современных представлений о безопасности и эффективности ЭОУЛП при ФП. Обсуждены результаты важнейших клинических исследований ЭОУЛП у пациентов с ФП, положения действующих клинических рекомендаций по проведению этой процедуры. Рассмотрены доступные данные о возможностях антитромботической терапии после ЭОУЛП, перспективы будущих исследований в устранении пробелов в доказательной базе данной методики.
Фибрилляция предсердий, ушко левого предсердия, эндоваскулярная окклюзия ушка левого предсердия, пероральная антикоагулянтная терапия, антитромбоцитарная терапия, тромбообразование на устройстве
Короткий адрес: https://sciup.org/149144442
IDR: 149144442 | УДК: 616.12 | DOI: 10.29001/2073-8552-2023-38-4-46-54
Текст обзорной статьи Эндоваскулярная окклюзия ушка левого предсердия при фибрилляции предсердий: современные представления и перспективы (обзор)
Фибрилляция предсердий (ФП) является наиболее часто встречающейся устойчивой аритмией сердца, которая диагностирована у более чем 60 млн жителей нашей планеты, и ее распространенность неуклонно возрастает по мере старения населения [1]. По сравнению с синусовым ритмом ФП в 3–5 раз увеличивает риск кардиоэмболического ишемического инсульта, отличающегося тяжестью поражения и неблагоприятным прогнозом [2]. При высоком риске тромбоэмболии у больных с ФП (показатель CHA2DS2-VASc ≥ 2 баллов у женщин и ≥ 1 балла у мужчин) показана пожизненная пероральная антикоагулянтная терапия (oral anticoagulation therapy – ОАТ) [3]. Однако ее проведение, кроме неоптимальной приверженности пациентов, затрудняют геморрагические осложнения, когнитивные нарушения, медикаментозная аллергия, лекарственные взаимодействия, тяжелое нарушение функции почек, опасения врачей по поводу падений и выраженной хрупкости больных. Эти ситуации создали потребность в эффективной и безопасной немедикаментозной терапии для профилактики инсульта у пациентов с ФП.
Данные чреспищеводной эхокардиографии и патологоанатомических исследований у пациентов с неклапанной ФП об образовании тромбов в ушке левого предсердия (УЛП) способствовали расширению применения методик его окклюзии. Кроме эндоваскулярной окклюзии (ЭО) УЛП возможны хирургическое наложение швов, сшивание скобами и ампутация УЛП, но первая процедура получила наибольшее распространение [4, 5]. Окклюзия УЛП может рассматриваться у пациентов с ФП, нуждающихся в профилактике тромбоэмболии, которые имеют противопоказания к ОАТ [3, 6] (табл. 1).
Таблица 1. Международные рекомендации по закрытию ушка левого предсердия
Table 1. International recommendations for the closure of the left atrial appendage
|
Рекомендации Recommendations |
Класс рекомендаций Class of Recommendation |
Уровень доказательства Level of Evidence |
|
2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation [6] |
||
|
После хирургической окклюзии или иссечения УЛП рекомендуется продолжать антикоагулянтную терапию у пациентов с ФП из группы риска для профилактики инсульта After surgical occlusion or exclusion of the LAA, it is recommended to continue anticoagulation in at-risk patients with AF for stroke prevention |
I |
B |
|
Окклюзию УЛП можно рассматривать для профилактики инсульта у пациентов с ФП и противопоказаниями к длительному приему антикоагулянтов (например, у тех, у кого ранее было опасное для жизни кровотечение без обратимой причины) LAA occlusion may be considered for stroke prevention in patients with AF and contraindications for long-term anticoagulant treatment (eg, those with a previous lifethreatening bleed without reversible cause) |
IIb |
B |
|
Хирургическую окклюзию или иссечение УЛП можно рассматривать для профилактики инсульта у пациентов с ФП, подвергающихся операции на сердце Surgical occlusion or exclusion of the LAA may be considered for stroke prevention in patients with AF undergoing cardiac surgery |
IIb |
B |
|
Хирургическую окклюзию или иссечение УЛП можно рассматривать для профилактики инсульта у пациентов, подвергающихся торакоскопической операции при ФП Surgical occlusion or exclusion of the LAA may be considered for stroke prevention in patients undergoing thoracoscopic AF surgery |
IIb |
B |
|
2020 European Society of Cardiology Guidelines for the Management of Atrial Fibrillation [3 |
] |
|
|
Окклюзию УЛП можно рассматривать для профилактики инсульта у пациентов с ФП и противопоказаниями к длительной ОАТ (например, с внутричерепным кровотечением без обратимой причины) LAA occlusion may be considered for stroke prevention in patients with AF and contraindications for long-term anticoagulant treatment (eg, intracranial bleeding without a reversible cause) |
IIb |
B |
|
Хирургическую окклюзию или иссечение УЛП можно рассматривать для профилактики инсульта у пациентов с ФП, подвергающихся операции на сердце Surgical occlusion or exclusion of the LAA may be considered for stroke prevention in patients with AF undergoing cardiac surgery |
IIb |
C |
Примечание: ОАТ – пероральная антикоагулянтная терапия, УЛП – ушко левого предсердия, ФП – фибрилляция предсердий.
Note: ACC – American College of Cardiology AHA – American Heart Association, HRS – Heart Rhythm Society, OAT – oral anticoagulant therapy.
Несмотря на все более широкое применение ЭО-УЛП в клинической практике, выбор оптимальной тактики выполнения процедуры, особенно последующей антитромботической терапии, остается малоизученным. Настоящий обзор проведен с целью критической оценки современных представлений о безопасности и эффективности ЭОУЛП у пациентов с ФП, перспектив будущих исследований в устранении пробелов в доказательной базе данной методики.
Доказательная база эндоваскулярной окклюзии ушка левого предсердия
Хирургическое закрытие УЛП с использованием нескольких методов сопровождалось уменьшением частоты ишемического инсульта и системной эмболии у пациентов с ФП, которые продолжали получать ОАТ [7]. Между тем эффективность такого вмешательства для профилактики ишемического инсульта у пациентов с ФП, не принимающих ОАТ, остается недоказанной.
Разработано несколько моделей устройств для ЭО-УЛП, но только устройства Watchman (Boston Scientific) в 2015 г. и Amulet (Abbott) в 2021 г. были одобрены The
United States Food and Drug Administration для профилактики инсульта без длительного приема ОАТ и активно оцениваются в клинических исследованиях [4] (рис. 1).
Проведены два рандомизированных клинических исследования, в которых сопоставлялись безопасность и эффективность ЭОУЛП с помощью устройства Watchman и ОАТ варфарином – PROTECT-AF и PREVAIL [8, 9]. Результаты обоих проектов продемонстрировали, что стратегия ЭОУЛП не уступала лечению варфарином в профилактике ишемического инсульта при среднем периоде наблюдения 3,8 года и 18 мес. соответственно. Метаанализ двух этих исследований ( n = 1114) с более длительным наблюдением (5 лет) подтвердил не уступающую ОАТ эффективность ЭОУЛП в отношении комбинированной конечной точки – инсульт, системная эмболия и сердечно-сосудистая смерть со статистически значимым превосходством, благодаря снижению частоты опасных кровотечений, главным образом, внутричерепных кровоизлияний [10]. Однако оба рандомизированных исследования проводились с участием пациентов без противопоказаний к ОАТ, что в настоящее время является основным показанием к ЭОУЛП.
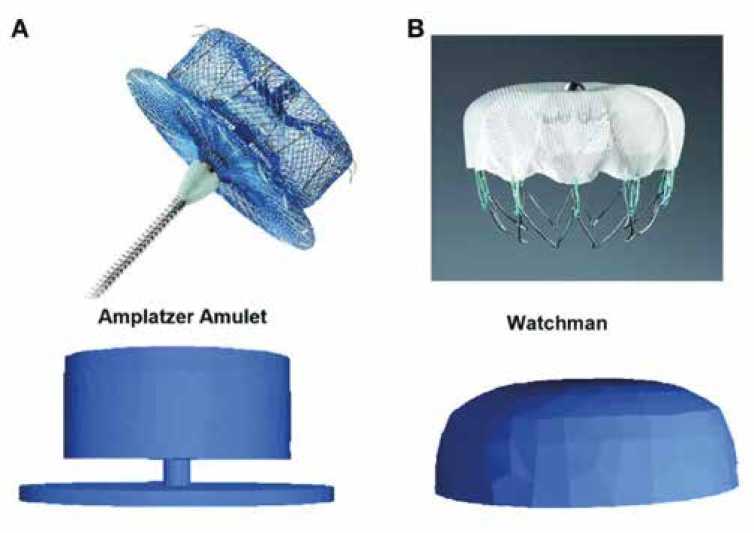
Рис. 1. Устройства Amplatzer Amulet (А) и Watchman (В) для окклюзии ушка левого предсердия, принципы их действия (внизу) Fig. 1. Amplatzer Amulet (A) and Watchman (B) devices for left atrial appendage occlusion, how they work (below)
В последующем международном многоцентровом регистре EWOLUTION были собраны данные о 1020 пациентах, подвергавшихся ЭОУЛП с имплантацией окклюде-ра Watchman; 73% этих больных имели противопоказания к ОАТ и не получали ее. Нежелательные явления, связанные с процедурой, регистрировались у 2,3% пациентов, что значительно меньше, чем в PROTECT-AF и PREVAIL. По данным однолетнего наблюдения в EVOLUTION, сообщалось о частоте смертельного исхода 9,8% и ишемического инсульта – 1,1% пациентов при использовании окклюдера Watchman (относительное снижение риска инсульта на 84% по сравнению с оценочными историческими данными) [11].
Устройство AmplatzerТМ, использовавшееся для ЭО-УЛП в итальянском регистре у 613 пациентов высокого риска (средний балл CHA2DS2-VASc 4,2, средний балл HAS-BLED 3,2), обеспечивало выраженный успех процедуры, адекватный профиль безопасности и эффективности со снижением риска ишемического инсульта или транзиторной ишемической атаки на 66% и больших кровотечений – на 40% по сравнению с ожидаемой частотой этих событий по показателям риска тромбоэмболии и кровотечений [12]. Последующий регистр имплантации устройства Amulet, представляющего собой модификацию Amplatzer, проведенный с участием 1088 пациентов, из которых 83% имели противопоказания к OAT, а 72% перенесли большие кровотечения, подтвердил эти данные. В нем успех процедуры достигался в 99% случаев, частота ишемического инсульта составляла 2,9% в год при низкой частоте тромбообразования на устройстве (TНУ) – 1,7% [13].
В большинстве наблюдательных исследований собирались данные о пациентах с «противопоказаниями к ОАТ», предполагая применение пероральных антагонистов витамина К. Однако наличие противопоказаний к этим препаратам не обязательно исключает применение прямых пероральных антикоагулянтов (ПOAК), которые отличаются более высокой безопасностью. Поэтому существует очевидная необходимость сравнения ПOAК и ЭОУЛП у больных с ФП, особенно учитывая, что пациенты с очень высоким риском кровотечения (с очень низкими показателями гемоглобина или тромбоцитов, с тяжелой почечной недостаточностью) исключались из регистрационных исследований ПOAК фазы III.
В исследовании PRAGUE-17 402 пациента с высоким риском тромбоэмболии и геморрагии (средние показатели CHA2DS2-VASc – 4,7 балла, HAS-BLED – 3,1 балла) рандомизировали в отношении 1 : 1 для ЭОУЛП или OAT с использованием ПOAК. Показана не меньшая эффективность интервенционной стратегии ЭОУЛП по сравнению с ПOAК в предотвращении суммы событий первичной конечной точки – инсульт, транзиторная ишемическая атака, системная эмболия, сердечно-сосудистая смерть, клинически значимое кровотечение (относительный риск – ОР 0,81 при 95% доверительном интервале – ДИ 0,56–1,18; p < 0,0006). ЭОУЛП также ассоциировалась со значительным снижением частоты клинически значимых непроцедурных кровотечений (ОР 0,55 при 95% ДИ 0,31–0,97; р < 0,039) [14]. Однако это исследование не имело статистической мощности для оценки влияния лечения на риск тромбоэмболических осложнений.
Многочисленные нерандомизированные исследования подтверждали эффективность ЭОУЛП в снижении риска ишемического инсульта и большого кровотечения [15]. Однако эти наблюдательные проекты имели ряд ограничений: использование гетерогенных конечных точек, отсутствие контрольной группы и косвенно полученные выводы об эффективности путем сравнения частоты ишемических и геморрагических осложнений с их прогнозом по показателям CHA2DS2-VASc и HAS-BLED соответственно. Эти данные не обеспечили уровень доказательств, необходимый для широкого принятия ЭО-УЛП в качестве основного метода профилактики инсульта при ФП.
Совокупность имеющихся данных позволяет предположить, что ЭОУЛП не уступает ОАТ у тщательно отобранных пациентов с неклапанной ФП. Однако остаются основания для сомнений. Во-первых, отсутствуют убедительные доказательства, подтверждающие возможный механизм действия ЭОУЛП – уменьшение кардиоэмболии вследствие исключения полости УЛП из системного кровообращения. Действительно, частота ишемического инсульта / системной эмболии была выше в группе устройств в PROTECT AF и PREVAIL (ОР 1,7; р = 0,08), но уравновешивалась снижением риска геморрагического инсульта (ОР 0,2; р = 0,0022) [10]. Ответа на вопрос – устраняет ли ЭОУЛП источник эмболии или просто уменьшает риск кровотечений, связанных с длительной ОАТ, – еще нет. Во-вторых, редкость тромбоэмболических осложнений в завершенных исследованиях вызывает некоторую обеспокоенность по поводу надежности их выводов, требуя проведения более крупных исследований для убедительного подтверждения пользы ЭОУЛП. Ожидаемая частота тромбоэмболий на основе исторического прогноза с учетом шкалы CHA2DS2-VASc может переоценивать риск ишемического инсульта в современной практике [16]. В-третьих, в завершенных исследованиях ЭОУЛП участвовали только пациенты, считавшиеся кандидатами на кратковременную ОАТ после процедуры. Пока отсутствуют данные рандомизированных исследований ЭОУЛП у пациентов с ФП и абсолютными противопоказаниями к ОАТ.
Каким больным показана эндоваскулярная окклюзия ушка левого предсердия?
В настоящее время основные международные рекомендации едины в том, что применение ЭОУЛП показано пациентам с ФП и риском по CHA2DS2-VASc ≥ 2 балла у мужчин или ≥ 3 балла у женщин, а также с абсолютным противопоказанием к OAT из-за высокого риска кровотечения или ее непереносимости [3, 6]. В случае высокого риска кровотечения, например, из-за предшествующего внутричерепного кровоизлияния, пороков развития сосудов головного мозга, церебральных новообразований, ангиодисплазии, воспалительных заболеваний кишечника с признаками кровотечения, рецидивирующей анемии во время ОАТ, гематологических заболеваний с повышенным риском кровотечения, хронической болезни почек в стадии преддиализа или диализа можно рассмотреть проведение ЭОУЛП с целью предупреждения тромбоэмболии по причине ФП без создания риска большого ятрогенного кровотечения [3, 5].
Церебральные или системные тромбоэмболические события в анамнезе при терапии ОАТ в правильной дозировке (в случае ПOAК) или с международным нормализованным соотношением в терапевтическом диапазоне (в случае варфарина) могут представлять собой дополнительное показание к ЭОУЛП [3, 5]. Процедуру ЭОУЛП можно рассматривать как альтернативу OAT даже у пациентов с недостаточной приверженностью к ОАТ, особенно при наличии высокого риска тромбоэмболии по CHA2DS2-VASc. В любом случае, предполагая возможность выполнения ЭОУЛП, следует информировать пациента о преимуществах и рисках процедуры, учитывать его предпочтения. Продолжающиеся крупные рандомизированные исследования у больных с ФП предоставят дополнительные надежные данные о безопасности и эффективности ЭОУЛП по сравнению со стандартной ОАТ с применением ПOAК (CHAMPION-AF, ClinicalTrials. gov Identifier: NCT 04394546; CATALYST, ClinicalTrials.gov Identifier: NCT 04226547; STROKE-CLOSE, ClinicalTrials. gov Identifier: NCT 02830152).
Тромбоз, связанный с окклюдером ушка левого предсердия
В наблюдательных и рандомизированных исследованиях частота TНУ после ЭОУЛП составляла от 1,7 до 3,8% [14, 17–20]. Данное осложнение ассоциировалось с 3–5-кратным увеличением риска инсульта и системной эмболии [18, 19, 21, 22]. Выявление предрасполагающих к ТНУ факторов риска имеет важное значение, но эта задача сложна из-за большого количества потенциально влияющих факторов и низкой частоты таких осложнений в целом [23]. Хотя отдельные исследования показали возможность предупреждения ТНУ с помощью ОАТ, остается несколько проблем. Во-первых, большинство пациентов, направляемых на ЭОУЛП, не являются подходящими кандидатами для стандартной пролонгированной ОАТ. Поэтому у них трудно разрешить противоречие между риском тромбоэмболических событий и риском большого кровотечения при ОАТ. Во-вторых, даже среди пациентов, получавших ОАТ, выявлялось ТНУ, которое ухудшало клинические исходы, включая повышение смертности [21, 22]. В-третьих, даже при разрешении ТНУ при ОАТ высока частота рецидивов (35% – при продолжении ОАТ, 50% – после ее прекращения) [24].
Между тем большинство инсультов после ЭОУЛП возникает у пациентов без ТНУ, поэтому его клиническая значимость изучена недостаточно [25]. Если ТНУ диагностируется при визуализации после ЭОУЛП, антикоагулянтная терапия должна быть продолжена. У пациентов, получающих двойную антитромбоцитарную терапию (ДАТ), она должна быть прекращена, и требуется назначить ОАТ [26]. Повторная визуализация с интервалом 45–90 дней может быть выполнена для оценки разрешения тромба с решением о возможности прекращения антикоагуляции. Компьютерная томография сердца и чреспищеводная эхокардиография имеют сопоставимую точность обнаружения ТНУ [4] и должны выбираться в соответствии с опытом медицинского персонала, учетом предпочтений пациента и его клинического профиля.
Нельзя исключить снижение актуальности ТНУ в будущем в результате модификации окклюдеров, например, благодаря использованию антитромботического покрытия устройства по аналогии с коронарными стентами. В сентябре 2023 г. The United States Food and Drug Administration одобрило окклюдер УЛП последнего поколения Watchman FLX™ Pro с покрытием, предназначенным для уменьшения ТНУ, обеспечения ускоренного заживления и эндотелизации поверхности устройства. Доклинические исследования показали, что полимерное покрытие обеспечивает снижение воспаления на 86% через 3 дня после процедуры, уменьшение тромбообра-зования на 70% через 14 дней и увеличение покрытия эндотелиальной тканью на 50% через 45 дней после процедуры [27]. Это устройство также доступно в новом варианте размера 40 мм, который позволит расширить спектр анатомии УЛП, поддающийся закрытию с помощью технологии Watchman.
Антитромботическая терапия после эндоваскулярной окклюзии ушка левого предсердия
В настоящее время рекомендуется проводить анти-тромботическую терапию в постпроцедурный период по крайней мере на время, необходимое для эндотелиза-ции устройства, которое, согласно патологоанатомическим исследованиям, может составлять до 3 мес. Тип оптимальной антитромботической терапии после ЭОУЛП, а также ее продолжительность остаются предметом дискуссий.
Как в PROTECT-AF, так и в PREVAL, после ЭОУЛП с использованием устройства Watchman пациенты принимали варфарин в сочетании с аспирином по 75 мг/сут в течение первых 45 дней, затем проводилась ДАТ аспирином и клопидогрелом по 75 мг/сут в течение 6 мес., а далее назначался прием аспирина по 325 мг/сут. При такой тактике частота геморрагических осложнений была высокой (>10% случаев за год), особенно в раннем послеоперационном периоде [10]. В период проведения ДAT частота кровотечений оказалась существенно ниже (0,6%) [10].
В метаанализе 10 когортных исследований ( n = 2440) показано, что лечение ПОАК после имплантации устройства Watchman было связано с уменьшением частоты больших кровотечений (ОР 0,52 при 95% ДИ 0,30–0,89) и всех кровотечений (ОР 0,38 при 95% ДИ 0,25–0,58) по сравнению с применением варфарина в течение 1,5– 12 мес. наблюдения. Однако частота тромбоэмболии (ишемический инсульт, транзиторная ишемическая атака или системная эмболия), смертности от всех причин, ТНУ и затеков вокруг устройства > 5 мм были сопоставимы между группами ПОАК и варфарина [28].
Согласно консенсусу European Heart Rhythm Association / European Association of Percutaneous Cardiovascular Interventions, режим OAT с применением ПOAК вместо варфарина может быть рассмотрен для пациентов, перенесших ЭОУЛП с имплантацией Watchman, без противопоказаний к OAT и высокого риска кровотечения. Пациентам с противопоказаниями к OAT в качестве альтернативы предлагается ДAT в течение 3–6 мес. независимо от типа устройства [5], и такая тактика после ЭОУЛП преобладает в реальной клинической практике. Однако данное положение не подтверждалось конкретными результатами рандомизированных исследований и представляет собой мнение экспертов.
Поскольку не выполняется крупных рандомизированных исследований, сравнивающих различные анти-тромботические стратегии после ЭОУЛП, назначение терапии для профилактики TНУ после процедуры основывается на собственных представлениях врача и на результатах многоцентровых регистров, проводившихся на ограниченном количестве пациентов, без строгой оценки событий или определения исходов. В реальной практике у пациентов с высоким риском кровотечения, как правило, избегают применения OAT, предпочитая схемы ДAT или антитромбоцитарной монотерапии (АМТ) различной продолжительности. Исключение затеков вокруг устройства или его тромбоза с помощью чреспищеводной эхокардиографии может быть полезным при выборе антитромботической терапии после имплантации. Прием аспирина предлагалось прекращать через 6– 12 мес. после ЭОУЛП, если для этого нет других конкретных показаний [29].
Данные о низкой тромбогенности устройств семейства Amplatzer [30 позволяют избежать применения OAT после имплантации и ограничить антитромботическую терапию антитромбоцитарными препаратами, варьируя ее продолжительность с учетом риска кровотечения у пациента. В регистре пациентов, получивших Amplatzer Amulet, отмечалось, что ДАТ не сопровождалась повышением частоты TНУ в сравнении с применением ПOAК. Более того, не наблюдалось повышенного риска ТНУ и в группе монотерапии аспирином (из-за особенно высокого риска кровотечения) [31]. С другой стороны, нет рандомизированных исследований, которые продемонстрировали бы, что АМТ столь же эффективна, как и ДАТ в отношении профилактики ишемических событий и TНУ. При этом па- циенты, получающие ДAT после имплантации окклюдера УЛП, по-видимому, имеют более высокий риск кровотечения по сравнению с АМТ [32]. Следовательно, оптимальная продолжительность и тип антитромбоцитарной терапии после ЭОУЛП остаются спорными и не подтверждены адекватными клиническими исследованиями.
Изучена возможность более полной защиты от TНУ при использовании ПОАК вместо ДAT за счет ослабления повышения уровня тромбина после процедуры имплантации. Так, в рандомизированном исследовании ADRIFT у 105 пациентов с ФП после ЭОУЛП в течение 3 мес. сопоставлялись лечение ривароксабаном в дозах 10 мг/сут или 15 мг/сут и ДАТ (аспирин 75 мг/сут и клопидогрел 75 мг/сут). Применение ривароксабана в обеих дозах ассоциировалось со снижением образования тромбина, но исследование не имело достаточной статистической мощности для оценки клинических исходов [33].
Развивается концепция сочетания ЭОУЛП с ОАТ для достижения оптимальной профилактики инсульта у больных с ФП. Она исходит из результатов рандомизированного исследования LAAOS III, в котором у пациентов с ФП, перенесших кардиохирургическое вмешательство, установлено превосходство хирургического закрытия УЛП вместе с ОАТ в сравнении с только ОАТ – снижение относительного риска ишемического инсульта или системной эмболии на 33% (ОР 0,67 при 95% ДИ 0,53–0,85; р = 0,001) [34]. Хотя данный подход ограничивается только пациентами, у которых может применяться длительная ОАТ, сама эта концепция подтвердилась в наблюдательном исследовании с участием 555 пациентов с ФП, получивших устройство Watchman. В нем применение половинных доз ПОАК в комбинации с аспирином в течение в среднем 13 мес. было связано со снижением частоты первичной комбинированной конечной точки (ТНУ, тромбоэмболия и большое кровотечение) – 1,0 против 9,5% (ОР 9,8 при 95% ДИ 2,3–40,7; р = 0,002) при «традиционном» лечении, состоявшем из аспирина и ПОАК в обычной дозе в течение первых 45 дней, затем ДАТ еще 6 мес. и далее АМТ аспирином [35].
У 262 пациентов с ФП после ЭОУЛП в течение 6 мес. оценивались безопасность и эффективность ривароксабана в сравнении с дабигатраном: частота TНУ составляла 1,9 и 8,2% ( р = 0,038) соответственно при сходном риске кровотечения [36]. Однако данные крупных рандомизированных исследований низких доз ПОАК в такой ситуации по-прежнему отсутствуют. У пациентов с наиболее высоким риском кровотечения даже низкая доза антикоагулянта может быть противопоказана, и ДAT может сопровождаться высокой частотой кровотечений. Поэтому требуется разработка стратегии антитромботи-ческой терапии после ЭОУЛП, которая обеспечивала бы высокий уровень безопасности в сочетании с адекватной эффективностью.
Ретроспективное многоцентровое итальянское исследование с участием 610 пациентов с ФП после ЭОУЛП продемонстрировало более низкий риск большого кровотечения при АМТ в сравнении с ДАТ – 2,9 против 6,7% (скорректированный ОР 0,37 при 95% ДИ 0,16–0,88; р = 0,024) без существенных различий частоты ишемических событий (ТНУ или серьезные нежелательные сердечно-сосудистые события) – 7,8 против 7,4% случаев (скорректированный ОР 1,34 при 95% ДИ 0,70–2,55; р = 0,38) соответственно [37].
С целью получения более достоверных данных об оптимальной антитромботической терапии после ЭОУЛП проводится многоцентровое рандомизированное исследование ARMYDA AMULET (ClinicalTrials.gov Identifier: NCT02879448), в ходе которого 1878 пациентов с ФП после ЭОУЛП рандомизированы 1 : 1 для получения ДАТ (аспирин и клопидогрел) в течение 3 мес., а затем только аспирина в течение еще 3 мес. или АМТ аспирином в течение 6 мес. Первичной конечной точкой безопасности является совокупная частота осложнений, связанных с процедурой, смерти от всех причин, большого кровотечения, а первичной конечной точкой эффективности – суммарная частота ишемического инсульта или системной эмболии.
В рандомизированном исследовании подобной направленности ASPIRIN-LAAO (ClinicalTrials.gov Identifier: NCT03821883) исследуется терапия аспирином в сравнении с отсутствием антитромботической терапии. Исследование ESCORT-AF (ClinicalTrials.gov Identifier: NCT04135677) включает 3 группы лечения – ривароксабан в дозе 20 мг/сут по сравнению с ривароксабаном в дозе 10 мг/сут и с ДAT. В исследовании ANDES (ClinicalTrials.gov Identifier: NCT03568890) сравнивается 8-недельное лечение ПOAК против ДAT. В исследовании ADALA (ClinicalTrials.gov Identifier: EudraCT number 2018001013-32) сопоставляются 3 группы лечения (апиксабан в дозе 5 мг 2 раза/сут против апиксабана в дозе 2,5 мг 2 раза/сут и против ДAT) в течение 3 мес. В рандомизированном исследовании SAFE-LAAC (ClinicalTrials.gov Identifier: NCT03445949) после имплантации окклюдера УЛП сравнивается ДAT продолжительностью 6 мес. или всего 1 мес. Эта информация указывает на значительные пробелы в доказательной базе антитромботической терапии после ЭОУЛП у больных с ФП.
Поскольку большинство пациентов с ФП, подвергающихся ЭОУЛП, отличаются высоким риском кровотечения, в ожидании результатов проводимых рандомизированных исследований антитромботическая (чаще всего антитромбоцитарная) терапия после имплантации устройства должна подбираться индивидуально с учетом как риска кровотечения, так и риска ТНУ [38] (табл. 2).
Сравнение окклюдеров ушка левого предсердия
В настоящее время доступно несколько устройств для ЭОУЛП с различными характеристиками и теоретически отличающимися профилями риска ТНУ. Между тем доказательства, полученные при прямом сравнении различных устройств, ограничены. В рандомизированном исследовании AMULET IDE сравнивали устройства Watchman и Amulet в большой популяции пациентов с ФП (n = 1878) [17]. Первичная конечная точка безопасности (совокупность осложнений, связанных с процедурой, смерть от всех причин или большое кровотечение в течение 12 мес.) регистрировалась в 14,5 против 14,7% случаев (р < 0,001), первичная конечная точка эффективности процедуры (совокупность ишемического инсульта или системной эмболии через 18 мес.) – в 2,8 против 2,8% случаев (р < 0,001) в группах имплантации Watchman и Amulet соответственно. Частота большого кровотечения и смерти от всех причин также существенно не различалась между группами (10,6 против 10,0% и 3,9 против 5,1% соответственно). Осложнения, связанные с процедурой, чаще наблюдались в группе ок-клюдера Amulet (4,5 против 2,5%; р = 0,02), в основном были связаны с развитием перикардиального выпота и эмболизацией устройства.
Через 45 дней частота полной окклюзии УЛП, определявшаяся как успешная имплантация при отсутствии затеков вокруг устройства > 5 мм, оказалась выше в группе Amulet (98,9 против 96,8% в группе Watchman; р = 0,003). Следовательно, окклюдер Amulet не усту- пал в безопасности и эффективности профилактики инсульта при неклапанной ФП по сравнению с устройством Watchman и превосходил его в отношении успеха окклюзии УЛП. Хотя осложнения, связанные с процедурой, чаще встречались при использовании окклюдера Amulet, их риск уменьшался в зависимости от опыта оператора.
Таблица 2. Варианты антитромбоцитарной терапии после эндоваскулярной окклюзии ушка левого предсердия, подобранные индивидуально в зависимости от риска тромбоза и кровотечения, связанного с устройством
Table 2. Antiplatelet therapy options after left atrial appendage occlusion, individualized based on device-related risk of thrombosis and bleeding
|
Клиническая ситуация / терапия Clinical situation / therapy |
Время после ЭОУЛП Post-LAAO time |
|||||
|
1 мес. 1 month |
2 мес. 2 months |
3 мес. 3 months |
4 мес. 4 months |
5 мес. 5 months |
6 мес. 6 months |
|
|
Не очень высокий риск кровотечения (особенно, если высок риск ТНУ Not very high risk of bleeding (especially if the risk of DRT is high) |
) |
|||||
|
Клопидогрел Clopidogrel |
• |
• |
• |
– |
– |
– |
|
Аспирин Aspirin |
• |
• |
• |
• |
• |
• |
|
Очень высокий риск кровотечения и высокий риск ТНУ Very high risk of bleeding and high risk of DRT |
||||||
|
Клопидогрел Clopidogrel |
• |
– |
– |
– |
– |
– |
|
Аспирин Aspirin |
• |
• |
• |
– |
– |
– |
|
Очень высокий риск кровотечения в отсутствие высокого риска ТНУ Very high risk of bleeding in the absence of high risk of DRT |
||||||
|
Аспирин Aspirin |
• |
• |
• |
– |
– |
– |
Примечание: ТНУ – тромбообразование на устройстве, ЭОУЛП – эндоваскулярная окклюзия ушка левого предсердия. Высокий риск кровотечений: массивные кровотечения в анамнезе, желудочно-кишечные заболевания с риском кровотечений, пожилой возраст, тяжелая хроническая почечная недостаточность, анемия. Высокий риск ТНУ: высокий риск по CHA2DS2-VASc, тяжелая хроническая почечная недостаточность, дисфункция левого желудочка, большое устройство, глубокий имплантат Watchman, остаточные затеки вокруг устройства после имплантации.
Note: DRT – device related thrombus, LAAO – left atrial appendage occlusion. High risk of bleeding: history of major bleeding, gastrointestinal disease at risk of bleeding, advanced age, severe chronic renal insufficiency, anemia. High risk of DRT: high CHA2DS2-VASc, severe chronic renal failure, left ventricular dysfunction, large device, deep Watchman implant, residual leak after implant.
По данным метаанализа сообщений об имплантации устройств Watchman ( n = 3267) и Amulet ( n = 2957) не было обнаружено статистически значимых различий в частоте инсульта (ОР 1,24 при 95% ДИ 0,92–1,67; р = 0,17), системной эмболии (ОР 1,10 при 95% ДИ 0,51–2,35; р = 0,81), смерти от всех причин (ОР 0,97 при 95% ДИ 0,80–1,18; р = 0,77), кардиальной смерти (ОР 0,99 при 95% ДИ 0,77–1,29; р = 0,96), большого кровотечения (ОР 1,18 при 95% ДИ 0,98–1,43; р = 0,08). Однако в группе Watchman по сравнению с группой Amulet наблюдалась более высокая частота ТНУ (ОР 1,48 при 95% ДИ 1,06– 2,06; р = 0,02) и затеков вокруг устройства > 5 мм (ОР 2,57 при 95% ДИ 1,63–4,04; р < 0,0001) [39].
Недавно опубликованы результаты отдаленного наблюдения за участниками исследования Amulet IDE [40]. В течение 3 лет ОАТ существенно чаще не проводилась при использовании окклюдера Amulet (96,2%) по сравнению с устройством Watchman (92,5%) (р < 0,01). При этом не отмечалось значимых различий частоты ишемического инсульта или системной эмболии (5,0 против 4,6%; р = 0,69); совокупности всех инсультов, системной эмболии или смерти от сердечно-сосудистых заболеваний (11,1 против 12,7%; р = 0,31); большого кровотечения (16,1 против 14,7%; р = 0,46); смерти от всех причин (14,6 против 17,9%; р = 0,08) и смерти от сердечно-сосудистых заболеваний (6,6 против 8,5%; р = 0,14) после имплантации устройств Amulet и Watchman соответственно. В течение 3 лет ТНУ или затеки вокруг устройства ≥ 3 мм чаще предшествовали ишемическому инсульту и смерти от сердечно-сосудистых заболеваний у пациентов, получивших окклюдер Watchman, по сравнению с получившими устройство Amulet. По мнению авторов работы, более частая возможность отказа от ОАТ без негативных последствий при использовании окклюдера Amulet может указывать на его превосходство по сравнению с устройством Watchman.
Заключение
ЭОУЛП представляет собой полезный способ лечения для пациентов с ФП и показана для профилактики тромбоэмболии при высоком риске большого кровотечения. Доступные в настоящее время данные подтверждают необходимость индивидуализации постпроцедурной антитромботической терапии на основе оценки геморрагического риска у конкретного пациента. Результаты проводимых исследований должны помочь установить соотношение эффективности / безопасности ЭОУЛП по сравнению с лечением ПOAК, а также оптимальную антитромботическую терапию у пациентов, перенесших ЭОУЛП.
Список литературы Эндоваскулярная окклюзия ушка левого предсердия при фибрилляции предсердий: современные представления и перспективы (обзор)
- Elliott A.D., Middeldorp M.E., Van Gelder I.C., Albert C.M., Sanders P. Epidemiology and modifiable risk factors for atrial fibrillation. Nat. Rev. Cardiol. 2023;20(6):404-417. https://doi.org/10.1038/s41569-022-00820-8.
- Escudero-Martínez I., Morales-Caba L., Segura T. Atrial fibrillation and stroke: A review and new insights. Trends Cardiovasc. Med. 2023;33(1):23-29. https://doi.org/10.1016/j.tcm.2021.12.001.
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J.J., Blomström-Lundqvist C. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur. Heart J. 2021;42(5):373-498. https://doi.org/10.1093/eurheartj/ehaa612.
- Saw J., Holmes D.R., Cavalcante J.L., Freeman J.V., Goldsweig A.M., Kavinsky C.J. et al. SCAI/HRS expert consensus statement on transcatheter left atrial appendage closure. Heart Rhythm. 2023;20(5):e1- e16. https://doi.org/10.1016/j.hrthm.2023.01.007.
- Glikson M., Wolff R., Hindricks G., Mandrola J., Camm A.J., Lip G.Y.H. et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion an update. Europace. 2020;22(2):184. https://doi.org/10.1093/europace/euz258.
- January C.T., Wann L.S., Calkins H., Chen L.Y., Cigarroa J.E., Cleveland J.C.Jr. et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ ACC/HRS Guideline for the management of patients with atrial fibrillation: A report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation. 2019;140(2):e125-e151. https://doi.org/10.1161/CIR.0000000000000665.
- Whitlock R.P., Belley-Cote E.P., Paparella D., Healey J.S., Brady K., Sharma M. et al. Left atrial appendage occlusion during cardiac surgery to prevent stroke. N. Engl. J. Med. 2021;384(22):2081-2091. https://doi.org/10.1056/NEJMoa2101897.
- Reddy V.Y., Sievert H., Halperin J., Doshi S.K., Buchbinder M., Neuzil P. et al. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. JAMA. 2014;312(19):1988-1998. https://doi.org/10.1001/jama.2014.15192.
- Holmes D.R.Jr., Kar S., Price M.J., Whisenant B., Sievert H., Doshi S.K. et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J. Am. Coll. Cardiol. 2014;64(1):1-12. https://doi.org/10.1016/j.jacc.2014.04.029.
- Reddy V.Y., Doshi S.K., Kar S., Gibson D.N., Price M.J., Huber K. et al. 5-year outcomes after left atrial appendage closure: from the PREVAIL and PROTECT AF trials. J. Am. Coll. Cardiol. 2017;70(24):2964-2975. https://doi.org/10.1016/j.jacc.2017.10.021.
- Boersma L.V., Ince H., Kische S., Pokushalov E., Schmitz T., Schmidt B. et al. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-Year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. 2017;14(9):1302-1308. https://doi.org/10.1016/j.hrthm.2017.05.038.
- Berti S., Santoro G., Brscic E., Montorfano M., Vignali L., Danna P. et al. Left atrial appendage closure using AMPLATZER™ devices: A large, multicenter, Italian registry. Int. J. Cardiol. 2017;248:103-107. https://doi.org/10.1016/j.ijcard.2017.07.052.
- Landmesser U., Tondo C., Camm J., Diener H.C., Paul V., Schmidt B. et al. Left atrial appendage occlusion with the AMPLATZER Amulet device: one-year follow-up from the prospective global Amulet observational registry. EuroIntervention. 2018;14(5):e590-e597. https://doi.org/10.4244/EIJ-D-18-00344.
- Osmancik P., Herman D., Neuzil P., Hala P., Taborsky M., Kala P. et al. 4-year outcomes after left atrial appendage closure versus nonwarfarin oral anticoagulation for atrial fibrillation. J. Am. Coll. Cardiol. 2022;79(1):1-14. https://doi.org/10.1016/j.jacc.2021.10.023.
- Busu T., Khan S.U., Alhajji M., Alqahtani F., Holmes D.R., Alkhouli M. Observed versus expected ischemic and bleeding events following left atrial appendage occlusion. Am. J. Cardiol. 2020;125(11):1644-1650. https://doi.org/10.1016/j.amjcard.2020.02.041.
- Alkhouli M., Friedman P.A. ischemic stroke risk in patients with nonvalvular atrial fibrillation: JACC review topic of the week. J. Am. Coll. Cardiol. 2019;74(24):3050-3065. https://doi.org/10.1016/j.jacc.2019.10.040.
- Lakkireddy D., Thaler D., Ellis C.R., Swarup V., Sondergaard L., Carroll J. et al. Amplatzer Amulet left atrial appendage occluder versus Watchman device for stroke prophylaxis (Amulet IDE): A randomized, controlled trial. Circulation. 2021;144(19):1543-1552. https://doi.org/10.1161/CIRCULATIONAHA.121.057063.
- Dukkipati S.R., Kar S., Holmes D.R., Doshi S.K., Swarup V., Gibson D.N. et al. Device-related thrombus after left atrial appendage closure: incidence, predictors, and outcomes. Circulation. 2018;138(9):874-885. https://doi.org/10.1161/CIRCULATIONAHA.118.035090.
- Alkhouli M., Busu T., Shah K., Osman M., Alqahtani F., Raybuck B. Incidence and clinical impact of device-related thrombus following percutaneous left atrial appendage occlusion: a meta-analysis. JACC Clin. Electrophysiol. 2018;4(12):1629-1637. https://doi.org/10.1016/j.jacep.2018.09.007.
- Kar S., Doshi S.K., Sadhu A., Horton R., Osorio J., Ellis C. et al. Primary Outcome evaluation of a next-generation left atrial appendage closure device: results from the PINNACLE FLX trial. Circulation. 2021;143(18):1754-1762. https://doi.org/10.1161/CIRCULATIONAHA.120.050117.
- Simard T., Jung R.G., Lehenbauer K., Piayda K., Pracoń R., Jackson G.G. et al. Predictors of device-related thrombus following percutaneous left atrial appendage occlusion. J. Am. Coll. Cardiol. 2021;78(4):297-313. https://doi.org/10.1016/j.jacc.2021.04.098.
- Sedaghat A., Vij V., Al-Kassou B., Gloekler S., Galea R., Fürholz M. et al. Device-related thrombus after left atrial appendage closure: data on thrombus characteristics, treatment strategies, and clinical outcomes from the EUROC-DRT-Registry. Circ. Cardiovasc. Interv. 2021;14(5):e010195. https://doi.org/10.1161/CIRCINTERVENTIONS.120.010195.
- Simard T.J., Hibbert B., Alkhouli M.A., Abraham N.S., Holmes D.R.Jr. Device-related thrombus following left atrial appendage occlusion. EuroIntervention. 2022;18(3):224-232. https://doi.org/10.4244/EIJ-D-21-01010.
- Asmarats L., Cruz-González I., Nombela-Franco L., Arzamendi D., Peral V., Nietlispach F. et al. recurrence of device-related thrombus after percutaneous left atrial appendage closure. Circulation. 2019;140(17):1441-1443. https://doi.org/10.1161/CIRCULATIONAHA.119.040860.
- Tan B.E., Boppana L.K.T., Abdullah A.S., Chuprun D., Shah A., Rao M. et al. Safety and feasibility of same-day discharge after left atrial appendage closure with the WATCHMAN device. Circ. Cardiovasc. Interv. 2021;14(1):e009669. https://doi.org/10.1161/CIRCINTERVENTIONS.120.009669.
- Saw J., Nielsen-Kudsk J.E., Bergmann M., Daniels M.J., Tzikas A., Reisman M. et al. Antithrombotic therapy and device-related thrombosis following endovascular left atrial appendage closure. JACC Cardiovasc. Interv. 2019;12(11):1067-1076. https://doi.org/10.1016/j.jcin.2018.11.001.
- Saliba W.I., Kawai K., Sato Y., Kopesky E., Cheng Q., Ghosh S.K.B. et al. Enhanced thromboresistance and endothelialization of a novel fluoropolymer-coated left atrial appendage closure device. JACC Clin. Electrophysiol. 2023;9(8Pt2):1555-1567. https://doi.org/10.1016/j.jacep.2023.04.013.
- Tan B.E., Wong P.Y., Lee J.Z., Tan N.Y., Rao M., Cheung J.W. Direct oral anticoagulant versus warfarin after left atrial appendage closure with WATCHMAN: updated systematic review and meta-analysis. Curr. Probl. Cardiol. 2022;47(11):101335. https://doi.org/10.1016/j.cpcardiol.2022.101335.
- Patti G., Pengo V., Marcucci R., Cirillo P., Renda G., Santilli F. et al. The left atrial appendage: from embryology to prevention of thromboembolism. Eur. Heart J. 2017;38(12):877-887. https://doi.org/10.1093/eurheartj/ehw159.
- Hildick-Smith D., Landmesser U., Camm A.J., Diener H.C., Paul V., Schmidt B. et al. Left atrial appendage occlusion with the Amplatzer™ Amulet™ device: full results of the prospective global observational study. Eur. Heart J. 2020;41(30):2894-2901. https://doi.org/10.1093/eurheartj/ehaa169.
- Landmesser U., Tondo C., Camm J., Diener H.C., Paul V., Schmidt B. et al. Left atrial appendage occlusion with the AMPLATZER Amulet device: one-year follow-up from the prospective global Amulet observational registry. EuroIntervention. 2018;14(5):e590-e597. https://doi.org/10.4244/EIJ-D-18-00344.
- Bergmann M.W., Ince H., Kische S., Schmitz T., Meincke F., Schmidt B. et al. Real-world safety and efficacy of WATCHMAN LAA closure at one year in patients on dual antiplatelet therapy: results of the DAPT subgroup from the EWOLUTION all-comers study. EuroIntervention. 2018;13(17):2003-2011. https://doi.org/10.4244/EIJ-D-17-00672.
- Duthoit G., Silvain J., Marijon E., Ducrocq G., Lepillier A., Frere C. et al. Circ. Cardiovasc. Interv. 2020;13(7):e008481. https://doi.org/10.1161/CIRCINTERVENTIONS.119.008481.
- Whitlock R.P., Belley-Cote E.P., Paparella D., Healey J.S., Brady K., Sharma M. et al. Left atrial appendage occlusion during cardiac surgery to prevent stroke. N. Engl. J. Med. 2021;384(22):2081-2091. https://doi.org/10.1056/NEJMoa2101897.
- Della Rocca D.G., Magnocavallo M., Di Biase L., Mohanty S., Trivedi C., Tarantino N. et al. Half-dose direct oral anticoagulation versus standard antithrombotic therapy after left atrial appendage occlusion. JACC Cardiovasc. Interv. 2021;14(21):2353-2364. https://doi.org/10.1016/j.jcin.2021.07.031.
- Li X., Zhang X., Jin Q., Xue Y., Lu W., Ge J. et al. clinical efficacy and safety comparison of rivaroxaban and dabigatran for nonvalvular atri al fibrillation patients undergoing percutaneous left atrial appendage closure operation. Front. Pharmacol. 2021;12:614762. https://doi.org/10.3389/fphar.2021.614762.
- Patti G., Sticchi A., Verolino G., Pasceri V., Vizzi V., Brscic E. et al. Safety and efficacy of single versus dual antiplatelet therapy after left atrial appendage occlusion. Am. J. Cardiol. 2020;134:83-90. https://doi.org/10.1016/j.amjcard.2020.08.013.
- Patti G., Ghiglieno C. Indications, evidence, and controversy in the closure of the left atrial appendage. Eur. Heart J. Suppl. 2023;25(Suppl. B):B126-B130. https://doi.org/10.1093/eurheartjsupp/suad091.
- Bing S., Chen R.R. Clinical efficacy and safety comparison of Watchman device versus ACP/Amulet device for percutaneous left atrial appendage closure in patients with nonvalvular atrial fibrillation: A study-level meta-analysis of clinical trials. Clin. Cardiol. 2023;46(2):117-125. https://doi.org/10.1002/clc.23956.
- Lakkireddy D., Thaler D., Ellis C.R., Swarup V., Gambhir A., Hermiller J. et al. 3-year outcomes from the amplatzer Amulet left atrial appendage occluder randomized controlled trial (Amulet IDE). JACC Cardiovasc Interv. 2023;16(15):1902-1913. https://doi.org/10.1016/j.jcin.2023.06.022.


