Эндоваскулярное лечение постинфарктных дефектов межжелудочковой перегородки
Автор: Хелимский Дмитрий Александрович, Крестьянинов О.В., Осиев А.Г., Шермук А.А., Гранкин Д.С., Кретов Е.И., Ибрагимов Р.У., Байструков В.И., Ким Е.М., Марченко А.В., Зубарев Д.Д., Редькин Д.А., Нарышкин И.А., Найденов Р.А., Покушалов Е.А., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 2 т.20, 2016 года.
Бесплатный доступ
Цель. Оценить возможность и безопасность транскатетерного закрытия постинфарктных дефектов межжелудочковой перегородки в различные сроки после острого инфаркта миокарда. Материал и методы. С 2010 по 2015 г. в Новосибирском научно-исследовательском институте патологии кровообращения имени академика Е.Н. Мешалкина транскатетерное закрытие постинфарктного дефекта межжелудочковой перегородки проводилось у 15 пациентов (11 женщин и 4 мужчин). Время от возникновения инфаркта миокарда до вмешательства составило от 1 дня до б мес. (в среднем 10,9 нед.). Три пациента подвергались вмешательству в острой фазе инфаркта миокарда (2 нед. и менее). Размеры дефекта по данным эхокардиографии составили 7-24 мм (в среднем 13,5 мм), размеры устройства от 12 до 34 мм (в среднем 22,8 мм). Время процедуры и флюороскопии составило 65-170 (в среднем 115,3) и 14-78 (32,5) мин. Результаты. Успешная имплантация окклюдера наблюдалась в 14 случаях из 15. У одного пациента произошла дислокация окклюдера. В дальнейшем пациент подвергся успешной хирургической коррекции дефекта. Имплантация окклюдера не улучшила клинический статус пациентов в критическом состоянии. В обоих случаях прогрессировала полиорганная недостаточность, в итоге первый пациент умер на 2-е сутки после операции, а второй на 9-е. Выводы. Эндоваскулярное закрытие может служить альтернативой и позволяет избежать открытой операции у пациентов с выраженной сопутствующей патологией и подходящей анатомией. Однако внутрибольничная летальность остается высокой, даже после успешной имплантации окклюдера.
Постинфарктный дефект межжелудочковой перегородки, окклюдер, эндоваскулярное лечение, инфаркт миокарда
Короткий адрес: https://sciup.org/142140746
IDR: 142140746 | DOI: 10.21688-1681
Текст научной статьи Эндоваскулярное лечение постинфарктных дефектов межжелудочковой перегородки
Разрыв межжелудочковой перегородки является редким, но серьезным осложнением острого инфаркта миокарда [1]. Постинфарктный дефект межжелудочковой перегородки вызывает прогрессирование сердечной недостаточности, обусловленной значительным сбросом крови слева направо на уровне желудочков сердца, что может привести к летальному исходу без своевременного лечения. Внедрение стратегии ранней реперфузии миокарда значительно снизило частоту данной патологии до менее 1% всех случаев инфаркта миокарда (0,2% в исследовании GUSTO-I) [2]. Значительный вклад первичного чрескожного коронарного вмешательства в развитие данного осложнения был показан в исследовании Yip и коллег (0,23% с первичным

Статья доступна по лицензии Creative Commons Attribution 4.0.
Таблица 1 Клиническая характеристика пациентов
Выделяют два типа дефекта: простой и сложный. Простой тип характеризуется наличием прямых каналов в перегородке, в то время как при сложном типе дефект имеет извилистый ход внутри перегородки и края отверстия располагаются на разных уровнях [9].
Факторы риска: женский пол [5, 6, 10, 11], артериальная гипертензия, отсутствие предшествующих инфарктов миокарда либо стенокардии [7].
На протяжении последних десятилетий основным методом лечения данной патологии являлась хирургическая коррекция дефекта межжелудочковой перегородки с одномоментным аортокоронарным шунтированием. Однако все более широкое распространение получает метод эндоваскулярного закрытия постинфарктных дефектов.
Цель – оценить эффективность и безопасность эндоваскулярного метода лечения у пациентов с постинфарктными дефектами межжелудочковой перегородки.
Материал и методы
С 2010 по 2015 год в Новосибирском научно-исследовательском институте патологии кровообращения имени академика Е.Н. Мешалкина транскатетерное закрытие постинфарктного дефекта межжелудочковой перегородки проводилось у 15 пациентов (11 женщин (73,3%) и 4 мужчин (26,7%)). Средний возраст пациентов составил 69±6,6 года. Ни у одного из пациентов не проводилось первичное хирургическое закрытие дефекта. У 10 (66,7%) пациентов был передний инфаркт миокарда и у 5 (33,3%) задний. Время от возникновения инфаркта миокарда до вмешательства составило от 1 дня до 6 мес. (в среднем 10,9 нед.). Три (20%) пациента подвергались вмешательству в острой фазе инфаркта миокарда (2 нед. и менее), у остальных 12 (80%) имелись хронические дефекты. Два пациента находились в критическом состоянии и нуждались в инотропной и дыхательной поддержке. Остальные пациенты были гемодинамически стабильными: 10 пациентов – III–IV класс по Нью-Йоркской ассоциации сердца (NYHA), 3 пациента – I–II класс по Killip (табл. 1).
По данным эхокардиографии (ЭхоКГ) у 13 (86,7%) пациентов имелся простой дефект и у 2 (13,3%) паци-

а
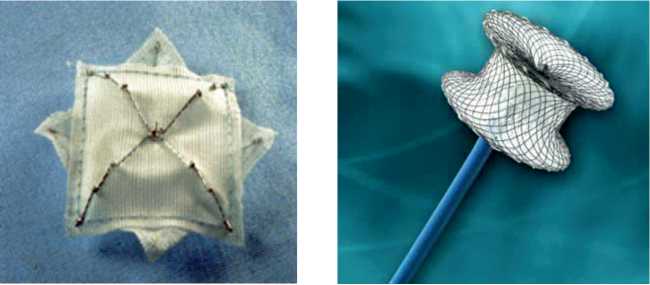
бв
Модели окклюдеров: а – Clamshell (USCI Angiographics, Tewksbury, MA); б – CardioSeal (NMT Medical, Boston, MA); в – Amplatzer (AGA Medical Corporation)
Occluder models: а – Clamshell (USCI Angiographics, Tewksbury, MA); б – CardioSeal (NMT Medical, Boston, MA);
в – Amplatzer (AGA Medical Corporation)
ентов сложный. Дефекты располагались в верхушечном сегменте перегородки в 11 (73,3%) случаях и в базальном сегменте в 4 (26,7%) случаях. Коронарография проводилась перед процедурой у всех пациентов. Остаточный шунт оценивался эхокардиографически непосредственно после имплантации и через 3–5 дней после процедуры.
После первого сообщения об успешном эндоваскулярном закрытии дефекта межжелудочковой перегородки Локом Д.Е. в 1988 г. при помощи Rashkind double umbrella было разработано несколько видов ок-клюдеров для этой цели: Clamshell (USCI Angiographics, Tewksbury, MA), CardioSeal (NMT Medical, Boston, MA), Amplatzer (AGA Medical Corporation) ( рисунок ). Предыдущий опыт работы с врожденными дефектами межжелудочковой перегородки показал, что система Amplatzer наиболее удобна и пользуется большей популярностью [12, 13]. Экстраполяция такого опыта привела к использованию этого семейства окклюдеров для закрытия постинфарктных дефектов межжелудочковой перегородки.
Устройство для закрытия постинфарктного дефекта межжелудочковой перегородки представляет собой са-моцентрирующийся нитиноловый каркас, который состоит из двух дисков, соединенных талией. Главное отличие данного устройства заключается в том, что длина талии и размер дисков соответствуют размерам взрослой межжелудочковой перегородки, которая у пациентов с постинфарктными дефектами, как правило, гипертрофирована. Закрытие дефекта происходит частично за счет полиэстеровых вставок, но главным образом за счет тромбоза в области талии. Так как окклюзия достигается с помощью центральной части устройства, неровность перегородки не влияет на результат, а саморасширяю-щее свойство окклюдера способствует устранению последствий от дальнейшего расширения дефекта [14].
Процедура проводилась под флюороскопическим и эхокардиографическим контролем. Закрытие постинфарктного дефекта межжелудочковой перегородки выполнялось по следующей методике. Пунктировались правая бедренная артерия и вена. В артерию устанавливался интродьюсер 6Fr. Затем через артериальный доступ дефект межжелудочковой перегородки пересекался с помощью диагностического катетера и проводника длиной до 260 см, который продвигался в легочную артерию, захватывался ловушкой и выводился наружу через венозный инродьюсер. Таким образом формировалась артериовенозная петля. Размер окклю-дера подбирался в 1,5–2 раза больше размера дефекта, определенного по чреспищеводной ЭхоКГ, для того чтобы избежать возможной дислокации окклюдера и остаточных шунтов после процедуры. Система доставки проводилась через бедренную вену в левый желудочек. После удаления дилататора и проводника окклюдер заводился в дистальный отдел доставляющей системы, находящийся в левом желудочке. Далее выводился левожелудочковый запирающий элемент, направлялся к межжелудочковому дефекту, и под контролем флюороскопии выводился правожелудочковый запирающей элемент.
После проверки устойчивого стояния окклюдера в межжелудочковом дефекте и контроля трансторакальным ультразвуковым исследованием доставляющий трос отсоединялся от закрывающего устройства. После
Таблица 2 Данные процедуры
Результаты
Успешная имплантация окклюдера наблюдалась в 14 (93,3%) случаях. У одного пациента не удалось достичь адекватного позиционирования окклюдера в дефекте, в результате чего были скомпрометированы подклапанные структуры трикуспидального клапана. В дальнейшем пациент подвергся успешной хирургической коррекции дефекта. В одном случае потребовалась имплантация двух окклюдеров ввиду наличия значимого шунта после первого вмешательства. Несмотря на успешные непосредственные результаты процедуры смертность составила 20% (3 из 15). Так имплантация окклюдера не улучшила клинический статус пациентов в критическом состоянии. В обоих случаях прогрессировала полиорган-ная недостаточность, в итоге первый пациент умер на 2-е сутки после операции, а второй на 9-е. Еще у одного пациента с хроническим дефектом в послеоперационном периоде развился выраженный гемолиз, который, наряду с прогрессирующей сердечной недостаточностью, привел к смерти пациента на 4-е сутки. Из 15 пациентов только в 2 случаях удалось добиться полного закрытия дефекта. Небольшой резидуальный шунт на- блюдался у 12 пациентов. Следующие осложнения отмечены во время вмешательства и в послеоперационном периоде: гемолиз в 3 случаях, гемоперикард в 1 случае, тромбоэмболия легочной артерии в 1 случае, желудочное кровотечение в 1 случае.
Размеры дефекта по данным ЭхоКГ составили 7–24 мм (в среднем 13,5), размеры устройства от 12 до 34 мм (в среднем 22,8). Время процедуры и флюороскопии составило 65– 170 (в среднем 115,3) и 14–78 мин (32,5 мин) (табл. 2).
Обсуждение
Несмотря на прогресс в фармакотерапии, инвазивной кардиологии, хирургической технике, смертность после данного осложнения остается высокой. По данным литературы госпитальная летальность при хирургическом закрытии дефекта составляет 23–81% [2, 15, 16]. Высокая летальность после подобных операций обусловлена исходной тяжестью оперируемых больных, пожилым возрастом пациентов, тяжелой сопутствующей патологией, а также нередкими техническими проблемами хирургической процедуры [17].
В течение последнего десятилетия развитие получил метод эндоваскулярного закрытия постинфарктных дефектов межжелудочковой перегородки. Однако оценка эффективности этого метода ограничена небольшим количеством наблюдений в различных центрах (всего около 300 пациентов).
Эндоваскулярное вмешательство может использоваться у пациентов как в острой фазе инфаркта миокарда, так и подостром периоде. Постифарктный дефект межжелудочковой перегородки чаще всего формируется в острой фазе инфаркта. В течение нескольких недель развивается коагуляционный некроз миокарда, и за счет литических ферментов происходит распад некротизированного миокарда. Из-за продолжающего некроза, резорбции и ретракции некротизированной ткани увеличивается размер дефекта. В самой большой серии наблюдений у данной группы пациентов Thiele и соавторы оценивали применение первичного эндоваскулярного закрытия дефекта у 29 пациентов [18]. 16 из 29 пациентов (55%) находились в состоянии кардиогенного шока. Успешная имплантация окклюдера была достигнута у 25 из 29 (86%) пациентов. Однако выживаемость в течение 30 дней составила только 35%. Госпитальная летальность в группе пациентов с кардиогенным шоком после успешной имплантации составила 93%, в группе без кардиогенного шока 36%. Схожие данные были получены в других исследованиях. В нашем случае имплантация окклюдера у пациента с кардиогенным шоком также была безуспешна. При стабильном состоянии пациента даже в острой фазе инфаркта миокарда имплантация окклюдера сопровождается положительными непосредственными и отдаленными результатами, что наблюдалось у наших пациентов. Мы считаем, что у отдельных пациентов с подходящей анатомией первичное эндоваскулярное закрытие постинфарктных дефектов межжелудочковой перегородки может быть операцией выбора. В таких случаях необходимо использовать окклюдер большего размера (в 1,5–2 раза).
В подострой фазе инфаркта миокарда происходит заживление миокарда. Перегородка становится более фиброзированной, и в ней развиваются рубцовые изменения [9], в связи с чем многие хирурги предпочитают откладывать операцию на несколько недель для обеспечения адекватной аппозиции краев и крепления швов во время операции [19]. То же самое применимо и к эндоваскулярному вмешательству. По данным литературы у данной группы пациентов госпитальная смертность после транскатетерного закрытия постинфарктного дефекта межжелудочковой перегородки составляет около 19%, что коррелирует с нашим исследованием. Таким образом эндоваскулярное закрытие постинфарктного дефекта может применяться у пациентов данной группы с положительными госпитальными результатами.
В отдельную группу можно выделить пациентов с остаточными шунтами после хирургического лечения. Остаточные шунты наблюдаются в 10–37% случаев после операции. Это связано с образованием новых дефектов или прорезы- ванием швов. Таким образом, в 11% случаев может потребоваться повторное вмешательство. У таких пациентов эндоваскулярное закрытие дефекта является альтернативой, которая позволяет избежать повторной операции.
На сегодняшний день окончательно не решен вопрос касательно оптимального времени вмешательства. Одни исследователи считают правильным применять раннюю агрессивную тактику, другие – ждать полной стабилизации состояния и формирования рубцовой ткани по краям дефекта, которое происходит приблизительно к 8-й неделе после инфаркта миокарда. Однако не все пациенты доживают до такого срока [20]. В рекомендациях ACC/ AHA 2013 г. немедленное хирургическое вмешательство, независимо от клинического статуса, показано всем пациентам (класс I рекомендаций). В то же время в рекомендациях ESC не дается однозначного ответа на этот вопрос.
В ряде исследований показана важность раннего хирургического вмешательства [21–23]. Однако в последних метаанализах выявлено достоверное повышение выживаемости с увеличением времени от инфаркта миокарда. В наиболее крупном метаанализе Arnaoutakis с соавторами проанализировали данные 2 876 пациентов, подвергавшихся хирургическому закрытию дефекта межжелудочковой перегородки. Смертность среди них составила 54,1% в группе до 7 дней от инфаркта миокарда и 18,4% в группе пациентов, оперированных после этого времени. Чем больше интервал между инфарктом миокарда и операцией, тем меньше вероятность смерти (менее 6 ч отношение шансов [ОШ] 6,18; 6–24 ч ОШ 5,53; 1–7 дней ОШ 4,59; 8–21 дней ОШ 2,37; p<0,01) [24].
Мы считаем, что данная закономерность справедлива для эндоваскулярного вмешательства и что сроки процедуры зависят преимущественно от тяжести состояния пациента. Если пациент стабилен, операция может быть выполнена через 3–4 нед. после инфаркта с низким риском вмешательства. Если пациент находится в шоке, обусловленном лево-правым шунтом, либо состояние пациента прогрессивно ухудшается, показано немедленное вмешательство. Однако риск такой операции значительно выше.
Заключение
Постинфарктный дефект межжелудочковой перегородки – это значительное осложнение инфаркта миокарда. Несмотря на то что хирургическое закрытие дефекта с одновременным аортокоронарным шунтированием остается «золотым стандартом», лечение постинфарктного дефекта межжелудочковой перегородки, эндоваскулярное закрытие может служить альтернативой и позволяет избежать открытой операции у пациентов с выраженной сопутствующей патологией и подходящей анатомией. Однако внутрибольничная летальность остается высокой даже после успешной имплантации окклюдера. Таким образом, необходимы дальнейшие исследования для определения тех групп пациентов, которые получат наибольшую пользу от хирургического или эндоваскулярного закрытия дефекта.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Эндоваскулярное лечение постинфарктных дефектов межжелудочковой перегородки
- Pohjola-Sintonen S., Muller J.E., Stone P.H., Willich S.N., Antman E.M., Davis V.G., Parker C.B., Braunwald E. Ventricular septal and free wall rupture complicating acute myocardial infarction: experience in the Multicenter Investigation of Limitation of Infarct Size//Am. Heart J. 1989. Vol. 117. P. 809-818.
- Crenshaw B.S., Granger C.B., Birnbaum Y., Pieper K.S., Morris D.C., Kleiman N.S., Vahanian A., Califf R.M., Topol E.J. Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction. GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) Trial Investigators//Circulation. 2000. Vol. 101. P. 27-З2.
- Yip H.K., Fang C.Y., Tsai K.H., Chang H.W., Yeh K.H., Fu M., Wu C.J. The potential impact of primary percutaneous coronary intervention on ventricularseptal rupture complicating acute myocardial infarction//Chest. 2004. Vol. 125. P. 1622-1628.
- Bhimji S.H. Ventricular septal rupture following myocardial infarction. Режим доступа: http://emedicine.medscape.com/article/428240 (дата обращения 02.04.16).
- Park J.Y., Park S.H., Oh J.Y., Kim I.J., Lee Y.H., Park S.H., Kwon K.H. Delayed ventricular septal rupture after percutaneous coronary intervention in acute myocardial infarction//Korean J. Intern. Med. 2005. Vol. 20. P. 24З-246.
- Poulsen S.H., Praestholm M., Munk K., Wierup P., Egeblad H., Nielsen-Kudsk J.E. Ventricular septal rupture complicating acute myocardial infarction: clinical characteristics and contemporary outcome//Ann. Thorac. Surg. 2008. Vol. 85. P. 1591-1596.
- Harikrishnan S., Tharakan J., Titus T., Kumar A., Sivasankaran S., Krishnamoorthy K.M. Ventricular septal rupture following myocardial infarction: clinical, haemodynamic, angiographic profile and long-term outcome. Int. J. Cardiol. 2007. Vol. 120. P. 279-280.
- Assenza G.E., Valente A.M., Volpe M., Martucci G., Landzberg M.J., Lock J.E. Transcatheter closure of post-myocardial infarction ventricular septal rupture//Circ. Cardiovasc. Interv. 201З. Vol. 6. P. 59-67 DOI: 1O.1161/CIRCINTERVENTIONS.112.972711
- Edwards B.S., Edwards W.D., Edwards J.E. Ventricular septal rupture complicating acute myocardial infarction: identification of simple and complex types in 53 autopsied hearts//Am. J. Cardiol. 1984. Vol. 54. P. 1201.
- Menon V., Webb J.G., Hillis L.D., Sleeper L.A., Abboud R., Dzavik V., Slater J.N., Forman R., Monrad E.S., Talley J.D., Hochman J.S. Outcome and profile of ventricular septal rupture with cardiogenic shock after myocardial infarction: a report from the SHOCK Trial Registry. Should we emergently revascularize Occluded Coronaries in cardiogenic shock?//J. Am. Coll. Cardiol. 2000. Vol. 36. P. 1110-1116.
- Sugiki H., Murashita T., Kunihara T., Matsuzaki K., Shiiya N., Yasuda K. Risk factors for the surgical repair of ventricular septal perforation; an 8-year multi institutional analysis//Kyobu Geka. 2005. Vol. 58. P. 278-283.
- Arora R., Trehan V., Kumar A., Madhuri K. Transcatheter closure of congenital ventricular septal defects: experience with various devices//J. Interv. Cardiol. 2ООЗ. Vol. 16. P. 8З-91.
- Michel-Behnke I., Waldecker B., Akintuerk H., Valeske K., Schranz D. Percutaneous closure of congenital and acquired ventricular septal defects-considerations on selection of the occlusion device//J. Interv. Cardiol. 2005. Vol. 18. P. 89-99.
- Lee E.M., Roberts D.H., Walsh K.P. Transcatheter closure of a residual postmyocardial infarction ventricular septal defect with the amplatzer septal occlude//Heart. 1998. Vol. 80. No. 5. P. 522-524.
- Barker T.A., Ramnarine I.R., Woo E.B., Grayson A.D., Fabri B.M., Bridgewater B., Grotte G.J. Repair of post-infarct ventricular septal defect with or without coronary artery bypass grafting in the northwest of England: a 5-year multi-institutional experience//Eur. J. Cardiothorac. Surg. 200З. Vol. 24. No. 6. P. 940-946. DOI: 10.1016/S1010-7940(03)00465-2.
- Jeppsson A., Liden H., Johnsson P., Hartford M., Radegran K. Surgical repair of post infarction ventricular septal defects: a national experience//Eur. J. Cardiothorac. Surg. 2005. Vol. 27. No. 2. P. 216-221.
- Deja M.A., Szostek J., Widenka K., Szafron B., Spyt T.J., Hickey M.J., Sosnowski A.W. Post infarction ventricular septal defect -can we do better?//Eur. J. Cardiothorac. Surg. 2000. Vol. 18. P. 194-201.
- Thiele H., Kaulfersch C., Daehnert I., Schoenauer M., Eitel I., Borger M., Schuler G. Immediate primary transcatheter closure of postinfarction ventricular septal defects//Eur. Heart J. 2009. Vol. 30. P. 81-88 DOI: 10.1093/eurheartj/ehn524
- Papalexopoulou N., Young C.P., Attia R.Q. What is the best timing of surgery in patients with post-infarct ventricular septal rupture//Interactive Cardio Vascular. Thoracic. Surgery. 2О1З. Vol. 16. No. 2. P. 19З-196 DOI: 10.1093/icvts/ivs444
- Лукин О.П., Андриевских С.И., Пискунов С.А., Дерксен С.А. Случай комбинированной коррекции постинфарктного дефекта межжелудочковой перегородки//Патология кровообращения и кардиохирургия. 201З. Т. 17. № 1. С. 87-89.
- David T.E. Operative management of postinfarction ventricular septal defect//Semin. Thorac. Cardiovasc. Surg. 1995. Vol. 7. P. 208-21З.
- Scanlon P.J., Montoya A., Johnson S.A., McKeever L.S., Sullivan H.J., Bakhos M., Pifarre R. Urgent surgery for ventricular septal rupture complicating acute myocardial infarction//Circulation. 1985. Vol. 72. Suppl II. P. II-185-90.
- Maltais S., Ibrahim R., Basmadjian A., Carrier M., Bouchard D., Cartier R., Demers P., Ladouceur M., Pellerin M., Perrault L.P. Postinfarction ventricular septal defects: towards a new treatment algorithm?//Ann. Thorac. Surg. 2009. Vol. 87. P. 687-692 DOI: 10.1016/j.athoracsur.2008.11.052
- Arnaoutakis G.J., Zhao Y., Timothy J.G., Sciortino C.M., McCarthy P.M., Conte J.V. Surgical repair of ventricular septal defect after myocardial infarction: outcomes from the society of thoracic surgeons national database//Ann. Thorac. Surg. 2012. Vol. 94. P. 436 DOI: 10.1016/j.athoracsur.2012.04.020


