Энергетический спектр электронов поверхностной фазы оксида железа, взаимодействующей с макромолекулами фторполимеров при действии СО2-лазерного излучения
Автор: Литинский Аркадий Овсеевич, Новиков Сергей Игоревич, Петров Максим Владимирович
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Химическая физика
Статья в выпуске: 11, 2007 года.
Бесплатный доступ
В рамках метода теории функционала плотности типа B3LYP/LanL2DZ с использованием кластерных моделей взаимодействующих центров изучены и обсуждены особенности электронно-энергетических характеристик и спектров одноэлектронных состояний поверхностной фазы оксида железа и различных хемосорбционных контактов с остатками макромолекул фторполимера. Этому процессу способствует обработка взаимодействующих подсистем лазерным СO2-излучением, частота которого близка к частотам валентных колебаний связей, претерпевающих разрыв в процессе образования поверхностных структур.
Короткий адрес: https://sciup.org/14968603
IDR: 14968603 | УДК: 539.2:
Текст научной статьи Энергетический спектр электронов поверхностной фазы оксида железа, взаимодействующей с макромолекулами фторполимеров при действии СО2-лазерного излучения
В рамках метода теории функционала плотности типа B3LYP/LanL2DZ с использованием кластерных моделей взаимодействующих центров изучены и обсуждены особенности электронно-энергетических характеристик и спектров одноэлектронных состояний поверхностной фазы оксида железа и различных хемосорбционных контактов с остатками макромолекул фторполимера. Этому процессу способствует обработка взаимодействующих подсистем лазерным CO2-излучением, частота которого близка к частотам валентных колебаний связей, претерпевающих разрыв в процессе образования поверхностных структур.
Оксидные пленки, а также композиционные материалы на их основе широко применяются в качестве материалов в элементах электронных приборов. Представляют интерес также материалы, получаемые покрытием оксидных пленок полимерами (оксид-полимерные композиции). Для их практического использования требуется знание как энергетических характеристик соответствующих контактов, так и особенностей энергетического спектра электронов соответствующих структур.
В данной работе изучены спектры одноэлектронных состояний оксида железа (ОЖ) Fe +2 (включая поверхность) и хемосорбционных комплексов поверхности ОЖ- Fe +2 с макромолекулами фторполимера (ФП). Рассчитаны также энергии образования соответствующих хемосорбционных связей.
На поверхности ОЖ всегда имеются гидроксидные группы (они обнаруживаются ИК-спек-троскопически, поскольку валентные колебания связей O-H являются характеристическими), поэтому за основу модели поверхности Fe +2 -оксидной фазы нами был выбран молекулярный кластер (МК), содержащий поверхностную OH-группу (рис. 1) [1–5].
Рис. 1. Кластер, моделирующий локальный фрагмент поверхности оксида железа
В этот кластер входят ближайшие к Fe +2 атомы кислорода (октаэдрическое окружение), которые замыкались атомами водорода, количество которых отвечало необходимой степени окисления иона железа (+2) и электронейтральности МК [6].
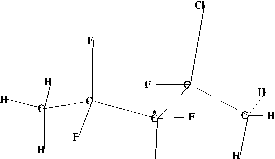
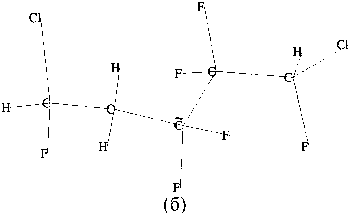
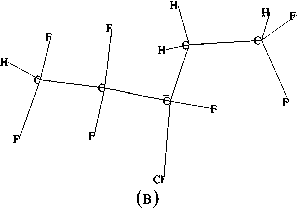
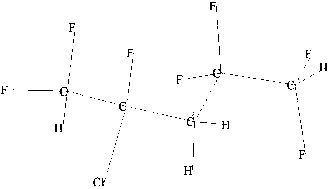
Макромолекула ФП (за основу принят фторкаучук СКФ-32), два элементарных звена кото-~ — рой изображены на рисунке 2, содержит 4 типа неэквивалентных атомов углерода (C*, C, C, С /), поэтому она моделировалась низкомолекулярными структурами, в центре которых располагался один из этих атомов углерода (рис. 3) (разорванные валентности макромолекулы ФП замыкались атомами водорода).
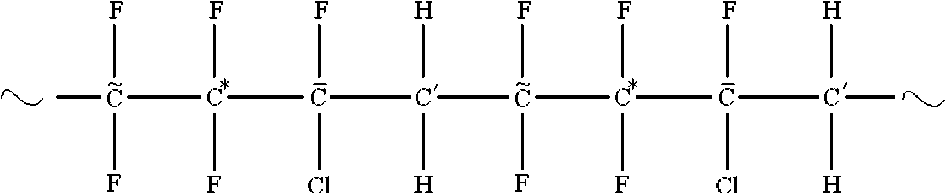
Рис. 2. Строение макромолекулы фторполимера (на примере фторкаучука СКФ-32)
(а)
(г)
~ —
Рис. 3. Кластерные модели углеродных C *(а)-, C (б)-, C (в)- и С / (г)-центров макромолекулы фторполимера
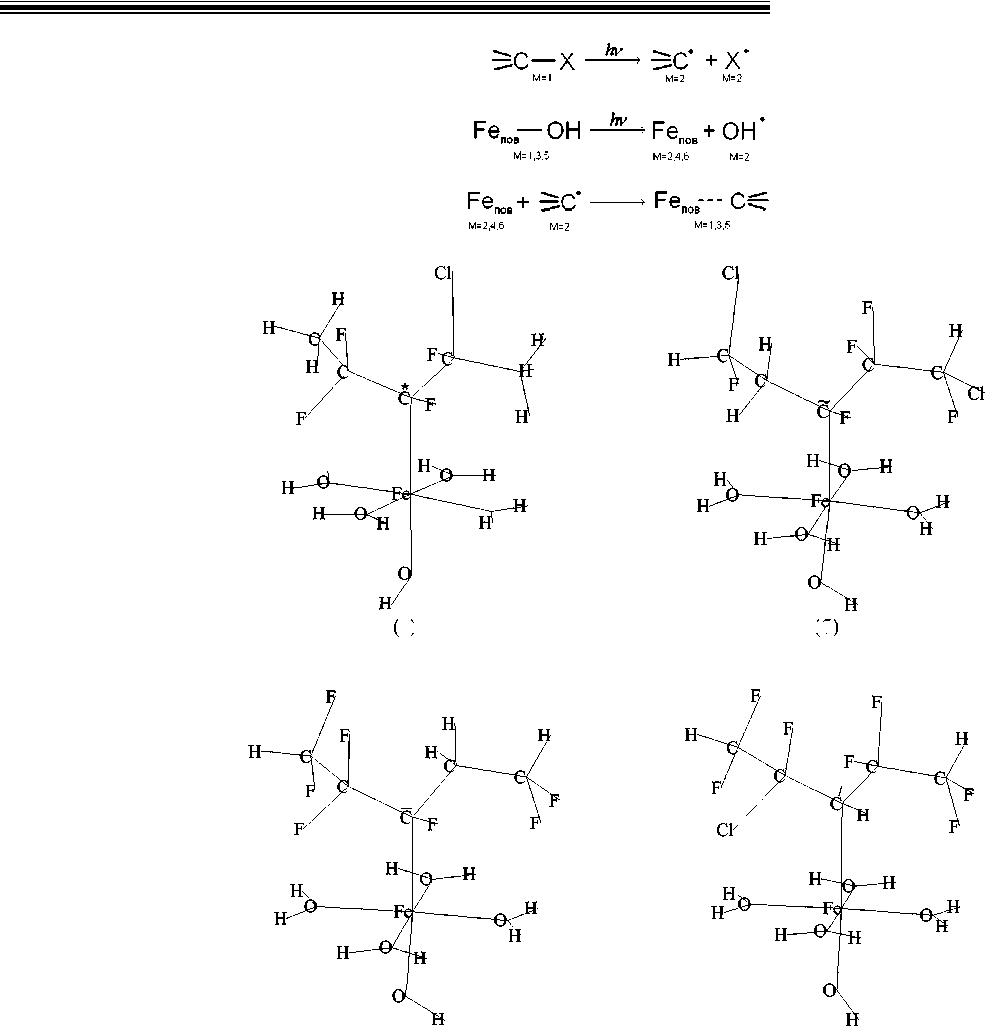
Частоты валентных колебаний связей , и лежат в области 900 ^ 1 100 см -1 [7], поэтому следует ожидать, что под воздействием излучения СО 2 -лазера (основная частота излучения которого v = 944 см -1 ) эти связи способны разорваться вследствие их резонансного «расшатывания». Образующиеся при этом радикалы ФП-макромолекулы и неполнокоординированные поверхностные Fe-центры могут рекомбинировать друг с другом с образованием соответствующего поверхностного соединения ( -контакт) (рис. 4). Таким образом, схема протекающих процессов имеет вид (M = 2 S + 1 – мультиплетность соответствующих структур, S – полный спин системы; X – F, Cl, или H):
(а)
(б)
(в)
(г)
Рис. 4. Кластерные модели адгезионных связей между Fe-центрами поверхности оксида железа ~- и C*(а)-, C(б)-, C(в)- и С /(г)-углеродными центрами макромолекулы фторполимера
Спектры одноэлектронных состояний соответствующих объемных и поверхностных фаз, а также энергии их образования рассчитывались в рамках вычислительной схемы теории функционала плотности типа B3LYP/LanL2DZ (трехпараметрический гибридный обменный функционал Беке [8] и корреляционный функционал Ли, Янга и Пара [9; 10]; валентно-расщепленный двухэкспоненциальный базис Даннинга-Хузинаги [11] для атомов первых двух периодов периодической системы и эффективный псевдопотенциал в сочетании с двухэкспоненциальным базисом для остальных атомов [12–14]).
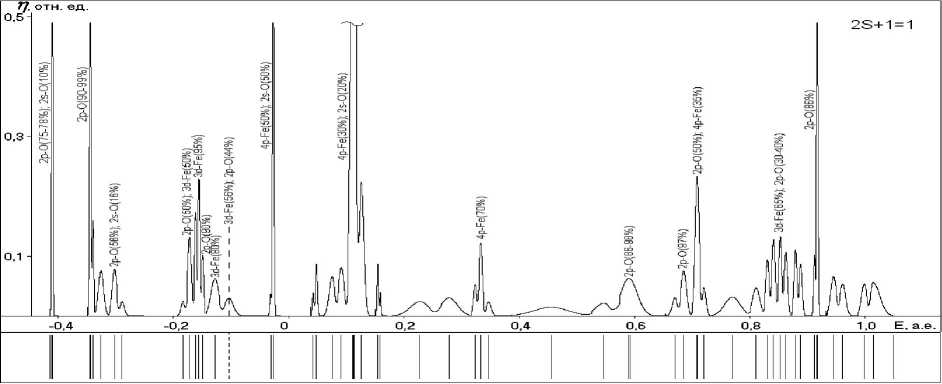
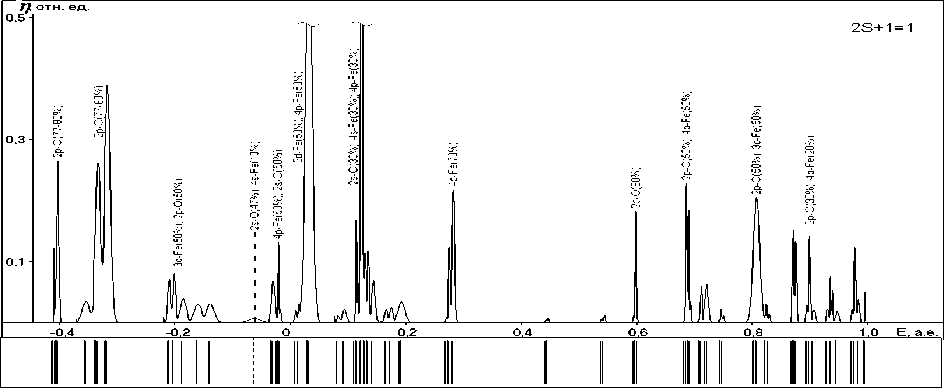
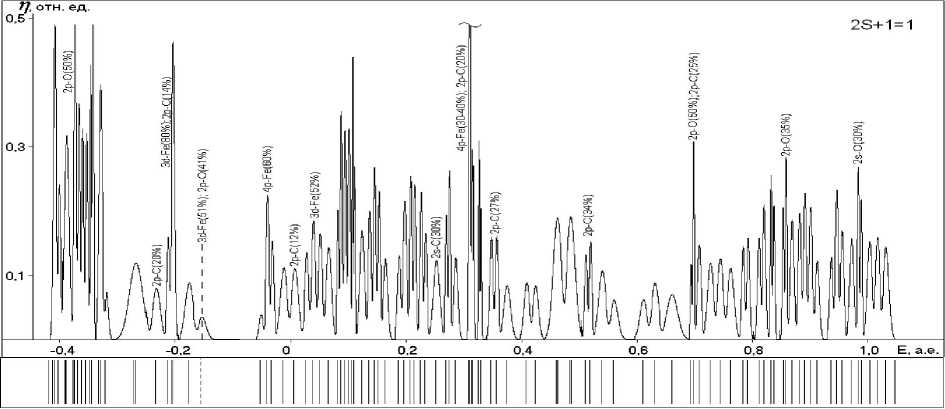
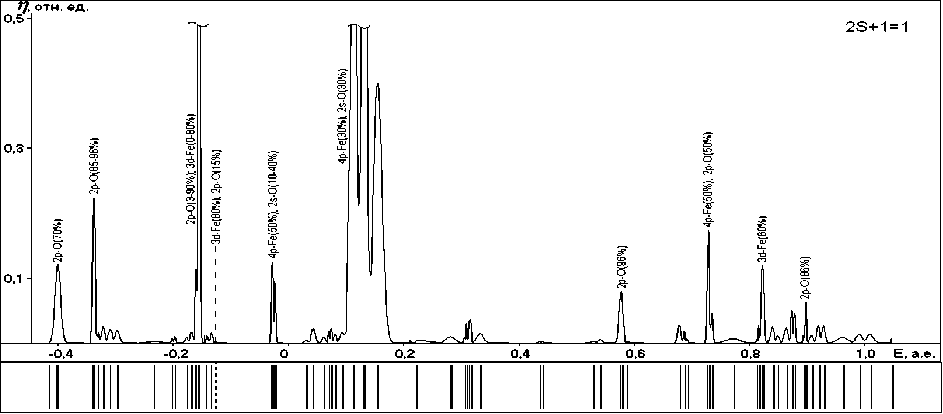
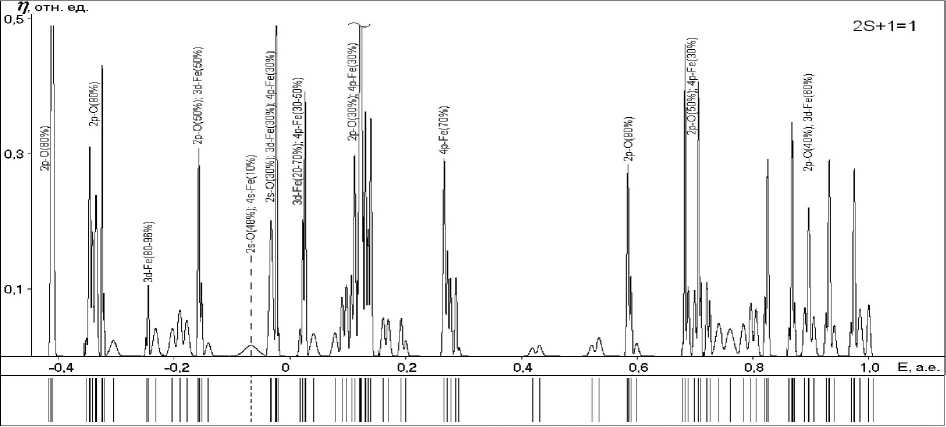
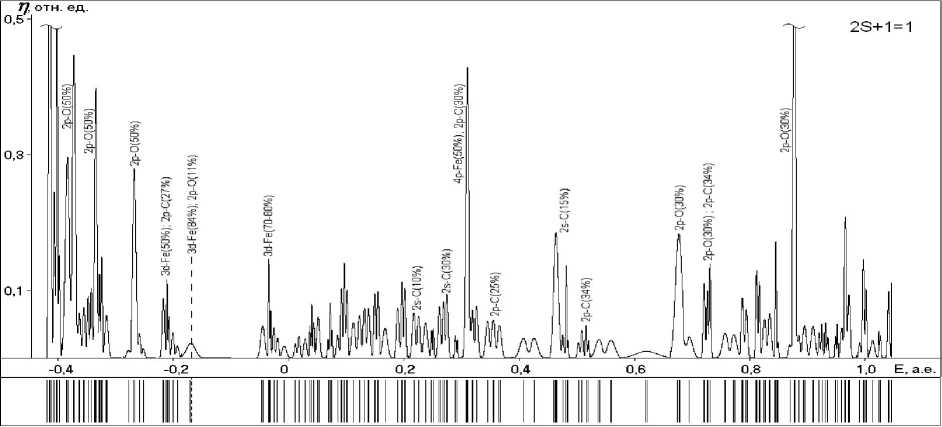
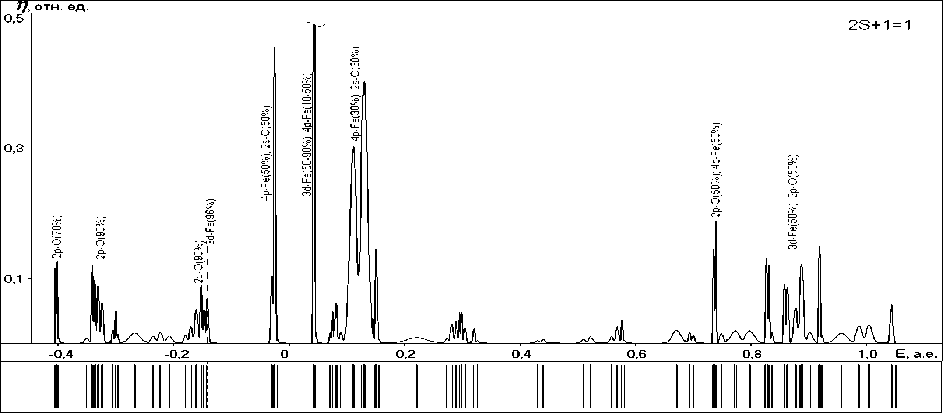
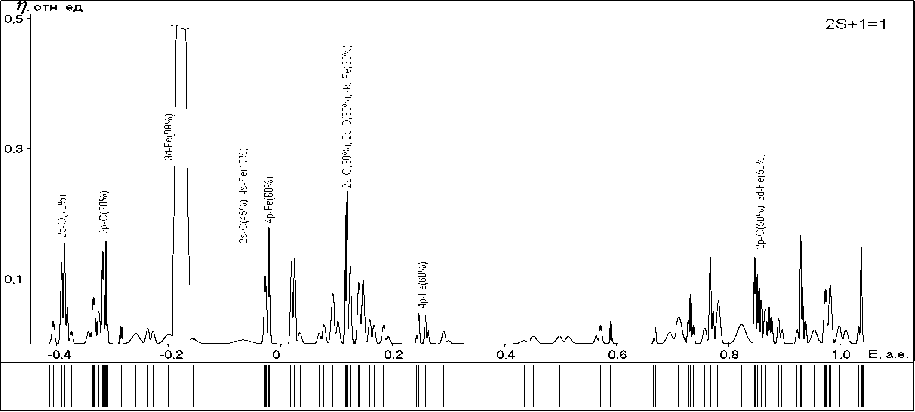
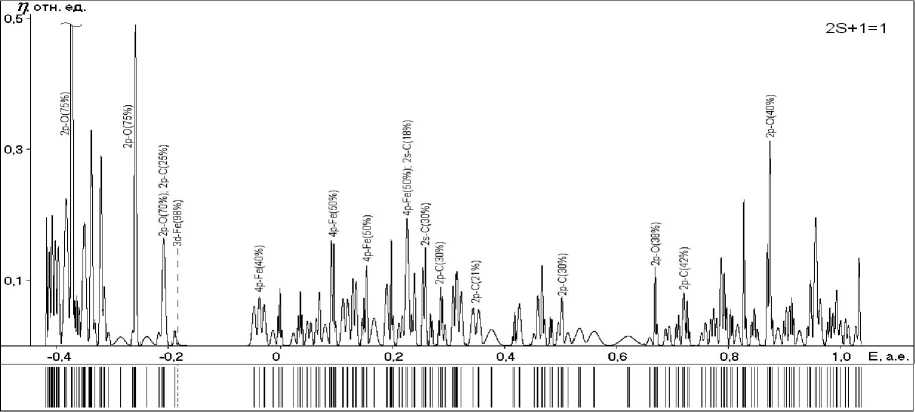
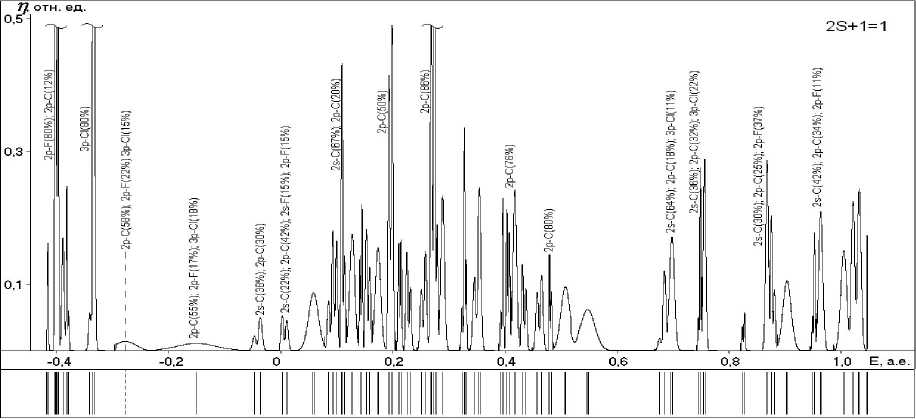
Рассчитанные спектры *) , полученные для структур с различной мультиплетностью **) , оптимизированные значения межатомных расстояний и энергии разрыва (образования) соответствующих хемосорбционных связей приведены на рисунке 5 и в таблицах 1 и 2.
Оптимизированные длины связей R(C-F), R(C-Cl), R(C-H) и энергии разрыва ( Δ Ε ) этих связей
Таблица 1
|
^С—F |
^C-F |
^C-CI |
^с-н |
|
|
R, А |
1,42 |
1,40 |
1,86 |
1,096 |
|
A E , эВ |
4,05 |
3,98 |
2,43 |
4,510 |
В соответствии с результатами, приведенными в таблице 3 и на рисунке 6, более стабильными оказываются структуры с наибольшей мультиплетностью (это относится как к поверхности ОЖ, так и к его объемной фазе и хемосорбционным контактам). Наиболее значительное понижение энергии имеет место для высокоспиновых состояний Feпов- и Fe-OH-центров (при М = 6 и М = 5 соответственно). Для всех Fe--- С^-структур понижение энергии в ряду M = 1 ^ M = 3 ^ M = 5 примерно одинаково.
a)
Рис. 5. Энергетические спектры и графики плотностей одноэлектронных состояний структур с различными мультиплетностями (указаны в верхнем углу):
а , г , ж – поверхностных гидроксидов; б , д , з – ОЖ-Fe2+-поверхностных структур;
в , е , и – хемосорбционных комплексов ; к, л – радикала и макромолекулы ФП соответственно
(см. также продолжение рисунка на последующих страницах)
б)
в)
г)
д)
е)
ж)
з)
и)
к)
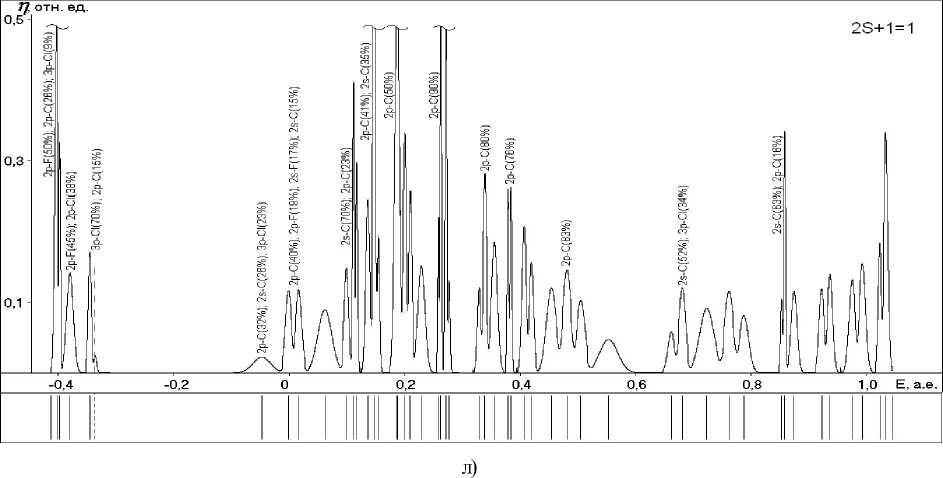
Рис. 5. Окончание
Что касается энергий разрыва АЕ связей Fe-OH и Fe---c^, характеризующих прочность этих связей, то она максимальна для структур с мультиплетностью М = 3. При этом для структур Fe-OH А Е (M = 1) > А Е (M = 5), а для всех структур типа Ре---Сё А Е (M = 1) < А Е (M = 5) (см. табл. 2, рис. 7).
Для контактов с одной и той же мультиплетностью а) в случае -центров энергия хемо-сорбционных связей выше, чем для других центров; б) для ^С - и ^с-центров величины А Е примерно одинаковы, а для -центра энергия разрыва несколько выше. Отметим также, что величины энергий разрыва связей не коррелируют с длинами этих связей.
Таблица 2
Оптимизированные значения межатомных расстояний R(Fe-OH) и R( ) и энергии разрыва (ΔE) этих связей в комплексах поверхности оксидной фазы железа с OH-группой или остатком макромолекулы фторполимера
|
2 S + 1 = 1 |
2 S + 1 = 3 |
2 S + 1 = 5 |
|||||
|
° R, А |
А Е , эВ |
° R, А |
А Е , эВ |
° R, А |
А Е , эВ |
||
|
Feпов-OH |
|||||||
|
2,02 |
3,67 |
2,09 |
3,98 |
2,13 3,57 |
|||
|
^епо"в" |
|||||||
|
« з к О 5 д Е н К |
C * |
2,25 |
3,32 |
2,26 |
3,73 |
2,45 |
3,18 |
|
~ C |
2,13 |
3,33 |
2,16 |
3,70 |
2,30 |
3,07 |
|
|
C |
2,14 |
3,74 |
2,17 |
4,09 |
2,33 |
3,47 |
|
|
С / |
2,38 |
3,87 |
2,40 |
4,25 |
*) |
*) *) |
|
Таблица 3
Разности энергий структур с различной мультиплетностью
[ A ' пов = Е пов ( М = 2) - Е „в ( М = 4) ; А" „о8 = E „o8 ( М = 4) - Е в ( М = 6); д ' = Е ( М = 1)- Е ( М = 3); А" = Е ( М = 3) - Е ( М = 5) ; см. рис. 6]
|
Структура |
A ' пов , эВ |
A '/ пов , эВ |
|
Fe пов |
0,10 |
1,58 |
|
Fe-OH |
0,41 |
1,16 |
|
Fe---C— |
0,51 |
1,02 |
|
Fe---C^ |
0,47 |
0,95 |
|
Fe---C^ |
0,45 |
0,95 |
|
Fe---c'^ |
0,47 |
*) |
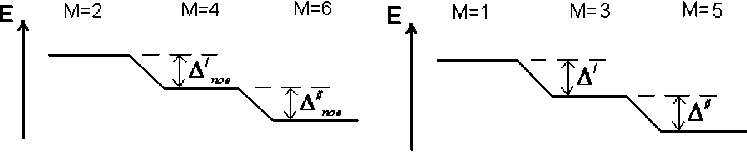
(а)
(б)
Рис. 6. Схема изменения полных энергий E структур с различной мультиплетностью (M = 2 S + 1, S – полный спин системы) для структур:
а) ОЖ-Fe2+ и б) или
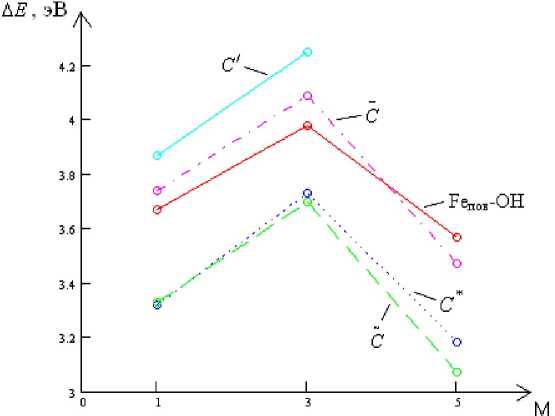
Рис. 7. Энергии разрыва связей А Е поверхностного ОЖ-Fe2+-центра с остатком макромолекулы ФП или группой OH при различных мультиплетностях хемосорбционных структур
Таблица 4
Энергии £ / аа ) , е"^а ) нескомпенсированных спинов электронов:
-
а) поверхностного ОЖ-Fe2+-центра для различных мультиплетностей М системы;
-
б) остатков макромолекулы фторполимера (М = 2)
Fe пов
а
М
2
4
6
е 'а ) ,эВ
–1,69
–1,83
–3,84 –4,15
–1,82 –4,24 –4,83
–4,84 –4,85
б
C *
~
C
C -
С /
е"а ) , эВ
–7,54
–7,28
–7,49
–8,59
Таблица 5
Смещения энергий верхних занятых состояний Д е для хемосорбционной структуры Feпов-OH для состояний с различной мультиплетностью М
|
Fe пов -OH |
|||||||
|
М |
1 |
3 |
5 |
||||
|
А е , эВ |
–1,13 |
–1,62 |
–1,81 |
–2,01 |
–2,07 |
–2,19 |
–2,31 |
Таблица 6
Смещения энергий верхних занятых состояний Де (эВ) при образовании контакта поверхности ОЖ-Fe2+ с остатком макромолекулы ФП для различных мультиплетностей М хемосорбционного комплекса
|
М |
1 |
3 |
5 |
|||||
|
5 О а § I 3 Я 3 м Р О Ь п ^ У 2 |
C * |
–2,48 |
–2,75 |
–2,84 |
–3,15 |
–3,30 |
–3,82 |
–3,84 |
|
~ C |
–2,13 |
–2,33 |
–2,41 |
–2,71 |
–2,93 |
–3,42 |
–3,55 |
|
|
C - |
–2,00 |
–2,24 |
–2,30 |
–2,57 |
–2,84 |
–3,32 |
–3,44 |
|
|
С / |
–2,69 |
–3,00 |
–3,08 |
*) |
*) |
*) |
*)*) |
|
Анализ приведенных на рисунке 5 спектров одноэлектронных состояний изученных систем позволяет сделать следующие выводы:
-
1) ОЖ-Fe 2+ - поверхностные структуры . Верхним занятым состояниям отвечают связывающие орбитали Fe-O-связей для состояний с мультиплетностью М = 2; 4; 6. А также зона занятых состояний содержит кроме связывающих состояний Fe-O-связей состояния, отвечающие неподеленным парам атомов кислорода и 3 d -орбиталям атомов железа в случае М = 4; 6) энергии последних превышают энергии электронов неподеленных пар атомов кислорода). Энергии верхних занятых орбиталей, спины электронов которых нескомпенси-рованы в рамках метода ТФП они соответствуют энергиям ионизации электронов), в целом увеличиваются по модулю) с увеличением мультиплетности поверхностной структуры табл. 4).
Вакантным состояниям отвечают состояния, соответствующие разрыхляющим орбиталям связей Fe-O, среди которых имеются также состояния, вклад в которые превносят преимущественно орбитали атомов железа.
-
2) В результате образования поверхностного гидроксида ПГ ) имеет место стабилизация структуры (см. табл. 5), одна из причин которой - уменьшение энергии А е верхнего занятого
состояния. Величина I A s | (табл. 5) нарастает с увеличением мультиплетности системы и в целом коррелирует с энергиями разрыва связей Fe-OH (табл. 2).
В верхние занятые состояния ПГ преимущественный вклад вносят 3 d -орбитали железа [для высокоспиновых систем (М = 3; 5)]; в случае М = 1 эти состояния оказываются несколько глубже, а верхним состояниям отвечают связывающие орбитали связей Fe-O. Для ПГ с М = 3 и 5 связывающие состояния связей Fe-O лежат энергетически глубже по сравнению с энергиями 3 d -Fe-орбиталей.
Вакантные состояния (ВС) ПГ подразделяются на группы, в каждую из которых входят состояния, преимущественный вклад в которые вносят разрыхляющие орбитали Fe-OH-связей либо только орбитали атомов железа. Состояния первой группы соответствуют нижней границе зоны ВС, а также могут иметь и более высокие энергии. Состояния второй группы – выше нижней границы зоны ВС (насколько выше, зависит от величины М).
2 +
-
3) - структуры . В верхние занятые состояния преимущественный вклад
вносят 3 d -состояния атома железа, причем в большей степени это относится к высокоспиновым системам. Состояниям с более глубокими энергиями отвечают связывающие орбитали хемосорбционных связей, а с еще более глубокими энергиями – связывающие орбитали Fe-O-связей и неподеленных пар электронов атомов кислорода; в нижние вакантные состояния основной вклад вносят 4 p - или 3 d -орбитали атомов железа, более высокоэнергетическим состояниям отвечают разрыхляющие орбитали хемосорбционных связей и связей Fe-O.
Список литературы Энергетический спектр электронов поверхностной фазы оксида железа, взаимодействующей с макромолекулами фторполимеров при действии СО2-лазерного излучения
- Эварестов Р.А. Квантово-химические методы в теории твердого тела. Л.: ЛГУ, 1982. 279 с.
- Жидомиров Г.М. Кластерные приближения в квантово-химических исследованиях хемосорбции и поверхностных структур//Итоги науки и техники. М.: ВИНИТИ, 1984. Т. 9. С. 3-161.
- Литинский А.О. Квазимолекулярные модели хемосорбции и поверхностных структур: Дис.... д-ра хим. наук. М.: МГУ, 1987. 344 с.
- Особенности воздействия лазерного излучения на фторэластомеры при формировании новых антифрикционных и защитных покрытий/Е.И Тескер [и др.]//Физика и химия обработки материалов. 2001. № 3. С. 28-33.
- Пенкаля Т. Очерки кристаллохимии. Л.: Изд-во «Химия», 1974. 496 с.
- Исследование механизма формирования адгезионных связей фторполимерных пленочных покрытий с металлической подложкой под действием излучения CO2-лазера/Е.И. Тескер [и др.]//Физика и химия обработки материалов. 2005. № 1. С. 70-77.
- Бранд Дж. Применение спектроскопии в органической химии/Дж. Бранд, Г. Эглинтон. М.: Мир, 1967. 279 с.
- Becke A.D. Density-functional thermochemistry. III. The role of exact exchange/A.D. Becke//Journal of Chemical Physics. 1993. Vol. 98. P. 5648-5652.
- Lee C. Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density/С. Lee, W. Yang, R.G. Parr//Physical Review. 1988. Vol. 37. P. 785-789.
- Miehlich B. Chem. Phys. Lett./B. Miehlich, A. Savin, H. Stoll. 1989. Vol. 157. 200 p.
- Dunning T.H. Modern Theoretical Chemistry/T. H. Dunning, Jr. Hay, P. J. Hay. 1976. Vol. 3. P. 1-28.
- Hay P.J. Ab initio effective core potentials for molecular calculations. Potentials for the transition metal atoms Sc to Hg/P.J. Hay, W.R. Wadt//Journal of Chemical Physics. 1985. Vol. 82. P. 270-283.
- Wadt W.R. Ab initio effective core potentials for molecular calculations. Potentials for main group elements Na to Bi/W. R. Wadt, P. J. Hay//J. Chem. Phys. 1985. Vol. 82. P. 284-298.
- Hay P.J. Ab initio effective core potentials for molecular calculations. Potentials for K to Au including the outermost core orbitals/P. J. Hay, W. R. Wadt//J. Chem. Phys. 1985. Vol. 82. P. 299-310.


