Энтальпия образования силицидов 3D-элементов периодической системы Д.И. Менделеева
Бесплатный доступ
В работе проиллюстрирована возможность применения разработанной математической модели для расчета энтальпии образования кристаллических бинарных соединений произвольного состава на примере силицидов d-элементов IV периода.
Короткий адрес: https://sciup.org/147158552
IDR: 147158552 | УДК: 536.75
Текст научной статьи Энтальпия образования силицидов 3D-элементов периодической системы Д.И. Менделеева
С начала прошлого века предпринимались многочисленные попытки связать те или иные свойства веществ с зарядами ядер атомов. Были получены эмпирические уравнения для решения различных частных задач. Обычно в уравнение вводится «эффективный» заряд ядра - порядковый номер элемента с переменной, как правило, не обоснованной, произвольной поправкой. При этом не учитываются взаимодействия частиц.
В работах [1, 2] предложена модель расчета стандартной энтальпии образования Ay#298 (кДж-моль-1) в зависимости от суммарного заряда ядра. Однако и в этой модели не учитываются взаимодействия между частицами и используются подгоночные коэффициенты, как при любом компьютерном моделировании. Из этой модели в качестве функции взята «удельная энтальпия» h - отношение энтальпии образования к общему заряду ядер.
h =—L_22L (i)
Zz где Zz - сумма зарядов ядер с учетом состава соединения.
По определению h - эффективная величина, так как принимается, что на каждый ядерный заряд приходится одинаковая доля энтальпии. Однако принято, что ядра пространственно разделены.
В основе разработанной математической модели расчета стандартной энтальпии образования лежат оправдавшие себя расчеты молярной теплоемкости С° [3, 4] и стандартной энтропии ^298 [5] бинарных кристаллических соединений. Разработанные математические модели расчета теплоемкости, энтропии адекватно описывают имеющиеся экспериментальные данные, приведенные в справочной литературе.
Это дало возможность использовать аналогичный прием разделения диаграммы «свойство-состав» на области твердых растворов (ОТР) и выделения в них кристаллообразующего (КО) и для рассмотрения зависимости стандартной энтальпии образования сложных веществ от состава.
Все поле «свойство-состав» разбивается на и областей квазиравновесных твердых растворов, в каждой из которых выделяются центральные кристаллообразующие компоненты. В первой ОТР кристаллообразующим всегда является металл. В других ОТР в качестве КО может быть принят любое устойчивое соединение, для которого известны структура, состав, энтальпия образования, т.е. h. Однако решающая роль принадлежит начальной и конечной кристаллическим структурам (в пределах ОТР).
Зависимость h от состава в пределах «-ой области можно отобразить линейным уравнением:
h„=an*KnX, (2) где Кп - структурный коэффициент, определяемый комбинацией линейных структурных характеристик расположения частиц к и координационного числа (кк^. Свободный член а„ определяется для каждой ОТР экстраполяцией зависимости h - х на х = 0, либо аналитически.
Для любой системы зависимость h - х начинается с нуля (первая ОТР), так как A fH°MeK^ = 0 - по определению. Так как для каждой ОТР Кп имеет свое численное значение, определяемое сочетанием линейных характеристик к для веществ на границах ОТР [6], то коор- динаты самих границ аналитически определяются совместным решением уравнений (2) для сопряженных областей.
В качестве объектов рассмотрения выбраны важные с теоретической и практической сторон силициды 3(/-элементов периодической системы Д.И. Менделеева.
Система Ti-Si
Из данных табл. 1 следует, что в системе титан - кремний можно выделить три области твердых растворов в соответствии с изменениями кристаллических структур: Ti - Ti5Si3, Ti5Si3 - TiSi и TiSi - TiSi2.
Таблица 1 Стандартная энтальпия образования силицидов титана TiSi,
|
№ |
Вещество |
Структура |
- АуЯ298, [9-П] |
z(TiSi,) |
^1,2,3 |
^1,2,3 > ур. (3-5) |
- Ay Я298, УР- С) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Ti6Si TiSioje? |
тетр. (куб.) |
24,33333 |
1,12500 |
164,250 27,375 |
||
|
2 |
Ti3Si TiSio,333 |
26,66667 |
2,25000 |
180,000 60,000 |
|||
|
3 |
Ti5Si3 TiSio,6 |
ГПУ-2 (Mn5Si3) |
616 123,2 |
30,4 |
4,05263 |
4,05000 |
615,600 123,120 |
|
4 |
Ti3Si4 TiSio,8 |
33,2 |
4,30313 |
714,320 142,864 |
|||
|
5 |
TiSi |
ромб.-4 (MnP) |
164 |
36 |
4,55556 |
4,55625 |
164,025 |
|
6 |
Ti2Si3 TiSi],5 |
43 |
4,08484 |
351,296 175,648 |
|||
|
7 |
TiSi2 |
ГПУ-3 (CrSi2) |
180 |
50 |
3,60000 |
3,62426 |
181,213 |
OTP-V. Ti-TisSh (х = 0=0,6) . Кристаллообразующим компонентом в этой области является титан (ОЦК-2, a-Fe). Переходу к Ti5Si3 (ГПУ-2, Mn5Si3) соответствует структурный коэффициент 3 3
^1 =^оцк "кгпу "Ккч = д • — ■6 = 6,750. Расчетное уравнение (2) окончательно приобретает следующий вид:
/j1(TiSiJ = 6,75x.
ОТР-Зл TisSU-TiSi (х = 0,6=1,0) . За кристаллообразующее соединение выбран силицид Ti5Si3, для которого по уравнению (3) получаем значение h = 4,050. Переходу от Ti5Si3 (ГПУ) к
з (
TiSi (ромб.) отвечает коэффициент К2 = кгпу • кромб -кКЧ~ = — • - ■ 6 = 1,265625. Свободный
2 \ 8)
член определяется как а2 = A(Ti5Si3)- K2x(Ti5Si3) = 4,05 -1,265625 ■ 0,6 = 4,05 - 0,759375 = 3,290625.
Уравнение (2) для второй области в итоге принимает вид: h2 (TiSi,) = 3,290625 +1,265625 х .
OTP-3'. TiSi-TiSi? (х = 0,1 =2,0) . В качестве КО соединения для третьей области выбран силицид TiSi (й = 4,55625). При переходе от TiSi (ромб.) к TiSi2 (ГПУ-3) структурный коэффициент
, г, , , з 3 V2
определяется следующим образом К3 = кромб • кгпу ■ к кч =---s—
8 2
значение свободного члена определяется аналитически
= 4,55625-10,932-1 = 5,48825.
Уравнение (2) можно для ОТР-3 представить таким образом: й3(TiSi,) = 5,48825 - 0,932л.
•4 = 0,9320. Численное
а3
Результаты расчетов по уравнениям (3)-(5) приведены в табл. 1 и на рис. 1. Зависимость /^TiSiJ-x аналогична по форме («журавлик») взаимосвязи /г(СгОх) - х [7].
Рассмотрение последующих систем приводится конспективно (по типу системы Ti - Si).
Система V-Si
OTP-1: V - Vs Sh (x = 04-0,6).
K\ = ^оцк ’krny 'Ккч^' ‘6 = 4,242264.
' A] (VSix) = 4,24264 x.(6)
OTP-2; VsSh - VSi (x = 0,64-1,0) .
^2 = krny .кку6/ккч=Й-.^.4 = 1,15470 .
h2 (VSi J = 1,85276 -1,1547 x.(7)
OTP-3 : VSi - VSi, (x = 1,04-2,0) .
^3 - kKy6 • krny ■ ккч = 1 ■ (73 -1). 4 = 1,46410.
/z3(VSix) = 4,47156-1,4641x.(8)
Результаты расчетов по уравнениям (б)-(8) приведены в табл. 2 и на рис. 2.
Таблица 2
Стандартная энтальпия образования силицидов ванадия VSix
|
№ |
Вещество |
Структура |
-Ау77298, [9-Н] |
XVSiJ |
^1,2,3 |
^1,2,3 ’ ур. (6-8) |
- АуН298, УР- (1) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
V3Si VSio,333 |
куб.-2 (CrSi3) |
117,152 39,051 |
27,66667 |
1,40964 |
1,41423 |
117,381 39,127 |
|
2 |
V2Si VSio,5 |
ромб. (ГПУ) |
128,449 64,225 |
30 |
2,14082 |
2,12132 |
127,279 63,640 |
|
3 |
V5Si3 VSio.6 |
ГПУ-2 (Mn5Si3) |
401,664 80,333 |
31,4 |
2,55838 |
2,54558 |
399,657 79,931 |
|
4 |
VSi |
куб.-4 (FeSi) |
110,876 |
37 |
2,99665 |
3,00746 |
111,276 |
|
5 |
V2si3 VSiL5 |
200,832 100,416 |
44 |
2,28218 |
2,27641 |
200,324 100,162 |
|
|
6 |
VSi2 |
ГПУ (тетр.) (MnSi2) |
78,450 |
51 |
1,53824 |
1,54336 |
78,711 |
Система Cr-Si
ОТР-1: Ст - Cr3Si (х = 04-0,333) .
К\ W • Куб. • = 2 ^ . ^. 6 4,77297 .
fy (CrSiJ = 4,77297 X.
(Ю)
OTP-2: CnSi - Cr5 Sh (х = 0,3334-0,6) .
К2 = ккуб • kmemp. .K„=^JL4 = 1,59099.
/z2(CrSix) = 1,06066 +1,59099 х.
ОГР-3: Crs Sh -CrSi, (х = 0,64-2,0) .
К3 = kmemp • кгпу • ккч = — "^j^ ‘ 4 = 0,61237 .
/^(CrSL^ 2,38267-0,61237 х. (И)
Результаты расчетов по уравнениям (9)—(11) приведены в табл. 3 и на рис. 3.
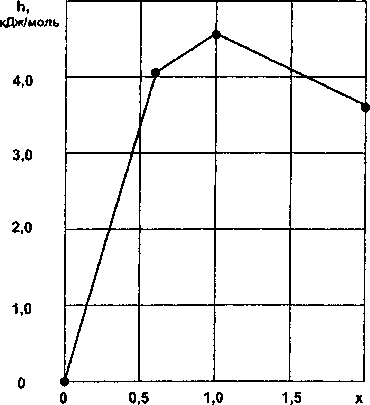
Рис. 1. Зависимость удельной энтальпии h от состава х силицидов титана • - эксперимент; — - расчет
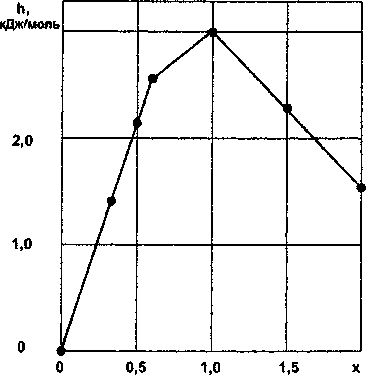
Рис. 2. Зависимость удельной энтальпии h от состава х силицидов ванадия • - эксперимент; — - расчет
Стандартная энтальпия образования силицидов хрома CrSix
Таблица 3
|
№ |
Вещество |
Структура |
- АуЯ298, [9-И] |
XCrSix) |
^1,2,3 |
^1,2,3 > yp.(9-11) |
- АуЯ298, yp.(i) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Cr3Si Сг81о,ззз |
куб.-2 (CrSi3) |
13 8,072±6,276 46,024 |
28,66667 |
1,60549 |
1,59099 |
136,824 45,608 |
|
2 |
Cr2Si CrSi0,5 |
куб.-4 (CaF2) |
31 |
1,85616 |
115,082 57,541 |
||
|
3 |
Cr5Si3 CrSio,6 |
тетр.(ГПУ-4) (W5Si3) |
326,352±6,092 65,270 |
32,4 |
2,01451 |
2,01525 |
326,470 65,294 |
|
4 |
Cr4Si3 CrSio:75 |
куб.-4 (Th3P4) |
34,5 |
1,92339 |
265,428 66,357 |
||
|
5 |
CrSi |
куб.-4 (FeSi) |
71,128±6,276 |
38 |
1,87179 |
1,77030 |
67,271 |
|
6 |
Cr3Si4 CrSi]i333 |
куб.-8 (MgAl2O4) |
42,66667 |
1,56618 |
200,472 66,824 |
||
|
7 |
Cr2Si3 CrSiL5 |
ГПУ-2 (NiAs) |
45 |
1,46412 |
131,770 65,885 |
||
|
8 |
CrSi2 |
ГПУ-3 (CrSi2) |
59,831±4,184 |
52 |
1,15060 |
1,15793 |
60,212 |
Система Mn-Si
ОТРА\ Мп - Mn3Si (Mn5Si2) х = О^-О.ЗЗЗ (0,4) .
К\ = кку6х • к^ • ккч = (72 -1). | - 6 = 3,72792.
^(MnSiJ^ 3,72792 х. (12)
O7P-2:Mn2Si-MnSi х = 0,333(0,4)4-1,0 .
3,141
^2 = ^62 ' ^куб. -Ккч ~ 2" I 3" ‘ д’J ‘ ^ = 0)88889.
/72(MnSiJ = 1,10269 + 0,88889 х.
ОТР-3 : MnSi - MnSi, х = 1,0-r2,0.
V _ Ъ- , Я
JX3 ^куб. ^memp.
ккч = 2(л/з -1)- • 4 = 0,39848 .
V У бТб
^(MnSiJ = 2,39006- 0,39848х.
Результаты расчетов по уравнениям (12)—(14) приведены в табл. 4 и на рис. 4.
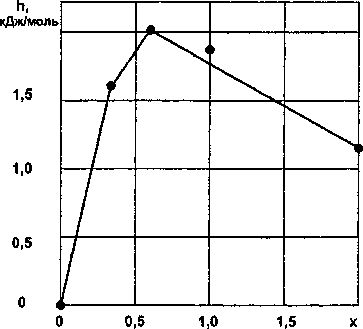
Рис. 3. Зависимость удельной энтальпии h от состава х силицидов хрома • - эксперимент; — - расчет
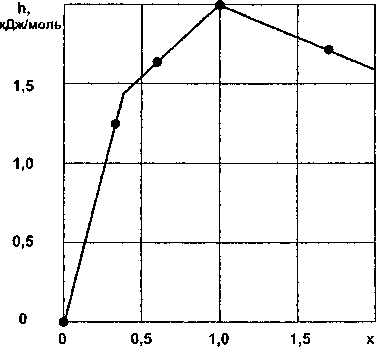
Рис. 4. Зависимость удельной энтальпии h от состава х силицидов марганца • - эксперимент; — - расчет
Таблица 4
Стандартная энтальпия образования силицидов марганца MnSi,
|
№ |
Вещество |
Структура |
-ДуЯ298, [9-П] |
z(MnSix) |
^1,2,3 |
^1,2,3 ’ УР-(12-14) |
- ^/-^298 > УР- (1) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Mn6Si MnSio.ie? |
27,33333 |
0,61232 |
101,896 16,983 |
|||
|
2 |
Mn3Si Мп81о,ззз |
куб.-2 (CrSi3) |
110,876±6,276 36,959 |
29,66667 |
1,24580 |
1,24264 |
110,595 36,865 |
|
3 |
Mn5Si3 MnSi0,6 |
ГПУ-2 (Mn5Si3) |
273,215±8,368 54,643 |
33,4 |
1,63602 |
1,63602 |
273,215 53,643 |
|
4 |
MnSi |
куб.-4 (FeSi) |
77,822±8,368 |
39 |
1,99544 |
1,99158 |
77,672 |
|
5 |
MnSiij |
тетр.-16 (MnSi2) |
83,680±8,368 |
48,8 |
1,71475 |
1,71265 |
83,577 |
|
6 |
MnSi2 |
тетр.-16 (MnSi2) |
53 |
1,59310 |
84,434 |
||
|
7 |
Mn2Si3 MnSi i,5 |
46 |
1,79234 |
164,896 82,448 |
|||
|
8 |
Mn3Si2 MnSio,66? |
34 |
1,69528 |
172,920 57,640 |
|||
|
9 |
Mn2Si MnSi0,5 |
32 |
1,54713 |
99,016 49,508 |
Система Fe-Si
ОТР-1: Fe - Fe5 Si 2 (х = 04-0,6) .
^1 - кОцк ' крпу ' Ккч - уу' у" 4 - 3,07920.
hx (FeSiJ = 3,0792 х.
OTP-2: FesSh-FeSi (х = 0,6* 1,0) .
^2 = кГпу • ккуб ‘ Ккч = у у' 4 = 1,33333.
^2 (FeSiJ = 0,58196 +1,33333 х.
OTP-3; FeSi - FeSb , (х = 1,04-2,5).
^3 = ккуб. ■ ктетр" Ккч - у---6~ 4 ” 0,54433.
h3 (FeSi,) = 2,45962 - 0,54433 х .
Результаты расчетов по уравнениям (15)—(17) приведены в табл. 5 и на рис. 5.
Таблица 5
Стандартная энтальпия образования силицидов железа FeSi,
|
№ |
Вещество |
Структура |
[9-H] |
z(FeSix) |
^1,2,3 |
^1,2,3’ УР. (15-17) |
-kj-И, УР- (1) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Fe3Si Ре81о,ззз |
93,8±6,276 31,267 |
30,667 |
1,01958 |
1,02640 |
94,429 31,476 |
|
|
2 |
Fe5Si3 FeSi0,6 |
ГПУ-2 (Mn5Si3) |
234,304±6,276 46,861 |
34,4 |
1,36223 |
1,38896 |
237,697 47,539 |
|
3 |
FeSi |
куб.-4 (FeSi) |
76,576±4,184 |
40 |
1,91418 |
1,91529 |
76,612 |
|
4 |
Fe3Si4 FeSii^ |
44,667 |
1,73385 |
232,335 77,445 |
|||
|
5 |
Fe2Si3 FeSiL5 |
47 |
1,64313 |
154,454 77,227 |
|||
|
6 |
FeSi2 |
тетр. (MnSi2) |
76,149±6,276 |
54 |
1,41017 |
1,37096 |
74,032 |
|
7 |
Fe3Si7 FeSi2i333 |
208,362±6,276 69,454 |
58,667 |
1,18388 |
1,18952 |
209,355 69,785 |
Система Co-Si
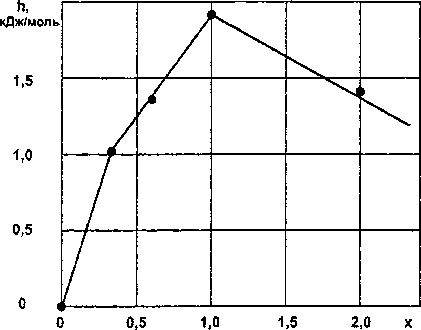
Рис. 5. Зависимость удельной энтальпии h от состава х силицидов железа • - эксперимент; — - расчет
ОТР-1: Со - Co2Si (х = 0+0,5) .
= 3V[.6 = 3 57973.
4V2 8
7^1 крлу • kp0Mg ■ ккч
^(CoSiJ = 3,57973 х.(18)
OTP-2: Co2Si - CoSi (x = 0,54-1,0) .
K2=kp^'k*'K„= уГ 4 = 1,29904.
^(CoSi,^ 1,14035 + l,29904x.(19)
OTP-3: CoSi - CoSi2 (x = 1,0+2,0) .
7^3 к-куб ■ k^y^ • ккч
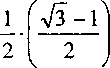
•4 = 0,73205.
^3(CoSix) = 3,17144-0,73205x.(20)
Результаты расчетов по уравнениям (18-20) приведены в табл. 6 и на рис. 6.
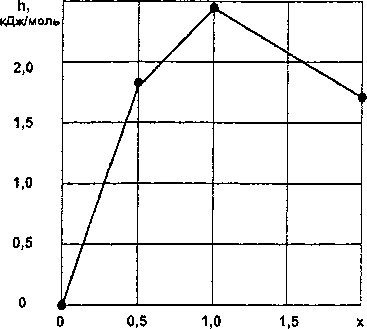
Рис. 6. Зависимость удельной энтальпии h от состава х силицидов кобальта • - эксперимент; — - расчет
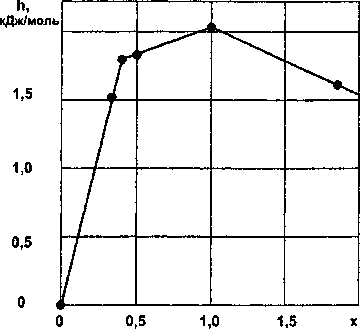
Рис. 7. Зависимость удельной энтальпии h от состава х силицидов никеля • - эксперимент; — - расчет
Таблица 6
Стандартная энтальпия образования силицидов кобальта CoSi,
|
№ |
Вещество |
Структура |
-\j-H29%1 Г9-Ш |
г(Со81Л) |
^1,2,3 |
^1,2,3- ур. (18-20) |
- АуН298, УР-(1) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Co3Si CoSio.333 |
31,666 |
1,19324 |
113,358 37,786 |
|||
|
2 |
Co2Si CoSi05 |
ромб. |
124,265±66276 62,132 |
34 |
1,82742 |
1,78987 |
121,711 60,855 |
|
3 |
CoSi |
куб. |
100,416±6,276 |
41 |
2,44917 |
2,43939 |
100,015 |
|
4 |
CoSi2 |
куб. |
93,973±4,184 |
55 |
1,70860 |
1,70734 |
93,904 |
|
5 |
СО2$1з CoSii5 . |
48 |
2,07337 |
199,043 99,522 |
Система Ni-Si
ОТРЛ : Ni -NisSi; (х = 0+0,4) .
К\ = кщк "к гпу ‘ккч = ' *2 • 6 = 4,5.
О й1(№811)=4,5х.
OTP-2: Ni5Si2-NiSi (х = 0,4+1,0) .
^2 - кГПу • к ромб.' Ккч - ^ ' ^у^'4 - 0,38490.
h2 (NiSi* ) -1,64604 + 0,3 849 х.
О7Р-3: NiSi - NiSi? (х=1,0+2,0) .
кз = кр0Л(б. ■ ккуб ■ ккч = -^= • 7б(-7з -1)- 4 = 0,48804.
h3 (NiSi^) = 2,51898 - 0,48804 х .
Результаты расчетов по уравнениям (21)—(23) приведены в табл. 7 и на рис. 7.
Таблица 7
Стандартная энтальпия образования силицидов никеля NiSi*
|
№ |
Вещество |
Структура |
- А/Я298, [9-И] |
2(№81Ц |
^1,2,3 |
^1,2,3 ’ УР-(21-23) |
- АуЯ298, УР- О) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
№381 №Sio>333 |
куб.-1 (Cu3Au) |
148,950±15,662 49,650 |
32,667 |
1,51990 |
1,5000 |
147,000 49,000 |
|
2 |
Ni58i2 NiSio,4 |
ГПУ |
301,666±2,992 60,333 |
33,60 |
1,79563 |
1,79904 |
302,370 60,474 |
|
3 |
№2Si NiSio,5 |
ГПУ-2 (Ni2In) |
128,080±12,552 64,040 |
35,0 |
1,82971 |
1,83849 |
128,694 64,347 |
|
4 |
Ni3Si2 NiSio,66? |
ГПУ |
37,333 |
1,90264 |
213,096 71,032 |
||
|
5 |
№811,856 |
куб.-4 (СаГ2) |
87,027±8,368 |
53,984 |
1,61209 |
1,61318 |
87,086 |
|
6 |
NISI |
ромб.-4 (МпР) |
85,354±8,368 |
42,0 |
2,03224 |
2,03044 |
85,299 |
|
7 |
№Si2 |
куб. |
86,7±2,492 |
56,0 |
1,54290 |
86,402 |
|
|
8 |
Ni2Si3 №SiL5 |
49,0 |
1,78620 |
175,048 87,524 |
Заключение
-
1. Результаты расчетов по разработанной модели не выходят за пределы доверительных интервалов экспериментальных данных и существенно их уточняют.
-
2. Модель обладает предсказательностью и позволяет рассчитывать энтальпии образования силицидов З^-элементов произвольного состава.
-
3. Полученные данные могут использоваться как справочные, а так же в технических и физико-химических расчетах особенно в области малых содержаний кремния (стали и сплавы).
Список литературы Энтальпия образования силицидов 3D-элементов периодической системы Д.И. Менделеева
- Ватолин, Н.А. Термодинамическое моделирование в высокотемпературных неорганических системах/Н.А. Ватолин, Г.К. Моисеев, Б.Г. Трусов. -М.: Металлургия, 1994. -352 с.
- Моисеев, Г.К. Стандартные энтальпии образования родственных соединений в системах металл -бор/Г.К. Моисеев, А.Л. Ивановский//Изв. ЧНЦ УрО РАН, 2005. -Вып. 3(29). -С. 5-9.
- Рябухин, А.Г. Модель расчета стандартных теплоемкостей Ср нестехиометрических соединений/А.Г. Рябухин//Известия ЧНЦ УрО РАН. -2003. -Вып. 4(21). -С. 38-42.
- Рябухин, А.Г. Расчет молярных теплоемкостей C0p нестехиометрических бинарных соединений (бертоллидов)/А.Г. Рябухин//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2003. -Вып. 4. -№ 8(24). -С. 134-141.
- Рябухин, А.Г. Математическая модель расчета энтропии кристаллических оксидов/А.Г. Рябухин//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2005. -Вып. 6. -№ 6(46). -С. 179-186.
- Рябухин, А.Г. Математическая модель расчета энтальпии образования оксидов/А.Г. Рябухин//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 31-35.
- Рябухин, А.Г. Расчет стандартной энтальпии кристаллических оксидов хрома/А.Г. Рябухин, О.Н. Груба//Изв. ЧНЦ УрО РАН. -Вып. 2(32). -2006. -С. 29-32.
- Рябухин, А.Г. Расчеты стандартных энтальпий и энергий Гиббса образования карбидов хрома произвольного состава/А.Г. Рябухин, О.Н. Груба//Вестник ЮУрГУ. Серия «Металлургия». -2005-Вып. 6.-№10 (50)-С. 9-13.
- Корнилов, И.И. Взаимодействие тугоплавких металлов переходных групп с кислородом/И.И. Корнилов, В.В. Глазова. -М.: Наука, 1967. -255 с.
- Диаграммы состояния силикатных систем: Справочник. Вып. 2. Металл-кислородные соединения силикатных систем/под ред. Н.А. Торопова. -Л.: Наука, 1969. -372 с.
- Термические константы веществ: Справочник в 10 вып./под ред. В.П. Глушко. -М.: АН СССР. -ВИНИТИ. -1974. -Вып. VII (Т.2). -343 с.


