Этапное лечение синдрома компрессии чревного ствола
Автор: Чупин Андрей Валерьевич, Орехов Павел Юрьевич, Лебедев Дмитрий Петрович, Паршин Павел Юрьевич, Лесняк Виктор Николаевич, Кемеж Юлия Владимировна, Бакулина Ирина Фадеевна
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 2 (14), 2013 года.
Бесплатный доступ
Приведен клинический случай и обзор литературы по редкому заболеванию – синдрому компрессии чревного ствола. Отражены как типичные проявления патологии, так и наиболее спорные моменты патогенеза, диагностики и лечения. Предложен диагностический алгоритм для своевременного выявления заболевания, а также показано, что для достижения хорошего эффекта может потребоваться несколько этапов вмешательства. По мере накопления и систематизации опыта возможна выработка более детальных показаний к различным видам хирургического лечения.
Компрессия чревного ствола, ангиопластика, стентирование чревного ствола
Короткий адрес: https://sciup.org/14338453
IDR: 14338453
Текст научной статьи Этапное лечение синдрома компрессии чревного ствола
Истинная распространенность ишемической болезни органов брюшной полости окончательно не ясна. Ишемия может быть обусловлена как атеросклеротическим стенозом, так и экстравазальной компрессией висцеральных сосудов. В последнем случае наиболее часто страдает чревный ствол (ЧС), который может сдавливаться срединной дуговой связкой диафрагмы (lig. arcuatum mediaum), ее внутренними ножками, гипертрофированными узлами чревного сплетения, либо увеличенными лимфатическими узлами [1-3]. Предполагается, что у 10-24% асимптомных пациентов имеется различная степень компрессии ЧС [4, 5]. Приблизительно только у 1% больных возникают выраженные клинические проявления [4], которые подталкивают клиницистов в первую очередь к выявлению заболеваний органов желудочно-кишечного тракта.
Проводившиеся во 2 половине прошлого века сопоставления клинических проявлений абдоминальной ишемии и данные рентгенологических и ангиографических исследований дали основание ввести новую сосудистую нозологию – синдром абдоминальной ишемии, вызванной компрессией чревного ствола. Было предложено несколько названий: синдром компрессии чревного ствола (СКЧС) [6], синдром срединной дугообразной связки (ДС) [7], компрессия ЧС дугобразной связкой диафрагмы [8, 9], синдром аортального туннеля диаф- рагмы [10]. Так или иначе, но во всех названиях отражается основной патогенетический механизм развития заболевания – сдавление ЧС структурами диафрагмы. В международной статистической классификации болезней (МКБ-10) этот синдром назван «синдром компрессии чревного ствола брюшной аорты» (СКЧС). При подтвержденном диагнозе СКЧС, выраженных жалобах и неэффективности консервативного лечения ставится вопрос о хирургической коррекции. Сложность этой анатомической зоны и доступа к ней, трудности самого реконструктивного этапа, вероятность рецидива заболевания являются главными лимитирующими факторами при оценке показаний к оперативному лечению. Стремление к минимальной инвазивности заставляет искать новые подходы – выполнение ренгенхирургических или лапароскопических операций, показания к которым еще не достаточно разработаны.
Литературные данные свидетельствуют об интересе к проблеме СКЧС – в интернет-ресур-се PubMed приводится 41 обзорная статья. Несмотря на это, суммарное количество наблюдений невелико, а отсутствие широкомасша-табных статистических исследований, спорные вопросы этиологии и патогенеза, трудности диагностики из-за стертого или асимптомного течения, вопросы выбора тактики лечения создают много нерешенных проблем до настоящего времени. Приводим клинический пример успешного этапного лечения пациентас выраженными проявлениями СКЧС.
Клиническое наблюдение
Больной Б, 31 г., поступил 15.03.2010 г. c жалобами на постоянные тупые ноющие боли в верхней половине живота, усиливающиеся после приема пищи, тошноту, рвоту после еды, жидкий стул 1-2 раза в день.
В анамнезе: язвенная болезнь двенадцатиперстной кишки с 1996 г., ежегодные весенние обострения. Ухудшение с января 2010 г: в течение 2-х месяцев болевой синдром нарастал, похудел на 3 кг за 2 месяца.
Объективный статус. Состояние больного удовлетворительное. Пониженного питания, гипостенического телосложения. Гемодинамика стабильная, с тенденцией к гипотонии. Живот мягкий, болезненный при пальпации в эпигастрии, правом и левом подреберьях, правой подвздошной области. Выслушивается систо- лический шум над брюшной аортой.
При лабораторных исследованиях отклонений от нормальных показателей не выявлено. Ультразвуковое исследование внутренних органов (15.03.2010): признаки диффузных изменений печени, поджелудочной железы. ЭГДС с биопсией (18.03.2010): признаки хронического гастрита, дуоденита. Рубцовая деформация луковицы 12-перстной кишки без нарушения ее проходимости. Неполное сдавление извне вертикального отдела 12-перстной кишки.
Ирригоскопия (17.03.2010): Органических изменений в толстой кишке не выявлено. Компьютерная томография брюшной полости и забрюшинного пространства(22.03.2010): субтотальный стеноз устья чревного ствола. Забрюшинные лимфоузлы не увеличены (рис. 1).
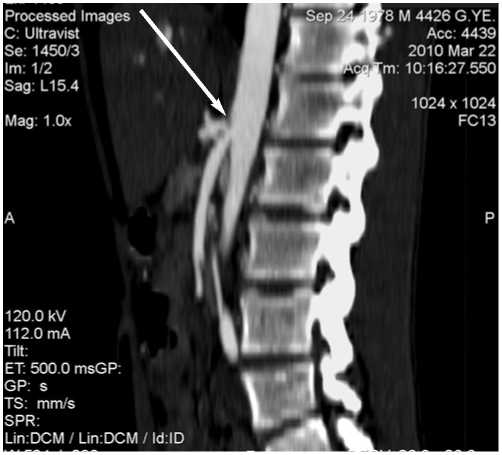
Рис. 1. МСКТ . MIP. Стеноз чревного ствола (стрелка)
Заключение ангиохирурга (23.03.2010) – «Экстравазальная компрессия чревного ствола». Учитывая положительную динамику от проводимого консервативного лечения, показания к оперативному лечению поставлены не были. После проведенного курса консервативной терапии больной выписан с улучшением – боли в верхних отделах живота значительно уменьшились, улучшилось общее состояние. Через месяц после выписки у больного вновь появились интенсивные боли и неустойчивый стул после приема даже небольшого количества пищи, прогрессирующее снижение веса. При физикальном осмотре существенных изменений по сравнению с осмотром от марта 2010 г. нет. Отмечается четкий систолический шум в эпигастральной области на выдохе, исчезновение шума на вдохе. При ангиографическом исследовании от 28.06.10 выявлена локальная окклюзия чревного ствола. Поставлен диагноз: Экстравазальная компрессия с локальной окклюзией чревного ствола. Хроническая абдоминальная ишемия, стадия субкомпенсации. Язвенная болезнь 12-перстной кишки, часто-рецидивирующее течение, ремиссия. Рубцовая деформация луковицы 12-ПК. Учитывая отрицательную динамику, определены показания к оперативному лечению. 13.07.2010 больной оперирован. Доступ – торакофренолюмбото-мия слева по 8 межреберью. При интраоперационной ревизии выявлен критический стеноз устья ЧС за счет экстравазальной компрессии гипертрофированной левой ножкой диафрагмы (рис. 2) – ножка резецирована.
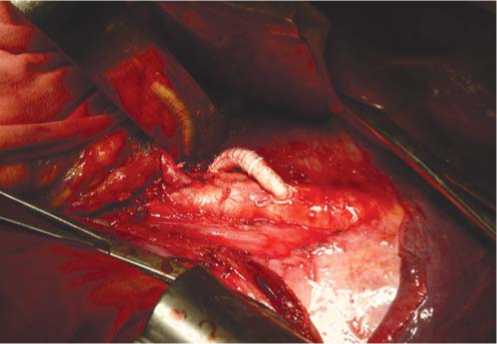
Рис. 3. Аллопротезирование чревного ствола армированным протезом GoreTex (6 мм) от дистального отдела нисходящей грудной аорты
ствола проходима. Все висцеральные ветви
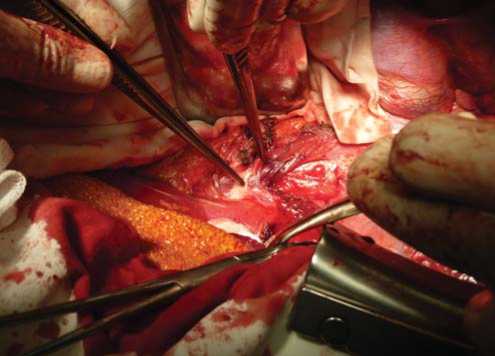
Рис. 2. Гипертрофированная мышечно-сухожильная часть (взята в пинцеты) левой ножки диафрагмы
В зоне компрессии сохраняется выраженная рубцовая перетяжка ЧС, что послужило основанием для проведения реконструктивного этапа. ЧС пересечен, в просвете циркулярный локальный фиброзный стеноз. Культя ЧС лигирована и ушита. Выполнено аллопротезиро-вание чревного ствола армированным проте- зом GoreTex 6 мм от дистального отдела нисходящей грудной аорты (рис. 3). Дистальный анастомоз наложен конец-в-конец в 1 см от трифуркации ствола. Течение послеоперационного периода гладкое, исчезли боли и расстройства стула после приема пищи. Аускуль-тативно – четкий ритмичный систолический шум в эпигастрии (от функционирующего протеза) без взаимосвязи с актом дыхания. КТ сосудов брюшной полости через 2 недели после операции: протезированная часть чревного проходимы, заполнение просвета однородное.
Контрольное обследование пациента проведено через 5 мес. Со слов больного, исчезли боли в животе после еды, появился аппетит. Неделю назад стали появляться жалобы на кратковременное чувство тяжести и дискомфорта в эпигастральной области, возникающее через 1 час после еды. При осмотре общее состояние удовлетворительное. Сохраняется выраженный дефицит массы тела. Живот мягкий, не вздут, безболезненный, аускультативно – грубый систолический шум в эпигастральной области – заподозрен рестеноз ЧС. При КТ с контрастированием подтвержден локальный критический рестеноз на 3 мм ниже дистального анастомоза (в области трифуркации).
В связи с рецидивом клиники абдоминальной ишемии, не поддающейся консервативной терапии, больному 09.02.2011 проведена ангиография, при которой верифицирован критический рестеноз ЧС ниже дистального анастомоза (рис. 4).
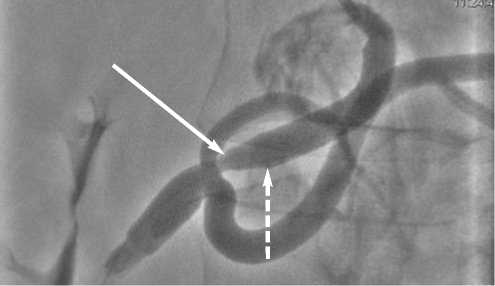
Рис. 4. Критический рестеноз чревного ствола (сплошная стрелка) ниже дистального анастомоза (пунктирная стрелка)
Предположено развитие рестеноза за счет сдавления рубцующимися окружающими тканями. Выполнена ангиопластика и стентирование ЧС в зоне стеноза с полным восстановлением просвета (рис. 5 и 6). Течение послеоперационного периода гладкое, осложнений нет. Больной отмечет исчезновение болевого синдрома и диспепсических жалоб. Систолического шума в эпигастральной области нет.
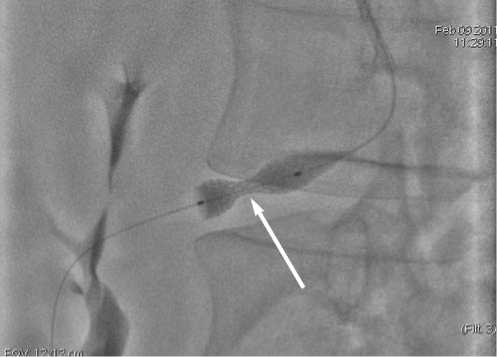
Рис. 5. Ангиопластика и стентирование чревного ствола в зоне стеноза. Отчетливо видна "перетяжка" стента и баллона в зоне критического стеноза чревного ствола (стрелка)
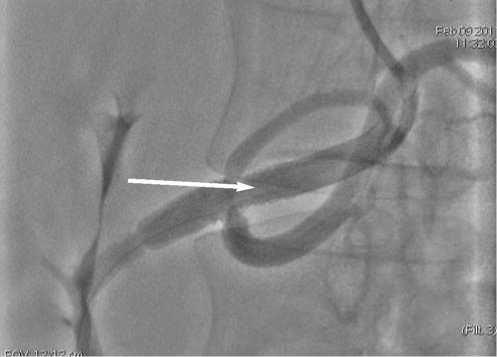
Рис. 6. Полное восстановление просвета чревного ствола после ангиопластики и стентирования (стрелка)
При контрольном осмотре через 2 месяца жалоб не предъявляет. Отмечает полное исчезновение болей, нормализацию стула. Общее состояние удовлетворительное. Живот мягкий, не вздут, безболезненный, при аускультации патологи-ческих шумов не определяется.
Осмотрен в отдаленном периоде через 23 месяца после стентирования. Периодически беспокоят «голодные» боли в эпигастрии, уменьшающиеся после приема пищи. Общее состояние удовлетворительное. Живот мягкий, не вздут, безболезненный, при аускультации патологических шумов не определяется. МСКТ от 15.01.2013 г. – ЧС после протезирования и стентирования проходим, данных за рестеноз нет (рис. 7).
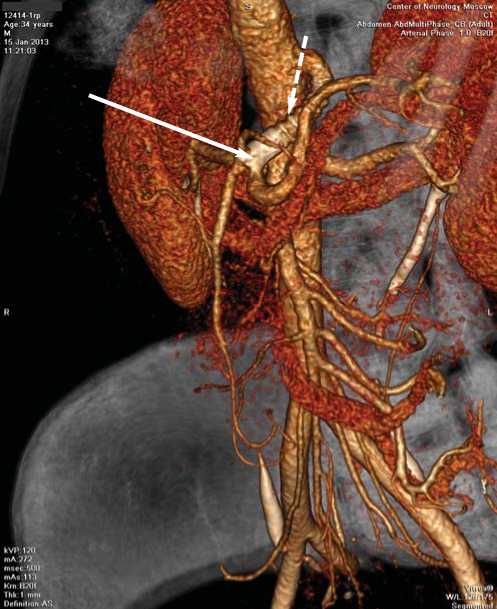
Рис. 7. МСКТ. 3D реконструкция. Проходимость армированного протеза (пунктирная стрелка), стента (сплошная стрелка) и всех ветвей чревного ствола сохранены. Стенозов не выявлено.
Обзор литературы и обсуждение проблемы
Вопросы этиологии, патогенеза и выбора метода лечения СКЧС остаются во многом нерешенными до сих пор. Рядом авторов вообще оспаривается существование такой нозологии, а сам диагноз СКЧС во многих случаях является как бы диагнозом исключения [11]. Действительно, асимптомное течение стеноза ЧС [12-18] и даже одновременная компрессия ЧС и верхней брыжеечной артерии (ВБА) [19, 20] отмечаются значительно чаще, чем симп-томные проявления.
Поводом для сомнений может служить и этиопатогенез заболевания. Основная этиологическая теория СКЧС основана на ишемии органов ЖКТ при сдавлении ЧС или ВБА. Молодой возраст [21, 22] и наблюдения семейной наследственности СКЧС [12-15, 22] свиде- тельствует в пользу врожденного характера и соответственно раннего проявления заболевания. Несмотря на это, симптоматика в детском возрасте отмечается казуистически редко [23], возникая преимущественно в среднем возрасте. Возможное объяснение более поздних клинических проявлений связывают с исчерпанием компенсаторных механизмов [21, 24], хотя одинаково развитая коллатеральная сеть у симптомных и асимптомных пациентов с СКЧС, выявляемая при ангиографии, позволяет предположить, что возникновение симптомов вызывается не только недостаточностью коллатерального русла [25]. В нашем примере возникновение симптоматики вследствие критического стеноза ЧС, рецидив клинических проявлений на фоне рестеноза и стойкое купирование абдоминальной ишемии при восстановлении нормальной проходимости ЧС может однозначно свидетельствовать в пользу ишемического генеза СКЧС вне зависимости от других механизмов и служить основой для оценки показаний к хирургической коррекции кровотока. Как уже отмечалось, восстановление нормального просвета ЧС представляет наиболее четкое доказательство взаимосвязи с абдоминальной ишемией, что поддерживается многими авторами [2, 8, 9, 24, 26-29].
На ранних этапах заболевания неспецифич-ность клинической картины приводит к тому, что пациенты долгое время обследуются у врачей различных специальностей по поводу патологии органов брюшной полости. В нашем наблюдении ранняя манифестация язвенной болезни 12-ПК в 17-летнем возрасте с ежегодными обострениями также не вызвала должной настороженности и долгое время трактовалась вне связи с сосудистой патологией.
При подозрении на СКЧС в первую очередь следует обращать внимание на внешний вид больного – характерен молодой возраст [6 , 3033 ] и астеническое телосложение [4]. У женщин заболевание возникает значительно чаще, в соотношении к мужчинам 4:1 [18]. В развернутой стадии классическая картина синдрома характеризуется болями в животе, обычно через 20-30 мин после приема пищи, нарушением функции кишечника (часто выражающиеся в неоднократном поносе), снижением веса. Симптоматика имеет сходные характеристики с ишемией кишечника при атеросклеротической окклюзии магистральных висцеральных артерий [6, 34-36] однако дискомфорт после приема пищи обычно менее выражен [30].
При подозрении на СКЧС следует обращать внимание на аускультацию брюшной полости – наличие систолического шума в эпигастрии, усиливающегося на выдохе, служит важным дифференциально-диагностическим симптомом. Однако отсутствие шума не может служить поводом для исключения, субтотальный стеноз или окклюзия ЧС могут не давать шумовой симптоматики.
Следующей стадией диагностики является использование малоинвазивных методик: допплерографии и дуплексного сканирования [18, 37-40], цифровой субтракционной ангиографии [38, 40-42], спиральной компьютерной томографии [43], магнитно-резонансной ангиографии [11, 38, 44]. К настоящему времени диагностические критерии по каждой из методик уже достаточно хорошо разработаны. На современном этапе МСКТ с контрастированием сосудов брюшной полости обладает высокой разрешающей способностью и в случае, если не планируется оперативное вмешательство, МСКТ может служить завершающим этапом диагностики. Эти же методики можно успешно использовать в послеоперационном периоде для подтверждения адекватности восстановленного кровотока.
В случае планируемого оперативного вмешательства ангиография, особенно в боковой проекции с дыхательными пробами, является наиболее информативной в диагностике анатомо-топографических особенностей и признаков стеноза ЧС. Рентгенсемиотика СКЧС хорошо описана – локальный устьевой стеноз, часто в сочетании с постстенотическим расширением [45 -52].
Показания к оперативному лечению обычно выставляются при наличии симптомов абдоминальной ишемии, доказанной критической компрессии ЧС и неэффективности консервативной терапии. В нашем наблюдении первоначально отмечался хороший терапевтический эффект, в связи с чем, показания к операции не были поставлены сразу. Быстрый рецидив клинических проявлений дает нам основание думать сейчас о том, что при выраженной клинической картине и критическом стенозе ЧС, показания к операции должны выставляться сразу же, поскольку консервативное лечение дает нестойкий результат.
Способы хирургического лечения при абдоминальной ишемии делятся на паллиатив- ные, декомпрессионные и реконструктивные [53]. Декомпрессионные операции, т.е. направленные на рассечение или удаление различных врожденных или приобретенных компрессионных факторов (резекция связки или ножек диафрагмы, удаление опухоли, аневризмы и т.д.) являются наиболее частыми, составляя до 55% от числа операций, выполняемых по поводу хронической ишемии органов пищеварения [54].
В случае сдавления ЧС дугообразной связкой или ножками диафрагмы большинство авторов приводят хорошие результаты, крайне низкую летальность и частоту осложнений [6, 27, 29, 55-61]. Подобный оптимизм и относительная простота декомпрессионных операций побудила к поиску еще менее инвазивных методик. В последние годы в литературе появились сообщения об успешном применении лапароскопической техники для декомпрессии ЧС [43, 44, 62, 63] и робот-ассистированных операций [33]. Однако, если после разделения структурных элементов диафрагмы и/или периартериальных нервных тканей, вовлеченных в процесс, стенозированный ЧС не восстанавливается до нормального калибра и остается значимый градиент давления в месте стеноза, требуется реконструкция этого сегмента путем резекции стенозированного участка с анастомозом конец-в-конец или протезирования/ шунтирования или эндартерэктомии. Выполнение этого этапа требует конверсии на открытое вмешательство. В доступной литературе мы не нашли указаний на критерии, позволяющие достоверно спрогнозировать окончательный объем вмешательства на дооперационном этапе.
Возможности интервенционной радиологии – баллонной дилатации и стентирования СКЧС – оцениваются как противоречивые и, в совокупности с отсутствием значительного количества наблюдений и отдаленных результатов, не позволяют рассматривать этот метод в качестве выбора [11, 64, 65].
В нашем наблюдении предполагаемая окклюзия ЧС сразу послужила основанием для открытого вмешательства. Выбор доступа остается на усмотрение хирурга. Окончательный объем операции становится ясным только после устранения сдавливающего фактора.
Хотя точный процент благоприятных хирургических результатов неизвестен, в большинстве публикаций он превышает 80% [22, 29]. Успех первичной операции в приводимом нами наблюдении подтверждался явным клиническим улучшением и данными МСКТ.
Сложной является проблема рецидива заболевания. В нашем наблюдении повторное возникновение симптомов абдоминальной ишемии через 5 мес. после операции заставило заподозрить рестеноз ЧС. Дуплексное сканирование в сочетании с МСКТ успешно позволяет решить вопрос верификации стеноза, однако выявление причины рестеноза и выбор лечебной тактики не столь очевидны. С равной долей вероятности причиной быстрого рецидива рестеноза могла быть как миоинтимальная гиперплазия стенки артерии в зоне наложения зажима, так и экстравазальная компрессия ЧС ниже дистального анастомоза рубцующимися окружающими мягкими тканями. Повторное хирургическое вмешательство открытым доступом в столь сложных условиях представляло значительные трудности и повышенный риск осложнений. В связи с этим решено выполнить эндоваскулярное вмешательство. Успешно выполненная ангиопластика со стентированием дала хороший эффект, что подтверждено контрольной ангиографией, исчезновением систолического шума в эпигастрии, а также быстрым клиническим улучшением. Обследование в отдаленном периоде подтвердило правильность выбранной тактики: симптомов абдоминальной ишемии нет, сосудистые шумы в брюшной полости не выслушиваются, при МСКТ ре-стенозов не выявлено. Таким образом, эндоваскулярное лечение может рассматриваться как эффективный и безопасный метод при рестенозах ЧС после декомпрессии и даже аллопротезирования.
Заключение
Приведенный клинический пример и обзор литературы показывают ряд проблем в диагностике и лечении СКЧС. Данные литературы и небольшой собственный опыт позволил нам сформулировать предварительный алгоритм для успешного решения этих вопросов. В основе лежит клиническая картина, в частности, проявления абдоминальной ишемии. Аускультация брюшной полости должна являться обязательным исследованием. Выявление патологического сосудистого шума, его связь с дыханием или другими функциональными пробами служит обоснованием для проведения дуплексного сканирования (ДС) висцеральных ветвей аорты. Сочетание клинических проявлений, в первую очередь абдоминальной ишемии и подтвержденного при ДС стеноза ЧС является показанием для завершающего этапа диагностики – МСКТ с контрастированием или ангиографией висцеральных артерий. Выбор метода вмешательства – открытой, лапароскопической или эндоваскулярной операции зависит от целого ряда обстоятельств и на сегодняшний день должен рассматриваться индивиду-ально. Хотя результаты первичного стентировании при СКЧС неоднозначны, в случае рестеноза хороший отдаленный результат позволяет рассматривать метод в качестве выбора. По мере накопления и систематизации опыта возможна выработка более детальных показаний к различным видам хирургического лечения.
Список литературы Этапное лечение синдрома компрессии чревного ствола
- PRATES J.C. Celiac trunk compression syndrome. A review. Int J Morphol. 2006; 24(3):429-436.
- Bacourt F., Brun J.G., Goeau-Brissoniere O. Compression associee du tronc coeliaque, de l'artere mesenterique superieure et de l'aorte par le ligament arque de diaphragm. Presse Med. 1984;13:731-2.
- Houssin D., Lecompte Y., Bismuth H. Compression de l'artere mesenterique superieure et du tronc coeliaque par le ligament argue median. Ann Chir. 1979; 33:71-6.
- Horton KM, Talamini MA, Fishman EK. Median arcuate ligament syndrome: evaluation with CT angiography. Radiographics 2005; 25 (5): 1177-82. PMID 16160104 DOI: 10.1148/rg.255055001
- Lindner HH, Kemprud E. A clinicoanatomical study of the arcuate ligament of the diaphragm. Arch Surg 1971; 103 (5): 600-5. PMID 5117015.
- Dunbar D., Molnar W., Beman F.F., Marable S.A. Compression of the celiac trunk and abdominal angina. Am J Roentgenol Radium Ther Nucl Med. 1965; 95:731-44.
- Carey J.P., Stemmer E.A., Connolly, J. E. Median arcuate ligament syndrome. Arch Surg. 1969;99: 441-6.
- Hivet M., Lagadec B. Compression du tronc coeliaque par le ligament argue du diaphagme. Rev. Chir. Mal. Foie de la Rate e du Princreas. 1970; 45:129-34.
- Hivet M., Lagadec B., Poilleux J. Les stenoses chroniques du tronc coeliaque. Chirurgie Mem Acad Chir. 1970; 96:483-6.
- Bobbio A. La sindrome del canale aortico del diaframma (Stenosi da compressione del tronco celiaco). Omnia Med. 1968; 46:595-608.
- Gloviczki P., Duncan A.A. Treatment of celiac artery compression syndrome: does it really exist? Perspect Vasc Surg Endovasc Ther. 2007 Sep; 19(3): 259-63.
- Van De Berg L., Lombard R., Dreze Ch., Guffens J.M., Delvigne J., Van De Berg A. Traitement chirurgical des stenoses du tronc coeliaque. Acta Chir Belg. 1972;5:334-51.
- Dondival P., Dreze Ch. Stenose du tronc coeliaque chez une mere et sa fille par compression due au ligament argue median du diaphragme. J Genet Hum, 1972; 20:466-7.
- Warter J., Storck D., Gillet B., Tongio J. Nature congenitale des stenoses par compression diaphragmatique du tronc celiaque. Nouvel argument en faveur de cette interpretation: les cas de deux soeurs. J Med. (Strasbourg). 1974; 5:369-75.
- Bech F., Loesberg A., Rosenblum J., et al. Median arcuate ligament compression syndrome in monozygotics twins. J Vasc Surg. 1994;19:934-8.
- Olivier Cl., Rettori R., Di Maria G. Stenoses non atheromateuses et compressions du tronc coeliaque. Chirurgie. 1970; 96:471-82.
- Debray C.H., Leymarios J., Hardouin J.P., et al. Les obliterations ostiales progressives des arteres digestives. Aspects clinique et arteriographique. A propos de six cas. Press Med. 1967; 75:691-6.
- Trinidad-Hernandez M., Keith P., Habib I., White J.V. Reversible gastroparesis: functional documentation of celiac axis compression syndrome and postoperative improvement. Am Surg. 2006; 72:339-44.
- Watson W.C., Sadikali F. Celiac axis compression. Experience with 20 patient and a critical appraisal of the syndrome. Ann Intern Med. 1977; 86:278-84.
- Langeron P., Becquet R., Puppinck P., et al. Double compression du tronc coeliaque et de la mesenterique superieure par ligament arque. Chirurgie. 1980;106:127-31.
- Warter J., Storck D., Kieny R., Tongio J. Stenoses congenitales du tronc coeliaque. Arch Fr. Mal. Appar. Dig. 1970; 59: 765-80.
- Warter J., Storck D., Kieny R., Tongio J. La maladie phreno-coeliaque. Ann. Radiol. 1976;19:361-70,
- Foertsch T., Koch A., Singer H., Lang W. Celiac trunk compression syndrome requering surgery in 3 adolescent patients. J Pediatr Surg. 2007;42:709-13.
- Bobbio A., Zanella E. Compression stenosis of the celiac axis (the aortic canal syndrome). Long term results of surgical decompression. Surg. 1971; 1:176-82.
- Cornell S.H. Severe stenosis of the celiac artery. Analysis of patients with and without symptons. Diagn Radiol. 1971; 99:311-6.
- Lawson J.D., Ochsner J.L. Median arcuate ligament syndrome with severe two-vessel involvement. Arch Surg. 1984;119:226-7.
- Houdard Cl., Carles J.F., Helenon Ch., Boschet P. A propos d'un cas de compression extrinseque du tronc coeliaque. J Chir. 1970; (Paris), 99:19-24.
- Snyder M.A., Mahoney E.B., Rob C.G. Symptomatic celiac artery stenosis due to constriction by the neurofibrous tissue of the celiac ganglion. Surgery. 1967;61: 372-6.
- Tridico F., Zan S., Bruno F., et al. La sindrome da compressione del tronco celiaco. Considerazioni su di un caso clinico. Min Cardioangiol. 1988; 36:385-90.
- Marable S.A., Molnar W., Beman F.M. Abdominal pain secondary to celiac axis compression. Am J Surg. 1966;111:493-5.
- Lord R.S.A., Stoney R.J., Wylie E.J. Coeliacaxis compression. Lancet 1968; 2:795-8.
- Cormier J.M., De La Fontaine P. Stenose extrinseque du tronc coeliaque. Chirurgie 1970; 96:453-6.
- Loffeld R.J., Overtoom H.A., Rauwerda J.A. The celiac axis compression syndrome. Digestion. 1995; 56: 534-7.
- Mikkelsen W.P., Zaro J.A. Intestinal angina. New Engl J Med. 1959;260:912-4.
- Bobbio A., Zanella E., Chiampo L. La stenosi da compressione del tronco celiaco. Minerva Chir. 1967; 22: 1024-34.
- Curl J.H., Thompson N.W., Stanley J.C. Median arcuate ligament compression of the celiac and superior mesenteric arteries. Ann Surg. 1971;173:314-20.
- Farma J.M., Hoffman J.P. Nonneoplastic celic axis occlusion in patients undergoing pancreaticoduodenectomy. Am J Surg. 2007; 193()3:341-4.
- Foertsch T., Koch A., Singer H., Lang, W. Celiac trunk compression syndrome requering surgery in 3 adolescent patients. J Pediatr Surg. 2007;42: 709-13.
- Jaik N.P., Stawicki S.P., Weger N.S., Lukaszczyk J.J. Celiac artery compression syndrome: successful utilization of robotic-assisted laparoscopic approach. J Gastroentestin. Liver Dis. 2007;16:93-6.
- Tseng Y.C., Tseng C.K., Chou J.W., Lai H.C., et al. A rare cause of mesenteric ischemia: celic axis compression syndrome. Intern. Med. 2007;46:1187-99.
- Desmond C.P., Roberts S.K. Exercise-related abdominal pain as a manifestation of the median arcuate ligament syndrome. Scand J Gastroenterol. 2004; 12:1310-3.
- Mensink P.B., Petersen A.S., Kolkman J., et al. Gastric exercice tonometry: The key investigation in patients with suspected celiac artery compression syndrome. J Vasc Surg. 2006;44:277-81.
- Baldasarre E., Torino G., Siani A., et al. The laparoscopic approach in the median arcuate ligament syndrome. Swiss Med. 2007. Wkly, 137: 253-4.
- Dordoni L., Tshomba Y., Giacomelli M., et al. Celiac artery compression syndrome. Sucsessful laparoscopic treatment: a case report. Vasc Endovasc Surg. 2002; 36 (4):317-21.
- Broussin, J.; Caille, J. M.; Basseau, J. P.; Grelet, P.; Diard, F. & Bellet, M. Syndrome d'obliteration du tronc coeliaque par ligament arque. J. Radiol. Electrol. Med Nucl., 1970;51: 826-8.
- Deutsch V. Compression of the coeliac trunk and the angiographic evaluation of its hemodynamic significance. Clin Radiol. 1968;19:309-14.
- Brandt L.J., Boley S.J. Celiac axis compression syndrome. A critical review. Am J Dig Dis. 1978; 23: 633-40.
- Harjola P.T., Lahtiharju A. Celiac axis syndrome. Abdominal angina caused by external compression of the celiac artery. Am J Surg. 1968; 115:864-9.
- Warter J., Storck D., Kieny R., et al. Aspects radiologiques des stenoses du tronc coeliaque. J Radiol Electrol. 1970; 51:721-30.
- Tongio J., Beeckman P., Kieny R., Warter P. Aspects angiographiques des stenoses des arteres digestives. J Belg Radiol. 1971;54:639-49.
- Huguet J.F., Deronzier R., Burelle H., et al. Les stenoses congenitales du tronc coeliaque. J Radiol. 1972; 53:895-6.
- Joubaud F., Pillet J., Boyer, J. Compression extrinseque du tronc coeliaque par ligament argue du diaphragme. Sem Hop. Paris. 1977; 53:157-64.
- Бураковский В.И., Бокерия Л.А. Сердечнососудистая хирургия. М: Медицина 1989; 752 с.
- Heberer G., Dostal G., Hoffmann K. Diagnosis and operative treatment of chronic mesenteric artery insufficiency. Dtsch Med Wochenschr 1972; 97: 19: 750-57.
- Szilagyi D.E., Rian R.L., Elliott J.P., Smith R.F. The celiac artery compression syndrome. Does it exist? Surgery. 1972; 72:849-63.
- Gautier R.,Barrie J., Sarrazin R. Les angors abdominaux non atheromateux. A propos de deux cas. Lyon Chir. 1965; 61:893-5.
- Cormier J.M., De La Fontaine P. Stenose extrinseque du tronc coeliaque. Chirurgie. 1970; 96: 453-6.
- Stanley J.C., Fry W.J. Median arcuate ligament syndrome. Arch Surg. 1971; 103:252-8.
- Kieny R., Cinqualbre J. Indications et resultats de la chirurgie des stenoses et obliterations des arteres digestives. Ann Radiol. 1976; 19:387-93. Клиническая практика №2, 2013 http://clinpractice.ru 33 Случай из практики
- Guibert B., Braillon G., Croisille M., et al. Stenose du tronc coeliaque par le ligament arque. Lyon Chir. 1980; 76:321-5.
- Ghosn P.B., Rabbat A.G., Trudel J., D'amico P., et al. Celiac compression syndrome. Can Surg. 1982; 25:377-9.
- Jarry J., Berard X., Ducasse E., et al. Laparoscopic management of median arcuate ligament syndrome. J Mal Vasc 2008; 33: 1: 30-34.
- Vaziri K., Hungness E.S., Pearson E.G., Soper N.J. Laparoscopic treatment of celiac artery compression syndrome: case series and review of current treatment modalities. J Gastrointest Surg 2009; 13(2): 293-8.
- Ikeda O., Tamura Y., Nakasone Y., Yamashita Y. Celiac artery stenosis/occlusion treated by interventional radiology. Eur J Radiol 2009; 71(2): 369-77.
- Delis KT, Gloviczki P, Altuwaijri M, McKusick MA. Median arcuate ligament syndrome: Open celiac artery reconstruction and ligament division after endovascular failure. J Vasc Surg 2007; 46: 799-802.


