Этиологическая роль условно-патогенной микрофлоры в патогенезе имплантат-ассоциированного воспаления у больных после первичного эндопротезирования коленного сустава
Автор: Бабушкина И.В., Бондаренко А.С., Ульянов В.Ю., Чибрикова Ю.А., Авилов Р.Г., Купина Е.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 1 т.14, 2018 года.
Бесплатный доступ
Цель: изучить этиологическую роль условно-патогенной микрофлоры в патогенезе имплантат-ассоциированного воспаления у больных после первичного эндопротезирования коленного сустава и антибиотикочувстви-тельность основных групп возбудителей. Материал и методы. Проведен ретроспективный анализ микробиологических исследований образцов клинического материала от 383 пациентов с имплантат-ассоциированным воспалением, развившимся после первичного эндопротезирования коленного сустава. Результаты. Грампози-тивные кокки (63,5%) являются ведущими возбудителями имплантат-ассоциированного воспаления, отмечена тенденция к увеличению этиологической роли коагулазоположительных стафилококков. Среди грамнегативной флоры (33,4%) основными возбудителями были представители семейства Enterobacteraceae и неферменти-рующие бактерии. Выявлен высокий уровень резистентности штаммов Staphylococcus spp. к антибиотикам различных групп, наиболее активными были препараты групп оксазолидинонов и глицилциклинов. Отмечен высокий уровень резистентности грамотрицательных бактерий к цефалоспоринам и макролидам; наибольшая активность выявлена у карбапенемов и фторхинолонов. Заключение. Наиболее значимыми этиологическими факторами в патогенезе имплантат-ассоциированного воспаления у больных после первичного эндопротезирования коленного сустава являются грампозитивные кокки и грамнегативные представители семейства Enterobacteraceae и неферментирующие бактерии.
Имплантат-ассоциированное воспаление, коленный сустав, патогенез, первичное эндопротезирование, условно-патогенная микрофлора, этиология
Короткий адрес: https://sciup.org/149135061
IDR: 149135061
Текст научной статьи Этиологическая роль условно-патогенной микрофлоры в патогенезе имплантат-ассоциированного воспаления у больных после первичного эндопротезирования коленного сустава
-
1 Введение . Имплантат-ассоциированное воспаление остается одной из основных проблем неудовлетворительных результатов первичного эндопротезирования коленного сустава [1], что связано с особенностями патогенеза этого типового патологического процесса, для которого характерно формирование микробной биоплёнки, защищающей возбудителей инфекции за счет образования полисахаридного комплекса от воздействия факторов неспецифического и специфического иммунитета, а также антибактериальных препаратов [1, 2]. Дифференциальная диагностика между инфекционными осложнениями и асептической нестабильностью часто бывает затруднена в связи со сложностями микробиологической верификации патологического процесса, необходимостью бактериального исследования аспирата или интраоперационных образцов перипротезных тканей, замедленным ростом возбудителей имплантат-ассоциированного воспаления [3]. Достаточно часто инфекционные осложнения, вызванные низковирулентными (low-grade) возбудителями, например эпидермальным стафилококком, ошибочно расцениваются как асептическая нестабильность [4, 5].
Грамположительная кокковая флора чаще обусловливает случаи «ранней» послеоперационной инфекции [6]. Широкое распространение метициллинре-зистентных штаммов стафилококка (MRS-инфекции) затрудняет этиотропную терапию перипротезных инфекционных осложнений в связи с частым отсутствием чувствительности не только к β-лактамным антибиотикам, но и к другим классам антибактериальных препаратов. «Поздние» инфекционные осложнения с одинаковой частотой обусловлены как грамположи-тельной аэробной кокковой флорой, так и грамотри-цательными аэробными и анаэробными бактериями. В настоящее время особое внимание уделяется роли микробных ассоциаций и полимикробной этиологии нагноений после эндопротезирования [6].
Для выбора эффективной антимикробной терапии важна идентификация так называемых «трудных для лечения» (Difficult-To-Treat — DTT) возбудителей, в связи с тем что спектр антибактериальных препаратов, активных в отношении возбудителей в составе микробной биопленки, сформированных патогенами, классифицируемыми как DTT-возбудители, крайне ограничен [6, 7].
Принимая во внимание особенности патогенеза имплантат-ассоциированного воспаления, предполагается учитывать, наряду с минимальной подавляющей концентрацией (MIC), более значимые показатели, такие как минимальная подавляющая биопленку эрадикационная концентрация (MBEC) [7].
Цель : изучить этиологическую роль условно-патогенной микрофлоры в патогенезе имплантат-ассоци-ированного воспаления у больных после первичного
эндопротезирования коленного сустава и антибио-тикочувствительность основных групп возбудителей.
Материал и методы . Проведен ретроспективный анализ результатов микробиологических исследований образцов клинического материала от 383 пациентов, находившихся на лечении в НИИТОН СГМУ им. В. И. Разумовского Минздрава России в период с 2014 по 2017 г. с имплантат-ассоциированным воспалением, развившимся в сроки от 4 недель до 12 месяцев после первичного эндопротезирования коленного сустава. Идентификацию микроорганизмов осуществляли по общепринятым методам (приказ МЗ СССР №535). Клинический материал (отделяемое ран, аспират, интраоперационные образцы перипротезных тканей) высевали на селективные и дифференциально-диагностические питательные среды, изучали морфологические, культуральные и тинкториальные свойства микроорганизмов. Микроорганизмы идентифицировали с использованием микробиологического анализатора BD BBL™ Crystal™ AutoReader (Becton Dickinson, США) и панелей Crystal TM Enteric/Nonfermenter ID Kit, Crystal TM Gram-Positive ID Kit (Becton Dickinson, США). Чувствительность микроорганизмов к антибактериальным препаратам определяли диско-диффузионным методом (МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам») с использованием Mueller-Hinton-Agar (Becton Dickinson, США) и сенси-дисков (Becton Dickinson, США). Детекцию метициллинрезистент-ности проводили с использованием «MeReSa Agar Base, MRSA AlertTM» (HiMedia, Индия). Для пробо-подготовки применяли Densi-La-Meter (Pliva-Lachema Diagnostika, Чехия).
Статистическую обработку данных осуществляли с помощью пакета программ IBM SPSS Statistics 20. Большинство полученных данных не соответствовали закону нормального распределения, поэтому взаимосвязь между качественными признаками устанавливали путем выявления взаимной сопряженности, для чего определяли критерий χ2. Рассчитывали показатель достоверности р, значения которого считали статистически достоверными при р<0,05.
Результаты . Проведенный анализ этиологической структуры возбудителей инфекционно-воспалительных осложнений после первичного эндопротезирования коленного сустава продемонстрировал достаточное разнообразие микроорганизмов различных таксономических групп. Всего за указанный период исследовано 695 образцов от 383 пациентов. Отмечено, что в 48,3% исследований выделена монокультура микроорганизмов, в 16,9% обнаружена микробная ассоциация, 34,7% образцов не дали бактериального роста. В составе микробных ассоциаций преимущественно выделены S.aureus в сочетании с грамотрицательными неферментирующими бактериями или дрожжеподобными грибами рода Candida .
В структуре выделенной микрофлоры преобладали грамположительные кокки, на долю которых приходилось 63,5% случаев. Штаммы стафилококка
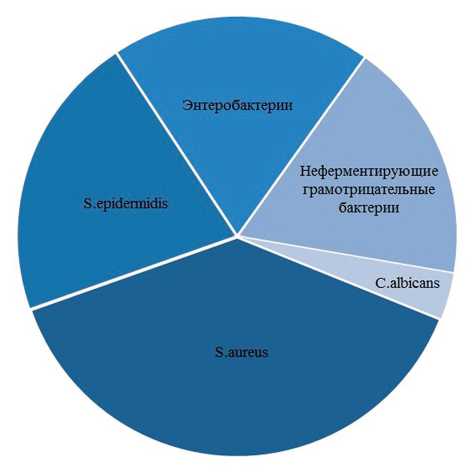
Рис. 1. Этиологическая структура основных возбудителей инфекционно-воспалительных осложнений, представленных в виде монокультуры составляли 53,9% случаев, из них к коагулазоположительным относилось 34,8% выделенных штаммов (S.aureus); 19,1% составляли штаммы S.epidermidis. Другие микроорганизмы, относящиеся к грамположи-тельной кокковой флоре (Streptococcus spp., Enterococcus spp.), встречались реже (9,6%) (рис. 1).
Как самостоятельный возбудитель инфекционно-воспалительных осложнений стафилококк обнаружен у 53,9% пациентов, в составе микробных ассоциаций — у 11,3% обследованных; всего штаммы Staphylococcus spp . в исследуемом материале выделены у 65,2% пациентов.
Отмечено увеличение доли S.aureus в этиологической структуре возбудителей имплантат-ассоции-рованного воспаления в 2016-2017 гг. на 18,3% по сравнению с 2014–2015 гг. (χ2=7,15; df=2; р<0,05). Количество инфекционных осложнений, связанных с инфицированием низковирулентными коагулазоотрицательными стафилококками, в 2016–2017 гг. уменьшилось на 21,1 % по сравнению в 2014-2015 гг. (χ2=11,43; df=2; р<0,05).
Представители грамнегативной флоры встречались в 33,4% случаев. Среди них наиболее часто обнаруживались микроорганизмы, относящиеся к семейству Enterobacteraceae (17,3%). Выявлено широкое видовое разнообразие энтеробактерий, выделенных у пациентов с гнойными осложнениями — более 14 видов. Основными представителями энтеробактерий были E.coli — 12,8% и Enterobacter spp. — 4,5%, другие представители (Klebsiella spp., Kluyvera spp., Proteus spp .) встречались значительно реже. Неферментирующие грамотрицательные бактерии встречались в 16,1% случаев, среди них штаммы Ps.aeruginosa составляли 12,8%, штаммы Acinetobacter spp. — 6,7%.
Следует отметить возрастание удельного веса энтеробактерий среди представителей грамотрица-тельной флоры в 2016-2017 гг. на 12,7% по сравнению в 2014–2015 гг. (χ2=6,19; df=2; р<0,05). Особое внимание следует обратить на грамотрицательные неферментирующие бактерии рода Acinetobacter , ко-
% 90
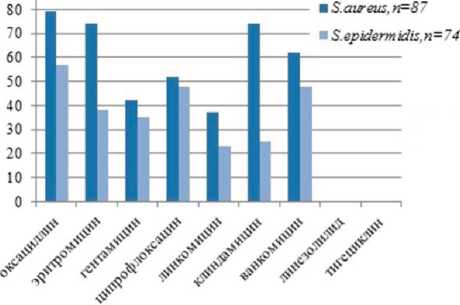
Рис. 2. Устойчивость к антибактериальным препаратам штаммов Staphylococcus spp., % торые встречались в 6,7% случаев, но все выделенные штаммы были полирезистентными.
Дрожжеподобные грибы рода Candida выделяли спорадически (3,1%) в виде самостоятельного возбудителя имплантат-ассоциированного воспаления, в составе микробных ассоциаций они выявлены в 38,3% случаев.
Проведен анализ антибиотикограмм 161 штамма стафилококка, выделенного у пациентов с инфекционно-воспалительными осложнениями после первичного эндопротезирования коленного сустава. Изучена чувствительность микроорганизмов к 17 антибактериальным препаратам семи классов (рис. 2).
Частота выделения штаммов S.aureus , устойчивых в метициллину (MRSA), составила 79,8%; штаммов S.epidermidis (MRSE) — 57,9%. Таким образом, метициллинрезистентность, определяющая устойчивость ко всем β-лактамным антибиотикам, у штаммов S.aureus была выше, чем у штаммов S.epidermidis (χ2=7,382; df=2; p<0,05).
Выявлено наличие резистентности клинических штаммов стафилококка к хинолонам. Устойчивыми к ципрофлоксацину оказались 52,4% штаммов золотистого и 48,7% штаммов эпидермального стафилококка; к левофлоксацину 48,3 и 27,3% штаммов соответственно; к моксифлоксацину 39,8% штаммов S.aureus и 29,2% штаммов S.epidermidis . К представителю группы макролидов — эритромицину были резистентны 74,5% штаммов S.aureus и 55,2% S.epidermidis .
Установлен высокий уровень резистентности штаммов Staphylococcus spp . к антибактериальным препаратам группы линкозамидов. К клиндамицину были резистентны 74,3% штаммов золотистого стафилококка и 25,7% штаммов эпидермального стафилококка; к линкомицину 37,4% штаммов золотистого стафилококка и 23,5% штаммов эпидермального стафилококка. Линкозамиды и гликопептиды являются препаратами выбора при MRS-инфекции, поэтому следует отметить высокий уровень резистентности штаммов Staphylococcus spp . к ванкомицину: 62,4% штаммов S.aureus и 48,5% штаммов S.epidermidis были устойчивы к данному препарату.
Антибиотики группы оксазолидинонов показаны при инфекционных осложнениях, вызванных MRS-штаммами, обладающими сниженной чувствительностью к гликопептидам. К наиболее широко применяемому антибиотику этой группы — линезолиду устойчивых штаммов стафилококка не выявлено. К
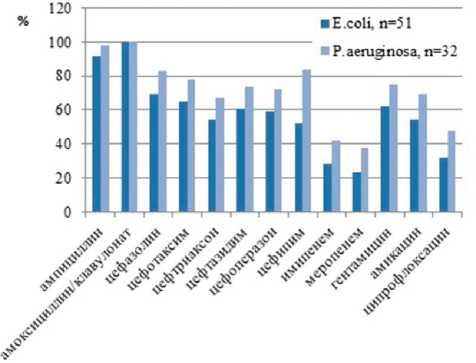
Рис. 3. Устойчивость к антибактериальным препаратам клинических штаммов грамотрицательных бактерий, % представителю группы глицилциклинов — тигецикли-ну также не выявлено резистентных штаммов.
В результате анализа антибиотикограмм установлено, что у штаммов, выделенных в составе микробных ассоциаций и в виде монокультуры, чувствительность к антибактериальным препаратам существенно различается. У штаммов S.aureus , выделенных в виде монокультуры, устойчивость к метициллину, определяющая устойчивость ко всем в-лактамным антибиотикам, обнаружена в 79,8% случаев, тогда как штаммы S.aureus , выделенные в составе микробных ассоциаций, метициллинре-зистентностными были в 85,4% случаев (х2=9,351; p<0,05). Среди штаммов S.epidermidis, выделенных в виде монокультуры, 57,9% были метициллинрези-стентными (MRSE), в составе микробных ассоциаций резистентность к метициллину была обнаружена у 74,9% штаммов (х2=7,268; p<0,05).
У выделенных клинических штаммов грамотри-цательных бактерий проанализирована чувствительность к 15 антибактериальным препаратам. Установлен высокий уровень резистентности штаммов энтеробактерий и грамотрицательных неферментирующих бактерий к профильным антибиотикам (рис. 3).
Все исследуемые штаммы энтеробактерий и неферментирующих грамотрицательных бактерий были устойчивы к ингибиторозащищенному пенициллину (амоксиклаву); к пенициллину расширенного спектра действия (ампициллину) — 92,5% штаммов E.coli и 98,7% штаммов Paeruginosa . Выявлен высокий уровень резистентности клинических штаммов грамотрицательных бактерий к цефалоспоринам. К цефазолину были устойчивы 69,5% штаммов E.coli и 83,0% штаммов Paeruginosa. К цефалоспоринам III поколения (цефотаксиму, цефтриаксону, цефтазидиму, цефоперазону) были устойчивы 60,3% штаммов E.coli и 73,1% штаммов Paeruginosa. К цефипиму резистентны 52,4% штаммов E.coli и 84,2% штаммов P.aeruginosa. Выявлена устойчивость штаммов грамотрицательных бактерий к аминогликозидам (62,7% штаммов E.coli и 75,1% штаммов Paeruginosa были устойчивыми к гентамицину, к амикацину 54,5% штаммов E.coli и 69,3% штаммов Paeruginosa ).
Наиболее выраженная активность в отношении штаммов грамотрицательных бактерий отмечена у карбапенемов (75,1 % штаммов E.coli и 67,8% штаммов P.aeruginosa были чувствительны к имипенему и меропенему). Несколько меньшая активность на- блюдалась у антибиотиков группы фторхинолонов: 63,8% штаммов E.coli и 51,3% штаммов Paeruginosa чувствительны к ципрофлоксацину, левофлоксацину и моксифлоксацину.
Обсуждение . Установлено, что ведущим возбудителем имплантат-ассоциированного воспаления является грамположительная кокковая флора, представленная в основном штаммами S.aureus и коагулазоотрицательными стафилококками. Обнаружена тенденция к дальнейшему увеличению роли S.aureus в этиологической структуре возбудителей инфекционно-воспалительных осложнений после первичного эндопротезирования коленного сустава
Широкое распространение метициллинорезистентных штаммов S.aureus (MRSA) и S.epidermidis (MRSE) создает сложную проблему в плане выбора рациональной антибиотикотерапии, в связи с тем что для этих штаммов характерна не только устойчивость ко всем β-лактамным антибиотикам, но и ассоциированная устойчивость к аминогликозидам, макролидам, линкозаминам и тетрациклинам.
Существенная роль стафилококков в этиологической структуре ортопедической инфекции обусловлена не только высокой частотой их встречаемости и высоким уровнем приобретенной устойчивости к антибактериальным препаратам различных групп, но и способностью быстро формировать многоуровневые микробные биопленки на поверхности искусственных имплантатов. Присутствие возбудителей в составе биопленок затрудняет диагностику пери-протезной инфекции и значительно снижает эффективность антибактериальной терапии, в том числе препаратами, высокоактивными в отношении MR-стафилококков [8].
Грамотрицательные бактерии, преимущественно энтеробактерии, псевдомонады и ацинетобактер, сохраняют существенную роль в этиологической структуре имплантат-ассоциированного воспаления. Выявлено большое видовое многообразие энтеробактерий, выделенных у пациентов с гнойными осложнениями, отмечено возрастание их роли в общей структуре возбудителей инфекционных осложнений после первичного эндопротезирования коленного сустава в 2016–2017 гг. Источниками энтеробактерий в стационаре обычно является сам пациент, поэтому не следует недооценивать роль эндогенного пути инфицирования. Наиболее тяжелые гнойно-воспалительные осложнения вызывают неферментирующие грамотрицательные бактерии, которые встречались в 16,1% случаев. Их клиническая значимость обусловлена полирезистентностью подавляющего большинства штаммов и широким спектром факторов вирулентности, среди которых высокая способность к адгезии с образованием биопленок. Нозокомиальные штаммы Acinetobacter spp. часто обладают плазмидами антибиотикорезистентности и способны передавать их другим штаммам в составе ассоциатов, что значительно затрудняет эффективную антибио-тикотерапию. Наличие ассоциаций микроорганизмов может свидетельствовать о неэффективности предшествующей антибактериальной терапии, способствующей селекции антибиотикорезистентных штаммов [9, 10].
Для выбора тактики лечения и антимикробной терапии значимой является идентификация трудных для лечения (Difficult-To-Treat — DTT) возбудителей, к которым относят рифампицин-устойчивые стафилококки, фторхинолон-устойчивые грамотрицатель-ные бактерии, грибы Candida spp. [11].
Заключение . Наиболее значимыми этиологическими факторами в патогенезе имплантат-ассоции-рованного воспаления у больных после первичного эндопротезирования коленного сустава являются грампозитивные кокки и грамнегативные представители семейства Enterobacteraceae и неферментирующие бактерии.
Список литературы Этиологическая роль условно-патогенной микрофлоры в патогенезе имплантат-ассоциированного воспаления у больных после первичного эндопротезирования коленного сустава
- Клюшин H.M., Абабков Ю.В., Ермаков A.M. Парапротезная инфекция как причина ревизионных вмешательств после тотального эндопротезирования коленного сустава: этиология, диагностика, лечение. ЭНИ Забайкальский медицинский вестник 2015; 2: 189-197
- Hopкин И.А., Шпиняк С. П., Гиркало М.В., Барабаш А. П. Исходы хирургического лечения инфекционных осложнений тотального эндопротезирования крупных суставов. Вестник травматологии и ортопедии им. Н.Н. Приорова 2014; 3: 67-71
- Божкова С. А. Современные принципы диагностики и антибактериальной терапии инфекций протезированных суставов (обзор литературы). Травматология и ортопедия России 2011; 3: 126-136
- Божкова С. А., Тихилов P.M., Краснова M.B. и др. Ортопедическая имплантат-ассоциированная инфекция: ведущие возбудители, локальная резистентность и рекомендации по антимикробной терапии. Травматология и ортопедия России 2013;4:5-15
- Masters JP, Smith NA, Foguet P, et al. A systematic review of the evidence for single stage and two stage revision of infected knee replacement. ВМС Musculoskeletal Disorders 2013 Jul; 14: 222. DOI: 10.1186/1471-2474-14-222
- Cancienne JM, Granadillo VA, Patel KJ, et al. Risk Factors for Repeat Debridement, Spacer Retention, Amputation, Arthrodesis, and Mortality after Removal of an Infected Total Knee Arthroplasty with Spacer Placement. J Arthroplasty 2017 Sep; S0883-5403 (17) 30760-X.
- DOI: 10.1016/j.arth.2017.08.037
- Ульянов В. Ю., Лунева И. О., Ульянова Е. В. Способность госпитальных штаммов Staphylococcus aureus к пленкообразованию. Международный журнал прикладных и фундаментальных исследований 2012; 5: 89
- Ульянов В.Ю. Способность госпитальных штаммов Ps. aeruginosa к пленкоо-бразованию. Клиническая микробиология и антимикробная химиотерапия 2012; 14 (2): 52
- Бабушкина ИВ, Мамонова ИА, Гладкова ЕВ. Этиологическая роль возбудителей хронического остеомиелита и влияние наночастиц металлов на клинические штаммы Staphylococcus aureus. Вестник Пермского университета. Серия: Биология 2014; 2: 52-56
- Гординская H.A., Сабирова E.B., Абрамова H. В. и др. Резистентность основных возбудителей инфекции в отделении гнойной остеологии. Вопросы травматологии и ортопедии 2012; 2 (1): 14-17
- Oliva A, Furustrand Tafin U, Maiolo EM, Jeddari S,Betrisey B, Trampuz A. Activities of fosfomycin and rifampin on planktonic and adherent Enterococcus faecalis strains in an experimental foreign-body infection model. Antimicrob Agents Chemother2014; 58 (3): 1284-1293.


