Этиология инфекционного спондилодисцита: есть ли связь с успехом лечения
Автор: Любимова Л.В., Любимов Е.А., Павлова С.И.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.31, 2025 года.
Бесплатный доступ
Введение. Проблема лечения пациентов с инфекционными спондилодисцитами в настоящее время приобрела большую актуальность из-за роста частоты возникновения заболевания, трудности диагностики и низкой выявляемости этиологического фактора.Цель работы - оценить зависимость исходов лечения больных инфекционным спондилодисцитом от положительных / отрицательных результатов микробиологического исследования интраоперационных материалов.Материалы и методы. Проведен ретроспективный анализ исходов лечения 52 пациентов с инфекционным спондилодисцитом с отсутствием роста культуры в исследуемых биологических образцах (группа I, n = 22) и выявленным возбудителем (группа II, n = 30). Диагноз верифицировали на основании МРТ-картины, результатов интраоперационного микробиологического исследования тканей, клинической картины, маркеров воспаления в крови (СОЭ и СРБ). Неблагоприятными исходами считали смерть и/или рецидив спондилодисцита.Результаты. Положительный рост культуры выявлен в 57,7 % случаев: преобладали стафилококки (57,2 %), а именно Staphylococcus aureus (42,9 %). Пациенты группы I в два раза чаще принимали антибиотики на догоспитальном этапе (p = 0,0049), имели на 20 % больше времени задержки в диагностике (p = 0,7286), средние уровни СРБ и СОЭ ниже, чем во II группе (p > 0,05). Неблагоприятные исходы - по одному летальному случаю в каждой группе; рецидивы инфекции - только в группе II в 13,3 % случаев (p = 0,3814), причем три четверти случаев вызваны Pseudomonas aeruginosa.Обсуждение. Неблагоприятными прогностическими факторами при инфекционных спондилодисцитах являются отрицательный микробиологический результат, неврологические нарушения и сопутствующий эндокардит (p ≤ 0,05). Ассоциированный с S. aureus спондилодисцит сопровождается повышенными смертностью и частотой осложнений.Заключение. Больные спондилодисцитами с отрицательным результатом микробиологического исследования в сравнении с пациентами с культуроположительной инфекцией имели лучший исход лечения при минимуме рецидивов (p > 0,05).
Инфекционный спондилодисцит, этиология спондилодисцита, инфекция позвоночника, возбудитель спондилодисцита, рецидив инфекции позвоночника, исходы лечения спондилодисцита, антибиотикотерапия
Короткий адрес: https://sciup.org/142245099
IDR: 142245099 | УДК: 616.721.1-002.1-022-02-08:615.33:615.036 | DOI: 10.18019/1028-4427-2025-31-2-202-209
Текст научной статьи Этиология инфекционного спондилодисцита: есть ли связь с успехом лечения
Проблема лечения больных инфекционными заболеваниями позвоночника (спондилодисциты) в настоящее время приобрела большую актуальность из-за роста частоты возникновения патологии. Во Франции в 2002–2003 гг. уровень заболеваемости инфекционным спондилодисцитом (ИС) составлял 0,2–2,4 на 100 тыс. населения в год [1], к 2010 г. увеличившись до 6,1, а в 2019 г. — до 11,3 [2]. В 2020 г., по данным регистра Германии, этот показатель составил 14,4 на 100 тыс. населения в год [3].
Другими, не менее важными, проблемами инфекционных заболеваний позвоночника являются трудность диагностики и низкая частота выявляемости этиологического фактора. По данным французского исследования SPONDIMMO, средняя продолжительность симптомов до постановки диагноза ИС составляет 25 (0–427) дней [4]. К моменту постановки диагноза пациенты амбулаторно принимают как нестероидные противовоспалительные, так и антибактериальные препараты, что, в конечном итоге, может влиять на выявление возбудителей инфекции.
Отсутствие роста микроорганизмов в образцах биологических материалов может достигать 68 % [5]. По данным исследования E. Pola et al., отрицательный микробиологический посев является наиболее значимым неблагоприятным прогностическим фактором ИС [6]. Однако существует ограниченное количество исследований, которые предоставляют или сравнивают результаты лечения в случаях ИС, когда возбудитель был или не был обнаружен.
Цель работы — оценить зависимость исходов лечения больных инфекционным спондилодисцитом от положительных / отрицательных результатов микробиологического исследования интраоперационных материалов.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен сплошной ретроспективный анализ случаев лечения пациентов с инфекционным спондило-дисцитом в условиях Федерального центра травматологии, ортопедии и эндопротезирования (Чебоксары, далее — Центр) за период с 2016 по 2022 гг.
В исследование включены все случаи консервативного и хирургического лечения ИС ( n = 52), за исключением пациентов в возрасте 18 лет и младше.
Диагноз ИС основан на данных клинической картины, МРТ-исследованиях, маркерах воспаления в крови (скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ)), результатах микробиологического исследования интраоперационных тканевых биоптатов, смывов с удаленных металлоконструкций. Время доставки биоматериала в лабораторию составляло 15–60 мин.
Степень тяжести спондилодисцита определяли по шкале SponDT, включающей оценку результатов СРБ, боли по ВАШ и данных МРТ-исследования [7].
Исследования крови на стерильность проводили у пациентов с признаками системной воспалительной реакции (повышение уровня прокальцитонина в крови более 1,0 нг/мл), не получавших антибактериальную терапию ( n = 2).
В четырех случаях проведено исследование биопсийного материала, в 48 — тканевых биоптатов, взятых во время операции, в 14 — смывов с удаленных металлоконструкций. Взятие биологического материала у пациентов, получающих консервативную терапию, осуществляли в условиях операционной методом игольной аспирации из пространства диска под контролем электронно-оптического преобразователя с рентген-навигацией. Забор тканевых биоптатов во время операции проводили в количестве не менее трех образцов с последующим выделением изолятов микроорганизмов в соответствии с утвержденными стандартами микробиологических исследований. Образцы тканей гомогенизировали, затем помещали в бульон с тиогликолевой средой. Производили пересев на плотные питательные среды: на 1 сут. — на Колумбийский, Шоколадный и Шедлер агары; на 5 сут. — на Шоколадный и Шедлер агары, и на 10 сут. — на Шедлер агар. Для аэробных, анаэробных и капнофильных микроорганизмов условия инкубации создавали с помощью газогенерирующих пакетов. Металлические конструкции, извлеченные во время операции, для выделения микроорганизмов из микробных биопленок подвергали обработке в УЗ-машине BRANSON 8510 (США) в течение 5 мин. при частоте (40 ± 2) кГц с последующим посевом смывов на питательные среды и на флаконы анализатора. Срок инкубации составлял 14 сут.
Видовую идентификацию возбудителей с определением чувствительности выполняли на автоматическом анализаторе Vitec 2-compact (Bio Merieux, Франция) и полуавтоматическом анализаторе Multiscan FC (Thermo Fisher, США).
Пациенты с ИС разделены на две группы: I, основная ( n = 22), — с отсутствием роста культуры в исследуемых биологических образцах; II, контрольная ( n = 30), — рост культуры получен. Группы сопоставимы по полу, возрасту, ИМТ и коморбидности (табл. 1).
Таблица 1
Характеристика пациентов исследуемых групп
|
Показатели |
I группа ( n = 22) |
II группа ( n = 30) |
р < 0,05 |
||
|
абс. |
% |
абс. |
% |
||
|
Мужчины |
12 |
54,5 |
16 |
53,3 |
1,0000 |
|
Женщины |
10 |
45,5 |
14 |
46,7 |
|
|
Коморбидность, в т.ч.: |
|||||
|
сахарный диабет |
4 |
18,2 |
7 |
23,3 |
0,7411 |
|
онкопатология |
1 |
4,5 |
2 |
6,7 |
1,0000 |
|
ВИЧ-инфекция |
0 |
0,0 |
2 |
6,7 |
0,5023 |
|
системные заболевания |
2 |
9,1 |
2 |
6,7 |
1,0000 |
|
Локализация инфекционного процесса по отделам позвоночника, в т.ч.: |
|||||
|
шейный |
3 |
13,6 |
1 |
3,3 |
0,3053 |
|
грудной |
5 |
22,7 |
6 |
20,0 |
1,0000 |
|
поясничный или пояснично-крестцовый |
14 |
63,6 |
23 |
76,7 |
0,3625 |
|
Классификация по степени тяжести (SponDT): |
|||||
|
легкая |
0 |
0,0 |
1 |
3,3 |
1,0000 |
|
умеренная |
10 |
45,5 |
15 |
50,0 |
0,7852 |
|
тяжелая |
12 |
54,5 |
14 |
46,7 |
0,7793 |
|
По пути инфицирования: |
|||||
|
первичные (гематогенные) |
14 |
63,6 |
23 |
76,7 |
0,1461 |
|
вторичные (послеоперационные) |
8 |
36,4 |
7 |
23,3 |
|
|
Количество пациентов, пролеченных антибиотиками на амбулаторном этапе |
19 |
86,4 |
13 |
43,3 |
0,0049* |
|
Возраст, лет |
56,8 (50,2–60,8) |
57,8 (56,4–64,6) |
0,7564 |
||
|
ИМТ, кг/м2 |
26,3 (23,2–29,4) |
28,2 (26,1–30,4) |
0,2977 |
||
|
Период от начала заболевания до выставления диагноза, дни |
122,5 (64,3–180,7) |
99,9 (64,9–134,3) |
0,7286 |
||
* — статистически значимые различия
Оценку болевого синдрома после операции и на этапе катамнеза оценивали по визуальной аналоговой шкале ВАШ, удовлетворенность результатами лечения — по опросникам EQ-5D и EQ VAS [8, 9].
Благоприятными исходами считали полное заживление послеоперационной раны с нормализацией лабораторных и рентгенологических данных на момент проведения исследования (даже при сохраняющемся неврологическом дефиците и/или хроническом болевом синдроме). Неблагоприятными исходами считали смерть и/или рецидив спондилодисцита с клиническими и инструментальными признаками инфекции. Общий срок наблюдения после санации составил 32,9 (24,9–35,1) мес.
Полученные данные регистрировали в виде электронных таблиц, визуализацию структуры данных и их анализ проводили с помощью программы MS Office Excel, 2007 (Microsoft, США) и программы Graf Pad. Для описания количественных показателей выполняли проверку на нормальность распределения по критерию Колмогорова – Смирнова. При нормальном распределении для описания признака использовали его среднее значение и среднеквадратичное отклонение с 95 % ДИ. Сопоставление количественных признаков между группами сравнения выполняли с применением критерия Манна – Уитни. Категориальные данные (пол, исход) описывали условными кодами не измеряемых категорий, не подлежащих упорядочиванию. Для оценки эффективности проведенного лечения в группах проводили расчет точного теста Фишера. Различия показателей между группами считали статистически достоверными при p < 0,05.
РЕЗУЛЬТАТЫ
Среди 52 пролеченных больных ИС в 42,3 % ( n = 22) мы не получили роста микроорганизмов в исследуемых интраоперационных биологических материалах ( n = 21) и тканях во время биопсии ( n = 1). Пациенты с отрицательными результатами посевов (группа I) в сравнении с группой II чаще получали антибактериальную терапию на догоспитальном этапе ( p = 0,0049) и имели на 20 % больше времени задержки в диагностике ( p = 0,7286).
В обеих группах преобладали поражения поясничного или пояснично-крестцового отделов позвоночника. Статистически значимых различий по степени тяжести спондилодисцита в группах наблюдения не выявлено, однако среди пациентов группы I тяжелые спондилодисциты встречали чаще (54,5 % против 46,7 %).
Два случая ИС (6,7 %) с выделенными микроорганизмами отнесены к полимикробной инфекции и представлены микробными ассоциациями:
-
1) Pseudomonas aeruginosa + Enterococcus faecalis + Enterococcus faecium + Staphylococcus epidermidis MRSE ;
-
2) Staphylococcus epidermidis MRSE + Corynebacterium .
Среди возбудителей мономикробной инфекции (93,3 % случаев) ведущими патогенами являлись стафилококки, удельный вес которых составил 57,2 % с превалированием доли Staphylococcus aureus . Второе место по частоте встречаемости принадлежало грамотрицательным микроорганизмам (21,4 %), представленным Escherichia coli, Pseudomonas aeruginosa и Klebsiella pneumonia (рис. 1).
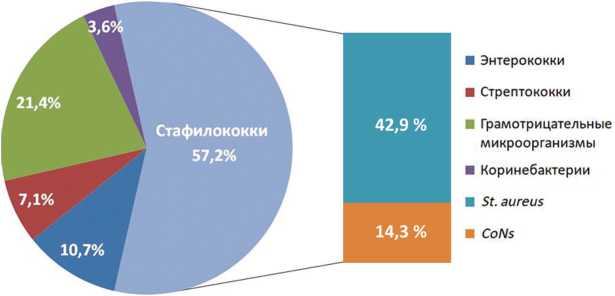
Рис. 1. Спектр возбудителей спондилодисцитов с одним выделенным микроорганизмом
Исследование крови на стерильность показало положительный результат у двух обследованных пациентов контрольной группы, не получавших антибактериальную терапию на амбулаторном этапе: в одном случае выявлен Staphylococcus aureus , в другом — Streptococcus pneumoniae .
На догоспитальном этапе в обеих группах наблюдения были повышены лабораторные показатели воспаления в крови с преобладанием более высоких значений СОЭ, СРБ и Д-димера в группе II без статистически значимых различий (табл. 2).
Таблица 2
Лабораторные показатели в группах до санации
|
Показатели |
I группа ( n = 22) |
II группа ( n = 30) |
р < 0,05 |
|
Лейкоциты крови, 109/л |
8,3 (7,0–9,5) |
7,7 (6,6–8,9) |
0,3152 |
|
СОЭ (мм/ч) |
35,1 (20,7–49,6) |
52,9 (13,7–66,1) |
0,0597 |
|
СРБ (мг/л) |
52,9 (14,4–83,8) |
61,1 (42,3–80,0) |
0,1802 |
|
Д-димер (нг/мл) |
1137,9 (643,6–1632,0) |
1305,9 (880,2–1732,0) |
0,5104 |
По данным МРТ-исследования наличие абсцессов различных локализаций в группе I выявлено в 54,5 % ( n = 12), в группе II — в 43,3 % ( n = 13) случаев ( p = 1,0000).
Консервативную терапию в виде антибиотикотерапии (6–12 нед.) с фиксацией позвоночника жестким корсетом в группе I получил один пациент, в группе II — три пациента ( p = 0,6288). Остальным пациентам с ИС выполнено хирургическое лечение (табл. 3).
Таблица 3
Методы хирургической санации в группах
|
Хирургические вмешательства |
I группа ( n = 21) |
II группа ( n = 27) |
||
|
абс. |
% |
абс. |
% |
|
|
Декомпрессия с этапным вентральным и дорсальным спондилодезом |
2 |
9,5 |
– |
|
|
Вентральный спондилодез |
2 |
9,5 |
2 |
7,4 |
|
Передний спондилодез с фиксацией пластиной |
2 |
9,5 |
– |
|
|
Задний спондилодез с фиксацией ТПФ |
14 |
66,7 |
21 |
77,8 |
|
Санация только с декомпрессией |
1 |
4,8 |
3 |
11,1 |
|
Задний спондилодез костной аутокрошкой |
– |
1 |
3,7 |
|
Средняя продолжительность внутривенной антибиотикотерапии составила (12,4 ± 3,8) дня, пероральной антибактериальной терапии — (71,9 ± 55,4) дня. В группе II эмпирическая внутривенная антибактериальная терапия «гликопептид + бета-лактам» была наиболее частой внутривенной схемой (54,5 %), далее по частоте — комбинация «цефуроксим + амикацин» (22,7 %); монотерапия цефалоспоринами III–IV поколения (13,6 %) и комбинация цефалоспоринов с рифампицином (9,1 %). Фтор-хинолоны в сочетании с рифампицином были наиболее частой схемой эмпирической пероральной антибактериальной терапией (36,4 %), другие распространенные пероральные схемы: монотерапия хинолонами (18,2 %) или клиндамицином (18,2 %), комбинация «хинолон + доксициклин» (13,6 %) или «хинолон + ко-тримоксазол» (13,6 %). Пероральную комбинированную терапию двумя и более антибиотиками использовали в 48,1 % случаев.
При успешной санации достоверных различий в качестве жизни больных в группах наблюдения не выявлено (табл. 4). Пациенты, как правило, удовлетворены качеством жизни в среднем на 75 баллов.
Таблица 4
Удовлетворенность пациентов проведенным лечением на этапе катамнеза
|
Показатели |
I группа ( n = 22) |
II группа ( n = 30) |
р < 0,05 |
|
Оценка качества жизни по опроснику EQ-5D (от 0 до 1 балла) |
0,71 (0,61–0,80) |
0,76 (0,67–0,86) |
0,3083 |
|
Оценка состояния здоровья по «термометру здоровья» EQ-VAS (от 0 до 100 баллов) |
70,33 (59,23–81,43) |
76,83 (69,83–84,14) |
0,3256 |
|
Шкала ВАШ, баллы |
2,53 (1,58–3,49) |
2,11 (1,43–2,80) |
0,6184 |
Средний срок наблюдения после санации в группе I составил 31,5 мес. (20,5–36,5), в группе II — 34,0 мес. (23,0–37,0), р = 0,6397. Рецидивы в виде глубокой инфекции позвоночника в группе I не выявлены, в группе II рецидивы наблюдали у 4 (13,3 %) пациентов, санированы оперативным путем ( р = 0,3814). Летальные исходы имели место в каждой группе наблюдения по одному случаю: на фоне прогрессирования опухолевого процесса в группе I и после консервативного лечения рецидива инфекционного спондилодисцита на фоне тромбоза брыжеечной артерии в группе II. В трех случаях из четырех рецидивы инфекции наблюдали у пациентов со спондилодисцитом, вызванным Pseudomonas aeruginosa .
ОБСУЖДЕНИЕ
Микробиологическое исследование является ключевым элементом в диагностике и лечении ИС. Однако получить культуральный рост при исследовании биологического материала удается далеко не во всех случаях. Авторы нескольких крупных проспективных исследований обнаружили, что возбудитель не может быть выделен в 21–34 % случаев [1, 10–12].
В исследовании M. Stangenberg et al. показано, что частота обнаружения бактериальных патогенов посредством интраоперационного взятия проб составляла 66,3 % и могла быть увеличена за счет результатов посевов крови до общего показателя 80,6 % ( n = 170/211) [13]. По данным исследования E. Pola et al., микробиологический диагноз установлен в 74,3 % случаев; положительный анализ крови на стерильность — в 55,5 %, выявление возбудителя при пункционной биопсии — в 44,1 %, при интраоперационной — в 59,6 % случаев [6]. Наши результаты поиска возбудителя ИС отличаются от данных зарубежных коллег, поскольку мы ограничились микробиологическим исследованием образцов пункционной биопсии и интраоперационного биоматериала, получив положительный результат в 57,7 % случаев. В связи с тем, что 61,5 % пациентов на дооперационном этапе получали антибактериальную терапию, им не было проведено исследование крови на стерильность. Не исключается, что выполнение данного анализа в рамках скрининг-диагностики ИС могло бы уточнить наши результаты в поиске инфекционного агента.
Оценивая структуру выделенных при микробиологическом исследовании возбудителей, мы получили подобные с другими исследованиями результаты, согласно которым S. aureus являлся наиболее распространенным возбудителем примерно в 50 % случаев спондилодисцита [14, 15]. Однако в опубликованном в 2023 г. анализе заболеваемости спондилодисцитом в Германии за десятилетний период представлены данные, свидетельствующие о снижении доли S. aureus в общей микробной структуре: в большинстве случаев зарегистрированы коагулазонегативные стафилококки (27,1 %), за которыми следовали грамотрицательные бактерии (22,4 %), на долю S. aureus приходилось лишь 19,4 % [3].
Недавний анализ случаев ИС после имплантации металлоконструкций [16] показал, что наиболее распространенным возбудителем являлся S. epidermidis (40,6 %), который в последнее время стал преобладать и у пациентов с имплантат-ассоциированной инфекцией [17]. О росте значимости грамотрицательных патогенов в этиологии ИС также свидетельствует проведенное во Франции исследование (за 2010– 2019 гг.) с частотой выделения данных патогенов 26,4 % (второе место после стафилококков, — 52,3 %) [2].
ИС является сложным для лечения состоянием и вызывается широким спектром организмов [18]. Поиск возбудителя инфекции — важная составляющая лечения пациентов с ИС. По нашим данным, гра-мотрицательные микроорганизмы и коагулазонегативные стафилококки входят в тройку лидеров с частотой встречаемости 21,4 % и 14,6 % соответственно. Подобная тенденция роста грамотрицательных патогенов и коагулазонегативных стафилококков, вероятно, связана с эпидемиологическим неблагополучием, вызванным старением населения, увеличением числа ослабленных пациентов с множественной коморбидностью, а также ростом инвазивных процедур и хирургических вмешательств на позвоночнике.
Несмотря на то, что пациенты контрольной группы получали этиотропную антибактериальную терапию, лучшие результаты лечения, характеризующиеся отсутствием рецидива инфекции при аналогичных показателях удовлетворенности качеством жизни, получены в группе с отрицательным бактериологическим исследованием. Данные, схожие с нашими, получили J. Gillard et al., которые не зарегистрировали рецидивов инфекции после эмпирической двухкомпонентной антимикробной терапии, включающей внутривенное введение фторхинолонов, в отличие от группы пациентов в установленным инфекционным агентом и подобранной этиотропной терапией [19].
M. Stangenberg et al. получили данные о том, что ассоциированный с S. aureus спондилодисцит сопровождался повышенной смертностью и более высокой частотой осложнений, что связано с высокой частотой выявления возбудителя не только в тканях, но и в кровотоке [13].
В отличие от ранее обсуждаемых работ, N. Hopkinson et al. подчеркнули важность поиска возбудителя ИС (поскольку результат лечения хуже, если возбудитель не обнаружен) и показали тенденцию к более длительным курсам антибиотикотерапии. Авторы также указали на то, что эти случаи сложнее поддаются лечению. Отметим, что исследуемая группа пациентов представлена малой выборкой: 22 случая — в публикации 2001 г. и 23 — в 2016 г. [21, 22].
В 2018 г. E. Pola et al. опубликовали исследование 207 случаев ИС, сделав заключение, что отрицательный микробиологический посев являлся статистически подтвержденным отрицательным прогностическим фактором, наряду с неврологическими нарушениями, на момент постановки диагноза и фоновым эндокардитом [6]. Следует отметить, что работы N. Hopkinson (2001, 2016) и E. Pola (2018) носили описательный характер. Мы же в своем исследовании попытались проанализировать исход лечения ИС в зависимости от полученного положительного или отрицательного результата интраоперационного микробиологического исследования.
Худшие исходы лечения пациентов с идентифицированным возбудителем в нашем исследовании могли быть обусловлены не диагностированной бактериемией, поскольку мы не брали кровь на стерильность у всех пациентов с ИС. Нам также показался интересным тот факт, что 75 % случаев рецидива ИС связаны с грамотрицательными патогенами (в частности, Pseudomonas aeruginosa ), что может свидетельствовать о неблагоприятном влиянии данного возбудителя на исход лечения ИС.
Пациенты I группы достоверно чаще использовали антибиотики на амбулаторном этапе до взятия биоматериала на бактериологическое исследование, хотя оптимальным является воздержание от антибиотиков до тех пор, пока не будет обнаружен микроорганизм. Мы предположили, что прием антибиотиков на амбулаторном этапе увеличивает их общую курсовую дозу, что также могло положительно сказаться на исходе лечения ИС с отрицательным микробиологическим результатом.
Положительное влияние на исход лечения ИС коррелирует с исследованием S. Bhagat et al., в котором авторы сообщают, что начало приема антибиотиков до обнаружения микроорганизма может помочь снизить риск неврологического дефицита или деформации позвоночника [22]. Наше исследование также показало, что эмпирическая антибиотикотерапия «гликопептид + бета-лактам», используемая в большинстве случаев, не менее эффективна, чем этиотропное лечение.
Ограничениями исследования является его ретроспективный характер и небольшая выборка. Мы анализировали кровь на стерильность лишь у двоих пациентов, тогда как 100 % охват данным исследованием мог бы повысить частоту выделения возбудителей. Также остается открытым вопрос о разумном временном балансе от начала приема антибиотиков до момента идентификации возбудителя.
ЗАКЛЮЧЕНИЕ
Больные спондилодисцитами с отрицательным результатом микробиологического исследования в сравнении с пациентами с культуроположительной инфекцией имели лучший исход лечения при минимуме рецидивов ( p > 0,05).


