К теории влияния малых добавок палладия на растворимость водорода в железе и флокенообразование в сталях
Автор: Мирзаев Джалал Аминулович, Кашуков Иван Васильевич, Мирзоев Александр Аминулаевич, Шабуров Константин Юрьевич
Рубрика: Физика
Статья в выпуске: 10 (143), 2009 года.
Бесплатный доступ
С позиции учета ближнего порядка в расположении атомов Pd и H дано объяснение причины значительного повышения растворимости водорода в кристаллической матрице железа, а также резкого снижения опасности образования флокенов при введении в сталь малых добавок палладия (эффект Архарова).
Водород в железе, растворимость, теория, флокены
Короткий адрес: https://sciup.org/147158614
IDR: 147158614 | УДК: 548.51
Текст научной статьи К теории влияния малых добавок палладия на растворимость водорода в железе и флокенообразование в сталях
Как известно [1, 2], растворимость водорода в железе существенно уменьшается при понижении температуры. Именно это обстоятельство является причиной образования ниже 100 °C специфических дефектов стали - флокенов - микротрещин, заполненных водородом [3]. Помимо температуры, растворимость водорода зависит от парциального давления рн^ газа Нг в окружающей образец атмосфере. Эта зависимость известна как закон Сивертса (закон ^Рщ )• Наиболее достоверные на наш взгляд формулы, описывающие указанный закон и основанные на измерениях Геллера и Сунь, приведены в [3]:
для а-железа
' з ' СМ я[100 г для у-железа
= Л"(Г).^ = 47,53-expf-^UPH2[aTM], (1а)
^н
( 22628Л /т г т
= 47,53-expl—— МРН2[атм]. (16)
Допустим, что железо или его сплав был насыщен водородом при высокой температуре до концентрации Сд, а затем резко охлажден до некоторой температуры Г в районе 300-500 К и изотермически выдержан. Тогда, вследствие падения растворимости водорода начнется процесс его выделения в любую возможную пору (пустоту). Если указанная малая пора изолирована от внешней атмосферы, то давление водорода в ней будет определяться условием равновесия с растворенным в стали газом (1):
f V
Рн = — > (2)
Л“ =47,534-exp
27185^ 1 см3 RT )атм1/2 100 г’ где А^Г) (здесь и в формуле (1)) представляет растворимость водорода в a-железе при рассматриваемой температуре и давлении р = 1 атм. Если учесть, что выделение газообразного водорода в порах конечного размера несколько уменьшает его концентрацию в металле [4], то можно получить более точную оценку давления водорода внутри полости
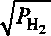
4/ \кгр(Ла)2
где / - объемная доля пор в металле, а Р = 7,018-1 О’4 - численный коэффициент. Но и в этом случае величина давления зависит от параметра А“(Т).
Влияние всех факторов (Т, f, С^, Л“) на величину давления водорода в порах было систематически изучено в работе [4]. Например, при понижении температуры давление изменяется по кривой с максимумом при некоторой температуре Тт, равной примерно 370 К, причем точное ее положение зависит от значений остальных параметров ( /, Сц, Л“ ). Увеличение растворимо сти водорода в стандартном состоянии Л“ вызывает значительное уменьшение давления. Оно снижается также при возрастании / , или уменьшении Сц . Однако эти параметры являются слабоуправляемыми в обычных металлургических технологиях., если только расплав стали не подвергают целенаправленному вакуумированию. Такая операция резко снижает исходное содержание водорода в стали С^ и, соответственно, опасность флокенообразования, но является очень затратной.
Из формулы (3) виден иной способ устранения флокенов - на основе повышения растворимости Лв. Но так как при стандартном состоянии внешнее давление фиксировано, то добиться уменьшения давления в порах можно только одним способом - легированием стали элементами, резко повышающими растворимость водорода. К сожалению, за исключением относительно старых монографий П.В. Гельда [1, 3], в литературе почти отсутствуют интересующие нас сведения о влиянии легирующих элементов на растворимость водорода.
Однако о сильном воздействии одного элемента - палладия - известно довольно хорошо благодаря работам В.И. Архарова [5, 6]. Было показано, что малые добавки палладия (< 0,5 ат. %) в значительной мере, если не полностью, подавляют флокенообразование. Для объяснения этого удивительного результата авторы предположили, что атомы палладия сильно притягивают к себе атомы водорода. Поскольку атомы палладия адсорбируются на поверхностях зерен, то туда же стекаются и атомы водорода. Отметим, что до сего момента нет убедительных данных о сегрегации атомов палладия по границам зерна a-железа. Однако, в последующих статьях [7, 8], В.И. Архаров показал, что добавки палладия существенно повышают растворимость водорода в стали. Данные Архарова о растворимости водорода приведены в таблице с небольшими поправками по [3] на содержание легирующих элементов.
Таблица Растворимость водорода в двойном сплаве Fe+0,26 ат.%Рб при давлении окружающей атмосферы водорода 1 атм. [7]
|
Т,к |
Сн, см3/100 г |
|
973 |
1,98 |
|
873 |
1,30 |
|
773 |
1,08 |
|
673 |
0,56 |
Известна [9] теория растворения водорода в сплавах, разработанная В.П. Бурылевым. Применительно к рассматриваемой проблеме основное уравнение его теории для РНг = 1 атм. имеет следующий вид:
In Сн™1 = In Сн Fe + xPd • In HFe + xPd (1 - xPd ) , где 5pe-pd - энергия взаимообмена атомов Fe и Pd в бинарном растворе.
По данным [10] и [3] растворимость водорода в чистом палладии и железе при 673 К соответственно равны 523 и 0,37 см3/100 г. Поэтому второе слагаемое, равное 0,019, может обеспечить увеличение растворимости водорода в сплаве в 1,019 раз по сравнению с чистым железом, тогда как по экспериментальным данным [7] это увеличение происходит почти в полтора раза. Учет третьего слагаемого только ухудшает результат, поскольку атомы Fe и Pd образуют упорядоченные растворы, а значит 0Fe-Pd< 0.
Попытки использовать данную формулу для аналитического описания результатов В.И. Архарова для всех других температур также оказались безуспешными. Был сделан вывод, что теория Бурылева применима лишь в случае незначительного различия потенциалов взаимодействия с водородом атомов железа и атомов примеси замещения, тогда как в данном случае взаимодействие атомов палладия с атомами водорода оказалось очень сильным. Можно предположить, что атомы палладия являются ловушками для атомов водорода. В этом случае, невидимому, следует отказаться от модели с усредненным взаимодействием атомов, а попытаться построить модель на основе учета локальных межатомных связей.
Физика
Статистическая модель тройного раствора
Ниже представлена статистическая модель тройного твердого раствора Fe-Y-H, в основе которой лежат следующие допущения:
-
а) атомы палладия, которые для общности будут обозначены Y, образуют с железом раствор замещения. Каждый атом основной решетки окружен Zi,2 тетраэдрическими порами (Zi, 2 = 24), в которых могут располагаться атомы водорода. Но каждая тетрапора и, соответственно, расположенный в ней атом водорода, окружены Z2i = 4 атомами основной решетки. Таким образом каждая тетрапора принадлежит атому основной решетки на (1/Z2j) часть. Откуда, как и следовало ожидать, получаем число пор, приходящихся на один атом решетки равное v = -i— • Z12 = 6 .
^21
Атомы палладия могут мигрировать по основной решетке при высокой температуре аустенизации, гомогенизации или горячей деформации. Но при температурах ниже 500 °C перераспределение атомов палладия становится кинетически невозможным, поэтому равновесный ближний порядок устанавливается за счет диффузии атомов водорода;
-
б) Основной вклад в потенциальную энергию подсистемы атомов водорода дает взаимодействие пар ближайших соседей Fe-H и Y-H; их энергии связи обозначены ^ = fFe_H и ^ = fY_H • Если, как мы предполагаем, |^i|«|52|, то атомы водорода должны накапливаться около атомов палладия. Для характеристики ближнего порядка будем использовать параметры
р-р _ ^Fe-H .
(5а)
1 Fe-H p-Z21.7V.^’ р-р - ^y-h
2 ™ v.Z2VN.6^‘ впервые введенные М.А. Штремелем [11]. Здесь YF_H и Yy_h - количество пар ближайших соседей, , а также 9Ч и 9^ - атомные доли соответствующих элементов в подрешетках внедрения и замещения, N общее число атомов в системе. Поскольку YFe_H + AY_H = N • ^ • v • Z21, то имеем:
Д+Р2=1. (6)
Потенциальную энергию связи атомов водорода с окружением можно записать следующим образом:
^ = -^Fe-H -£1 +"^Y-H "е2 = -^'^21^н [£1 +^г(52 ~ е1)] ’ (7)
-
в) находящиеся в растворе атомы водорода удобно разделить на две подгруппы: атомы, окруженные только атомами железа (обозначим их число N^ ), и атомы водорода, содержащие в своем окружении хотя бы один атом Y (их количество - N^ ). Поскольку концентрация примесей замещения Y считается малой, менее 2-3 ат. %, то вероятность перекрытия координационных сфер тетрапор, ближайших для двух соседних атомов Y, будет мала. Фактически, каждый из N^ атомов водорода контактирует лишь с одним из атомов Y, и можно считать, что возникает N^ пар Y-H. Следовательно, параметры Р2 и N^ оказываются пропорциональными:
Термодинамическая вероятность распределения N^ атомов по N-9^ -Z]2 возможным пози циям равна
Остальные N^ атомов водорода расположены исключительно в окружении атомов железа, количество таких тетрапор - v-TV(l-^Y). Термодинамическая вероятность распределения этой группы атомов водорода:
r (ZX2-NQ-O^)\
(Ю)
1 N^^.N^-e^-N^V
Теперь, использовав полученные выше выражения для Е, Wx и Ж2, можно определить ту часть свободной энергии тройного раствора, которая зависит от присутствия водорода:
^Д-^Пп^-Ж,. (11)
Заметим, что в этом выражении не учтены слагаемые, отражающие кинетическую энергию атомов водорода и перераспределение зарядов вблизи них, а также изменение колебательной энтропии. Однако, эти слагаемые в первом приближении зависят только от общего числа атомов водорода.
Как известно [12], свободная энергия равновесного состояния должна быть минимальной, поэтому потребуем, чтобы:
( аг ) 1 ( эрА
=--------- — =0. (12)
I 9NH )t,N,Nh N" ^Н • Z2C V1 0P2 )t,N,Nh
Используя формулу Стирлинга для расчета функции F и ее производной, а также соотношение (12), находим соотношение, определяющее параметр ближнего порядка Р2, или пропорциональную ему величину N^ :
__g _ 1П (^Н ~ Wr ~^н) /1-5\ kT 0н(1-^-^+^)’ ( } где 0Н = н Л ^'^н, а s = ex-e2.
v-ZTVN
Как правило, количество атомов легирующего элемента значительно превышает число атомов водорода, поэтому 6Ч»6^Х и (1-0Y) »(^н ~^н)>чт0 позволяет упростить уравнение (13):
— = 1п—-- С1-^). (14)
($Н~^н) #Y
Удобно ввести параметр
Я =———ехр(—\ (15)
(1-6V)
и преобразовать (14) в соотношение:
которое считается типичным уравнением захвата атомов водорода ловушками [13]. Действительно, если Т —> 0, то при г > 0 параметр Я —* оо, а тогда 0Н —> 0ц, т-е- все атомы захвачены ловушками. Но, если Т —><х>, то Я= , а #н =#У’#н> т-е- атомы водорода равномерно рас-1 — Оу пределены по решетке.
После подстановки (16) в выражение (11) в последнем исчезают члены, содержащие N^ и Уц , что позволяет легко рассчитать химический потенциал атомов водорода [1,3]:
( ЭР А
Ан = ■ (17)
Проведя дифференцирование свободной энергии, получим:
^н = Ан +£7’1п#° -kT-Z2X -ln(l-^Y + Оу exp(s / кТ^), (18)
где //^ = ^^Fe-н есть химический потенциал стандартного состояния - бесконечно разбавленного раствора, однако величина //^ должна включать еще вклад от кинетической энергии и колебательной энтропии атомов водорода. При расчете на моль константу к следует заменить на 7?.
Физика
2. Расчет растворимости водорода.
Растворение водорода в металлах и сплавах описывается реакцией [12,13]
Ж)„=Им,. <19> где Нш - водород, растворенный в металле. Равновесие этой реакции соответствует равенству химических потенциалов:
2^Н2 “Ан ’ где //Нз - химический потенциал молекулы Н2 в газообразном состоянии, a //н - определенный выше химический потенциал растворенного в сплаве водорода. Для газа [12, 13]
^н2=М +i^ln/н2> (21)
где /Н2 - фугитивность (или летучесть) газа, а //ц2 - химический потенциал для стандартного состояния.
Приравняв выражения (18) и (21), найдем 1/7° -/7°
н RT .
Удобно перейти от концентрации водорода 6^ в атомных долях к концентрации Сц, выраженной в практических единицах см3/100 г при нормальных условиях. Связь этих величин про стая:
^=8,923-10~5ZFe-C^ или 1пб£ = 1пС£-5,3016.
Вместо (22) тогда получим
1„0 „0 г , ^
1пСн = 2£2к—сП + 5,3016 + Z21 • In 1 - ^Y + ^Y exp — RT VkT)
При не слишком высоких давлениях Н2 фугитивность совпадает с давлением, поэтому полученная формула отражает закон Сивертса для сплава Fe-Y-H. В случае 0У = 0 она должна перейти в уравнение (1а) растворимости водорода в a-железе, что позволяет сразу найти неизвестное первое слагаемое: ^Ан2 -Ан)/^ =-1,4402-3269,8/Г. Следовательно,
1 3269,8
1пСн -3,8614 — hZ21 - In
1 — AY + Ау expf -^
+ ln<2.
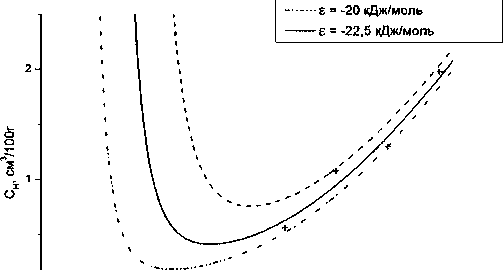
В .И. Архаров проводил измерения растворимости при давлении р = /= 1 атм, поэтому при анализе его результатов последнее слагаемое в (24) следует обратить в ноль. Как следует из (24) величина растворимости водорода в сплаве оказывается зависящей только от одного параметра е , равного разности энергий связи атомов водорода с железом (s"H-Fe) и водорода с примесью замещения (sH_Y ), в данном случае с палладием. Чтобы оценить величину е для сплава с 0,26 ат. % Pd (изучен Архаровым), была рассчитана серия кривых растворимости для разных е (Дж/моль), а на поле температура-концентрация нанесены экспериментальные данные (см. рис. 1). Наилучшее согласие эксперимента с теорией получается при е = 22 500 Дж/моль. Экспериментальные точки довольно точно расположены вдоль кривой, что позволяет говорить о согласии теории с экспериментом. Важно обратить внимание на особенность поведения кривых растворимости водорода в сплаве Fe-Pd при понижении температуры по сравнению с чистым железом. Для железа растворимость водорода непрерывно уменьшается при снижении температуры. Растворимость водорода в сплаве с палладием тоже снижается с понижением температуры до примерно 450 К, но затем начинается её рост по мере приближения к 0 К. Аналитически причина роста понятна; он обусловлен возрастанием функции exp(f/7?7') при стремлении Т ->0. Физическая причина заключается в том, что атомы водорода всё в большей степени захватываются атомами палладия, а тепловое движение уже не в силах преодолеть такое взаимопритяжение.
Но для проблемы флокенов особенно важно то, что у сплавов с палладием резко возрастает концентрация растворенного водорода при температуре Тт, для которой максимально давление в микропорах, что дает основание предполагать, что уровень этого давления для сплава с Pd будет существенно меньшим.
Для расчетов давления молекулярного водорода в порах в зависимости от температуры было использовано уравнение (3). Если в выражении (24) положить Тщ = /н =1, то функция Сц оказывается равной А“, входящей в уравнение (3). При решении уравнения (3) была внесена поправка
| + Эксп. данные (В.И. Архаров) |----е = -25 кДж/моль
и -------------------,-------------------1--------------------,--------------------1,-------------------,--------------------|
200 400 600 800 1000
Т.К
Рис. 1. Теоретические кривые растворимости водорода в сплаве Fe+0,26 ат. % Pd при различных значениях параметра е в сравнении с экспериментальными данными [7]
по [12], ибо при очень высоких давлениях Р^2 следует заменить на f^2.
Как и следовало ожидать, кривые температурной зависимости давления в порах Р^ имеет резкий максимум. Ниже мы рассматриваем влияние различных факторов только на максимальное давление, которое наиболее опасно с точки зрения возникновения флокенов.
Рис. 2 иллюстрирует влияние атомной доли палладия и исходного содержания водорода на максимум давления. Прежде всего бросается в глаза резкое уменьшение давления при добавлении палладия. Например, при введении 0,26 ат. % Pd в сплав, содержащий 5 см3/100 г водорода, максимальное давление, равное для железа 109 Па, уменьшается до 2-107 Па. Оно оказывается даже ниже, чем у железа, содержащего 1 см3/100 г водорода, а в таком железе (стали) флокены обычно не обнаруживаются. Возрастание исходной концентрации водорода, конечно, повышает давление, но эффективное воздействие палладия проявляется для любой исходной концентрации водорода. Влияние концентрации палладия и объемной доли пор на максимальное давление иллюстрирует рис. 3. Для железа максимальное давление заметно зависит от объемной доли пор. Но достаточно добавить примерно 0,2 % Pd, чтобы эта зависимость исчезла.
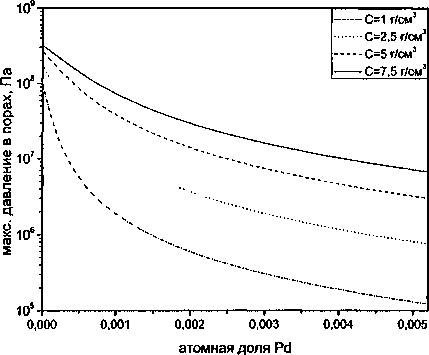
Рис. 2. Влияние концентрации палладия и исходного содержания водорода на максимальное давление водорода в порах (f = 0,005)
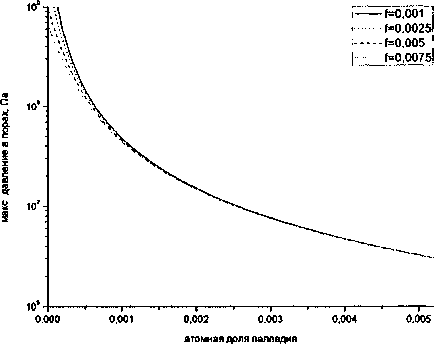
Рис. 3. Влияние концентрации палладия и объемной доли пор на максимальное давление в микропорах (Сд =5 см3/100 г)
Физика
Общие выводы
-
1. Разработана статистическая модель тройного раствора, содержащего сильно взаимодействующие растворенные атомы внедрения и замещения, например, водорода и палладия.
-
2. В рамках этой модели получено уравнение растворимости водорода в сплаве Fe-Pd, позволившее аналитически описать экспериментальные данные В.И. Архарова.
-
3. Температурная зависимость растворимости водорода в сплаве Fe-Pd-H имеет важную особенность - наличие минимума. В отличие от железа, где при Т -> 0 растворимость водорода стремится к нулю, в сплавах Fe-Pd она возрастает.
-
4. Этот эффект накопления водорода около ловушек-атомов является причиной резкого снижения давления водорода в микропорах по сравнению с железом и сталями и является причиной подавления образования флокенов при легировании стали малыми добавками палладия (эффект Архарова).
-
5. Существует, по-видимому, возможность введения других, менее дорогих добавок элементов, создающих столь же сильное взаимодействие с водородом, как палладий, и тем самым предотвращающих образование в стали флокенов.
Работа поддержана грантом 2.1.1/1776 целевой программа «Развитие научного потенциала высшей школы» Минобрнауки РФ.
Список литературы К теории влияния малых добавок палладия на растворимость водорода в железе и флокенообразование в сталях
- Гельд, П.В. Водород и несовершенства структуры металла/П.В. Гельд, P.A. Рябов, Е.С. Кодес. -М.: Металлургия, 1979. -221 с.
- Шаповалов, В.И. Флокены и контроль водорода в стали/В.И. Шаповалов, В.В. Трофименко. -М.: Металлургия, 1987. -161 с.
- Гельд, П.В. Водород в металлах и сплавах/П.В. Гельд, P.A. Рябов. -М.: Металлургия, 1974.-272 с.
- Мирзаев, Д.А. Термодинамический аспект выделения растворенного водорода в микропорах металла/Д.А. Мирзаев, A.A. Мирзоев//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2006. -Вып. 7. -№ 7(62). -С. 117-123.
- Архаров, В.И. О влиянии примеси палладия к железу на его проницаемость для водорода/В.И. Архаров, A.A. Кралина//Физика металлов и металловедение (ФММ) -1959. -Т. 8, вып. 1. -С. 45-52.
- О возможности снижения склонности стали к флокенообразованию посредством малых добавок палладия/В.И. Архаров, A.A. Кралина, Л.И. Кватер, П.В. Склюев//Известия АН СССР. -Металлы. -1967. -№ 1. -С. 105-111.
- Влияние малых добавок палладия на водородопроницаемость среднелегированной стали/И. Архаров, Т.Т. Мороз, И.А. Новохатский и др.//Физ.-хим. механика металлов. -1971. -Т. 7, №6.-С. 51-54.
- Архаров, В.И. О влиянии палладия на флокеночувствительность стали/В.И. Архаров, Т.Т. Мороз, И.А. Новохатский и др.//Физ.-хим. механика материалов. -1976. -Т. 12, № 1. -47-51.
- Бурылев, Б.П. Особенности физико-химического анализа металлических расплавов по изотермам растворимости газов в сплавах/Б.П. Бурылев//Труды X Российской конференции «Строение и свойства металлических и шлаковых расплавов», Т. 1. Теоретическое изучение металлических и оксидных расплавов. -Екатеринбург-Челябинск: Изд. ЮУрГУ, 2001. -С. 115-119.
- Маклеллан, Р.Б. Термодинамика разбавленных твердых растворов внедрения. Устойчивость фаз в металлах и сплавах/Р.Б. Маклеллан. -М.: «Мир», 1970. -С. 331-353.
- Штремель, М.А. Ближний порядок в тройных твердых растворах замещения-внедрения/М.А. Штремель, Ю.А. Крупин, E.B. Зарецкий//ФММ. -1978. -Т. 46, вып. 5. -С. 982-991.
- Даркен, Л.С. Физическая химия металлов (пер. с англ.)/Л.С. Даркен, Р.В. Гурри. -М.: Гос. научн.-техн. изд-во литературы по черн. и цв. металлургии, 1960.
- Колачев, Б.А. Термодинамика фазовых равновесий в системах металл-водород/Б.А. Колачев, P.M. Габидуллин//Итоги науки и техники. Серия «Металловедение и термическая обработка». -М.: 1986. -Т. 20. -С. 3-50.


