К вопросу о патомеханике внутрисуставных импрессионых переломов костей конечностей
Автор: Гилев М.В., Зайцев Д.В., Киселева Д.В., Измоденова М.Ю.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (80) т.22, 2018 года.
Бесплатный доступ
Целью исследования было изучение прочностных свойств трабекулярной кости человека околосуставной локализации при одноосном сжатии. Исследовали образцы трупной кости мужского ( N = 24; 60,0%) и женского ( N = 16; 40,0%) полов, средний возраст - 39,5 ± 5,6 г. Аттестовали проксимальный отдел большеберцовой кости ( N = 40), дистального эпиметафиза лучевой кости ( N = 40) и пяточную кость ( N = 40). Применяли физический, морфометрический, морфологический методы, метод компьютерной томографии, метод сканирующей электронной микроскопии и метод статистического анализа. Образцы деформировались до максимального напряжения ~ 30%. Максимальное напряжение для пяточной кости в 2,06 раза превышало показатель для дистального эпиметафиза лучевой кости ( p = 0,012) и в 2,09 раза для проксимального отдела большеберцовой кости ( p = 0,025). Модуль Юнга пяточной кости в 2,2 раза превышал аналогичный показатель для дистального эпиметафиза лучевой кости ( p = 0,004) и в 2,7 раза для проксимального отдела большеберцовой кости ( p = 0,024). Для образцов дистального эпиметафиза лучевой кости значение физической плотности составило 0,936 ± 0,073; для проксимального отдела большеберцовой кости - 0,912 ± 0,097; для пяточной кости - 1,092 ± 0,092 г/мм3. Для образцов дистального эпиметафиза лучевой кости радиоденситометрическая плотность равна 204,9 ± 7,2 HU ( Hounsfield unit, единицы Хаунсфилда); для проксимального отдела большеберцовой кости - 256,0 ± 7,0; для пяточной кости - 318,0 ± 3,0 HU. Наблюдалось повышение механических свойств с увеличением физической ( r = 0,678 при p = 0,002) и радиоденситометрической ( r = 0,508 при p = 0,012) плотности. Импрессионная деформация, возникающая при внутрисуставных переломах, характеризует трабекулярную костную ткань как упруго-пластичный материал, разрушение которого не происходит даже после достижения деформации 30% и более от высоты изучаемого образца, при этом обратимая деформация находилась в пределах 3%. Модуль Юнга, максимальное напряжение, упругая деформация, радиоденситометрическая и физическая плотность трабекулярной костной ткани околосуставной локализации являются критериями биоэквивалентного выбора остеозамещающего материала для устранения структурного дефекта.
Импрессионный перелом, трабекулярная кость, механические свойства, модуль юнга, плотность, внутрисуставной перелом
Короткий адрес: https://sciup.org/146282088
IDR: 146282088 | УДК: 531/534: | DOI: 10.15593/RZhBiomeh/2018.2.02
Текст научной статьи К вопросу о патомеханике внутрисуставных импрессионых переломов костей конечностей
К приоритетным проблемам современной травматологии и ортопедии относится лечение внутрисуставных переломов. Данная категория составляет до 17,6% случаев всех переломов [3, 17, 29, 30]. Неудовлетворительные исходы лечения наблюдаются в 9,4–47,7% случаев в зависимости от локализации [2, 26]. Внутрисуставной перелом – особый вид костного повреждения, характеризующийся наличием линии излома внутри суставной капсулы. При данном виде травмы костнодеструктивный процесс переходит на все элементы сустава: наравне с костью нарушается целостность гиалинового хряща и субхондральной кости, повреждаются мягкотканные структуры сустава, вследствие чего кровь и костный мозг попадают в полость сустава [1, 4, 12, 14].
Особым видом перелома трабекулярной кости является импрессионный, или вдавленный, перелом, характеризующийся образованием костносуставного дефекта [4]. Для внутрисуставного вдавленного перелома характерны два основных механизма травмы. Наиболее распространенным является непрямой механизм, предусматривающий опосредованное через сустав приложение травмирующей силы, что приводит к появлению сгибающего момента и, как следствие, вклинению одной части суставной поверхности в другую [12, 18]. Важную роль в конфронтации возникающей эксцентрической нагрузки играют связки, которые преобразуют изгибающий момент травмирующего вектора в прямую осевую нагрузку, «выламывающую» часть кости. Как правило, это приводит к простому перелому. Прямой механизм обусловлен непосредственным приложением силового вектора к метадиафизу кости или посредством передачи травмирующей силы по оси от одного конца костного сегмента к противоположному. Этот механизм обычно обусловливает взрывной характер перелома и вызывает тяжелые повреждения мягкотканного периартикулярного компонента. В результате возникают сложные внутрисуставные переломы с сопутствующими тяжелыми повреждениями мягких тканей [11, 17, 27].
Рассмотренные выше механизмы подробно раскрывают роль вектора травмирующей силы и связочного аппарата в возникновении импрессионного перелома, но не учитывают особенности трабекулярной кости как материала, микроструктура и механические свойства которого также в значительной мере влияют на характер травмы. Кроме того, проблема остеопороза и связанного с ним снижения механических характеристик костной ткани также требует тщательного подбора остеозамещающего материала, используемого при оперативном лечении импрессионных переломов, с целью не допустить резорбции кости вблизи имплантата по причине более высоких значений механических свойств материала по сравнению с костной тканью пациента.
Целью работы было изучение прочностных свойств трабекулярной кости околосуставной локализации при одноосном сжатии для определения патомеханики образования импрессионных внутрисуставных переломов костей конечностей.
Материалы и методы
Исследования проведены на образцах трабекулярной костной ткани околосуставной локализации, полученной от 40 лиц мужского (N = 24; 60,0%) и женского (N = 16; 40,0%) полов, умерших в возрасте от 30 до 50 лет (средний возраст – 39,5 ± 5,6 г.). Критериями включения в морфологический этап исследования являлся возраст умерших от 30 до 50 лет как наиболее соответствующий возникновению импрессионных переломов костей конечностей для отдельных нозологических форм. Критерием исключения являлись видимые макроскопически дегенеративнодистрофические заболевания искомых суставов. Исходя из особенностей локализации возникновения импрессионных внутрисуставных переломов, для исследования забирались фрагменты трабекулярной костной ткани околосуставной зоны в следующих локализациях: дистального отдела лучевой кости в центральной ее части (N = 40); проксимального отдела большеберцовой кости в области латерального мыщелка в центральной его части (N = 40); пяточной кости в области задней таранной ее суставной поверхности в центральной ее части (N = 40). Методика приготовления образцов костной ткани на примере проксимального отдела большеберцовой кости показана на рис. 1.
Для оценки влияния плотности костной ткани на ее физические свойства измерялась физическая плотность ткани образцов путем их взвешивания на электронных весах VIBRA AJ-420CE (Япония, точность 0,001 г) и измерения линейных размеров с помощью микрометра МКЦ-25 (Россия, точность 0,005 мкм). Физическую плотность определяли по формуле p = m⁄V , г/мм3; где p – плотность искомого костного образца, г/мм3; m – масса искомого костного образца, г; V – объем искомого костного образца, мм3. Для определения относительной радиоденситометрической плотности костной ткани была проведена компьютерная томография образцов на томографе Toshiba Aquilion 64 (Япония). На томографических срезах во фронтальной плоскости при последовательном шаге среза в 0,5 мм измеряли коэффициент абсорбции костной ткани в единицах Хаунсфилда ( HU ). Расчет искомых величин проводили в программе RadiAnt DICOM Viewer 4.5.1.
Изучение топологии и микроструктуры поверхности образцов трабекулярной костной ткани околосуставной локализации проводилось с использованием сканирующего электронного микроскопа JSM-6390LV фирмы Jeol . В процессе исследования был разработан и внедрен в практику способ подготовки поверхности образцов костной ткани для изучения её микроструктуры при помощи сканирующего электронного микроскопа (заявка № 2017138725). Структура поверхности образцов оценивалась до и после проведения испытаний на одноосное сжатие. Образцы фиксировались к предметному стеклу на эпоксидный клей. После этого производилось напыление углерода на исследуемую поверхность и проводилась сканирующая электронная микроскопия.
Нормальность распределения признака оценивалась при помощи теста Шапиро – Уилка, при этом если распределение отличалось от нормального,
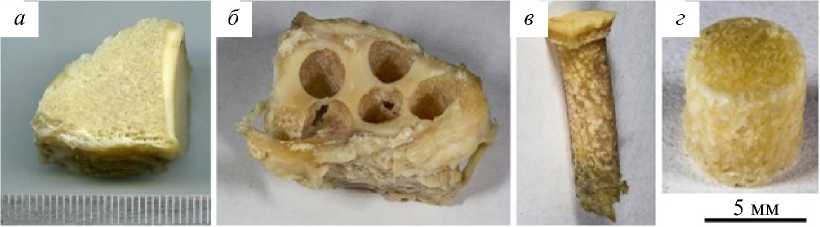
Рис. 1. Методика приготовления образцов трабекулярной костной ткани околосуставной локализации проксимального отдела большеберцовой кости (фотографии): а – вид исходного костного фрагмента; б – костный фрагмент после высверливания образцов при помощи корончатой фрезы; в – цилиндрическая заготовка с остатком гиалинового хряща; г – искомый образец для испытаний то применялинепараметрический анализ с использованием U-критерия Манна – Уитни и Краскела ‒ Уоллиса, если признак имел нормальное распределение, применяли параметрический анализ с использованием t-критерия Стьюдента. Степень взаимосвязи признаков оценивали при помощи коэффициента линейной корреляции Пирсона. Анализ статистических данных проводили в пакете Stata/MP 13.0 for Windows (Serial Number 3471502014).
В работе использовали физический, морфометрический, морфологический методы, метод компьютерной томографии, метод сканирующей электронной микроскопии, статистический метод.
Результаты
При испытании на одноосное сжатие все образцы обладали значительной необратимой деформацией, не приводящей к разрушению, что характеризовало их как упруго-пластичный материал. В эксперименте показано, что разрушение субхондральной трабекулярной костной ткани не происходило даже после достижения деформации в 30% и более от высоты изучаемого образца, при этом обратимая деформация находилась в пределах 3%. На деформационной кривой до максимального напряжения наблюдался линейный участок, характерный для материалов, которые деформировались упруго. Визуально можно было определить, что образец после испытания не разрушился, а претерпел значительную необратимую деформацию, при этом было отмечено отсутствие линий излома, характерных для кортикальной кости. Результаты деформационного поведения образцов трабекулярной костной ткани околосуставной локализации при одноосном сжатии представлены в табл. 1.
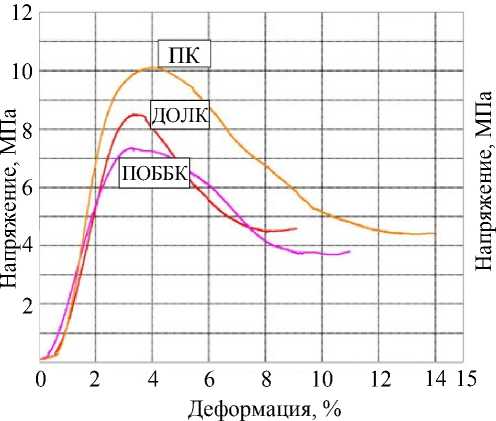
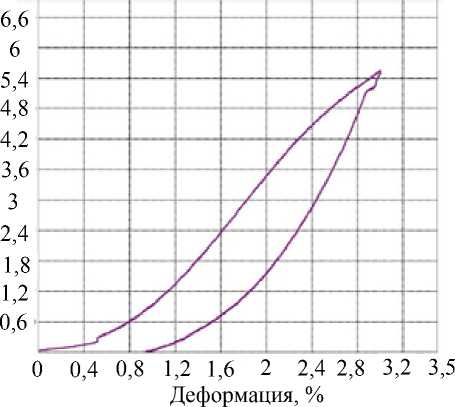
Обобщенные кривые деформационного поведения образцов трабекулярной костной ткани в зависимости от топики расположения и при циклической нагрузке представлены на рис. 2.
Как видно из табл. 1 и рис. 2, удалось выделить различие в механических свойствах между группами образцов в зависимости от топической принадлежности. Было показано, что максимальное напряжение в пяточной кости в 2,06 раза
Таблица 1
Результаты деформационного поведения образцов трабекулярной костной ткани околосуставной локализации при одноосном сжатии
|
Изучаемый параметр |
Дистальный отдел лучевой кости |
Проксимальный отдел большеберцовой кости |
Пяточная кость |
|
|
Максимальное напряжение, МПа |
Медиана |
4,33 |
4,25 |
8,9 |
|
25%-ный перцентиль |
3,52 |
2,45 |
6,33 |
|
|
75%-ный перцентиль |
8,49 |
7,35 |
13,76 |
|
|
Модуль Юнга, ГПа* |
Медиана |
0,17 |
0,14 |
0,38 |
|
25%-ный перцентиль |
0,11 |
0,09 |
0,24 |
|
|
75%-ный перцентиль |
0,38 |
0,32 |
0,59 |
|
|
Упругая деформация, % |
Медиана |
3,26 |
4,24 |
3,42 |
|
25%-ный перцентиль |
2,87 |
3,25 |
2,84 |
|
|
75%-ный перцентиль |
4,91 |
4,92 |
3,9 |
|
Примечание: * При этом для модуля Юнга получили значимое различие между группами по локализации ( p < 0,05).
а
Рис. 2. Обобщенные кривые деформационного поведения образцов трабекулярной костной ткани в зависимости от места расположения ( а ) и обобщенная деформационная кривая при циклической нагрузке ( б ): ПК – пяточная кость; ДОЛК – дистальный отдел лучевой кости; ПОББК – проксимальный отдел большеберцовой кости
б
превышает значение, полученное при исследовании дистального отдела лучевой кости ( p = 0,012), и в 2,09 раза превышает аналогичный показатель проксимального отдела большеберцовой кости ( p = 0,025). Модуль Юнга пяточной кости в 2,2 раз превышает аналогичный показатель в группе дистального отдела лучевой кости ( p = 0,004) и в 2,7 раза превышает аналогичный показатель в случае проксимального отдела большеберцовой кости ( p = 0,024). Максимальная упругая деформация, наблюдаемая в образцах из группы проксимального отдела большеберцовой кости, также превосходила значения в других группах, однако полученные данные были статистически недостоверны ( p > 0,05).
Для образцов дистального отдела лучевой кости значение физической плотности составило 0,936 ± 0,073; для проксимального отдела большеберцовой кости – 0,912 ± 0,097; для пяточной кости – 1,092 ± 0,092 г/мм3. По полученным результатам измерения физической плотности образцов провели аттестацию данных на принадлежность к нормальному распределению непараметрическим тестом Шапиро – Уилка, при этом получили распределение, не аппроксимируемое нормальным, вследствие чего при дальнейшем тестировании гипотез пользовались непараметрическими методами. Для множественного сравнения внутригрупповых различий был применен тест Краскела – Уоллиса, при этом различия были статистически значимыми (χ2-статистика = 11,898 при p = 0,0026). Значимо отличались плотность дистального отдела лучевой кости и пяточной кости ( p = 0,0218): плотность пяточной кости в 1,15 раза превосходила плотность дистального отдела лучевой кости.
Радиоденситометрическую плотность измеряли в единицах Хаунсфилда. Для образцов дистального отдела лучевой кости она составила 204,9 ± 7,2; для проксимального отдела большеберцовой кости – 256,0 ± 7,0; для пяточной кости – 318,0 ± 3,0 HU . Для множественного сравнения внутригрупповых различий был применен тест Краскела – Уоллиса, при этом различия были статистически значимыми ( p = 0,0062). Значимо отличалась плотность дистального отдела лучевой кости и проксимального отдела большеберцовой кости ( p = 0,028), а именно:
плотность проксимального отдела большеберцовой кости в 1,15 раза превосходила плотность дистального отдела лучевой кости; а плотность пяточной кости была больше, чем в случае дистального отдела лучевой кости, в 1,66 раза ( p = 0,018).
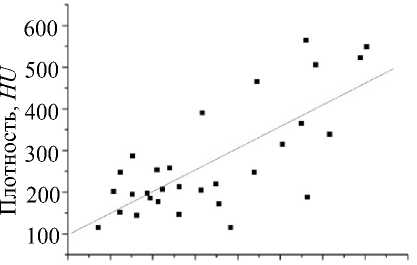
По результатам исследования строились графики корреляционной статистической зависимости по модели простой линейной регрессии: наблюдалось повышение механических свойств костной ткани с увеличением ее физической плотности (коэффициент Пирсона r = 0,678 при p = 0,002); кроме того, установлено повышение механических свойств костной ткани с увеличением ее радиоденситометрической плотности (коэффициент Пирсона r = 0,508 при p = 0,012). Показана прямая пропорциональная зависимость денситометрической и физической плотностей (коэффициент Пирсона r = 0,704 при p = 0,032). Соответствующие графики представлены на рис. 3.
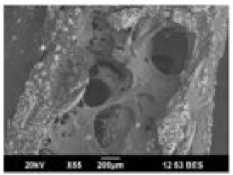
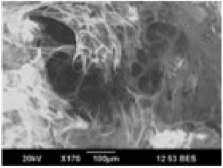
При аттестации образцов трабекулярной костной ткани околосуставной локализации до и после одноосного сжатия обращало на себя внимание отсутствие видимых микропереломов костных трабекул и увеличение последних в поле зрения после проведения одноосного сжатия (рис. 4).
1,2
1,1
1,0
0,9
0,8
0,7
0 2 4 6 8 10 12 14 16
0 2 4 6 8 10 12 14 16
Максимальное напряжение, МПа
б
Максимальное напряжение, МПа
а
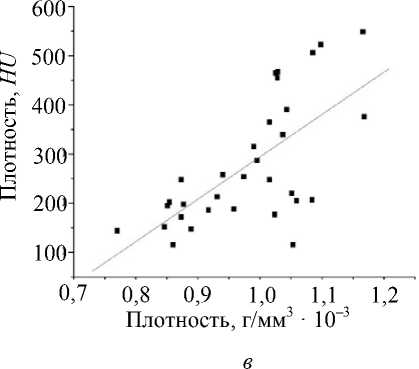
Рис. 3. Корреляционная статистическая зависимость по модели простой линейной регрессии: а – максимального напряжения от физической плотности костной ткани; б – максимального напряжения от денситометрической плотности костной ткани; в – физической плотности от денситометрической

а
б

в
г
Рис. 4. Аттестация микроструктуры образцов трабекулярной костной ткани околосуставной локализации до ( а , б ) и после ( в , г ) одноосного сжатия. Можно отметить отсутствие переломов костных трабекул и увеличение их в единице объема, т.е. компактизуемость
Обсуждение результатов
Изучение механических характеристик трабекулярной кости околосуставной локализации необходимо для научного обоснования используемых на сегодняшний день методов хирургического лечения внутрисуставных импрессионных переломов, а также для решения вопроса биомеханической совместимости материалов, используемых в ходе нарастания эпиметафизарного костного дефекта при импрессионном повреждении [5, 14, 15, 19, 32]. Так, C. Fölsch (2015), показал, что при взятии аллотрансплантата трабекулярной кости и последующей термодезинфекции происходит снижение упругого модуля при сжатии и сдвиге, а также уменьшение прочности на изгиб, при этом клинически значимого снижения прочности при растяжении выявлено не было [9, 10].
Проведенные нами исследования показали, что наблюдается определенный разброс механических характеристик образцов трабекулярной кости околосуставной локализации как между группами, так и внутри них. Данное обстоятельство, по нашему мнению, связано с некоторым возрастным интервалом выбранных объектов для исследования. Также определенный разброс может быть вызван различным выбором локализации места забора образцов из костных фрагментов. Так, по мнению M.G. Goff (2015) модуль Юнга губчатой кости определяется главным образом плотностью костной ткани и может варьироваться в достаточно широких пределах у одного и того же человека в зависимости от костной топографии [11]. По результатам исследования M. Tomanik (2016) изменения микроархитектоники субхонральной кости под влиянием суставной патологии приводят к снижению модуля Юнга [35]. Зависимость между функцией и микроархитектоникой кости наглядно показана в работе B.C. Roberts (2017) [28]. Отмечены значимые отличия в строении трабекулярной кости у пациентов с различными типами походки и патологии [16, 20, 21, 33, 38].
-
F. Xavier, J.J. Jauregui et al. (2017) проводили исследование плотности и механических свойств на сдвиг трабекулярной кости грудных позвонков. В ходе работы авторы установили положительную корреляционную связь механических свойств и плотности, а также показали, что прочностные свойства неодинаковы в разных участках тела позвонка. Наибольшая прочность костной ткани наблюдается в
его латеральных отделах (12 ± 2,74 Н), она несколько ниже в центральной части (10 ± 2,24 Н), наиболее низкие значения установлены в переднем отделе позвонка (2 ± 0,60 Н) [37].
Плотность кости является одним из определяющих факторов в патогенезе внутрисуставного перелома и при определении тактики лечения [19, 25]. M.J. Raschke et al. (2017) было отмечено, что простая импрессия, возникшая при гипоэргичной травме, характерна для пожилых людей со сниженной плотностью кости, тогда как среди людей молодого возраста чаще встречаются гиперэргичные повреждения, приводящие к многооскольчатым переломам [27]. Эксперименты, проведенные M . Bayat et al. (2016) и P.L. Sequetto et al. (2017), также подтверждают роль остеопороза в снижении прочности кости [7, 31].
В другом исследовании M. Taylor et al. (2002) упоминают о не столь частом и тривиальном механическом исследовании трабекулярной кости в пользу кортикальной. Также автором было показано, что на основе некоторых экспериментальных исследований механические свойства трабекулярной кости близки к кортикальной, например, модуль Юнга для трабекулярной кости на 20% ниже, чем у кортикальной кости [34]. В следующих работах [5, 16, 25, 32, 38] обосновывается, что механические характеристики трабекулярной кости зависят от многих параметров, таких как геометрия кости, возраст донорского образца, в ряде случаев отмечен половой диморфизм.
Точка максимального напряжения является характеристикой, определяющей максимальную нагрузку, которую кость способна выдержать без необратимой деформации. Модуль Юнга характеризует жесткость или податливость материала при упругой деформации. Чем образец жестче, тем большую нагрузку нужно приложить к нему, чтобы его упруго деформировать. Величина упругой деформации определяет, насколько можно деформировать образец без необратимых изменений в его микроструктуре. Необратимая деформация трабекулярной костной ткани околосуставной локализации в клинической практике проявляется в виде импрессионных, или вдавленных, переломов, которые характеризуются компрессией костной ткани.
В нашем исследовании было показано, что деформационное поведение трабекулярной костной ткани околосуставной локализации при одноосном сжатии характеризует данный материал как упруго-пластичный. Причем образец не разрушался даже по достижению деформации более 30%. Однако стоит отметить, что все три показателя механической прочности были достоверно выше у образцов пяточной кости. Данная особенность костного материала связана с его уникальным строением, когда костный каркас окружен органическим материалом. Так, Y. Chen et al. (2015) изучали при помощи метода компьютерной томографии и метода конечных элементов влияние наличия костного мозга тела третьего поясничного позвонка на его механические свойства. Авторы пришли к выводу, что наличие компонента костного мозга в теле позвонка способно увеличить максимальное напряжение на 18,81%. Благодаря большому количеству органического материала, даже при разрушении костной основы, не происходит хрупкого разрушения костного образца, что объясняет характер импресионного перелома [8]. T.A. Metzger (2015) в своих работах также отмечает роль костного мозга в адаптации кости к прикладываемым нагрузкам, так как клетки костного мозга наравне с остеоцитами способны отвечать на механические стимулы и изменять уровень своей активности в соответствии с потребностями организма [20].
В другом исследовании J. Wang et al. (2015) изучали методом компьютерной томографии и методом конечных элементов механические свойства проксимального отдела большеберцовой кости, шейки бедренной кости и большого вертела бедренной кости. Авторы пришли к выводу, что метод компьютерной томографии с возможностями современного пакета анализа данных может точно и эффективно предсказать модуль упругости и предел текучести трабекулярной кости человека [36]. К аналогичным выводам приходит авторский коллектив под руководством S.M. Nazemi (2015). Исследователи уделяют большое внимание изменению жесткости субхондральной кости в связи с потерей костной массы, снижением плотности и изменением упругого модуля (при снижении модуля на 20% жесткость снизилась на 11%, тогда как при повышении модуля упругости на ту же величину увеличение жесткости составило всего 1%) [6, 22, 23, 24].
Выводы
-
1. Для всех образцов трабекулярной костной ткани околосуставной локализации после испытания было отмечено отсутствие линий излома, характерных для переломов кортикальной кости.
-
2. Было показано, что максимальное напряжение образцов пяточной кости примерно в два раза выше, чем образцов дистального отдела лучевой кости и проксимального отдела большеберцовой кости ( p < 0,05). Подобная зависимость прослеживается и у модуля Юнга ( p < 0,05).
-
3. Максимальное напряжение с увеличением физической плотности кости растет ( r = 0,678 при p = 0,002).
-
4. Максимальное напряжение с увеличением денситометрической плотности костной ткани увеличивается ( r = 0,508 при p = 0,012).
-
5. Имеется прямая пропорциональная зависимость денситометрической и физической плотностей трабекулярной кости околосуставной локализации ( r = 0,704 при p = 0,032).
Заключение
Импрессионная деформация, возникающая при внутрисуставных переломах, характеризует трабекулярную костную ткань субхондральной локализации как упругопластичный материал, разрушения которого не происходит даже при достижении деформации в 30% и более от высоты изучаемого образца, при этом обратимая деформация находится в пределах 3%. Модуль Юнга, максимальное напряжение, упругая деформация, радиоденситометрическая и физическая плотность трабекулярной костной ткани околосуставной локализации являются критериями биоэквивалентного выбора остеозамещающего материала для устранения структурного дефекта, возникшего в результате импрессионного перелома.
Благодарности
Работа выполнена при поддержке Российского научного фонда № 15-19-10007.
Список литературы К вопросу о патомеханике внутрисуставных импрессионых переломов костей конечностей
- Гилев М.В. Хирургическое лечение внутрисуставных переломов проксимального отдела большеберцовой кости // Гений ортопедии. - 2014. - № 1. - С. 75-81.
- Кутепов С.М., Гилев М.В., Антониади Ю.В. Осложнения при хирургическом лечении внутрисуставных переломов проксимального отдела большеберцовой кости // Гений ортопедии. - 2013. - № 3. - С. 9-12.
- Тихилов Р.М., Фомин Н.Ф., Корышков Н.А., Емельянов В.Г., Привалов А.М. Современные аспекты лечения последствий переломов костей заднего отдела стопы // Травматология и ортопедия России. - 2009. - Т. 52, № 2. - С. 144-149.
- Федоров В.Г. Какой термин наиболее приемлем для описания эпиметафизарных переломов костей конечностей: «импрессионный перелом» или «компрессионный перелом»? // Гений ортопедии. - 2014. - № 4. - С. 104-107.
- Allen M.R., McNerny E., Organ J.M., Wallace J.M. True gold or pyrite: a review of reference point indentation for assessing bone mechanical properties in vivo // J. Bone Miner. Res. - 2015. - Vol. 30, № 9. - P. 1539-1550. DOI: 10.1002/jbmr.2603


