Качественный и количественный анализ флавоноидов травы гречихи посевной
Автор: Анисимова М.М., Куркин В.А., Ежков В.Н.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Коррекция экологического неблагополучия. Продукты питания
Статья в выпуске: 1-8 т.12, 2010 года.
Бесплатный доступ
В настоящее время особое место на фармацевтическом рынке занимают лекарственные препараты растительного происхождения, содержащие флавоноиды, которые обладают широким спектром биологической активности, в том числе антиоксидантной, гепатопротекторной, капилляроукрепляющей и ангиопротекторной. К перспективным источникам получения флавоноидных препаратов, в том числе рутина, можно отнести траву гречихи посевной (Fagopyrum sagittatum Gilib.), широко культивируемой в Российской Федерации, однако по-прежнему остается нерешенной проблема стандартизации сырья данного растения. Предложены новые подходы к стандартизации сырья гречихи посевной. Разработаны оригинальные методики определения показателей качества сырья, которые рекомендованы для включения в нормативную документацию. Содержание рутина в траве гречихе посевной, культивируемой в Самарской области, находится в диапазоне 2,50-3,70%. Изучена динамика накопления флавоноидов в зависимости от фазы вегетации растения.
Гречиха посевная, ангиопротекторное действие, рутин, флавоноиды
Короткий адрес: https://sciup.org/148199210
IDR: 148199210 | УДК: 639.782.519.711
Текст научной статьи Качественный и количественный анализ флавоноидов травы гречихи посевной
Ежков Владимир Николаевич, кандидат фармацевтических наук, профессор кафедры экономики и организации фармации
Цель настоящей работы – исследование по разработке методик качественного и количественного анализа нового вида лекарственного растительного сырья «Гречихи посевной трава».
Материалы и методы. Исследовали образцы надземной части гречихи посевной, культивируемой в Самарской области, а именно: СреднеВолжский филиал ГУ ВИЛАР (пос. Антоновка), Самарский ботанический сад. Образцы сырья собирали в фазу цветения в 2009 г. В ходе разработки методик качественного и количественного анализа нами использовалось водно-спиртовое извлечение травы гречихи посевной, при этом было предложено использование в данных методиках государственного стандартного образца (ГСО) рутина. Спектрофотометрические исследования осуществляли с использованием спектрофотометра «Specord 40» (Analytik Jena).
Результаты и их обсуждение. Для определения состава травы гречихи посевной разработана методика тонкослойного хроматографирования (ТСХ). В задачу исследования входил подбор системы растворителей и способа детектирования зон адсорбции на хроматограмме, позволяющих идентифицировать флавоноиды. Разделение флавоноидов было наиболее оптимальным в системе растворителей: хлороформ – метанол – вода (26:14:3) («Силуфол УФ 254» или «Сорбфил ПТСХ-АФ-А-УФ»). В данных условиях четко разделяются флавоноидные и фенил-пропаноидные соединения. Для обнаружения веществ на хроматограмме использовали детекцию в УФ-свете (254 нм и 366 нм). На хроматограмме обнаруживается доминирующее пятно с величиной R f около 0,4 (рутин), а также проявляются другие пятна, в частности, пятно фиолетового цвета с величиной R f - 0,2 (хлоро-геновая кислота), с R f - 0,8 (кверцетин) и с R f -
0,6 (изокверцитрин).
При проявлении хроматограммы щелочным раствором диазобензолсульфокислоты (ДСК) также обнаруживается доминирующее пятно с величиной R f ~0,4 (на уровне аналогичного пятна ГСО рутина). Следовательно, ТСХ позволяет объективно определять подлинность травы гречихи посевной по наличию доминирующего флавоноида – рутина.
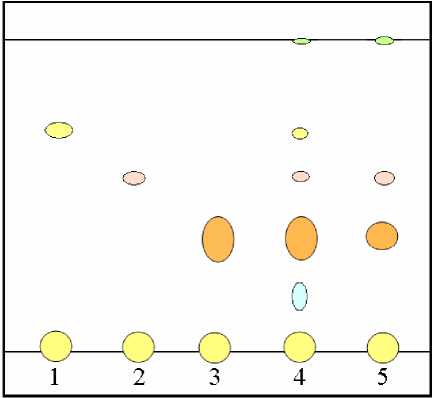
Рис. 1. ТСХ анализ водно-спиртовых извлечений из травы гречихи посевной:
1 – кверцетин; 2 – изоверцетрин; 3 – рутин; 4 – водноспиртовое извлечение из травы гречихи посевной на 70% этиловом спирте; 5 – водно-спиртовое извлечение из травы гречихи посевной на 96% этиловом спирте
Для оценки количественного содержания суммы флавоноидов, содержащихся в траве гречихи посевной, был предложен метод спектрофотометрии и была обоснована целесообразность использования ГСО рутина. С целью исключения вклада сопутствующих веществ в оптическую плотность нами применен спектрофотометрический метод, основанный на реакции комплексообразования с алюминием хлоридом. При этом происходит батохромный сдвиг полосы поглощения флавоноидов (рис. 2.).
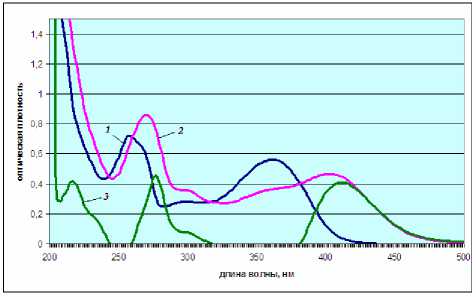
Рис. 2. Электронные спектры водно-спиртовых извлечений травы гречихи посевной:
1 – р-р водно-спиртового извлечения из травы гречихи посевной; 2 – р-р водно-спиртового извлечения из травы гречихи посевной с добавлением AlCl3; 3 – дифференциальный спектр
Для оптимизации методики анализа было изучено влияние концентрации алюминия хлорида, времени комплексообразования. Установлено, что на результаты анализа влияют концентрация раствора алюминия хлорида (оптимальным является 2% раствор) и время (устойчивое окрашивание наступает через 30 минут и сохраняется в течение 2 часов). С целью определения максимума поглощения анализи-руемой группы флавоноидов от перекрываю-щих их полос поглощения других (неанализи-руемых) соединений используют вариант про-ведения дифференциальной спекторофотомет-рии, с применением комплексообразующей добавки (AlCl 3 ) (рис. 2 и 3). Расчет содержания суммы флавоноидов в гречихе посевной прово-дится в пересчете на рутин, так как их дифференциальные спектры поглощения совпадают по положению с максимумом ГСО (государственный стандартный образец) рутина, поэтому при определении суммы флавоноидов в гречихе посевной мы сочли возможным проводить пересчет на ГСО рутина. Содержание суммы флавоноидов в пересчете на рутин и абсолютно сухое сырье в процентах ( X ) вычисляют по формуле:
X = D ∗ m 0 ∗ 40 ∗ 25 ∗ 100 ∗ 100
D 0 ∗ m ∗ 5 ∗ 50 ∗ (100 - W )
где D – оптическая плотность испытуемого раствора; D o – оптическая плотность раствора ГСО рутина; m – масса сырья, г; m о – масса ГСО рутина, г; W – потеря в массе при высушивании в процентах.
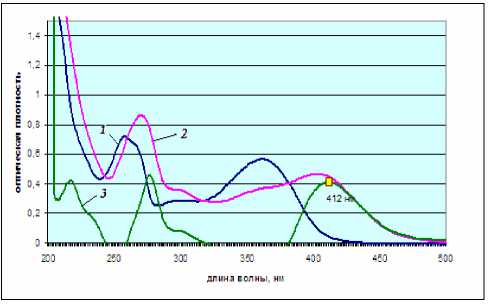
Рис. 3. Электронные спектры растворов рутина: 1 – раствор рутина; 2 – раствор рутина с добавлением AlCl3;
3 – дифференциальный спектр
Содержание суммы флавоноидов в гречихе посевной варьирует от 5,30 до 6,10% в зависимости от места культивирования и года сбора. Этот факт свидетельствует также о перспективности получения препарата из травы гречихи посевной на основе флавоноидного комплекса, обладающего ангиопротекторными и антиоксидантными свойствами. Для изучения динамики накопления флавоноидов определяли спектрофотометрическую зависимость концентрации флавоноидов в сырье от фазы вегетации гречихи посевной. Для всех образцов отсняли полный спектр поглощения по методике определения суммы флавоноидов в гречихе посевной. При сравнении оптических плотностей из табл. 1 видно, что фенольные соединения в наибольшем количестве локализованы в верхней части растения.
Таблица 1. Содержание рутина в зависимости от времени сбора
|
Время сбора |
№ образца |
Часть растения |
Оптическая плотность при 412 нм |
|
18 июля |
1 |
все растение |
0,204 |
|
2 |
верхушка |
0,524 |
|
|
28 июля |
3 |
все растение |
0,224 |
|
4 |
верхушка |
0,756 |
|
|
7 августа |
5 |
все растение |
0,272 |
|
6 |
верхушка |
0,916 |
|
|
17 августа |
7 |
все растение |
0,328 |
|
8 |
верхушка |
0,316 |
|
|
17 августа |
9 |
цветки |
1,480 |
Проведенные исследования при сравнении образцов, собранных в разные фазы вегетации, свидетельствуют о том, что по мере роста гречихи концентрация рутина в вегетативной массе вначале возрастает, достигает максимума во время полного (массового) цветения (в возрасте 30-40 дней), а далее постепенно уменьшается во время завязывания плодов. Наибольшее содержание флавоноидов в образцах, собранных 17 августа. Фаза сбора – массовое цветение.
Методика качественного ТСХ-анализа травы гречихи посевной. На линию старта пластинки «Сорбфил–ПТСХ-АФ-А-УФ» микропипеткой наносят 0,02 мл извлечения (см. методику количественного определения) и 0,02 мл 0,1% раствора ГСО рутина в виде пятен диаметром около 5 мм. Около 0,02 мл извлечения с помощью микропипетки наносят на стартовую линию, проведенную на рассто-янии 1,5-2 см от нижнего края хроматогра-фической пластинки «Сорбфил–ПТСХ-АФ-А-УФ». Пластинку с нанесенными пробами высушивают на воздухе, затем помещают в хроматографическую камеру, которую предварительно насыщают смесью растворителей: хлороформ-метанол-вода (26:14:3), и хроматографируют восходящим способом. Когда фронт растворителей пройдет около 8 см, пластинку вынимают из камеры, сушат на воздухе в течение 5 минут. Детекцию веществ осуществляли в УФ-свете (254 нм и 366 нм). На хроматограмме обнаруживается доминирующее пятно с величиной R f около 0,4 (рутин), а также проявляются другие пятна, в частности, пятно фиолетового цвета с величиной R f - 0,2 (хлорогеновая кислота), с R f - 0,8 (кверцетин) и с R f - 0,6 (изокверцитрин).
-
1. Подготовка пластинок. Пластинки «Сорбфил ПТСХ-АФ-А-УФ» (ТУ 26-11-17-89) разрезают попе-рек линий накатки соответственно на 2 части разме-ром 10 х 5 см и перед использованием активируют в сушильном шкафу
-
2. Приготовление раствора диазобензолсульфокислоты . 0,01 г диазобензолсульфокислоты (ГФ X, стр. 876) растворяют в 10 мл 10% раствора натрия карбоната. Раствор используют свежеприготов-ленным.
-
3. Приготовление раствора ГСО рутина. (см. методику количественного определения: раствор А). Срок годности раствора 1 мес.
при 100-105оС в течение 1 ч.
Методика количественного определе-ния флавоноидов в траве гречихи посевной. Около 1 г (точная навеска) воздушно-сухого образца измельченного сырья с размером частиц 3 мм помещают в колбу с притертой крышкой емкостью 100 мл, добавляют 40 мл 70% этилового спирта. Колбу взвешивают на тарирных весах с точностью до 0,01 г и присоединяют к обратному холодильнику. Экстракцию осуществляют при нагревании на кипящей водяной бане в течение 60 мин. После экстракции извлечение охлаждают и отфиль-тровывают через бумажный фильтр с красной полосой. Извлечение доводят на тарирных весах до первоначальной массы 70% этиловым спиртом.
1 мл полученного извлечения (1:40) переносят в мерную колбу вместимостью 25 мл и доводят 70% этиловым спиртом до метки (раствор А). 5 мл раствора А переносят в мерную колбу вместимостью 25 мл, добавляют 1 мл 2% раствора алюминия хлорида и доводят 96% этиловым спиртом до метки (раствор Б + AlCl3). В качестве раствора сравнения используют раствор, приготовленный по методике: 1 мл полученного извлечения (1:40) переносят в мерную колбу вместимостью 25 мл и доводят 70% этиловым спиртом до метки (раствор А). 5 мл раствора А переносят в мерную колбу вместимостью 25 мл и доводят 96% этиловым спиртом до метки (раствор Б). Параллельно измеряют оптическую плотность раствора ГСО рутина при длине волны 412 нм.
Содержание флавоноидов в пересчете на рутин в траве гречихи посевной в процентах ( X ) вычисляют по формуле:
D∗m0 ∗40∗25∗100∗100
X = ;
D0 ∗m∗5∗50∗(100-W)
где D – оптическая плотность испытуемого раствора; D o – оптическая плотность раствора ГСО рутина; m – масса сырья, г; m о – масса ГСО рутина, г; W – потеря в массе при высушивании в процентах.
Приготовление государственного стандартного образца рутина. Около 0,025 г (точная навеска) рутина помещают в мерную колбу на 50 мл, растворяют в 30 мл 70% этилового спирта при нагревании на водяной бане. После растворения содержимое колбы охлаждают до комнатной температуры и доводят 70% этиловым спиртом до метки (раствор А). 1 мл раствора А помещают в мерную колбу на 25 мл, прибавляют 1 мл 3% раствора алюминия хлорида и доводят 95% этиловым спиртом до метки (испытуемый раствор Б). В качестве раствора сравнения используют раствор, состоящий из 1 мл раствора А рутина, помещенного в мерную колбу на 25 мл и доведенного 95% этиловым спиртом до метки (раствор сравнения Б рутина).
Выводы:
-
1. Разработана методика качественного анализа гречихи посевной.
-
2. Разработана методика количественного определения суммы флавоноидов в пересчете на рутин в гречихе посевной.
-
3. Изучена динамика накопления флавоноидов в зависимости от времени сбора, части растения и времени экстракции.
-
4. Обосновано использование ГСО рутина в методиках анализа флавоноидов гречихи посевной.
-
5. Предложен новый вид лекарственного растительного сырья «Гречихи посевной тра-ва» как перспективного источника флавоно-идов, в том числе рутина.
Список литературы Качественный и количественный анализ флавоноидов травы гречихи посевной
- Государственный реестр лекарственных средств. Том I. Официальное издание. -М., 2008. -1398 с.
- Евдокимова, О.В. Препараты растительного происхождения при хронической венозной недостаточности//Новая аптека. 2006. № 4. С. 11-12.
- Крикова, А.В. Биологическая активность растительных источников флавоноидов/А.В. Крикова, Р.С. Давыдов, Ю.Н. Мокин и др.//Фармация. 2006. Т. 54, № 3. С. 17-18.
- Куркин, В.А. Фармакогнозия: Учебник для студентов фармацевтических вузов (факультетов)/В.А. Куркин. -2-е изд., перераб. и доп. -Самара: ООО «Офорт»; ГОУ ВПО «СамГМУ Росздрава», 2007. 1239 с.


